Extractos naturales de Zacate de limón (Cymbopogon citratus) y Hierba de San Juan (Hypericum perforatum) como conservadores de semen porcino
Las técnicas de reproducción animal han ido en constante evolución, siendo la más desarrollada la Inseminación Artificial. Dicha metodología, emplea el uso de diluyentes comerciales específicos para la conservación seminal. Sin embargo, existen deficiencias en el protocolo de recolección y dilución acelerando el proceso de peroxidación lipídica, capacitación espermática y reacción acrosomal temprana, así como, incrementado el costo de producción por lo cual, se propone la evaluación de extractos naturales de Cymbopogon citratus (Zacate de limón) e Hypericum perforatum (Hierba de San Juan) para su uso como una nueva alternativa para la conservación seminal durante 72 horas. En el presente trabajo se realizaron tres diferentes disoluciones (0.250,0.125 y 0.0625 µl) de cada extracto en 5 ml de semen recién recolectado de un semental Yorkshire de año y medio de edad. Los extractos fueron caracterizados mediante las técnicas de DPPH* y HPLC para determinación de antioxidantes y azúcares totales. La viabilidad de las muestras se analizó mediante un Analizador de Calidad Seminal (SQS® Zoitech). Los resultados fueron comparados con el uso de un diluyente de corta duración obteniendo como resultado para Zacate de limón una viabilidad de 66% vs. 63% (p<0.05) y Hierba de San Juan 82% vs. 63% (p<0.05) ambos para un lapso de tiempo de tres días. Mediante el uso de dichos extractos fue posible mantener la viabilidad espermática arriba del 60% durante 72 horas en almacenamiento.
Palabras clave: Extractos, conservador, semen, cerdo.
Materiales y Métodos
Síntesis de las muestras
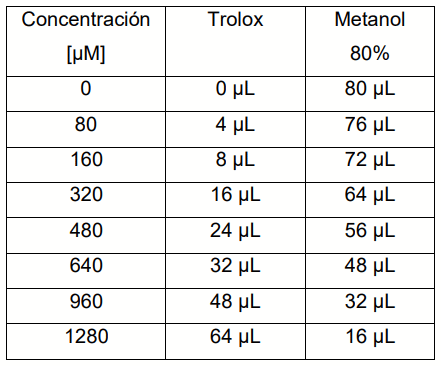
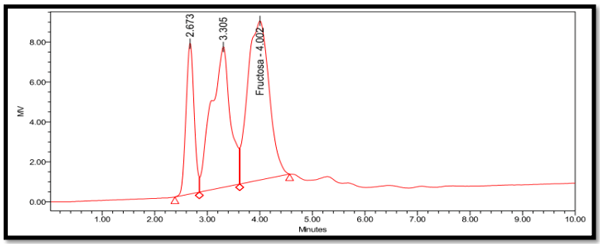
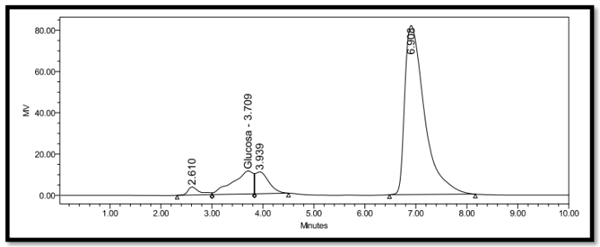
Determinación de azúcares totales mediante Cromatografía líquida de alta eficacia (HPLC)
Análisis estadístico
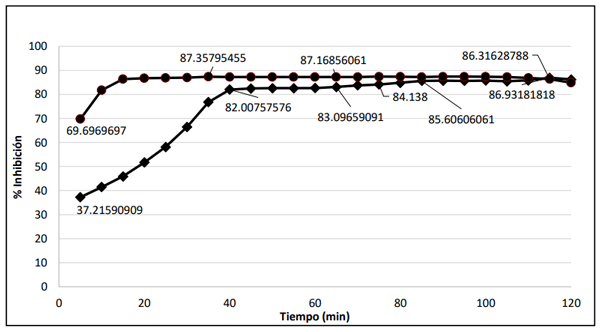
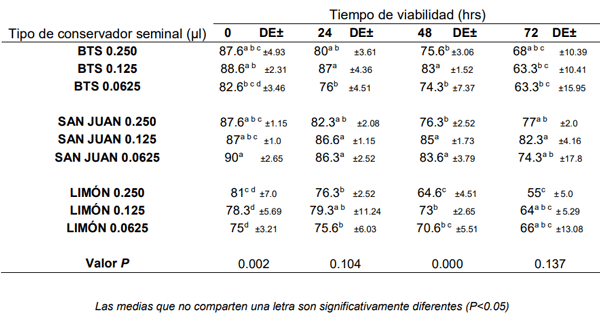
Resultados y Discusión
| Guerrero-Guzmán, Andrea*1, Villarreal-Pavón, Fabiola2, Zamudio-Ojeda, Adalberto3, Velázquez-Juárez, Gilberto4, Ramos-Ibarra, Roberto5, Sánchez-Chiprés, David*1,6 1Posgrado Maestría Interinstitucional en Producción Pecuaria, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara, México 2Licenciatura en Medicina Veterinaria y Zootecnista, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara, México 3Departamento de Física, Centro Universitario de Ciencias Exactas e Ingeniería, Universidad de Guadalajara, México 4Departamento de Química, Centro Universitario de Ciencias Exactas e Ingeniería, Universidad de Guadalajara, México. 5Departamento de Farmacobiología, Centro Universitario de Ciencias Exactas e Ingeniería, Universidad de Guadalajara, México. 6División de Ciencias Veterinarias, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara, México. *Autor responsable y de correspondencia: Andrea Guerrero Guzmán y David Sánchez Chiprés, Centro Universitario de Ciencias Biológicas y Agropecuarias, Camino Ramón Padilla Sánchez 2100, Nextipac, 44600 Zapopan, Jal. |
- Althouse, G. C. 2007. Artificial Insemination in Swine: Boar Stud Management. Current Therapy in Large Animal Theriogenology, 731–738
- Azam, S., Hadi, N., Khan, N.U., Hadi, S.M. Antioxidant and prooxidant properties of caffeine, theobromic and xanthine. Med. Sci. Monit. 9. No.9.
- Balakrishnan, B., Paramasivam, S. y Arulkumar, A. 2014. Evaluation of the lemongrass plant (Cymbopogon citratus) extracted in different solvents for antioxidant and antibacterial activity against human pathogens. Asian Pac J Trop Dis 4(1): S134-S139
- Da Costa, E.P.; Assis da Costa, A.H.; Macedo, G.G. y Pereira, E.C. 2011. Artificial Insemination in Swine. In: Manafi M (ed) Artificial Insemination in Farm Animals, InTech, Croatia, pp 95-114
- Del Valle Rodríguez, A. 2017. Evaluación de la calidad espermática de sementales porcinos utilizados en la monta natural. RedVet. 8:1-17.
- Desroches, N. R., McNiven, M. A., Foote, K. D. y Richardson, G. F. 2005. The Effect of Blueberry Extracts and Quercetin on Capacitation Status of Stored Boar Sperm. Cell Preservation Technology, 3(3): 165–168
- Fernández-Novell, J.M., Ballester, J., Altirriba, J., Ramió-Lluch, L., Barbera, A., Gomis, R., Guinovart, J.J. y Rodríguez-Gil, J.E. 2011. Glucose and fructose as functional modulators of overall dog, but not boar sperm function. Reproduction, Fertility and Development 23: 468–480
- Flores, C.; Meléndez, C.; Mendoza, C.; Márquez, Y.; Vilanova, L.T. 2018. Efecto antioxidante de la melatonina durante la conservación de semen de cerdo. Rev. Vet. 29 (1): 13-17
- Foote, R.H. 2002. The history of artificial insemination: Selected notes and notables. J Anim Sci. 80:1-10
- Funahashi, H. y Sano, T. 2005. Select antioxidants improve the function of extended boar semen stored at 10°C. Theriogenology, 63(6): 1605–1616
- Godea, J. 2003. Review: Semen extenders used in the artificial insemination of swine. Spanish Journal of Agricultural Research, 1(2): 17-27
- Johnson, L. A., Aalbers, J. G.,y Grooten, H. G. 1988. Artificial Insemination of Swine: Fecundity of Boar Semen Stored in Beltsville TS (BTS), Modified Modena (MM), or MR-A and Inseminated on One, Three and Four Days After Collection. Reproduction in Domestic Animals, 23(2): 49–55
- Knox, R.V., 2016. Artificial insemination in pigs today. Theriogenology 85: 83-93
- Kumar, S. and Pandey, A.k. 2013. Chemistry and Biological Activities of Flavonoids: An Overview. Sci. World. J. 162750.
- Martínez-Flórez, S., González-Gallego, J., Culebras, J.M., Tuñón, M.J. 2002. Los flavonoides: propiedades y acciones antioxidantes. Nutr. Hosp.17 6: 271-278
- Maza, L.; Maza, A.; Yong, G.; de la Torre, J.; Férnandez, A.; Guiris, M.; Lau, A.; León, H.; Ibarra, C.; Ocampo, P.; Macías, G.; Peralta, M.; Reyes, M.; Ruiz, H.; Ruiz, A.; Sánchez, H.; Melgar, F.; Trejo, A.; Bautista, G.; Mendoza, P.; Ruiz, B. y Oliva, A. 2015. Reproducción animal., p. 140
- Namal Senanayake, S.P.J. 2013. Green tea extract: Chemistry, antioxidant properties and food applications – A review. J. Functional Foods.
- Rodríguez-Gil, J.E. y Estrada, E. 2013. Artificial Insemination in Boar Reproduction. Chapter 2. In: Bonet S., Casas I., Holt W., Yeste M. (eds) Boar Reproduction. Springer, Berlín, Heidelberg. Pp. 589-607.
- Scoparo, C. T., de Souza, L. M., Dartora, N., Sassaki, G. L., Gorin, P. A. J., y Lacomini, M. 2012. Analysis of Camellia sinensis green and black teas via ultra high performance liquid chromatography assisted by liquid–liquid partition and two-dimensional liquid chromatography (size exclusion×reversed phase). Journal of Chromatography A, 1222: 29–37
- Silva, B., Ferreres, F., Malva, J., Dias, A. 2004. Phytochemical and atioxidant characterization of Hypericum perforatum alcoholic extracts. Food Chemestry 90: 157- 167
- Spinaci, M., Muccilli, V., Bucci, D., Cardullo, N., Gadani, B., Tringali, C., Galeati, G. y Tamanini, C. 2018. Biological effects of polyphenol-rich extract and fractions from an oenological oak-derived tannin on in vitro swine sperm capacitation and fertilizing ability. Theriogenology, 108: 284–290
- Szczęśniak-Fabiańczyk, B., Bochenek,M., Smorąg, Z. y Florian Ryszka. 2003. Effect of antioxidants added to boar semen extender on the semen survival time and sperm chromatin structure. Reprod. Biol. 3(1): 81-87
- Tsantarliotou, M., Sapanidoi, V. 2018. The importance of antioxidants in sperm quality and In Vitro embryo production. J. Veterinary Andrology. 3: 1-12.
- Valdebenito, N. 2007. Efecto de la cafeína en la motilidad y fertilidad espermática de Trucha Arcoíris (Oncorhynchus mykiss). Inf. Tecnol. 8. No. 2
- Wilde, O., De la vega, A., Cruz, M. 2004. Efecto de la adición de cafeína y lactato sobre la motilidad del semen equino diluido en leche descremada-glucosa. Zootecnia Trop. 22. No. 1.



Estados Unidos de América





