Circovirosis porcina, una de las patologías que causa más problemas sanitarios
Publicado: 25 de mayo de 2020
Por: Israel Campos. Facultad de Ciencias Veterinarias, Carrera de Medicina Veterinaria y Zootecnia. Universidad Autónoma Gabriel René Moreno. Bolivia
1.- Introducción.
La circovirosis porcina, es una de las patologías que causa más problemas sanitarios en la producción de dichos animales, causada por el PCV2, un agente infeccioso de muy fácil difusión, que afecta de forma natural a la especie porcina (domésticos y salvajes).
El PCV1 o circovirus porcino tipo I es apatógeno en el cerdo y el PCV2 o tipo II, aislado por primera vez en 1991, en cerdos que sufrían del Síndrome multisistémico de adelgazamiento post destete, es el causante de esta enfermedad. (Hamel, 2001).
Clínicamente la enfermedad está en el medio, presente en los diferentes sistemas de producción, causando serios problemas productivos, por ello, para su control se realizan vacunaciones, tanto a madres como a los lechones, dando resultados aceptables.
Sin embargo, es necesario que el SENASAG evalúe la efectividad real de dichas vacunaciones, para definir mejor la estrategia a seguir para controlar esta patología, en base a indicadores productivos, que determinen la eficacia técnica y económica de las vacunas en madres o lechones.
2.- Definición.
La circovirosis porcina, es una enfermedad viral que afecta a la especie porcina (cerdos y jabalíes), de distribución mundial, que causa grandes pérdidas económicas, debido al circovirus porcino tipo 2. Clínicamente se presenta como una enfermedad de desmedro; una enfermedad lenta y progresiva con un alto índice de mortalidad y morbilidad. También se puede presentar como un síndrome de dermatitis y nefropatía porcina con alta mortalidad.
3.- Sinonimia.
Circovirus porcino tipo 2 (PCV2), enfermedades asociadas a circovirus porcino, síndrome multisistémico de adelgazamiento post destete (PMWS), síndrome de dermatitis y nefropatía porcina (PDNS).
4.- Historia.
El circovirus porcino (PCV, del inglés porcine circovirus) fue descrito por primera vez por investigadores alemanes en el año 1974, como un virus contaminante de la línea celular de riñón de cerdo PK-15 (ATCC-CCL33), el cual fue denominado inicialmente como picornavirus- like (Tischer y col., 1974).
Estudios posteriores revelaron que se trataba de un virus muy pequeño, sin envoltura, con un diámetro de 17 nm y de simetría icosaédrica, el cuál presentaba un genoma de DNA circular, por lo que fue denominado circovirus porcino (PCV) (Tischer y col., 1982).
En el año 1997 el PCV fue asociado a una enfermedad que afectaba a cerdos de transición conocida como Síndrome Multisistémico de Desmedro Postdestete (PMWS, del inglés Postweaning Multysistemic Wasting Syndrome) (Clark, 1997).
Esta enfermedad ya era conocida desde 1991 en Canadá, pero se consideraba de etiología desconocida (Harding, 1996; Clark 1997; Harding y clark 1997; Harding y col., 1998).
Los síntomas observados eran pérdida de peso, palidez corporal, alteraciones respiratorias y, en algunos casos, diarrea e ictericia.
Las lesiones más frecuentemente observadas eran neumonía intersticial y linfoadenopatía generalizada, especialmente en los nódulos linfáticos inguinales superficiales. Otras lesiones que se observan con menor frecuencia eran hepatitis, nefritis y pancreatitis no supurativas (Harding, 1996; Clark 1997; Harding y clark 1997; Harding y col., 1998; Rosell y col., 1999).
En los tejidos lesionados se observaba sistemáticamente una gran cantidad de antígeno y ácido nucleico viral (Clark, 1997; Rosell y col., 1999). Estudios posteriores de secuenciación genómica demostraron que el genotipo de PCV presente en cerdos afectados con PMWS era diferente al genotipo de PCV que contaminaba persistentemente la línea celular PK-15 (Hamel y col., 1998; Meehan y col., 1998).
Por ello se sugirió la denominación de PCV tipo 1 (PCV-1) para el circovirus asociado a la línea celular PK-15, considerado apatógeno, y PCV tipo 2 (PCV-2) para el circovirus asociado a PMWS (Allan y col., 1998; Meehan y col., 1998).
De esta forma, hasta la fecha se ha utilizado la nomenclatura PCV-1 y PCV-2 para designar a los dos genotipos virales.
En Bolivia, no se conoce con exactitud la fecha de su aparición, pero en el año 2007, fue aislado el PCV 2 en LIVIDET, en la ciudad de Santa Cruz de la Sierra.
5.- Distribución.
PCV-2 es considerado un virus ubicuo, presente en países donde se han descrito o no enfermedades asociadas al circovirus porcino (PCVADs, del inglés, Porcine Circovirus Asociated Diseases) (Allan y Ellis, 2000).
Hasta la fecha, la infección por PCV-2 ha sido informada en Norteamérica, Europa (España, Francia, Reino Unido, Bélgica, Irlanda), Latinoamérica, Asia y África (Allan y Ellis, 2000).
Estudios retrospectivos mostraron que el PCV-2 ha estado presente en Europa desde 1969 y en Canadá desde 1985. Las infecciones con PCV-2 han sido prevalentes en porcinos domésticos en todo el mundo desde algunas décadas y comúnmente el virus está de manera endémica presente en todos los países con industria porcina intensiva (Nauwynck y col., 2007).
En nuestro país los departamentos más afectados son (por número de cabezas de ganado porcino en el 2010) el de Santa Cruz, Chuquisaca, La Paz, Tarija, Cochabamba y Potosí; siguiéndoles Beni, Oruro y Pando.
6.- Etiología.
El circovirus porcino tipo 2 en un agente vírico de 17 nm de diámetro, uno de los más pequeños entre los virus animales. Presenta una organización estructural relativamente simple: virus sin envoltura, con una cápside formada mayoritariamente por una sola proteína (proteína Cap o producto del fragmento de lectura abierto 2 [ORF2]), y una cadena simple de ADN de aproximadamente 1767-68 nucleótidos.
Este genoma también se codifica por proteínas involucradas en la replicación vírica (Rep y Rep’, productos del ORF1). Existiría un ORF3 que se especula podría codificar una proteína con capacidad apoptótica; no obstante, la función de esta proteína no está clara actualmente.
Es un virus altamente resistente y, por definición, de difícil eliminación con el uso de desinfectantes. Entre ellos, se consideran de utilidad para disminuir la carga vírica in vitro a la clorhexidina, formaldehídos, yodo (10%) y lejía.
Desde el punto de vista filogenético se consideran dos grandes grupos de PCV2. Estas agrupaciones se han definido muy recientemente como dos genotipos distintos (1 y 2), considerándose el genotipo 2 como más antiguo desde el punto de vista evolutivo.
Vista esta clasificación, es lógico preguntarse si todos los genotipos de PCV2 presentan la misma virulencia o no. La respuesta a esta cuestión no es clara. Pero diversos estudios indican que el porcentaje es mayor con el genotipo 1.
- Los casos de aparición epizoótica en Norteamérica se han asociado a un incremento muy marcado de prevalencia de cepas de PCV2 de genotipo 1.
- Un estudio reciente realizado en Europa asocia sistemáticamente el genotipo 1 a la existencia de enfermedad, mientras que no siempre es el caso con el genotipo 2. Si estos datos podrían explicar la aparición de brotes epizoóticos de circovirosis porcina a finales de los 90 en Europa y Sureste Asiático y en 2004/05 en Norte y Suramérica es algo que no está demostrado.
Una posible hipótesis consistiría en que el genotipo 2 de PCV2, potencialmente menos virulento, ha sido el genotipo más frecuente durante mucho tiempo, con casos esporádicos de enfermedad (al menos desde 1986); la irrupción de un genotipo más patogénico, presuntamente el genotipo 1, podría haber sido el responsable de los brotes epizoóticos de la enfermedad mencionados anteriormente.
Cabe destacar, no obstante, que incluso dentro de un mismo genotipo, podrían existir diferencias de patogenicidad. Por otro lado, y a pesar de la existencia de diferencias antigénicas entre distintos aislados de PCV2, la eficacia de las vacunas con independencia del genotipo de desafío sugiere que, aunque existan dos genotipos, podría existir solamente un serotipo de PCV2.
No obstante, ya desde hace casi 10 años, existe otra hipótesis para explicar la irrupción de la circovirosis porcina a nivel mundial: el “agente X”. Se trataría de un agente que actuaría facilitando una sobre replicación de PCV2 y, por tanto, jugaría un papel como factor desencadenante de la enfermedad en el 100% de los casos.
Esta hipótesis se ha sustentado en la controversia sobre PCV2 de ¿cómo un virus ubicuo podría ser causa de enfermedad? Lógicamente, esta hipótesis es anterior a la posible irrupción de genotipos de PCV2 con distinta virulencia. Lo que si es cierto es que después de estos 10 años (2000-2010), nadie ha podido aislar o detectar este posible “agente X”, y los datos de infecciones experimentales con “éxito” explicarían de forma muy difícil la existencia de un “agente X”. Si este “agente X” fuera el responsable del desencadenamiento de algunos casos de enfermedad, entonces se comportaría de forma similar a como lo hacen el parvovirus porcino, el virus del síndrome respiratorio y reproductivo porcino y Mycoplasma hyopneumoniae (desencadenadores de la enfermedad en cerdos coinfectados con PCV2).
En todos los casos, ¡nunca un agente cuya existencia se desconoce había generado tantos comentarios! Cabe decir, no obstante, que, a pesar de la gran eficacia demostrada por las vacunas frente a PCV2, ello tampoco descarta la existencia del famoso “agente X”.


7.- Epidemiología.
PCV2 es un virus ubicuo en cerdos y jabalíes. No obstante, ello no se correlaciona necesariamente con la distribución de la circovirosis porcina a nivel mundial.
Es cierto que la enfermedad ha sido descrita en todos los continentes, pero aún existen países en los cuales la infección está presente, pero donde el proceso clínico no ha sido aún descrito.
Esta temática volvería a tener una conexión con la existencia de distintos genotipos de PCV2 con una aparentemente distinta patogenicidad. ¿Podría ser que algunos países presentaran cerdos infectados con un genotipo poco patogénico en comparación con otros?
Un estudio danés publicado muy recientemente sugiere la existencia de un tercer genotipo de PCV2 (genotipo 3) que se detectó en muestras de cerdo correspondientes a los años 1980, 1987 y 1990. La existencia de este tercer genotipo podría indicar que se produciría un “gradiente genotípico” desde los años 80 hasta la actualidad que seguiría el orden de genotipos 3, 2 y 1, siendo este último el aparentemente relacionado con los brotes epizoóticos de enfermedad que se dieron en Dinamarca.
Actualmente desconocemos si ello es extrapolable al resto de Europa y si este “gradiente genotípico” también se ha dado o no en otras regiones del mundo.
Desde el punto de vista de las especies susceptibles a la infección por PCV2, al margen del cerdo doméstico y del jabalí, se desconoce la existencia de otras que pudieran serlo.
Al menos no se ha descrito infección por PCV1 o PCV2 en ninguna de las especies estudiadas: perro, gato, oveja, cabra, caballo, bovino, conejo, rata, ratón, pollo y especie humana (incluidas personas con un teórico alto riesgo de infección como podrían ser los veterinarios).
Por otro lado, se ha detectado PCV2 (por PCR) en suero de cerdos al menos hasta 28 semanas de vida, y en algunos casos esta positividad (desconociendo si es continua o intermitente) ha durado al menos hasta 21 semanas. Es por ello que se cree que, en un cierto porcentaje de animales, el PCV2 puede establecer una infección persistente en los cerdos.
El virus se ha podido detectar en distintas vías potenciales de excreción, secreciones nasales, saliva, tonsila, moco traqueal, orina, heces, semen y secreciones oculares, lo que indicaría que PCV2 podría excretarse potencialmente por cualquier vía orgánica.
Es más, los animales que padecen una circovirosis porcina, además de presentar una carga vírica significativamente superior en suero, también excretan significativamente más cantidad de virus.
Estudios experimentales, a la fecha, sugieren que el PCV-2 es de transmisión horizontal, por contacto directo, siendo considerada la vía oro-nasal la ruta más frecuente de infección entre animales infectados y susceptibles.
En granjas comerciales, la mayoría de los cerdos seroconvierten al PCV-2 entre los 2 y 4 meses de edad, indicando que la transmisión horizontal del PCV-2 entre cerdos es muy eficiente y ha sido demostrada bajo condiciones experimentales en donde se pone en contacto a cerdos susceptibles con cerdos infectados.
Las rutas de inoculación del PCV-2 tanto intranasal como subcutánea han sido usadas en intentos de reproducir experimentalmente la circovirosis. La transmisión transplacentaria del PCV-2 ha sido recientemente demostrada mediante el seguimiento de infecciones experimentales intranasales en cerdos, indicando que la transmisión vertical de PCV-2 es factible. Sin embargo, la frecuencia de estas alteraciones reproductivas bajo condiciones de campo es aparentemente variable, siendo raramente reportadas, pero en Corea del Sur, en cambio, se han descrito infecciones por PCV-2 en aproximadamente un 13% de los fetos abortados y nacidos muertos (Kim y col., 2004).
Experimentalmente, se ha detectado excreción de PCV-2 en semen de verracos previamente inoculados con PCV-2. No obstante, se desconoce si las cantidades de PCV-2 presentes en semen pueden realmente producir la infección de las cerdas, ya sea por monta natural o por inseminación artificial, sin embargo, estas vías de infección deben ser consideradas como potenciales rutas de diseminación.
El PCV-2 puede ser detectado mediante la reacción en cadena de la polimerasa (PCR) en la cavidad nasal, tonsilas, secreciones bronquiales, heces y orina, tanto en cerdos afectados como libres de PMWS, pero la carga viral del virus en las secreciones es mucho mayor en cerdos afectados con PMWS.
El virus puede ser aislado o detectado por PCR desde la cavidad nasal, rectal, vías urinarias, saliva, secreciones oculares y tonsilares. Sin embargo, aunque se sabe que el PCV-2 puede ser detectado en la cavidad nasal y en la tonsila de cerdos cursando con PMWS por hibridación in situ (HIS), no se ha probado definitivamente si la carga viral obtenida por estas vías corresponde a excreción viral o si es debida a la presencia del virus en el ambiente, el cual alcanza esta localización.
Si entre los 2 y 4 meses de vida se infectan prácticamente todos los animales en una granja, PCV2 tiene que ser un virus altamente contagioso.
No obstante, quizás el dato de interés más reciente sea la demostración de que no solamente PCV2 es transmisible, sino que también se puede transmitir la circovirosis porcina de un cerdo enfermo a uno sano.
A pesar de que ello pueda suponer una obviedad, no lo era desde el punto de vista científico. También es cierto que, en algunos de los modelos de transmisión documentados, casi siempre existe la coinfección con algún otro patógeno, cosa que no debería sorprender ya que… es lo que suele ocurrir en condiciones de campo.
Morbilidad 50% pero oscila entre el 5 y el 20% y la mortalidad está entre el 70-90%. Es imposible encontrar granjas porcinas seronegativas al PCV2.
Otras enfermedades asociadas al PCV2 son:
- PCV2 – Pneumonia.
- PCV2 - Deplesión linfoídea.
- PCV2 - Fallas reproductivas y abortos.
- PCV2 - Miocarditis y vasculitis en cerdos en crecimiento.
- PCV2 – Enteritis.
- PCV2 – Hepatitis.
- PCV2 PNP Neumonía proliferativa y necrotizante.
- PCV2 PDNS Síndrome de dermatitis y nefropatía porcina.
- PCV2 – Complejo Respiratorio Porcino.
- PCV2 – Temblor congénito.
- PCV2 – Síndrome de Desmedro Multisistémico Posdestete, PMWS (post-weaning multi-systemic wasting síndrome) o Circovirosis porcina.
Existe un efecto camada, porque la enfermedad tiende a afectar más a unas camadas que a otras, dentro de una explotación. Machos castrados más sensibles a la enfermedad, así como lechones más débiles y de menor peso al destete. Se ha detectado cierta resistencia en animales de raza Pietrain.
8.- Patogenia.
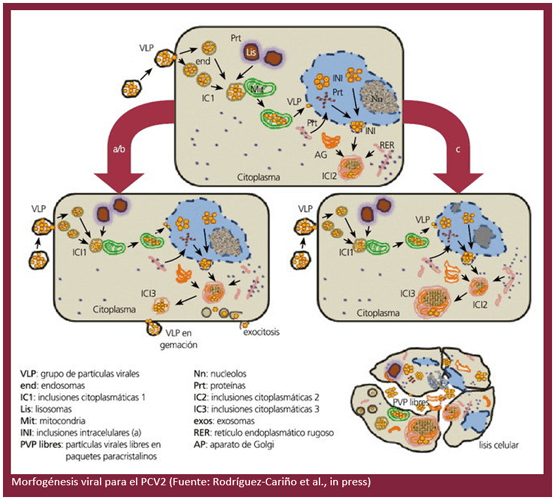
Desde la aparición de la CP, diferentes investigaciones han explicado parcialmente la morfogénesis del PCV2 y su relación con las células, en particular los realizados por el grupo de investigación de la Universidad de Ghent (Bélgica), quienes proponen, a través de otras metodologías, la internalización del virus a través de vesículas endocíticas una vez que el mismo se ha adherido a la superficie celular.
Se sostiene que esta primera fase celular puede tardar de 0 a 6 horas y en ella, probablemente, participan organelas como los lisosomas. Se observaron inclusiones intracitoplasmáticas contentivas de partículas virales.
Descripción de los cambios subcelulares in vitro.
A través de estudios ultraestructurales de infecciones experimentales in vitro llevados a cabo por el grupo de investigación del CReSA (Rodríguez-Cariño et al., in press), se ha propuesto la participación de la mitocondria en las primeras fases citoplasmáticas de replicación viral en la célula.
Estas investigaciones han demostrado la presencia de partículas virales que conforman conglomerados o factorías virales (VF) en estas organelas, lo cual no había sido previamente descrito con ningún otro virus conocido (Novoa et al., 2005).
Además, las mitocondrias muestran importantes alteraciones morfológicas cuya disfunción se ha relacionado con procesos inflamatorios.
Aunque no es un hecho frecuente, la patogénesis de algunos virus ADN y ARN, como el de la hepatitis B y el virus de la inmunodeficiencia adquirida, ha mostrado interacción entre virus y mitocondria.
Hasta la fecha no ha sido dilucidada cuál es la participación activa de la mitocondria en la replicación del PCV2 ni de otros orgánulos en el proceso de replicación viral, lo que sí ha sido demostrado en otras infecciones virales (Gómez-Villamandos et al., 1997; Mettenleiter, 2002; Mhamdi et al., 2007; Salanueva et al., 2003).
Es importante puntualizar que la mitocondria posee elementos moleculares y estructurales que pudieran facilitar la replicación viral.
El estudio in vitro ha permitido mostrar que hay cambios conformacionales de las partículas virales en su fase nuclear, la cual se ha señalado como una fase importante de la replicación viral, lo que se corresponde con lo referido en investigaciones previas (Finsterbusch y Mankertz, 2009).
De igual forma, se describió una segunda fase citoplasmática en la que parecía que participan activamente otros orgánulos en el ensamblaje, encapsidación y transporte viral (Novoa et al., 2005; Risco et al., 2002; Rodríguez-Cariño et al., in press).
Es importante acotar que durante esta infección experimental se observó en mayor grado el número de células muertas/apoptóticas a medida que pasaban las horas postinfección.
Hallazgos morfológicos en células de linfonodos.
Se han evaluado ultraestructuralmente linfonodos inguinales y mediastínicos procedentes de animales clínicamente afectados con CP y que cumplían con los criterios diagnósticos de la enfermedad (Segalés et al., 2005).
Se han evaluado ultraestructuralmente linfonodos inguinales y mediastínicos procedentes de animales clínicamente afectados con CP y que cumplían con los criterios diagnósticos de la enfermedad (Segalés et al., 2005).
Al igual que en otras investigaciones realizadas por el grupo de investigación del CReSA (Pérez-Martín et al., 2007), en este tejido se demostró la presencia de VF del PCV2 en un número importante de células histiocíticas/macrófagos (Rodríguez-Cariño y Segalés, 2009; Rodríguez-Cariño et al., 2010).
Similarmente a lo descrito en la primera fase de replicación de las infecciones experimentales in vitro, En histiocitos/macrófagos, linfocitos, células dendríticas y endoteliales se refirieron importantes alteraciones morfológicas subcelulares, particularmente en los macrófagos.
Sin embargo, sólo estas últimas células mostraron partículas virales de PCV2 y se demostró la localización del virus en la mitocondria a través de técnicas específicas de microscopía electrónica de transmisión y confocalidad (Rodríguez-Cariño et al., 2010). Esto reforzó la teoría expuesta en relación a la participación de las mitocondrias, de acuerdo a los resultados obtenidos en los estudios in vitro previamente citados (Rodríguez-Cariño et al., in press).
Pocos histiocitos mostraron inclusiones intranucleares, mientras que en algunos de ellos se observaron grandes inclusiones de paquetes virales (VF) que ocupaban amplias áreas citoplasmáticas (ICI). Estas grandes inclusiones podrían corresponder a los cuerpos de inclusión descritos histopatológicamente en los macrófagos que infiltran tejidos linfoides de animales afectados con CP (Rosell et al., 1999; Segalés et al., 2004).
De igual manera, se observaron partículas virales entre restos apoptóticos de células histiocíticas/macrófagos. Se podría especular, como ocurre en otras infecciones virales, que estas grandes estructuras virales intracitoplasmáticas podrían representar un paso previo a la lisis celular en la infección por PCV2, induciendo a su vez a la autofagia, lo que facilitaría la liberación de la progenie viral y el ciclo infeccioso (Jiang et al., 2008). Este proceso podría ser una forma alternativa de liberar el PCV2 en el espacio extracelular.
Los resultados observados en tejidos procedentes de animales afectados con CP indican de manera inequívoca que el PCV2 es capaz de replicarse en los macrófagos, aunque este tema ha sido históricamente controvertido.
En otras palabras, PCV2 provocaría un perjuicio sobre el factor de maduración de las células dendríticas, evitando así que se desarrollen respuestas inmunitarias eficientes frente a otros patógenos y, probablemente, frente al propio PCV2.
En la patogenia de las lesiones vasculares, se ha sugerido un mecanismo de hipersensibilidad de tipo III. La aceptación de este mecanismo intermediario de la enfermedad ha llevado a la búsqueda probable de agentes desencadenantes, entre ellos Streptococcus spp, Actinobacillus pleuropneumoniae, Haemophilus parasuis y Pasteurella Multocida.

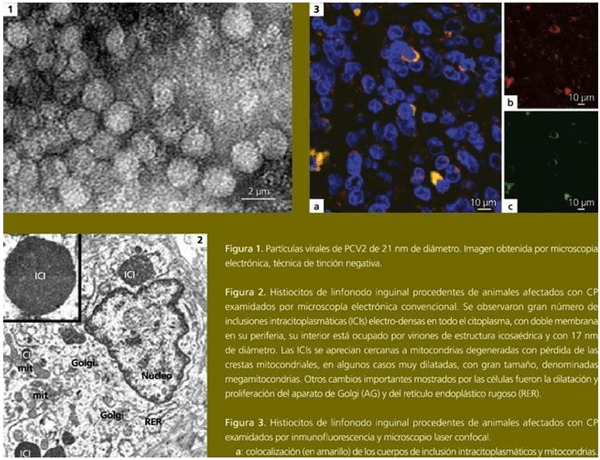
El PCV2 se suele encontrar habitualmente en el citoplasma y en el núcleo de células del sistema inmune, como ya hemos mencionado. Éstas células son: macrófagos de órganos linfoides, células dendríticas de órganos linfoides, células gigantes multinucleadas, células de Kupffer del hígado, macrófagos pulmonares alveolares e intersticiales y macrófagos en infiltrados inflamatorios de múltiples órganos.
Desde el punto de vista cuantitativo, las células de línea monocito-macrófagos contienen una gran cantidad de material vírico cuando se compara la existencia de antígeno o ácido nucleico en otros tipos celulares.
9.- Signos clínicos y lesiones macroscópicas.
La presentación clínica de las enfermedades tiende a cambiar con el tiempo, ya que durante su aparición y sus primeros meses/años de ocurrencia tiende a comportarse de forma epizoótica, y posteriormente tiende a la “estabilización” relativa en un marco enzoótico.
Esta situación, por supuesto, tampoco escapa a la circovirosis porcina. Por otro lado, el curso de la epidemiología de una enfermedad suele tener un efecto muy marcado sobre la forma en que se percibe clínicamente a nivel de campo. Mientras que a finales de los años 90 y hasta 2003, aproximadamente, la circovirosis porcina se caracterizaba por un muy marcado incremento del porcentaje de mortalidad y de cerdos retrasados en el crecimiento en un número relativamente elevado de granjas, esta situación ha ido atenuándose con el tiempo, de manera que al día de hoy estos porcentajes son generalmente menores y en un número más limitado de granjas.
Ello no significa, no obstante, que de forma particular aún existan casos concretos de granjas con altos porcentajes de mortalidad y de animales retrasados. Lógicamente, el retraso en el crecimiento es un hallazgo característico de la circovirosis porcina, pero existen muchas otras enfermedades porcinas que cursan con esta sintomatología.
Los signos clínicos que tradicionalmente han definido la circovirosis porcina son la mortalidad y el retraso en el crecimiento, tal como se ha dicho, pero también son sugestivos de la enfermedad el incremento de tamaño de linfonodos subcutáneos (básicamente linfonodos inguinales superficiales), la palidez corporal (anemia), las alteraciones respiratorias (disnea), la diarrea y, ocasionalmente, la ictericia.
La frecuencia de estos hallazgos debe considerarse variable. En algunas granjas, conjuntamente con una mortalidad incrementada, dominan los problemas respiratorios; mientras que otras se caracterizan sobre todo por alteraciones digestivas o simplemente por retraso en el crecimiento.
En la mayoría de los casos de circovirosis porcina, ha sido una constante la falta de respuesta a los tratamientos antibióticos. Esta situación es la que sugirió, ya desde un principio, el posible efecto inmunosupresor de esta enfermedad. También es importante destacar que la aparición del proceso clínico tiende a tener un carácter “individual”; es decir, los animales que enferman suelen encontrarse distribuidos de forma irregular dentro de la nave afectada. Por tanto, es frecuente que aparezcan uno o dos animales afectados, de forma aparentemente aleatoria, y el resto de cerdos del mismo corral se mantienen sanos sin ningún indicio de enfermedad.
Por tanto, y a pesar de que la transmisión horizontal de la enfermedad ha sido demostrada, existe también una susceptibilidad individual, probablemente de origen genético. Actualmente no se conocen los determinantes de esta aparente susceptibilidad genética, pero no se trata de un problema de raza, sino de línea genética concreta en contextos de granja determinados.
Cabe recordar que la circovirosis porcina es una enfermedad multifactorial y la genética animal debe considerarse como un factor más en el “rompecabezas” de esta entidad patológica.
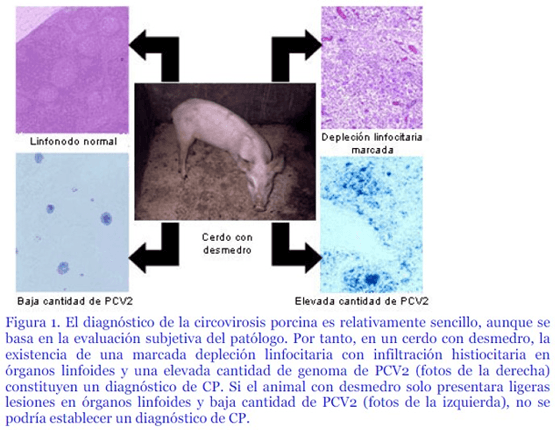
La necropsia siempre es un elemento diagnóstico importante para la mayoría de enfermedades, y también para la circovirosis porcina. Al margen de unas lesiones concretas que a continuación repasaremos, el hallazgo patológico quizás más relevante en casos de circovirosis porcina es el hecho de que al examinar unos cuantos animales, generalmente, no se obtiene un “patrón patológico” específico. En otras palabras, es frecuente que exista una variabilidad importante entre los hallazgos de necropsia, y que coincidan en la misma visita animales con evidencias de un proceso respiratorio, otros con diarrea, otros que mueren de úlcera gástrica y otros sin indicios macroscópicos claros de muerte.
Esta situación patológica sugiere otra vez el carácter inmunosupresor de la circovirosis porcina. Por otro lado, como ya se ha señalado, se pueden encontrar muchas otras lesiones dependiendo de las enfermedades concomitantes que puedan padecer los animales, y no es raro encontrar cerdos que presentan consolidación pulmonar cráneo-ventral (bronconeumonía catarral-purulenta, indicadora de una infección bacteriana pulmonar), úlcera gástrica de la pars esofágica, mono o poliserositis (infecciones bacterianas sistémicas), colitis catarral o fibrinonecrotizante, etc.
Al fin y al cabo, la expresión clínica de una granja que sufre circovirosis porcina acabará siendo aquella que aúne el conjunto de las distintas enfermedades presentes, con un dominio mayoritario de animales con retraso en el crecimiento y elevada mortalidad. Por tanto, no debería sorprender en base a lo señalado anteriormente, que el diagnóstico definitivo de la circovirosis porcina no pueda establecerse exclusivamente en base a los hallazgos clínicos y macroscópicos.
Lo que la sintomatología clínica y la necropsia aportan son indicios, más o menos consistentes, de que podría tratarse de una circovirosis porcina. Lógicamente, cuanto más evidente sea el cuadro clínico y exista una mayor cantidad de animales con lesiones asociables de forma directa a la enfermedad, más probable es que se trate de una circovirosis porcina.
No obstante, el diagnóstico definitivo de la enfermedad, al menos a día de hoy, necesita al menos del estudio histopatológico de los órganos linfoides de los animales afectados.
Los principales signos clínicos, ordenados según la frecuencia:
- alteraciones respiratorias sin respuesta a terapias antibióticas o desmedro.
- retraso en el crecimiento producido por pérdida de peso progresiva con emaciación o anemia, o diarrea o ictericia, o aumento en los porcentajes de mortalidad desde 2 - 4% a 5 - 15%.
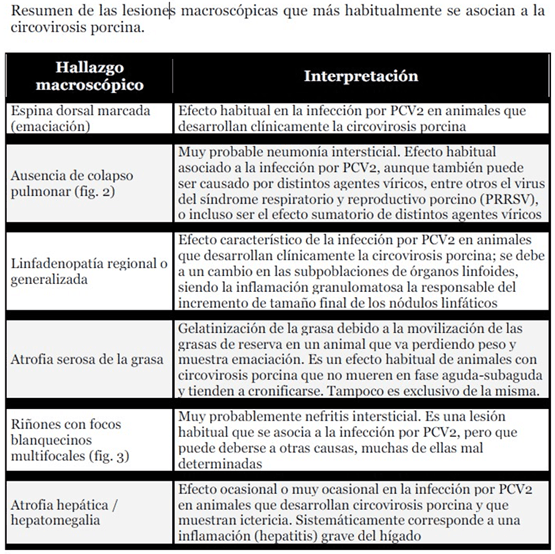
Las principales lesiones encontradas, ordenadas de mayor a menor frecuencia, son:
- Caquexia.
- Ausencia de colapso pulmonar.
- Consolidación pulmonar.
- Hipertrofia de ganglios (local o generalizado), especialmente inguinales superficiales, mediastinitos y mesentéricos.
- Úlceras gástricas crónicas y agudas.
- Serositosis (mono o poliserositosis).
- Pleuritis.
- Pericarditis.
- Peritonitis.
Además, con menor frecuencia se pueden observar:
- Riñones con focos blanquecinos.
- Neumonía necrotizante.
- Colitis.
- Atrofia hepática.
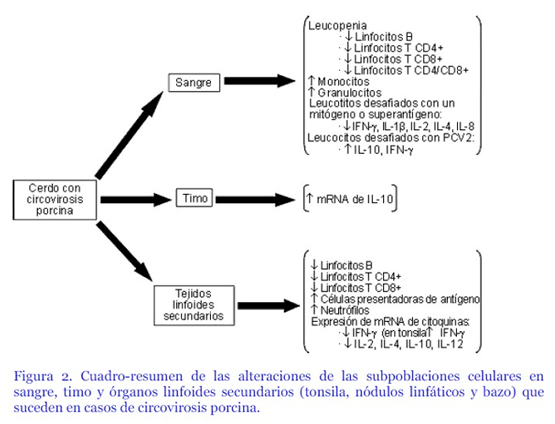
10.- Diagnóstico.
Se inicia con la historia clínica, la anamnesis y los signos clínicos observados en el grupo de cerdos afectados, luego debe realizarse un estudio histopatológico básico, en el que se pueden detectar lesiones características.
Con la finalidad de detectar la presencia de material antigénico, se pueden realizar dos técnicas de biología molecular: hibridación in situ e inmunohistoquímica.
Las cuales nos ayudan a establecer el tropismo celular del PCV2 (monocotios-macrófagos y células presentadoras de antígenos).
La detección del virus no equivale a la detección de la enfermedad.
Otras pruebas:
ELISA de captura, que emplea anticuerpos monoclonales específicos de PCV2. Esta prueba detecta casos positivos de PCV2, aislados de distintos países. Tiene una sensibilidad menor a la técnica de IHQ o HS, y como era de esperar, significativamente menor a la obtenida empleando diferentes métodos de PCR, ya que esta prueba de ELISA requiere la presencia de grandes cantidades de antígenos virales en la muestra a analizar.
Aislamiento viral en la línea celular pk15.
Resumen de los hallazgos en histopatología:
- Depleción linfoide en áreas interfoliculares y disminución o ausencia en el número de folículos linfoides y desorganización del tejido linfoide.
- Aumento de células de aspecto de tipo histiocitario.
- Cuerpos de inclusión intracitoplasmáticos principalmente en linfonódulos y placas de Peyer localizados en el citoplasma de macrófagos y células sinticiales.
Resúmen de la confirmación laboratorial:
- Detección de ácidos nucleicos de PCV2 por medio de hibridación in situ.
- Detección de PCV2 antígeno viral por inmunohistoquímica.
Muestras requeridas o muestras para histopatología: tejidos linfoides (tonsilas linfonódulos), bazo, pulmón, hígado, riñón e intestino. Se requieren 3 a 5 cerdos del plantel de donde provienen los órganos con lesiones microscópicas y linfonódulos o linfoadenopatías.
Enfermedades asociadas a la circovirosis porcina, en orden de importancia y según su frecuencia de presentación, son:
- Síndrome respiratorio y reproductivo (PRRS).
- Mycoplasma hyopneumoniae.
- Streptococcus spp.
- Influenza porcina (SIV).
- Salmonellaspp.
Otros patógenos de menor ocurrencia son:
- Haemophilus parasuis.
- Streptococcus suis.
Diagnóstico diferencial:
- Síndrome respiratorio y reproductivo porcino (PRRS).
- Enfermedad respiratoria inespecífica.
- Enfermedad de Glässer.
- Colibacilosis post-destete.
- Adenomatosis intestinal porcina (ileitis proliferativa).
- Intoxicación por Carbadox/Olaquindox.
- Úlcera gástrica en pars-esofágica.
- Disentería porcina.
- Espiroquetosis porcina.
- Epiritrozonosis.
11.- Prevención, control y erradicación.
La respuesta a los tratamientos antibióticos no es buena y en algunos casos puede resultar hasta negativa, sobre todo en aquellos donde el PCV2 está asociado con el Síndrome de Dermatitis y Nefropatía, ya que, al existir lesiones renales, la eliminación de las sustancias inyectadas puede verse alterada.
Evitar tratamientos inyectables, solo originamos estrés y aumentamos las muertes por falla cardíaca.
En casos donde la diarrea es uno de los síntomas más evidentes, puede intentarse el uso de soluciones con electrolitos y sustancias acidificantes, para intentar controlar a los patógenos secundarios. Evitar el uso de vacunas o inmunoestímuladores, durante el período de riesgo o curso agudo, ya que pueden potenciar la infección por PCV2.
Las acciones que han resultado en un mayor control de la enfermedad han sido mejorar el manejo, el bienestar animal y la vacunación, mostrando esta última, una eficacia muy prometedora, disminuyendo la mortalidad, incrementando el peso final y disminuyendo el porcentaje de cerdos atrasados en el ciclo de producción, así como el índice de abortos.
La erradicación o supresión total de la enfermedad se realiza a través de la eliminación del agente patógeno, por ello, teniendo en cuenta que el PCV2 es un virus ubicuo, altamente contagioso, infeccioso y muy resistente; parece claro que erradicar la infección por PCV2 puede ser una tarea muy difícil; además algunos estudiosos afirman que no debería de erradicarse por completo, ya que el riesgo de reinfección es muy elevado.
Por ello, además del elevado costo que supondría realizar mejoras en el manejo, el bienestar animal y en las acciones orientadas a eliminar la infección, es que no se ha podido erradicar.
Tipos de vacunas:
- Inactivadas.
- Recombinantes.
- Solo con el DNA viral.
- Solo con partes del agente patógeno.
Todas han demostrado cierto efecto protector, sea a través de la disminución de la densidad de las lesiones linfoides o por la disminución en el número de animales enfermos, tras la vacunación.
Ejemplos de vacunas en nuestro medio:

Referencias
Faurez, F., Dory, D., Grasland, B., Jestin, A. (2009) Replication of porcine circoviruses. Virol. J 2009; 6:60. May 18.
Noriega, J., Reyes, P., Bucarey, S. (2007) Circovirus porcino: un virus pequeño que genera un gran problema. Avances en Ciencias Veterinarias 22, pp. 62-71.
Sarradell J., Perez AM., Comba E., Pereira N., Anthony l., Andrada M., SegalesJ. (2004) Pathological findings in pigs affected by postweaning multisystemic wasting síndrome in Argentina. Rev. Arg. Microbiol. Jul-Sep; 36 (3): 118-24.
Páginas webs:
- http://www.3tres3.com/especial_circovirus/index.php?id_ficha=219&id_rel=164 (Fecha de consulta 9-11-17).
Temas relacionados:
Autores:
Universidad Autónoma Gabriel René Moreno - UAGRM
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.





