
Contenido patrocinado por:
VETANCO SA
Evaluar la actividad enzimática en el control de micotoxinas
Publicado: 17 de junio de 2020
Por: MV. Esp. Bruno Vecchi
Las micotoxinas (MX) son metabolitos secundarios tóxicos producidas por varios hogos filamentosos, principalmente Aspergillus, Fusarium y Penicillium [1]. Cuando los animales consumen alimentos contaminados con micotoxinas, ellos sufren una serie de efectos tóxicos como ser: disminución del consumo de alimentos, disminución de la ganancia de peso, diarrea, inmunosupresión, vómitos, lesiones ulcerativas, etc. [2]. Existen muchas estrategias distintas son utilizadas en los molinos y las granjas para reducir la concentración de micotoxinas: inactivación térmica, irradiación, dilución física y removedores de micotoxinas [3].
Los removedores de micotoxinas son, actualmente, la herramienta más eficaz para disminuir la concentración de micotoxinas en el animal. Hay dos grandes grupos de removedores de micotoxinas: los secuestrantes y los inactivadores enzimáticos. Los secuestrantes (SC) trabajan evitando la absorción de las micotoxinas a través del tracto gastrointestinal al unirlas a la superficie de los mismos. Pueden ser inorgánicos (Bentonitas, Aluminosilicatos, etc.) u orgánicos (Pared de levaduras) [4,5]. Los inactivadores enzimáticos (EZ) poseen una actividad biológica que les permite alterar la estructura química de las MX, transformándolas en metabolitos con menor o nulo efecto toxico. Normalmente pueden ser la totalidad de una bacteria, levadura o tan solo un extracto enzimático [6].
Las MX se clasifican en polares y no polares según su estructura química [7]. Las micotoxinas polares, como Aflatoxina B1 y Fumonisina B1 son las más polares de las micotoxinas y son más fácilmente secuestradas que las no polares. A su vez, el peso molecular, solubilidad, capacidad de disociación y cargas iónicas también juegan un papel esencial en la capacidad de ser adsorbidas [8]. Aflatoxina B1 tiene una mayor tasa de adsorción que Fumonisina B1, debido a esto, Aflatoxina B1 es el principal objetivo de los secuestrantes [9].
La mayoría de los secuestrantes han demostrado una baja, o nula, capacidad para adsorber micotoxinas NO polares como Deoxynivalenol (DON) y Zearalenona (ZEA) [6]. Por otra parte, los inactivadores enzimáticos han demostrado ser la mejor opción para el control de dichas micotoxinas [10, 11].
A la fecha, no existe un método analítico sencillo y practico que pueda evaluar la capacidad de remoción de micotoxinas in vivo. Los métodos de evaluación estándar son los ensayos in vitro. A pesar de esto, es importante que las condiciones del ensayo in vitro sean estrictamente controladas para que se asemejen lo más posible al modelo in vivo, de manera tal que los resultados puedan ser replicados [12].
En el presente ensayo, se diagramo un modelo in vitro que asemeja las condiciones del tracto gastrointestinal del animal. Replicando los tiempos de permanencia del alimento en cada una de las estructuras anatómicas, los pH de cada una de las estructuras, la temperatura, la motilidad intestinal y la presencia de enzimas digestivas propias del animal. De esta forma se logró un modelo que se ajusta, con gran satisfacción, a las condiciones in vivo.
Para el estudio se utilizó una dosis de desafío de DON según las directivas de China Hygienic Standard for Feed (GB13078-2017) y las regulaciones de la FDA, resultando en una dosis de 5.000 ppb [13].
Los removedores evaluados, expuestos en la Tabla 2, se seleccionaron en base a los de mayor prevalencia en el mercado. Se utilizaron a las dosis recomendadas por los fabricantes.
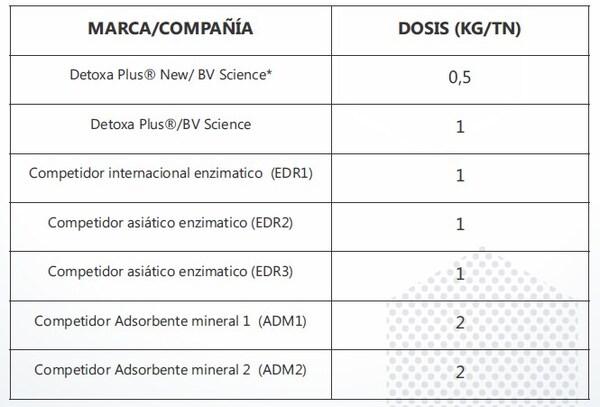
Tabla 2. EDR: Inactivadores enzimáticos. *Producto en fase de desarrollo, no disponible para la venta. Para información detallada por favor consultar el paper completo
Para la evaluación se utilizó HPLC ya que es considerado el método más preciso para evaluar las micotoxinas.
La dosis inicial fue de 5.000 ppb de DON, esta dosis está muy por encima de los límites máximos recomendados.
En el Gráfico 1 se puede observar la capacidad de remoción de DON en función del tiempo a lo largo del modelo in vitro del tracto gastrointestinal.
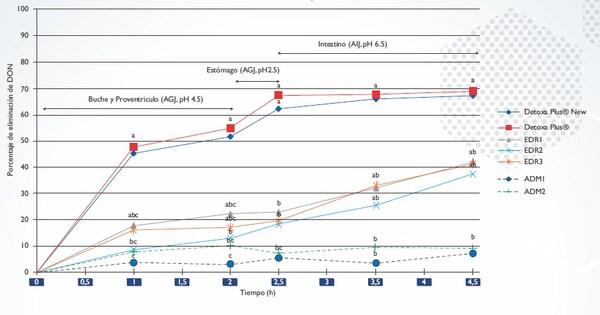
Gráfico 1. Remoción de DON (5.000 ppb iniciales) a lo largo de 4.5 horas en distintos pH con la presencia de inactivadores enzimáticos (línea solida) o adsorbentes (línea punteada).
AGJ: jugo gástrico artificial,
AIJ: jugo intestinal artificial.
EDR: inactivador enzimático.
Diferentes letras en la misma columna indican diferencias significativas entre tratamientos con p< 0.05
Discusión
Cuando evaluamos las primeras 2 horas podemos observar cómo Detoxa Plus® y Detoxa Plus®New (producto en fase de desarrollo, no disponible para la venta) poseen una capacidad deeliminación significativamente superior (50% y 52% respectivamente) al resto de los inactivadores enzimáticos (EDR1 es de 22%, EDR2 de 13% y EDR3 de 17%) y de los secuestrantes (ADM1 es de 3% y ADM2 de 7%). Cuando el pH desciende incluso más, debido al pasaje de la solución al estómago, encontramos un incremento aún mayor en la capacidad de remoción del Detoxa Plus® y el DetoxaPlus® New (67% y 62% respectivamente), mientras que el resto de los removedores no presentancambios significativos.
Esta capacidad de eliminar las micotoxinas en las primeras porciones del tracto gastrointestinal es especifica de Detoxa Plus®, ya que, a diferencia del resto, las enzimas presentes en el producto poseen su pico de actividad enzimática a pH ácidos.
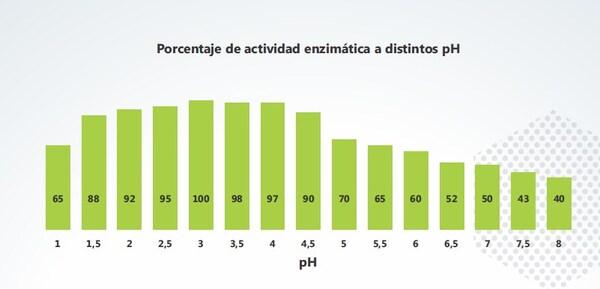
Cuando la solución llega a los intestinos, y se genera un incremento de pH (de 2.5 a 6.5), evidenciamos como la capacidad de biotransformación del Detoxa Plus® se ve disminuida, mientras que el resto de los inactivadores enzimáticos aumenta significativamente. Esta variación se da, ya que, las enzimas del resto de los productos evaluados, poseen su pico de actividad a un pH más cercano a la neutralidad. Por otra parte, la actividad de los secuestrantes no varía, demostrando que la capacidad de adsorción de los mismos no se ve influenciada por el pH.
Por último, luego de la totalidad del tránsito de la solución por el modelo animal (4.5 horas), se obtuvo una capacidad de remoción TOTAL de DON del Detoxa Plus® y el Detoxa Plus® New de (69% y 68% respectivamente) mientras que el resto de los inactivadores enzimáticos tuvieron una acción del 42% (EDR1), 41% (EDR2) y 38% (EDR3). A su vez los adsorbentes tuvieron una capacidad de eliminación de DON del 7% y 9% para ADM1 y ADM2 respectivamente.
La diferencia de eliminación total de DON entre Detoxa Plus® y el resto de los productos se da debido a que las enzimas de Detoxa Plus® comienzan a trabajar a pH acido, en las primeras porciones del tracto gastrointestinal, lo que le permite un mayor tiempo de acción total. El resto de los productos aumenta su velocidad de acción con la llegada al intestino, pero para entonces el alimento permanecerá muy poco tiempo en el mismo.
Conclusión
El presente trabajo demuestra que los inactivadores enzimáticos son una opción robusta para la eliminación de DON en el modelo in vitro y dentro de estos, el Detoxa Plus® y Detoxa Plus® New son los de mayor capacidad de eliminación. A su vez, bajo las mismas condiciones de desafío, los secuestrantes no fueron capaces de eliminar DON.
Referencias
- Pierron, A.; Alassane-Kpembi, I.; Oswald, I.P. Impact of two mycotoxins deoxynivalenol and fumonisin on pig intestinal health. Porc. Health Manag. 2016, 2, 21. [CrossRef] [PubMed]
- Wang, S.; Yang, J.; Zhang, B.; Wu, K.; Yang, A.; Li, C.; Zhang, J.; Zhang, C.; Rajput, S.A.; Zhang, N.; et al. Deoxynivalenol impairs porcine intestinal host defense peptide expression in weaned piglets and IPEC-J2 Cells. Toxins 2018, 10, 541. [CrossRef] [PubMed]
- He, J.; Zhoua, T.; Christopher, Y.J.; Greg, B.J.; Scott, P.M. Chemical and biological transformations for detoxification of trichothecene mycotoxins in human and animal food chains: A review. Trends Food Sci. Technol. 2010, 21, 67–76. [CrossRef]
- Nedeljkovic-Trailovic, J.; Trailovic, S.; Resanovic, R.; Milicevic, D.; Jovanovic, M.; Vasiljevic, M. Comparative investigation of the e_cacy of three di_erent adsorbents against OTA-induced toxicity in broiler chickens. Toxins 2015, 7, 1174–1191. [CrossRef]
- Saminathan, M.; Selamat, J.; Abbasi Pirouz, A.; Abdullah, N.; Zulkifli, I. Effects of Nano-composite adsorbents on the growth performance, serum biochemistry, and organ weights of broilers fed with aflatoxincontaminated feed. Toxins 2018, 10, 345. [CrossRef]
- Kabak, B.; Dobson, A.D.; Var, I. Strategies to prevent mycotoxin contamination of food and animal feed: A review. Crit. Rev. Food Sci. Nutr. 2006, 46, 593–619. [CrossRef]
- Wang, G.; Lian, C.; Xi, Y.; Sun, Z.; Zheng, S. Evaluation of nonionic surfactant modified montmorillonite as mycotoxins adsorbent for aflatoxin B1 and zearalenone. J. Colloid Interface Sci. 2018, 518, 48–56. [CrossRef] [PubMed]
- Huwig, A.; Freimund, S.; Kappeli, O.; Dutler, H. Mycotoxin detoxication of animal feed by different adsorbents. Toxicol Lett. 2001, 122, 179–188. [CrossRef]
- Phillips, T.D.; Kubena, L.F.; Harvey, R.B.; Taylor, D.R.; Heidelbaugh, N.D. Hydrated sodium calcium aluminosilicate: A high a_nity sorbent for aflatoxin. Poult. Sci. 1988, 67, 243–247. [CrossRef] [PubMed]
- Karlovsky, P.; Suman, M.; Berthiller, F.; De Meester, J.; Eisenbrand, G.; Perrin, I.; Oswald, I.P.; Speijers, G.; Chiodini, A.; Recker, T.; et al. Impact of food processing and detoxification treatments on mycotoxin contamination. Mycotoxin Res. 2016, 32, 179–205. [Cro ssRef]
- Tan, H.; Hu, Y.; He, J.; Wu, L.; Liao, F.; Luo, B.; He, Y.; Zuo, Z.; Ren, Z.; Zhong, Z.; et al. Zearalenone degradation by two Pseudomonas strains from soil. Mycotoxin Res. 2014, 30, 191–196. [CrossRef] [PubMed]
- Hahn, I.; Kunz-Vekiru, E.; Twaruzek, M.; Grajewski, J.; Krska, R.; Berthiller, F. Aerobic and anaerobic in vitro testing of feed additives claiming to detoxify deoxynivalenol and zearalenone. Food Addit. Contam. Part A 2015, 32, 922–933. [CrossRef] [PubMed]
- Park, D.L.; Troxell, T.C. US Perspective on mycotoxin regulatory issues. Adv. Exp. Med. Biol. 2002, 504, 277–285.
Temas relacionados:
Preguntas Relacionadas
¿Cuáles son los efectos tóxicos que sufren los animales al consumir alimentos contaminados con micotoxinas?
Cuando los animales consumen alimentos contaminados con micotoxinas, ellos sufren una serie de efectos tóxicos como ser: disminución del consumo de alimentos, disminución de la ganancia de peso, diarrea, inmunosupresión, vómitos, lesiones ulcerativas, etc.
¿Cuáles son las estrategias utilizadas para reducir la concentración de micotoxinas en los molinos y las granjas?
Existen muchas estrategias distintas son utilizadas en los molinos y las granjas para reducir la concentración de micotoxinas: inactivación térmica, irradiación, dilución física y removedores de micotoxinas.
¿Cuáles son las opciones para la eliminación de deoxinivalenol (DON)?
El presente trabajo demuestra que los inactivadores enzimáticos son una opción robusta para la eliminación de DON en el modelo in vitro y dentro de estos, el Detoxa Plus® y Detoxa Plus® New son los de mayor capacidad de eliminación. A su vez, bajo las mismas condiciones de desafío, los secuestrantes no fueron capaces de eliminar DON.
Autores:
VETANCO SA
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.

