Parvovirosis Canina: situación actual y protección de las vacunas contra las nuevas variantes virales circulantes en la región
Resumen
Parvovirus canino (CPV) tipo 2 es uno de los principales agentes causantes de diarreas en cachorros en varias partes del mundo. En los últimos años ha habido un interés trascendente por esta enfermedad debido a que luego del descubrimiento de la misma, a fines de la década del 70, se han encontrado nuevas variantes del virus (CPV-2a, CPV-2b, CPV-2c). En Uruguay esta enfermedad es una de las principales virosis en cachorros y las principales variantes circulantes son los genotipos CPV-2a y CPV-2c. Se ha observado que los síntomas clínicos producidos por la infección con las nuevas variantes virales son levemente diferentes a los producidos por el genotipo original (CPV-2). La forma de controlar CPV es a través de la vacunación de los animales susceptibles. Actualmente, la protección que confieren las vacunas comerciales contra las nuevas variantes es discutida. Algunos autores afirman que las vacunas con CPV-2 protegen eficazmente la enfermedad producida por las nuevas variantes. Sin embargo, otros trabajos demuestran lo contrario. El objetivo de esta revisión es recopilar la bibliografía actual existente de modo de facilitar la interpretación de la situación de la Parvovirosis canina en el Uruguay y la región.
PALABRAS CLAVE: Parvovirus canino, CPV-2c, diagnóstico, Uruguay.
Summary
Canine Parvovirus (CPV) type 2 is one of the main causative agents of diarrhea in puppies in different parts of the world. In recent years there has been an important concern about this disease because after its discovery, in the late 70's, new virus variants (CPV-2a, CPV-2b, and CPV-2c) have been found. This disease is associated with a major viral pathogen in puppies; in Uruguay the main circulating variants are CPV-2a and CPV-2c. It has been observed that the clinical symptoms produced by infection with the new viral variants are slightly different from those produced by the original (CPV-2). The way to control CPV is through vaccination of susceptible animals. Currently, the ability of new vaccines to confer protection against new variants is discussed. Some authors assert that the CPV-2 vaccines effectively protect against the disease caused by new variants. Nevertheless, other studies demonstrate the contrary. The goal of this review is to gather existing current literature, in order to facilitate interpretation of the situation of canine parvovirus in Uruguay and the region.
Key words: canine parvovirus, CPV-2c, diagnosis, Uruguay.
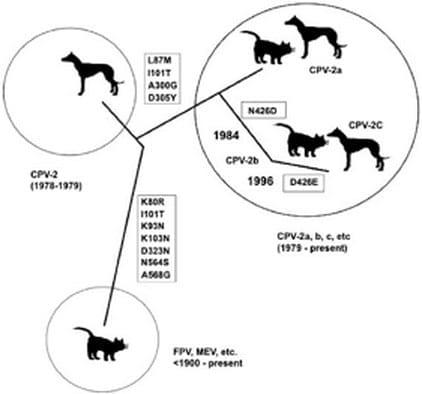
En cuanto a la distribución de las nuevas variantes a nivel mundial, CPV-2a, CPV-2b y CPV-2c circulan con diferentes frecuencias en los países de acuerdo a la región geográfica analizada. En Uruguay la enfermedad está presente desde hace varias décadas. El diagnóstico está basado principalmente en la anamnesis y los síntomas clínicos. En un trabajo realizado con 30 muestras provenientes de distintos departamentos (Montevideo, Canelones, San José y Lavalleja) la principal variante viral detectada fue CPV-2c (Pérez y col., 2007). Por otro lado también se han realizado aislamientos y caracterización de CPV-2c en cultivos celulares a partir de animales enfermos (Puentes y col., 2011; Blanc y col., 2011). Recientemente Pérez y col (2011) encontraron una mayor proporción de CPV-2a en muestras provenientes de casos clínicos ocurridos en caninos en el año 2010. Por lo tanto hasta el momento las dos variantes que han sido detectadas con mayor frecuencia en casos clínicos en el Uruguay son CPV-2a y CPV-2c. En referencia a algunos países de la región, en Argentina Calderón y col (2011) encontraron la variante CPV-2c en mayor proporción de muestras positivas analizadas provenientes de distintas partes de ese país. Al analizar la secuencia completa de la VP2 de distintos aislamientos se pudo observar que, a nivel nucleotídico, muestras Argentinas de CPV-2c tienen un 99,3% a 99,9% de identidad con relación a cepas internacionales de CPV-2c, mientras que la identidad a nivel de aminoácidos es de 99 ,7% a 100% (Calderón y col., 2012). Esto demuestra que existe un bajo grado de variabilidad en las secuencias analizadas de muestras provenientes de Argentina en relación a cepas internacionales. Sin embargo, los mismos autores encontraron sustituciones a nivel de aminoácidos relevantes en algunas muestras localizadas en regiones expuestas de la VP2 que pueden ser importantes. Por su parte en Brasil, se han detectado las variantes CPV-2a, CPV-2b y CPV-2c en diferentes proporciones en casos clínicos de las ciudades de Rio de Janeiro y Porto Alegre en los últimos años (Streck y col., 2009, Castro y col., 2011).
Varios trabajos han descrito los hallazgos clínicos y hematológicos en perros infectados naturalmente (Hirasawa y col., 1987) o experimentalmente (Macartney y col., 1984) con la cepa original CPV-2. Sin embargo son escasas y algo contradictorias las investigaciones que comparan la patogenicidad de las nuevas variantes virales en relación a CPV-2. CPV infecta los perros a través de la ruta oronasal y alcanza la mucosa intestinal luego de una diseminación inicial por tejidos linfoides. La viremia puede ser intensa y persistir por varias semanas, mismo que el virus haya desaparecido del contenido intestinal (Decaro y col., 2007). Los síntomas clásicos producidos por esta enfermedad mas allá de la variante viral presente, están relacionados en mayor o menor medida a cuadros de anorexia, letargia, vómitos y diarreas mucoides a hemorrágicas (Moon y col., 2008). Si comparamos la enfermedad producida por las nuevas variantes en relación al genotipo original, se ha visto que los genotipos CPV-2a y CPV-2b comúnmente causan una enfermedad más severa que CPV-2 (Decaro y col., 2005a). Se ha demostrado además que estas nuevas variantes, son eliminadas en mayor cantidad en materia fecal que el genotipo original (CPV-2) (Carmichael, 1994). Por otro lado, en relación a las diferencias en cuanto a la patogenicidad entre las nuevas variantes, mediante la técnica de Real Time PCR, se ha investigado la distribución de ADN viral en diferentes tejidos en perros infectados naturalmente con CPV-2a, CPV-2b y CPV-2c. En todos los tejidos analizados , se pudo detectar el genoma viral de los tres genotipos, demostrándose una amplia distribución del virus en el organismo y con un comportamiento similar entre las variantes estudiadas. La mayor carga viral fue detectada en tejidos linfoides con máxima cantidad en tonsilas de perros infectados con CPV-2c y en bazo de perros infectados con CPV-2b. Alta cantidad de virus también fue detectado en médula ósea en perros infectados con CPV-2a. Por otro lado, en la vejiga fue donde se encontró la menor cantidad de ADN viral y, sorpresivamente, los autores encontraron ADN viral en tejido nervioso (cerebro, cerebelo y bulbo cerebral). Finalmente, en la materia fecal el número de copias de ADN fue menor que en los órganos internos (Decaro y col., 2007). Este trabajo si bien fue realizado con pocos animales, no encontraron diferencias importantes entre la infección con CPV-2a, 2b o 2c. En contrapartida, en perros infectados experimentalmente, Moon y col. (2008) sí encontraron que la variante CPV-2a es más patogénica que CPV-2b. En este sentido, también se ha visto que la variante CPV-2c produce síntomas algo diferentes de las causadas por las variantes CPV-2a/2b (por ejemplo diarrea mucoide en lugar de hemorrágica) (Decaro y col., 2005a). En lo que respecta a la patogenicidad de las nuevas variantes en infecciones de células in vitro, Puentes y col. (2011) encontraron que la variante CPV-2c produjo menos efecto citopático (CPE) en cultivos celulares de la línea CRFK que en cultivos primarios obtenidos a partir de corazón fetal canino (FCH). La cepa CPV-2 de referencia no mostró diferencias en cuando al CPE producido entre estos dos cultivos celulares. Todos estos trabajos, si bien representan información relevante para la comprensión de la patogenicidad de las nuevas variantes virales de CPV en perros, tienen la limitante del escaso número de animales estudiados y de que algunos de ellos han sido evaluados en infecciones experimentales o in vitro. Por lo tanto, aun no son suficientes las investigaciones existentes, para comprender con exactitud la patogenicidad de las nuevas variantes virales de Parvovirus canino, comparando con el genotipo original de la enfermedad (CPV-2). Sin embargo, parece ser que del punto de vista clínico actualmente existe una mayor patogenicidad y severidad de la enfermedad en los animales diagnosticados por veterinarios. Si bien esta apreciación clínica es importante no se tiene información suficiente sobre los posibles cuadros clínicos leves producidos por CPV-2c que no llegan al consultorio y se recuperan sin atención veterinaria. Finalmente, existe una percepción clínica que solo los cachorros son susceptibles a la infección inducida por CPV-2. En este sentido, se han descrito brotes de esta enfermedad asociado a enteritis y mortalidad en perros adultos, pero la incidencia probablemente sea muy baja (Decaro y col., 2008).
Estrategias actualmente utilizadas para el diagnóstico viral
Si bien la anamnesis y los síntomas clínicos son fundamentales para realizar el diagnóstico, existen distintos patógenos que pueden causar cuadros similares en perros. Por lo tanto es conveniente la realización del diagnóstico definitivo utilizando una técnica de laboratorio. Varios métodos han sido desarrollados para el diagnóstico de CPV-2: aislamiento viral, Hemoaglutinación, SAT (Slide agglutination test), ELISA, SNAP (test comercial basado en el método del ELISA) e Inmunocromatografía, son métodos muy utilizados para el diagnóstico a partir de materia fecal de animales enfermos (Desario y col., 2005; Marulappa y Kapil, 2009; Schmitz y col., 2009; Puentes y col., 2010, 2011). Sin embargo, la sensibilidad de algunas de estas técnicas es relativamente baja (Esfandiari y Klingeborn, 2000; Desario y col., 2005; Schmitz y col., 2009). Schmitz y col. (2009), demostraron que los tests rápidos para el diagnóstico en material fecal (ej. SNAP test), tienen una alta especificidad pero pobre sensibilidad, al comparar con técnicas mas sensibles. Actualmente otros métodos basados en la detección de ADN viral pueden ser utilizados para el diagnóstico virológico. Se ha demostrado que la Reacción en cadena de la Polimerasa (PCR), la Real Time PCR y la MGB (Minor groove binder), tienen alta sensibilidad para la detección de CPV-2 (Decaro y col., 2005b, 2005c). Con la Real Time PCR y la MGB, es posible además cuantificar el ADN viral presente en la material fecal de perros infectados y es una técnica con alta especificidad, realizándose en un tiempo menor que la PCR convencional con gel de agarosa (Decaro y col., 2005b, 2005c). En un estudio realizado, de un total de 89 muestras analizadas de perros con diarrea, se encontró que la Real Time PCR fue capaz de diagnosticar el mayor número de animales positivos a CPV-2 (n=73), seguidas por PCR (n=68), aislamiento viral (n=54), Hemaglutinación (n=50) e inmunocromatografía (n=41) (Desario y col., 2005). Si bien estos resultados demuestran que la Real Time PCR es actualmente el mejor método para diagnosticar CPV-2, no es una técnica realizable a nivel de clínicas veterinarias, lo que dificulta su utilización de rutina por veterinarios. Actualmente una de las técnicas más utilizada para el diagnóstico rápido a nivel de clínicas veterinarias es la Inmunocromatografia. Es un método simple que puede ser realizado por veterinarios y por los propios dueños de las mascotas para confirmar la sospecha clínica de la enfermedad (Esfandiari y Klingeborn, 2000). Sin embargo se sabe que en estados tardíos de la infección los altos niveles de anticuerpos en el lumen intestinal pueden secuestrar la mayoría de los viriones, por lo que los test que se basan en la unión antígeno-anticuerpo (ej. Inmunocromatografía, hemoaglutinación y ELISA) pueden dar resultados falsos negativos (Desario y col., 2005). En este sentido, Puentes y col. (2010), encontraron baja concordancia en un estudio realizado donde se comparó el diagnóstico clínico realizado por veterinarios con el diagnóstico por las técnicas de Inmunocromatografía y Hemoaglutinación. Estos hallazgos advierten sobre las posibles diferencias que se pueden encontrar entre la clínica y estas técnicas actualmente disponibles, debiéndose ser cauteloso en la interpretación de resultados obtenidos para esta enfermedad.
Respuesta inmune protectora y status inmunitario de la población canina en el Uruguay
La respuesta inmune protectora contra Parvovirus es predominantemente humoral, siendo los anticuerpos capaces de neutralizar la mayoría de las partículas virales. La importancia de los anticuerpos en la protección contra la infección ha sido demostrada por la efectividad de la inmunidad materna mediada por anticuerpos que confiere eficientemente protección contra Parvovirus en las primeras semanas de crecimiento del cachorro. Por lo que la enfermedad ocurre predominantemente en animales jóvenes luego que los anticuerpos maternos han disminuido (Pollock y Carmichael, 1982). La respuesta inmune humoral adquirida por los animales inmunizados naturalmente o por vacunación debería estimular preferentemente la producción de Inmunoglobulinas A (IgA) a nivel local. Se ha visto que existe una relación directa entre títulos de IgA entéricos y la recuperación de la enfermedad (Rice y col., 1982). Esto concuerda con observaciones de Bienenstock y Befus (1980), quienes describen una resistencia inmunológica a la infección con CPV a nivel de mucosas en ausencia inclusive de títulos séricos de anticuerpos. Finalmente, en relación a la protección cruzada in vitro conferida por los anticuerpos contra las distintas variantes virales, se ha encontrado diferencias significativas entre la respuesta contra virus homólogos y virus heterólogos (Cavalli y col., 2008). Por otro lado, en lo que respecta a la inmunidad mediada por células, se ha visto que claramente juega un rol importante y tiene que ver fundamentalmente con la recuperación de la enfermedad (Hoelzer y Parrish, 2010).
En la práctica, en cuanto a los títulos de anticuerpos que protegen contra CPV, se ha descrito que títulos hemoaglutinantes iguales o mayores a 1/80 protegen contra la infección. Sin embargo algunos autores han observado que perros con títulos hemoaglutinantes de 1/160, y que fueron infectados experimentalmente con CPV-2b, tienen una replicación activa de virus luego del desafío. Estos resultados demuestran que la infección con CPV puede ocurrir incluso en presencia de títulos mayores o igual a 1/80, usualmente considerados protectores (Elia y col., 2005) y que quizás la hemoaglutinación no sea la técnica mas adecuada para evaluar la respuesta humoral en perros infectados con el virus (Cavalli y col., 2008). No existen suficientes trabajos científicos en Uruguay que demuestren los niveles de anticuerpos y el riesgo de contraer infección de la población canina vacunada y/o no vacunada. En un estudio realizado recientemente con 142 sueros de animales adultos provenientes de la ciudad de Montevideo, y sin antecedentes de vacunación, se encontró que un 89,4% y un 91% de los animales fueron seropositivos a CPV-2 y CPV-2c respectivamente, con títulos hemoaglutinantes promedios de 1/930 y 1/1370 (Eliopulos y col., 2010). Por un lado, este trabajo demuestra el alto porcentaje de inmunización natural que ocurre con CPV en estos animales. Si bien ya no se detecta la variante CPV-2 en la naturaleza existen reacciones cruzadas entre esta y las nuevas variantes lo que explica el alto porcentaje encontrado en ese estudio. Por otro lado, si consideramos como títulos protectores por hemaglutinación aquellos mayores o igual a 1/80, la población estudiada estaría, en promedio, ampliamente protegidos contra la enfermedad.
Eficacia de las vacunas existentes contra las nuevas variantes virales
La respuesta inmune contra CPV generada por una vacuna puede estar influenciada por varios factores. Dentro de los que tiene que ver con la vacuna en sí, la viabilidad del virus y el título viral en la misma, el grado de atenuación del patógeno, las propiedades antigénicas de las cepas vacunales y la ruta de administración, son factores importantes (De Cramer y col., 2010). En el Uruguay, no se realizan controles de potencia en las vacunas comerciales que verifiquen la inmunogenicidad de las mismas y la capacidad de inducir una respuesta inmune protectora. Franco y Puentes (2011), evaluaron la capacidad infectante in vitro de las vacunas a virus atenuado que se comercializan en el Uruguay, encontrando que 8 de 10 vacunas analizadas tenían al menos el virus viable capaz de replicarse en cultivos celulares. Esto no quiere decir que las vacunas funcionen, pero significa que en un principio el virus se encuentra en condiciones de replicarse en células y potencialmente inducir una respuesta inmune. Por otro lado, factores inherentes al animal como ser el estado nutricional, sanitario y la presencia de los anticuerpos maternos, también pueden condicionar el desarrollo de una adecuada respuesta inmune. La edad para realizar la primera vacunación en cachorros contra CPV y la interferencia de los anticuerpos maternales ha sido discutida en numerosas publicaciones (Pollock y Carmichael, 1982; Iida y col., 1990; Pratelli y col., 2000; Day, 2007). Lo cierto es que se ha demostrado que en ausencia de la inhibición de los anticuerpos maternos los cachorros son capaces de montar una respuesta inmune protectora a muy temprana edad (Day, 2007). Se ha visto que títulos de anticuerpos hemoaglutinantes maternos ≥ 1:20, son capaces de interferir con la respuesta inmune luego de la administración de la vacuna en el cachorro pero no son capaces de prevenir la infección por cepas de campo. En contraste, títulos ≥ 1:64 son considerados suficientes para proteger contra ambos (infección por la vacunación y enfermedad). Por lo tanto, estos títulos pueden interferir con la inmunización y dejar los cachorros susceptibles a la infección (Pollock y Carmichael, 1982). Se ha visto que esta “ventana de interferencia” está entre los 40 y 69 días de edad en los cachorros (Iida y col., 1990). Sin embargo, este periodo puede variar en caso que los animales se expongan a cepas virulentas de campo de CPV. Un estudio demostró que los títulos de anticuerpos maternos declinan más rápidamente si el cachorro es desafiado con el virus (Macartney y col., 1988). Por este motivo, es que se aconseja vacunar a los cachorros a los 30 días de edad, a fin de acortar esta ventana de susceptibilidad. Además, más recientemente, De Cramer y col. (2010), realizaron un experimento con 86 perros y demostraron que la mayoría de los animales (80%) con presencia de distintas concentraciones de anticuerpos maternos seroconvirtieron favorablemente cuando inmunizados a las 30 días de edad. Estos resultados son algo contradictorios a los desarrollados por Pollock y Carmichael (1982), comentado anteriormente. En lo que se refiere a la protección cruzada de las vacunas actuales contra las nuevas variantes de virus, existen controversias entre distintos trabajos científicos. Es importante recordar que el genotipo original de Parvovirus canino (CPV-2) ya no se detecta en infecciones naturales aunque es todavía utilizado en la gran mayoría de las vacunas comercializadas en Uruguay y gran parte del mundo. Experimentos realizados por Pratelli y col (2001), demostraron que cachorros inmunizados con vacunas con CPV-2 tuvieron títulos de anticuerpos neutralizantes significativamente más altos contra el virus homólogo (CPV-2) que contra el virus heterólogo (CPV-2b). Por otra parte, cachorros inmunizados con vacunas con CPV-2b tuvieron similares títulos de anticuerpos neutralizantes para ambos virus. Sin embargo a pesar de todo, según estos autores, el problema puede no ser tan crítico, teniendo en cuenta que los títulos de anticuerpos heterólogos, alcanzarían para proteger los cachorros inmunizados con vacunas CPV-2. Por otra parte, Ohshima y col. (2008) encontraron que anticuerpos producidos por perros inmunizados con vacunas con cepa CPV-2, no reaccionaron eficientemente con recientes aislamientos de CPV (CPV-2a/2b), cuando fueron comparados con los sueros de animales vacunados con las cepas homólogas. Lo que induciría a pensar de que la respuesta frente a virus heterólogos, no son adecuadas y pueden exponer los animales a la infección a las nuevas variantes. En este sentido, existen evidencias de animales enfermos que tenían historia de vacunación con cepas CPV-2, en los cuales se detectó la presencia de CPV-2c en materia fecal (Pérez y col., 2007; Puentes y col., 2011, Calderón y col., 2011). Contrario a estos resultados, algunos autores afirman que animales inmunizados experimentalmente con vacunas conteniendo la cepa CPV-2, están protegidos del desafío con cepas CPV-2b y CPV-2c (Spibey y col., 2008; Siedek y col., 2011). Por lo tanto, como se puede observar, aún no son suficiente concordantes los experimentos, para decir a ciencia cierta, si realmente es necesaria la actualización de las cepas utilizadas en las vacunas contra CPV.
Consideraciones finales
La respuesta inmune contra CPV generada por una vacuna puede estar influenciada por varios factores. Dentro de los que tiene que ver con la vacuna en sí, la viabilidad del virus y el título viral en la misma, el grado de atenuación del patógeno, las propiedades antigénicas de las cepas vacunales y la ruta de administración, son factores importantes (De Cramer y col., 2010). En el Uruguay, no se realizan controles de potencia en las vacunas comerciales que verifiquen la inmunogenicidad de las mismas y la capacidad de inducir una respuesta inmune protectora. Franco y Puentes (2011), evaluaron la capacidad infectante in vitro de las vacunas a virus atenuado que se comercializan en el Uruguay, encontrando que 8 de 10 vacunas analizadas tenían al menos el virus viable capaz de replicarse en cultivos celulares. Esto no quiere decir que las vacunas funcionen, pero significa que en un principio el virus se encuentra en condiciones de replicarse en células y potencialmente inducir una respuesta inmune. Por otro lado, factores inherentes al animal como ser el estado nutricional, sanitario y la presencia de los anticuerpos maternos, también pueden condicionar el desarrollo de una adecuada respuesta inmune. La edad para realizar la primera vacunación en cachorros contra CPV y la interferencia de los anticuerpos maternales ha sido discutida en numerosas publicaciones (Pollock y Carmichael, 1982; Iida y col., 1990; Pratelli y col., 2000; Day, 2007). Lo cierto es que se ha demostrado que en ausencia de la inhibición de los anticuerpos maternos los cachorros son capaces de montar una respuesta inmune protectora a muy temprana edad (Day, 2007). Se ha visto que títulos de anticuerpos hemoaglutinantes maternos ≥ 1:20, son capaces de interferir con la respuesta inmune luego de la administración de la vacuna en el cachorro pero no son capaces de prevenir la infección por cepas de campo. En contraste, títulos ≥ 1:64 son considerados suficientes para proteger contra ambos (infección por la vacunación y enfermedad). Por lo tanto, estos títulos pueden interferir con la inmunización y dejar los cachorros susceptibles a la infección (Pollock y Carmichael, 1982). Se ha visto que esta “ventana de interferencia” está entre los 40 y 69 días de edad en los cachorros (Iida y col., 1990). Sin embargo, este periodo puede variar en caso que los animales se expongan a cepas virulentas de campo de CPV. Un estudio demostró que los títulos de anticuerpos maternos declinan más rápidamente si el cachorro es desafiado con el virus (Macartney y col., 1988). Por este motivo, es que se aconseja vacunar a los cachorros a los 30 días de edad, a fin de acortar esta ventana de susceptibilidad. Además, más recientemente, De Cramer y col. (2010), realizaron un experimento con 86 perros y demostraron que la mayoría de los animales (80%) con presencia de distintas concentraciones de anticuerpos maternos seroconvirtieron favorablemente cuando inmunizados a las 30 días de edad. Estos resultados son algo contradictorios a los desarrollados por Pollock y Carmichael (1982), comentado anteriormente. En lo que se refiere a la protección cruzada de las vacunas actuales contra las nuevas variantes de virus, existen controversias entre distintos trabajos científicos. Es importante recordar que el genotipo original de Parvovirus canino (CPV-2) ya no se detecta en infecciones naturales aunque es todavía utilizado en la gran mayoría de las vacunas comercializadas en Uruguay y gran parte del mundo. Experimentos realizados por Pratelli y col (2001), demostraron que cachorros inmunizados con vacunas con CPV-2 tuvieron títulos de anticuerpos neutralizantes significativamente más altos contra el virus homólogo (CPV-2) que contra el virus heterólogo (CPV-2b). Por otra parte, cachorros inmunizados con vacunas con CPV-2b tuvieron similares títulos de anticuerpos neutralizantes para ambos virus. Sin embargo a pesar de todo, según estos autores, el problema puede no ser tan crítico, teniendo en cuenta que los títulos de anticuerpos heterólogos, alcanzarían para proteger los cachorros inmunizados con vacunas CPV-2. Por otra parte, Ohshima y col. (2008) encontraron que anticuerpos producidos por perros inmunizados con vacunas con cepa CPV-2, no reaccionaron eficientemente con recientes aislamientos de CPV (CPV-2a/2b), cuando fueron comparados con los sueros de animales vacunados con las cepas homólogas. Lo que induciría a pensar de que la respuesta frente a virus heterólogos, no son adecuadas y pueden exponer los animales a la infección a las nuevas variantes. En este sentido, existen evidencias de animales enfermos que tenían historia de vacunación con cepas CPV-2, en los cuales se detectó la presencia de CPV-2c en materia fecal (Pérez y col., 2007; Puentes y col., 2011, Calderón y col., 2011). Contrario a estos resultados, algunos autores afirman que animales inmunizados experimentalmente con vacunas conteniendo la cepa CPV-2, están protegidos del desafío con cepas CPV-2b y CPV-2c (Spibey y col., 2008; Siedek y col., 2011). Por lo tanto, como se puede observar, aún no son suficiente concordantes los experimentos, para decir a ciencia cierta, si realmente es necesaria la actualización de las cepas utilizadas en las vacunas contra CPV.
Referencias bibliográficas
Bienenstock J, Befus AD. (1982). Mucosal immunology. Immunology 41:249-470.
Blanc A, Negro C, Berois M, Reolon E, Arbiza J. (2011). Isolation and characterization of canine parvovirus type 2c circulating in Uruguay. Ciência Rural 41:1436-1440.
Buonavoglia C, Martella V, Pratelli A, Tempesta M, Cavalli A, Buonavoglia D, Bozzo G, Elia G, Decaro N, Carmichael LE. (2001). Evidence for evolution of canine parvovirus type-2 in Italy. J Gen Virol 82:1555–1560.
Calderón MG, Romanutti C, D' Antuono A, Keller L, Mattion N, La Torre J. (2011). Evolution of canine parvovirus in Argentina between years 2003 and 2010: CPV2c has become the predominant variant affecting the domestic dog population. Virus Res 157:106-110.
Calderón MG, Wilda M, Boado L, Keller L, Malirat V, Iglesias M, Mattion N, La Torre J. (2012). Study of canine parvovirus evolution: comparative analysis of full-length VP2 gene sequences from Argentina and international ?eld strains. Virus Genes 44:32–39.
Carmichael LE. (1994). Canine parvovirus type-2. An evolving pathogen of dogs. Ann Med Vet 138:459–464.
Castro TX, Costa EM, Leite JP, Labarthe NV, Cubel Garcia RC. (2011). Monitoring of canine parvovirus (CPV) strains detected in vaccinated puppies in Brazil. Res Vet Sci 90:336-340.
Cavalli A, Martella V, Desario C, Camero M, Bellacicco A, De Palo P, Decaro N, Elia G, Buonavoglia C. (2008). Evaluation of the Antigenic Relationships among Canine Parvovirus Type 2 Variants. Clin Vaccine Immunol 15:534-539.
Day MJ. (2007). Immune system development in the dog and cat. J Comp Pathol 137:10-15.
De Cramer KG, Stylianides E, van Vuuren M. (2011). Efficacy of vaccination at 4 and 6 weeks in the control of canine parvovirus. Vet Microbiol 149:126-132.
Decaro N, Desario C, Addie DD, Martella V, Vieira MJ, Elia G, Zicola A, Davis C, Thompson G, Thiry E, Truyen U, Buonavoglia C. (2007). The study molecular epidemiology of canine parvovirus, Europe. Emerg Infect Dis 13:1222-1224.
Decaro N, Desario C, Campolo M, Elia G, Martella V, Ricci,D, Lorusso E, Buonavoglia C. (2005a). Clinical and virological ?ndings in pups naturally infected by canine parvovirus type 2 Glu-426 mutant. J Vet Diagn Invest 17:133-138.
Decaro N, Desario C, Elia G, Martella V, Mari V, Lavazza A, Nardi M, Buonavoglia C. (2008) E.vidence for immunisation failure in vaccinated adult dogs infected with canine parvovirus type 2c. New Microbiol 31:125-130.
Decaro N, Elia G, Campolo M, Desario C, Lucente MS, Bellacicco AL, Buonavoglia C. (2005c). New approaches for the molecular characterization of canine parvovirus type 2 strains. J Vet Med B Infect Dis Vet Public Health 52:316–319.
Decaro N, Elia G, Martella V, Desario C, Campolo M, Di Trani L, Tarsitano E, Tempesta M, Buonavoglia C. (2005b). A real-time PCR assay for rapid detection and quantitation of canine parvovirus type 2 DNA in the feces of dogs. Vet Microbiol 105:19-28.
Decaro N, Martella V, Elia G, Desario C, Campolo M, Lorusso E, Colaianni M, Lorusso A, Buonavoglia C. (2007). Tissue distribution of the antigenic variants of canine parvovirus type 2 in dogs. Vet Microbiol 121:39-44.
Desario C, Decaro N, Campolo M, Cavalli A, Cirone F, Elia G, Martella V, Lorusso E, Camero M, Buonavoglia C. (2005). Canine parvovirus infection: Which diagnostic test for virus? J Virological Methods 126:179-185.
Elia G, Cavalli A, Cirone F, Lorusso E, Camero M, Buonavoglia D, Tempesta M. (2005). Antibody levels and protection to canine parvovirus type 2. J Vet Med B Infect Dis Vet Public Health 52:320-322.
Eliopulos N, Finger P, Nunes C, Castro C, Moreno J, Hubner S, Puentes R. (2010). Immune Response to canine Parvovirus (CPV): Comparision of antibodies to CPV-2 and CPV-2c in unvaccinated dogs. XXI Encontro Nacional de Virología, V Encontro de Virología do Mercosul. Gramado, RS, Brasil.
Esfandiari J, Klingeborn B. (2000). A comparative study of a new rapid and one-step test for the detection of parvovirus in faeces from dogs, cats and mink. J Vet Med B 47:145 153.
Franco G, Puentes R. (2011). Detección y aislamiento de Parvovirus canino a partir de vacunas comerciales. 7mas Jornadas Técnicas de la Facultad de Veterinaria. Montevideo – Uruguay.
Hirasawa T, Iwaki S, Watanabe K, Mikazuki K, Makino S, Hayashi Y. (1987). Outbreak of canine parvovirus infection and its elimination in a closed beagle dog colony. Zentralbl Veterinarmed B. 34:598–606.
Hoelzer K, Parrish C. (2010). The emergence of parvoviruses of carnivores. Vet Res 41:39. Epub 2010 Feb 15.
Iida H, Fukuda S, Kawashima N, Yamazaki T, Aoki J, Tokita K, Morioka K, Takarada N, Soeda T. (1990). Effect of maternally derived antibody levels on antibody responses to canine parvovirus, canine distemper virus and infectious canine hepatitis virus after vaccinations in beagle puppies. Jikken Dobutsu 39:9-19.
Macartney L, McCandlish IA, Thompson H, Corwell HJ. (1984). Canine parvovirus enteritis 1: clinical, hematological and pathological features of experimental infection. Vet Rec 115:201-210.
Macartney L, Thompson H, McCandlish IA, Cornwell HJ. (1988). Canine parvovirus: interaction between passive immunity and virulent challenge. Vet Rec 122:573-576.
Martella V, Decaro N, Buonavoglia C. (2006). Evolution of CPV-2 and implicance for antigenic/genetic characterization. Virus Genes 33:11-13.
Marulappa S, Kapil S. (2009). Simple Tests for Rapid Detection of Canine Parvovirus Antigen and Canine Parvovirus-Speci?c Antibodies. Clin Vaccine Immunol 16:127–131.
Moon HS, Lee SA, Lee SG, Choi R, Jeoung SY, Kim D, Hyun C. (2008). Comparison of the pathogenicity in three different Korean canine parvovirus 2 (CPV-2) isolates. Vet Microbiol 131:47-56.
Ohshima T, Hisaka M, Kawakami K, Kishi M, Tohya Y, Mochizuki M. (2008). Chronological analysis of canine parvovirus type 2 isolates in Japan. J Vet Med Sci 70:769-775.
Pérez R, Bianchi P, Calleros L, Francia L, Hernández M, Maya L, Panzera Y, Sosa K, Zoller S. (2011). Recent spreading of a divergent canine parvovirus type 2a (CPV-2a) strain in a CPV-2c homogenous population. Vet Microbiol. [Epub ahead of print]
Pérez R, Francia L, Romero V, Maya L, López I, Hernández M. (2007). First detection of canine parvovirus type 2c in South America. Vet Microbiol 124:147–152.
Pollock RV, Carmichael LE. (1982). Maternally derived immunity to canine parvovirus infection: transfer, decline, and interference with vaccination. JAVMA 180:37-42.
Pratelli A, Cavalli A, Martella V, Tempesta M, Decaro N, Carmichael L, Buonavoglia C. (2001). Canine parvovirus (CPV) vaccination: comparison of neutralizing antibody response in pups after inoculation with CPV2 or CPV2b modi?ed live virus vaccine. Clin Diag Lab Immunol 8:612-615.
Pratelli A, Cavalli A, Normanno G, De Palma MG, Pastorelli G, Martella V, Buonavoglia C. (2000). Immunization of pups with maternally derived antibodies to canine parvovirus (CPV) using a modi?ed live variant (CPV-2b). J Vet Med B Infect Dis Vet Public Health 47:273-276.
Puentes R, Eliopulos N, Finger P, Castro C, Nunes C, Furtado A, Franco G, Hubner S. (2010). Detección viral en cachorros con diagnóstico presuntivo de Parvovirus canino (CPV). Veterinaria (Montevideo) 46:47-49.
Puentes R, Eliopulos N, Pérez R, Franco G, Sosa K, Bianchi P, Furtado A, Hubner S, Esteves P. (2011). Isolation and characterization of canine parvovirus type 2c (CPV-2c) from symptomatic puppies. Braz J of Microbiol (in press).
Rice JB, Winters KA, Krakowka S, Olsen RG. (1982). Comparison of systemic and local immunity in dogs with canine parvovirus gastroenteritis. Infect Immun 38:1003-1009.
Schmitz S, Coenen C, Konig M, Thiel H, Neiger R. (2009). Comparison of three rapid commercial Canine parvovirus antigen detection tests with electron microscopy and polymerase chain reaction. J Vet Diagn Invest 21:344–345.
Siedek EM, Schmidt H, Sture GH, Raue R. (2011). Vaccination with canine parvovirus type 2 (CPV-2) protects against challenge with virulent CPV-2b and CPV-2c. Berl Munch Tierarztl Wochenschr 124:58-64.
Spibey N, Greenwood NM, Sutton D, Chalmers WS, Tarpey I. (2008). Canine parvovirus type 2 vaccine protects against virulent challenge with type 2c virus. Vet Microbiol 128:48-55.
Strassheim ML, Gruenberg A, Veijalainen P, Sgro JY, Parrish CR. (1994). Two dominant neutralizing antigenic determinants of canine parvovirus are found on the threefold spike of the virus capsid. Virology 198:175-184.
Streck A, Souza C, Goncalves K, Zang L, Pinto L, Canal C. (2009). First detection of Canine parvovirus Type 2C in Brazil. Braz J Microbiol 40:465-469.
Truyen U. (1999). Emergence and recent evolution of canine parvovirus. Vet Microbiol 69:47–50.


