Vacunas contra rinotraqueitis infecciosa bovina y la diarrea viral bovina
Producción de anticuerpos séricos en respuesta a la vacunación contra los virus de la rinotraqueitis infecciosa bovina y la diarrea viral bovina con una vacuna comercial
El objetivo fue determinar la prevalencia de anticuerpos séricos (PAS) en respuesta a la vacunación contra los virus de la rinotraqueitis infecciosa bovina (RIB) y diarrea viral bovina (DVB) en vacas lecheras en condiciones subtropicales. Se utilizó una vacuna polivalente comercial con virus inactivado de la DVB y virus activos modificados de la RIB, parainfluenza 3 y síndrome respiratorio bovino. Se formaron dos grupos: grupo experimental vacunado (GEV) y no vacunado (GEN), que fueron homogéneos en PAS contra RIB y DVB antes de la vacunación. El GEV se inmunizó el día 0 y el día 30 después de la primera vacunación (vacuna de refuerzo). Para detectar anticuerpos, se obtuvieron muestras de suero 30 días después de la primera y segunda vacunación. Los anticuerpos séricos contra RIB y DVB se determinaron mediante la prueba de ELISA. La PAS promedio contra RIB y DVB antes de la vacunación fue 16 (18 % en el GEV vs 14 % en el GEN; P>0.05) y 8 % (10 % en el GEV vs 6 % en el GEN; P>0.05), respectivamente. La primera y segunda vacunación contra RIB indujeron la formación de anticuerpos 30 días después de su aplicación; con la primera vacunación, la PAS en las vacas vacunadas fue 36 unidades porcentuales mayor (P<0.05) que en las no vacunadas (58 vs 22 %) y con la vacuna de refuerzo, la PAS en las vacas vacunadas fue 66 unidades porcentuales mayor (P<0.05) que en las no vacunadas (94 vs 28 %). La vacuna comercial no indujo la producción de anticuerpos contra DVB con ninguna de las dos inmunizaciones.
Palabras clave: Rinotraqueitis infecciosa bovina, Diarrea viral bovina, Vacuna polivalente, Virus activo modificado, Virus inactivado, Anticuerpos séricos, Vacas lecheras.
Introducción
Material y métodos
Localización del estudio
Grupos experimentales
Protocolo de vacunación
Muestreo sanguíneo y obtención de suero post-vacunación
Análisis de laboratorio
Variables de respuesta y análisis estadísticos
Resultados

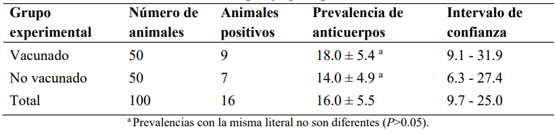
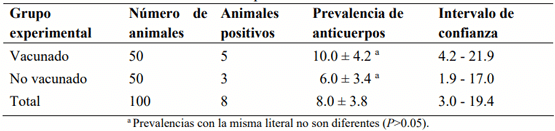
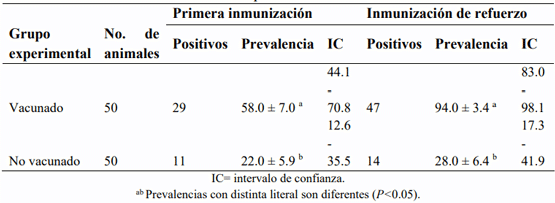
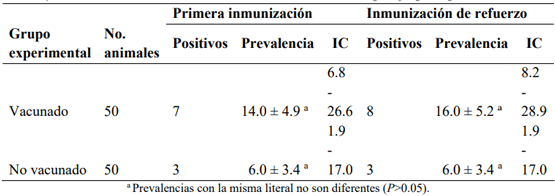
Discusión
Rinotraqueitis infecciosa bovina
Diarrea viral bovina
Conclusiones e implicaciones
1. OIE. Office International des Epizooties. Rinotraqueitis bovina infecciosa/vulvovaginitis pustular infecciosa (2.3.5.). Manual de la OIE sobre animales terrestres. 2004:514-525.
2. Gu X, Kirkland PD. Infectious bovine rhinotracheitis. Australian and New Zealand Standard Diagnostic Procedure. 2008: 1-18. https://www.agriculture.gov.au/sites/default/files/sitecollectiondocuments/animal/ahl/ANZ SDP-Infectious-bovine-rhinotracheitis-IBR.pdf. Consultado
3 Abr, 2020. 3. Reyes JM, Vázquez R, García JA. Seroprevalencia de IBR y DVB en hatos muestreados en México. 2002-2003. En: Posadas ME editores. XXVIII Congreso Nacional de Buiatría. Morelia, Michoacán, México. 2004:112.
4. Armas CA, Muñoz MCCR, Bolaños LDJ, Iñiguez MG. Determinación de agentes infecciosos causantes de abortos fetales en un hato lechero en Tizayuca, Hidalgo, México. En: Posadas ME editores. XXVIII Congreso Nacional de Buiatría. Morelia, Michoacán, México. 2004:135.
5. Escamilla HP, Morales SE, Martínez JJM, Medina CM. Frecuencia y causas de aborto de origen infeccioso en hatos de bovinos en el estado de Querétaro. En: Posadas ME editores. XXVIII Congreso Nacional de Buiatría. Morelia, Michoacán, México. 2004:111.
6. Waldner CL. Serological status for N. caninum, bovine viral diarrhea virus and infectious bovine rhinotracheitis virus at pregnancy testing and reproductive performance in beef herds. Anim Reprod Sci 2005;90(3-4):219-242.
7. Meléndez SRM, Valdivia FAG, Rangel MEJ, Díaz AE, Segura-Correa JC, Guerrero BAL. Factores de riesgo asociados a la presencia de aborto y desempeño reproductivo en ganado lechero de Aguascalientes, México. Rev Mex Cienc Pecu 2010;1(4):391-401.
8. Betancur HC, Gonzales TM, Reza GL. Seroepidemiología de la rinotraqueitis infecciosa bovina en el municipio de Montería, Colombia. Rev MVZ Córdoba 2006;11(2):830-836.
9. Zárate MJP, Rosete FJV, Ríos UA, Barradas PFT, López ER, Olazarán JS, et al. Estado reproductivo y prevalencia de IBR y DVB en hembras bovinas en tres épocas del año en la zona centro de Veracruz. En: Posadas ME editores. XXXVIII Congreso Nacional de Buiatría. Acapulco, Guerrero, México. 2013;759-766.
10. Lértora WJ. Diarrea viral bovina: Actualización. Rev Vet FCV UNNE 2003;14(1):1-11.
11. Liebler-Tenorio EM. Pathogenesis. In: Goyal SM, Ridpath JF. editors. Bovine viral diarrhea virus: diagnosis, management and control. Ames, Iowa, USA: Blackwell Publishing Professional; 2005:121-143.
12. Rubio GJL, Betancourt MA, Karg G. Síndrome respiratorio y digestivo en terneras trasladadas a la recría. REDVET 2009;10(8):1-7.
13. Vargas DS, Jaime J, Vera VJ. Perspectivas para el control del virus de la diarrea viral bovina (BVDV). Rev Colomb Cienc Pecu 2009;22:677-688.
14. Gasque GR. Diarrea viral bovina. En: Gasque GR editor. Enciclopedia Bovina. 1ª edición. Distrito Federal, México; 2008:126-127.
15. Rosete FJV, Granados ZL, Zárate MJP, Ríos UA, Banda RVM, Socci EGA, et al. Prevalencia e incidencia a diarrea viral bovina en vacas de doble propósito en pastoreo en trópico húmedo. VII Reunión Científica-Tecnológica Forestal y Agropecuaria Tabasco 2015 y IV Simposio Internacional en Producción Agroalimentaria Tropical. Tabasco, México. 2015:246-251.
16. De La Trinidad SH. Seroprevalencia y factores de riesgo de rinotraqueitis infecciosa bovina en ranchos ganaderos de Las Choapas, Minatitlán y Moloacán ubicados en la zona sur del estado de Veracruz, México [tesis de licenciatura]. Veracruz, Veracruz: Universidad Veracruzana; 2010.
17. Abad-Zavaleta J, Ríos-Utrera A, Rosete-Fernández JV, García-Camacho A, ZárateMartínez JP. Prevalencia de rinotraqueitis infecciosa bovina y diarrea viral bovina en hembras en tres épocas de año en la zona centro de Veracruz. Nova Scientia 2016;8(1):213- 227.
18. Calderón VG, Alvarado IA, Vilchis MC, Aguilar SA, Batalla CD. Detección de seropositividad al virus de rinotraqueitis infecciosa bovina (IBR), en ganado del municipio de Tizimín, Yucatán, México. Téc Pecu Méx 1997;35(3):161-164.
19. Sánchez-Castilleja YM, Rodríguez DJG, Pedroso M, Cuello S. Simultaneidad serológica de Neospora caninum con Brucella abortus y los virus de la rinotraqueitis infecciosa bovina y diarrea viral bovina en bovinos pertenecientes al estado de Hidalgo, México. Rev Salud Anim 2012;34(2):95-100.
20. Ríos-Utrera Á, Rosete-Fernández JV, Zárate-Martínez JP, Fragoso-Islas A, OlazaránJenkins S, Granados-Zurita L, et al. Rinotraqueítis infecciosa bovina: determinación de la prevalencia de anticuerpos en vacas mexicanas no vacunadas de los estados de Tabasco, Puebla y Veracruz. Rev Científ, FCV-LUZ 2018;28(5):349-359.
21. Ochoa X, Orbegozo M, Manrique AF, Pulido PM, Ospina J. Seroprevalencia de rinotraqueitis infecciosa bovina en hatos lecheros de Toca-Boyacá. Rev MVZ Córdoba 2012;17(2):2974-2982.
22. Motta GJL, Waltero GI, Abeledo MA. Prevalencia de anticuerpos al virus de la diarrea viral bovina, herpesvirus bovino 1 y herpes virus bovino 4 en bovinos y búfalos en el departamento de Caquetá, Colombia. Rev Salud Anim 2013;35(3):174-181.
23. Ruiz-Saenz J, Jaime J, Vera VJ. Prevalencia serológica y aislamiento del herpesvirus bovino 1 (BHV-1) en hatos ganaderos de Antioquia y del Valle de Cauca. Rev Colomb Cienc Pecu 2010;23:299-307.
24. Pariente AE, Ccama SA, Rivera GH. Anticuerpos contra el virus causante de la rinotraqueitis infecciosa en vacunos de la provincia del Melgar, Puno. Rev Inv Vet Perú 2006;17(2):137-143.
25. Zacarías RE, Benito ZA, Rivera GH. Seroprevalencia del virus de la rinotraqueitis infecciosa en bovinos criollos de Parinacochas, Ayacucho. Rev Inv Vet Perú 2002;13(2):61-65.
26. Sánchez TG, Benito ZA, Rivera GH. Seroprevalencia del virus de la rinotraqueitis infecciosa bovina en ganado lechero del Valle de Lima. Rev Inv Vet Perú 2003;14(1):54- 60.
27. Felmer A, Zúñiga AJ, López HM. Prevalencia y distribución espacial de brucelosis, leucosis bovina, diarrea viral bovina y rinotraqueitis infecciosa bovina a partir del análisis ELISA de estanques prediales en lecherías de la IX Región, Chile. Arch Med Vet 2009;41:17-26.
28. OIE. Office International des Epizooties. Rinotraqueitis bovina infecciosa/vulvovaginitis pustular infecciosa. (2.4.13). Manual de la OIE sobre animales terrestres. 2008:1-17.
29. Ruiz-Saenz J, Jaime J, Vera VJ. Vacunas contra el herpesvirus bovino-1: una mirada desde el pasado hacia el futuro de la inmunización. Acta Biol Col 2009;14(2):3-20.
30. Pérez S, Inman M, Doster A, Jones C. Latency-related gene encoded by bovine herpesvirus 1 promotes virus growth and reactivation from latency in tonsils of infected calves. J Clinical Microbiol 2005;43:393-401.
31. Elhassan AM, Fadol MA, El-Hussein AM. Seroprevalence of bovine herpes virus-1, bovine herpes virus-4 and bovine viral diarrhea virus in dairy cattle in Sudan. Pak Vet J 2011;31(4):317-320.
32. Gür S, Doğan N. The possible role of bovine herpes virus type-4 infection in cow infertility. Anim Sci J 2010;81(3):304-308.
33. Vilchis MC, Sosa RM, Alvarado IA, Aguilar SA, Hernández VR, Batalla CD. Evaluación de la vacuna tsv-2 de ibr-p13 en bovinos nacionales productores de leche. Téc Pecu Méx 1991;29:19-23.
34. Walz PH, Montgomery T, Passler T, Riddell KP, Braden TD, Zhang Y, et al. Comparison of reproductive performance of primiparous dairy cattle following revaccination with either modified live or killed multivalent viral vaccines in early lactation. J Dairy Sci 2015;98:8753-8763.
35. OIE. Office International des Epizooties. Rinotraqueitis infecciosa bovina y diarrea viral bovina: repercusiones en la salud animal y el comercio internacional. Animal Diseases Research Institute. 1998:147-156.
36. Quattrocchi V, Soria I, Langellotti CA, Gnazzo V, Gammella M, Moore PD, et al. A DNA vaccine formulated with chemical adjuvant provides partial protection against bovine herpes virus infection in cattle. Front Immunol 2017;8(37):1-11.
37. Romero SD, Montiel PT, Aguilar DM, Martínez HDI, García VZS. Prevalencia de diarrea viral bovina en el estado de Veracruz, México. En: Barradas LH, Ceja RI, Vázquez CLM editores. XXII Reunión Científica-Tecnológica Forestal y Agropecuaria. Veracruz, México. 2009:660-667.
38. Milián-Suazo F, Hernández-Ortíz R, Hernández-Andrade L, Alvarado-Islas A, DíazAparicio E, Mejía-Estrada F, et al. Seroprevalence and risk factors for reproductive diseases in dairy cattle in Mexico. J Vet Med Anim Health 2016;8(8):89-98.
39. Rosete FJV, Ríos UÁ, Zárate MJP, Olazarán JS, Granados ZL, Fragoso IA, et al. Prevalencia de anticuerpos contra diarrea viral bovina en vacas no vacunadas en los estados de Puebla, Tabasco y Veracruz, México. Rev Mex Cienc Pecu 2018;9(3):555-566.
40. Moennig V, Eicken K, Flebbe U, Frey HR, Grummer B, Haas L, et al. Implementation of two-step vaccination in the control of bovine viral diarrhoea (BVD). Prev Vet Med 2005;72:109-114.
41. Frey HR, Eicken K, Grummer B, Kenklies S, Oguzoglu TC, Moennig V. Foetal protection against bovine virus diarrhoea virus after two-step vaccination. J Vet Med 2002;49:489-493.
42. Lindberg A, Houe H. Characteristics in the epidemiology of bovine viral diarrhea virus (BVDV) of relevance to control. Prev Vet Med 2005;72:55-73.
43. Houe H, Lindberg A, Moennig V. Test strategies in bovine viral diarrhea virus control and eradication campaigns in Europe. J Vet Diag Inv 2006;18:427-436.
44. Wernike K, Gethmann J, Schirrmeier H, Schroder R, Conraths FJ, Beer M. Six years (2011-2016) of mandatory nationwide bovine viral diarrhea control in Germany - A success story. Pathogens 2017;6(50):1-8.
45. Abe Y, Tamura T, Torii S, Wakamori S, Nagai M, Mitsuhashi K, et al. Genetic and antigenic characterization of bovine viral diarrhea viruses isolated from cattle in Hokkaido, Japan. J Vet Med Sci 2016;78(1):61-70.
46. Barrett DJ, More SJ, Graham DA, O’Flaherty J, Doherty ML, Gunn HM. Considerations on BVD eradication for the Irish livestock industry. Irish Vet J 2011;64:12.
47. Khodakaram-Tafti A, Farjanikish GH. Persistent bovine viral diarrhea virus (BVDV) infection in cattle herds. Iran J Vet Res 2017;18(3):154-163.
48. Fulton RW, Confer AW, Burge LJ, Perino LJ, d’Offay JM, Payton ME, et al. Antibody responses by cattle after vaccination with commercial viral vaccines containing bovine herpesvirus-1, bovine viral diarrhea virus, parainfluenza-3 virus, and bovine respiratory syncytial virus immunogens and subsequent revaccination at day 140. Vaccine 1995;13(8):725-733.
49. González AM, Arnaiz I, Yus E, Eiras C, Sanjuán M, Diéguez FJ. Evaluation of longterm antibody responses to two inactivated bovine viral diarrhoea virus (BVDV) vaccines. Vet J 2014;199:424-428.
50. Walz PH, Riddell KP, Newcomer BW, Neill JD, Falkenberg SM, Cortese VS, et al. Comparison of reproductive protection against bovine viral diarrhea virus provided by multivalent viral vaccines containing inactivated fractions of bovine viral diarrhea virus 1 and 2. Vaccine 2018;36:3853-3860.





