Introducción
Los trabajos originales sobre el manejo de la fermentación ruminal fueron elaborados por investigadores de Cuba (Elías, 1971;) con una extensa revisión posterior sobre su utilización (Elías 1983), posteriormente en México publicamos varios trabajos sobre el efecto de los PF en diferentes especies y sistemas de pastoreo, con un resultado consistente en un aumento de la utilización de la celulosa de los forrajes fibrosos, debido a un incremento significativo en la población de bacterias celulolíticas (Galina et al., 2000; 2002; 2003; 2004a; 2004b, 2004c; Puga et al., 2001a; 2001b: 2001c; Ortíz et al., 2001; 2002). Por otra parte, el conocimiento de la importancia de la degradación del nitrógeno por los microorganismos ruminales ha permitido una inclusión racional de la urea en las dietas, además de tratamientos mecánicos o químicos de los forrajes que mejoran su digestibilidad, tanto con el uso de PF como LAB(Galindo et al., 2001; Ortiz-Rubio et al. 2007; Gutiérrez et al., 2012a; 2012b;). La formación de proteína digestible intestino microbiana (PDIM) puede llegar a ser el 80% o más en dietas que contengan una producción abundantede microorganismos ruminales, en formulas suplementadas con fuentes de nitrógeno no proteico, mientras que con concentrados comerciales la mayor parte de la proteína digestible intestino proviene del alimento (PDIA) por ello se han utilizado varias técnicas de protección de la proteína, contra de la acción de los microorganismos ruminales (Elias, 1983; Galina et al., 2000; 2003).
Las gramíneas y algunas leguminosas, proveen la base de la alimentación animal en la ganadería tropical; caracterizada por una gama de géneros y especies y por su amplia adaptación a diferentes ambientes “plasticidad”(Peters et al.2010 y Tittonell et al. 2010). Es posible utilizar eficientemente estos forrajes cuando las poblaciones bacterianas del rumen cubren sus requerimientos de energía, constituyentes nitrogenados esenciales, minerales y otros nutrientes (Elías, 1983), de no logarlo, se reduciría su consumo y aprovechamiento, aspecto que pudiera ser corregir con el uso de activadores de la fermentación ruminal, productos biológicos que incrementan la eficiencia digestiva (Puga et al., 2001a; 2001b; 2001c). Las repuestas que con mayor frecuencia se repiten en estos trabajos, de utilización de activadores microbianos, se asocian con la producción de ácidos grasos volátiles (AGV), modificación del pH ruminal y incremento de las bacterias responsables de la degradación de la fibra (Lila et al.2004).
En los ultimos años, el Instituto de Ciencia Animal (ICA) de Cuba, desarrolló un producto biológicamente activo, denominado VITAFERT, rico en levaduras y lactobacilos, ácidos orgánicos de cadenas carbonadas cortas, minerales traza y unbajo pH (Elías y Herrera, 2008; Gutierrez et al. 2012a; 2012b), que se ha utilizado como aditivo microbiano en cerdos y terneros, para prevenir o disminuir cuadros diarreicos, como estimulante del crecimiento, en el caso de animales no rumiantes, y en la fermentación ruminal del ganado vacuno (Gutiérrez, 2005).
A partir de la primera década del presente siglo se adicionaron a los trabajos originales sobre FR modificaciones sobre el uso de bacterias lácticas en rumiantes (Elías y Herrera, 2008) demostrando su efectividad en la digestibiidad de forrajes fibrosos (Galindo et al. 2001; Galina et al. 2007a; 2007b; Gutiérrez et al. 2012a; 2012b;), con todo estas investigaciones se ha obtenido un efecto significativamente mayor de degradación de la fibra en el rumen, que ha permitido el desarrollo de sistemas de manejo alternativos con o sin suplementación de LAB para mejorar la calidad del producto (Galina et al. 2008a; 2008b).
Por otro lado estudios sobre el perfil de los ácidos grasos poliinsaturados (AGPI) particularmente el ácido linoléico (C18,3 cis-9, cis-12, ALI) y el ácido alfa-linoléico conjugado (C18:3 cis-9, cis-12, cis-15 ALC) han demostrado que se encuentran en altas proporciones en los lípidos de los forrajes y de algunos suplementos (Shen, 2011; Castillo et al. 2013; Zened et al. 2013; Rubino, 2014). Estos ácidos froman parte de la dieta de los rumiantes y dependiendo de su concentración, modifican el perfil de ácidos grasos de la leche y de la carne, su composición se caracteriza por la presencia de un mayor volumen de ácidos grasos insaturados, que saturados, que aumentan en su saturación debido al proceso de biohidrogenación en el rumen (Castillo et al. 2013). Se han estudiado diversos factores que afectan el proceso de BH del ALI y ALC, como tambien estrategias nutricionales que muestran resultados positivos en el incremento de ácido trans-vaccenico (C18:2 trans-11, ATV) y ácido linoléico conjugado (Cis 18:2 cis-9, trans-11,ALC) en la leche (Galina et al.2009a; 2009b; 2010; 2012). Se han reportado que estos compuestos tienen efectos potencialmente benéficos a la salud humana (O´shea et al. 1998; Harfoot y Hazlewood, 1997; Herrera et al., 2004; Khanal, 2004).
Los probióticos lácticos (LAB) podrían ser una alternativa importante, particularmente si se toma en consideración el perfil de ácidos grasos no saturados del producto (Galindo et al. 2001; Galina et al. 2012;). En los rumiantes, la flora microbiana sirve para desdoblar la mayoría de los nutrientes, los cuales después son absorbidos en el intestino por el animal (Newbold et al. 2005). Por ello se han desarrollado diferentes sistemas biotecnológicos para manipular las actividades microbiológicas de la cámara de fermentación de los bovinos (Newbold et al. 2005). Los ácidos grasos no saturados que se producen durante la hidrólisis de los lípidos de la dieta, son saturados por los microrganismos ruminales, mediante biohidrogenación (BH), proceso que requiere de H2 (Jin et al. 2008; Castillo et al. 2013). El mayor intermediario para la BH son los ácidos grasos polinsaturados (PUFA), mientras que por las bacterias ruminales son el ácido linoleico conjugado (ALC) y el ácido trans-vaccenico (trans 11 C18:1 ATV). El ALC se deriva del ácido linoleico (C 18:2) y el ácido α linoleico (C 18:3) (Castillo et al. 2013). Una manipulación recomendable de la fermentación ruminal podría incrementar las principales formas de ALC – ácido linoleico conjugado isómero cis 19, trans 11 C 18:2; c9,T11 ALC (Newbold et al. 2005). Debido a que la remoción de ALC como intermediario depende de la BH, quizás sea posible de incrementar este proceso, proveyendo alternativamente receptores de electrones, las bacterias lácticas en el rumen pueden utilizar estos electrones disminuyendo la BH, además de que no producen metano, por eso la importancia de estudiar el efecto de BH de los suplementos lácticos, para mejorar el perfil de ácidos grasos de la leche (Galina et al., 2012).
El objetivo de este estudio fue revisar los avances en el manejo de la fermentación ruminal particularmente evaluar el efecto de un suplemento LAB en la producción de leche y su perfil de ácidos grasos esenciales en animales pastoreando y ramoneando en un sistema mixto de praderas y bosque tropical, con o sin la utilización de FR solo o con LAB comparandolo con suplementación con concentrados comerciales (COM).
Material y Métodos
El estudio se llevó a cabo en el rancho “El Fresno” en Suchitlán, Colima, a 19°23’ latitud norte, 103°41’ longitud oeste y 1,400 m sobre el nivel del mar. Clima Köppen´s clasificado como Aw1(w) con lluvias de Julio a Octubre, 1,000 mm anuales. La duración del período seco es de 8 a 9 meses con una temperatura promedio de 25°C. Un hato de 35vacas lecheras en la mitad de la lactación (511 ± 12 kg), cruzas de Cebú, los animales se mantuvieron sobre un sistema silvopastoril a partir de julio (SP), formado por una mezcla de gramíneas tropicales de zacates: estrella (Cynodon plectostachyus), e insurgente (Brachiaria brizanhta), acompañados de ramoneo de leguminosas en bosque tropical, suplementados con 3 kg de fermentador ruminal con o sin la adición de 1.5 kg/día, de un probiotico de bacterias lácticas (LAB) como suplemento durante el período silvopastoril. El área de pastoreo total fue de 20.9 ha -una mezcla de pastoreo sobre gramíneas tropicales de zacates: estrella (Cynodon plectostachyus), e insurgente (Brachiaria brizanhta) acompañados de ramoneo de leguminosas en bosque tropical. El bosque tropical ramoneado fue de Mimosa pudica, Plumera rubra, Bunchosia palmeri, Cordia alliodora, C. dentata, Platymiscium fasiocarpum, Erythroxylum mexicanum, E.rotundifolium, Caesalpina plumeria, Guttarda elliptica, Randia capitata, Caesalpina coriaria y Desmodium spp. Con una carga animal de 3.6 a 5.9 UA/ha. Paralelamente un segundo hato de 28 animales (514 ±14 kg) pastoreando en 16.5 ha de silvopastoril suplementados con 6 kg de un concentrado comercial para para vaca lechera de 160 g de PC (COM). Se pesaron la leche de los tres tratamientos en forma individual cada semana durante la observación. Se tomaro muestras semanales de leche de cada grupo para medir los ácidos grasos.
Durante todo el estudio el forraje excedía la capacidad de ingestión voluntaria de las vacas en lactación. La administración de suplementos de probióticos (LAB) contenía aproximadamente 4 x 107ufc de bacterias lácticas, compuesto por Lactobacilos plantarum, L. delbrueckii, L. helvaticus; Lactoccocus lactis, Leuconostoc mesenteroides, y Bifidus spp sobre una mezcla de 35% melaza y 65% suero de quesería. El promotor de la fermentación(3kg/d)contenía una mezcla de melaza (18%), harina de algodón (16%), cascarilla de arroz (10%), maíz (14%), pollinaza (10%), harina de pescado (8%), cebo de res (5%), sal común (4%), cal, carbonato cálcico (3%); cemento (1%), sales minerales (2%), ortofosfato cálcico (2%), urea (5%) y sulfato de amonio (2%). Se calcularon los volúmenes de MSI por vaca tomando muestras representativas en pastoreo, con base a las necesidades de energía y proteina para mantenimiento, crecimiento, producción de leche y estado fisiológico de acuerdo a la metodología utilizando el sistema de unidades forrajeras leche desarrollada por el INRA (1995).
Los análisis de ácidos grasos éter metálicos FAME fueron realizados por extracción por separado, utilizando cromatografía de gases (Varian modelo 3800) equipado con un muestreado automático (CP 8410) equipado con un detector FID. El cromatógrafo tenía una columna capilar de sílice fundida (60 m, 0.25 mm (di) 0.25 micras; película DB 23, J y W Supelco). Los picos FAME fueron identificados por comparación con los tiempos de retención, con los de una mezcla conocida de estándares de ácidos grasos (Sigma-Aldrich).
Los compuestos volátiles se determinaron mediante la técnica modificada de dinámica del espacio de cabeza. Las muestras fueron purgadas por burbujeo de helio y la extracción se llevó a cabo durante 60 min con helio a una velocidad de 50 ml/min. Los componentes volátiles fueron absorbidos en una trampa de vidrio lleno de 0.20 mg de Tenax TA, malla 60/80 y 0.05 mg de Carbopack C, malla 40/60. La desorción térmica se llevó a cabo por una trampa de calentamiento a 220 °C durante 5 minutos con un flujo de gas portador de helio (50 ml/min) en un sistema automático de desorción térmica (TDS2, Gerstel GmbH). El análisis gaseoso se realizó en un cromatógrafo modelo Agilent 6890 GC N instrumento conectado a un detector de masas cuádruple selectivo (TME) modelo 5973. Una columna capilar de sílice fundida revestida con dimetilpolisiloxano (HP 1, Agilent Technologies, USA.) de 30 m, 0.32 mm (di) 0.25 micras de espesor de la película, fue utilizado para analizar el perfil volátil de la leche. Las condiciones de funcionamiento fueron en un caudal de helio de 1.2 ml /min, la línea de transferencia a la EM 250°C de interfaz abierto splitless la temperatura del programa fue de 10 min a 40°C, con velocidad de calentamiento de 10°C/ min hasta un pico de 150°C calibrada durante 12 min. El espectrómetro de masas escaneada fue de m/z 29 a m/z 400 en tiempo de ciclo de 0.5 s. La fuente de iones se fijó en 230°C y los espectros se obtuvieron por impacto de electrones (70 eV). Los compuestos volátiles detectados fueron identificados por el estudio de los espectros de MS en comparación con los datos de Wiley (Wiley and son, Alemania). Cada muestra se analizó por duplicado. Los perfiles de ácidos grasos volátiles de la leche fueron expresados en porcentajes. El cromatografo efectua un muestreado automático (CP 8410) con detector FID. El aparato tenía una columna capilar de sílice fundida (60 m. 0.25 mm (di) 0.25 micras con una película DB 23, (J y W; Supelco). Los picos FAME fueron identificados por comparación de los tiempos de retención con los de mezcla conocida de estándares de ácidos grasos (Sigma-Aldrich). El estándar de ALC (cis-9, trans-10, cis-12 3%) se obtuvo de Larodan (Malmö, Suecia).
Los resultados fueron calculados por el modelo de ANDEVA bajo un arreglo totalmente aleteorizado
Resultados
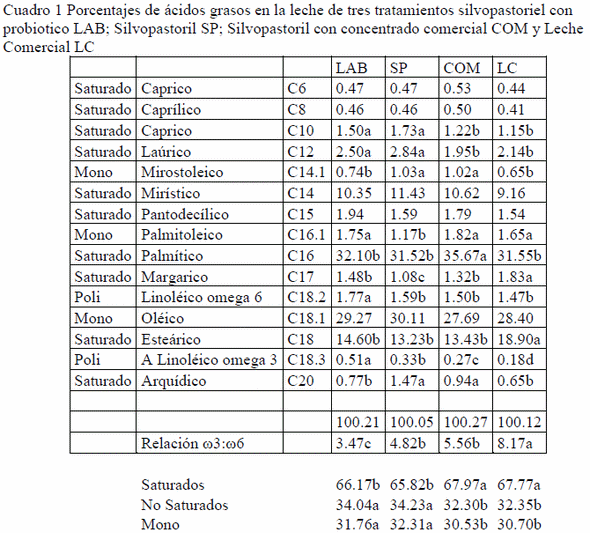
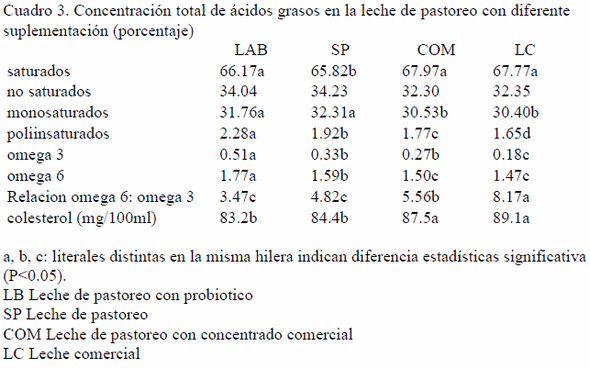
El promedio de producción de leche en ambos gruposfue de 17.5; LAB 14.1 (SP) y 16.5 (COM) kg/d (P<0.05). El sistema de alimentación afecto significativamente el perfil de ácidos grasos de la leche de las vacas estudiadas.Este efecto fue medido por el contenido de ácidos grasos de los sistemas de alimentación, en porcentajes de saturados e insaturados LAB 66.17:34.04%; SP 65.82:34.23%COM 67.97:32.30%; LC 67.77:32.35%como se muestra en el cuadro 1. El contenido de ácidos grasos polinsaturados, omega-3 fue LAB 0.51%; SP 0.33%; COM 0.27% superiores a las de la leche comercial (LC) que tuvo en promedio un 0.18% los resultados de omega 6 en fueron 1.77 % LAB; 1.59 % SP; y 1.50% COM mientras que la leche comercial tuvo un promedio de 1.47% (P<0-05). La relación de omega 6 / omega 3 fue de 3.47:1 LAB; 4.82:1 SP; 5.16 COM y 8.17 comercial.
Con respecto a los ácidos grasos saturados la LC y la COM fueron superiores a las leches de pastoreo, que no mostraron diferenciasentre ellas (P>0.05), los no saturados se comportaron en forma similar pero LAB y SP fueron superiores a COM y LC (P>0.05). Las diferencias entre las cuatro leches fue en el porcentaje de poiliinsaturados siendo mayor para LAB intermedia para SP y COM y menor para la LC(P>0.05). A través del análisis de la varianza se observó que el sistema de alimentación sólo modificó la concentración de AG poliinsaturados (P<0.01), por el contrario los AG monoinsaturados solamente fueron afectados (P<0.01) entre LAB y SP comparados con COM y LC. Si observamos los ácidos grasos poliinsaturados, tanto LAB fue mayor (P<0.05) en porcentaje (0.51%) siendo superior a los demás tipos de leche. Se observó efecto significativo (P<0.01) del sistema de alimentación sobre los diferentes tipos de leche.
A través del análisis de varianza se observó que existe interacción de los factores (P<0.01) sobre el contenido de AG ?3, ?6, así como en la relación que guardan éstos elementos, además de efecto por el sistema de alimentación sea en leche o en queso.
Al analizar el contenido de colesterol en los diferentes tipos de muestras se observó en LAB registró un contenido de 83.2 mg/100ml y SP 84.4 mg/100ml, mostrando diferencias significativas con COM 87.5 mg/100ml y LC 89.1 mg/100 ml. En este sentido el sistema de alimentación con o sin probioticos, mostró un menor cantidad de colesterol en ambos tratamientos.
Una elemento de promordial importancia es la relación de omega6/omega 3 que en la pesente observación fue de 3.47 para LAB y 4.82 para SP ligeramente dentro de los márgenes menores a 5 mientras que el mismo sistema silvopastoril al ser suplementado con concentrado comercial tiene una ralación de 5.56 a 1 probablemente bloqueando el efecto benéfico del omega 3, y el promedio de las leches comerciales fue de 8.17 a 1 que es muy superior a los limites que pemitan una utlización benéfica para el humano.
a, b, c: literales distintas en la misma hilera indican diferencia estadísticas significativa (P<0.05).
Sin literal en la misma hilera indica que no existió diferencia estadística significativa (P>0.05).
ND=No determinado
LB Pastoreo con Probiotico ; SP Pastoreo; COM Pastoreo con conncentrado comercial;
LCLeche comercial
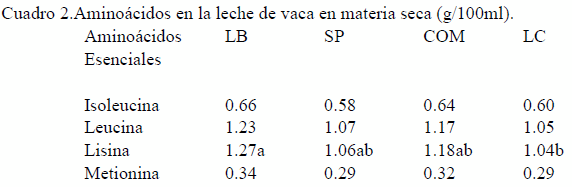
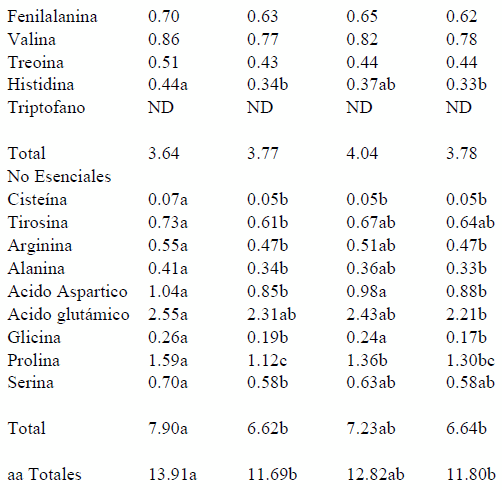
En este sentido se observa que para los aminoácidos esenciales, únicamente se registraron diferencias significativas (P<0.05) en lisina e histidina, sin embargo en el análisis de varianza no se observó interacción de los factores. La concentración de lisina fue más alta en la leche con probiotico (1.27%); que en la LC (1.04%). La histidina fue mayor en LB 0.44% respecto a la LC 0.33,(P<0.05),
Por otra parte, la concentración de aminoácidos no esenciales fue más dinámica, mostrando diversas variaciones; las cuales a través del análisis estadístico pudieron agruparse mayoritariamente a favor de la leche en pastoreo con probiotico, sobre todo cuando se comparan con los productos suplementados con concentrado comercial COM o la leche comercial LC. Sin embargo, es importante observar con detenimiento los resultados, ya que estos son muy similares a los encontrados en todas las leches de pastoreo.
Discusión
El comportamiento en la ingestión y rumia ha sido ampliamente documentado, sí se tiene en cuenta la naturaleza de la dieta, en lo esencial, su alta madurez vegetativa y forma física suministrada, aspectos que pudieron influir en el llenado delos órganos y velocidad de degradación de la materia seca en el tracto digestivo (Van Soest, 1982).Los PF han demostrado tener los elementos que permiten un mejor utilización de las paredes celulares, debido a varios factores incluyendo la presencia de una fuente de carbohidratos solubles para la formación de energía de las bacterias anaerobias, una proporción adecuada de azufre para el mantenimiento de las bacterias sulfor dependientes, fuentes de nitrógeno no proteico para el crecimiento bacteriano, además de elementos de sobrepaso como la harina de pesacado que complementan el efecto benéfico del PF entre otros (Galina et al., 2003) Al analizar el medio ruminal, los valores de pH obtenidos con el uso de PF (±6,9), aún cuando no existe un consenso único del valor de pH donde se optimice el funcionamiento ruminal, las cifras encontradas en la totalidad de los tratamientos se mantienen entre los límites fisiológicos de 6.0 y 7,2 (Elías, 1971; 1983;Calsamiglia et al. 2002, Krause y Oetzel, 2006), como valores óptimos para garantizar la digestión de la celulosa, y posibilitar incremento del ritmo de crecimiento de los microorganismos celulíticos/ hemicelulolíticos, su actividad enzimática, y con ello, los productos de su metabolismo (Marrero, 2005). Los valores de pH alcanzado con los PF tienen un efecto positivo que ejercen los activadores microbianos al estimular el crecimiento bacteriano y contribuir al mayor consumo de MS, fundamentalmente FDN (Puga et al., 2001a; 2001b; 2001c).
Castañeda et al. (2010) lograron resultados semejantes en el comportamiento de cabras y ovinos, al constatar aumento de las concentraciones de AGVs a partir de las 2 y 8 horas posteriores a la ingestión de alimento. A la vez, que afirmaron alcanzar una correlación negativa (r2= -0.454, P<0.01) entre el pH y las concentraciones de estos ácidos orgánicos. Un comportamiento análogo es probable con el uso de FR/ LAB en este nivel, indica que en el ecosistema mixto ruminal, hubo de estar influenciado no solo por la concentración de estos ácidos, sino también, por otros factores como la capacidad amortiguadora del medio (Ramos y Antonio, 2009; Elías et al., 2010). Como debió ocurrir en estos tratamientos, producto del aumento de la masticación y rumia, como se evidencio anteriormente, lo que trae consigo una mayor producción y segregación de saliva (Gutiérrez et al., 2012a; 2012b). La posibilidad de bufferar estas sustancias (carbonatos y fosfatos), además de la urea, y las cantidades de AGVs, acético y láctico contenidos en LAB, y producidos en el rumen, unidas a la estabilidad del pH, debieron mejorar sustancialmente la síntesis de proteína microbiana (Elías, 1983), y con ello aumentar la respuesta animal.
Según Smith (1975), a partir de las concentraciones AGVs, es posible estimar la masa microbiana del rumen. Trabajos en Cuba determinaron el nivel optimo de 6 mL kg PV-1 de LAB en la ración, para obtener una mayor producción de biomasa microbiana (Gutierrez et al., 2012a; 2012b). Esto evidencia mejor fermentación ruminal y, como consecuencia, mayor degradación de los forrajes ricos en paredes celulares, masa microbiana, que se convierte en parte de la digesta como proteína de sobrepaso de excelente composición aminoácidica, sale del rumen y se absorbe en el intestino delgado (López, 2009).
Aunque existe números estudios in-vivo que describen mejoras en la tasa de degradación de la MS en la dieta de vacunos que consumen básicamente fibra, con la adición de aditivos microbianos a partir de cultivos mixtos de levaduras y lactobacilos, como los realizados porFlores (2000) al utilizar el 1% de cepas de Lactobacillus plantarum en una dieta básica elaborada a partir de concentrado y alfalfa, donde se obtuvieron mejoras en la degradabilidad, otros estudios desarrollados por Castillo (2009),Galindo et al. (2001) y Marrero, (2005), al evaluar un preparados microbianos de S. cerevisiae, relacionados con las características de la fermentación ruminal en vacas alimentadas con dietas fibrosas, encontraron un aumento de las bacterias viables totales y celulolíticas; con el uso de LAB se mejoro significativamente el contenido de ácidos grasos esenciales en la leche de los animales (Galina et al. 2009; 2012 y Elías et al. 2010). Sin embargo, las diferencias encontradas en la ingestión de la MS y FDN con la dieta de LAB con respecto al resto de los tratamientos en este estudio, puede atribuírseles a efectos similar a lo logrados anteriormente en vacunos, y con ello, un incrementos en la tasa de desaparición del material fibroso del rumen, similar a lo descrito por Galina et al.(2007b).
Gutierrez et al. (2012a; 2012b) documentaron al respecto, que en la totalidad de sus tratamientos con probioticos en los diferentes tiempos, durante la cinética de incubación, se observo que a pesar del alto contenido en fibra, se encontraron niveles altos de degradación de la MS; esto a pesar que con anterioridad se había observado que en forrajes fibrosos se tenia baja digestibilidad, definidos como materiales de bajo valor nutritivo (Pérez- Infante, 2010), con altos niveles de FDN, cuyos efectos en la degradación ruminal habían sido discutidos por Vergara-López y Araujo-Febres (2006),quienes aseveran encontrar una correlación negativa del material fibroso con la digestión ruminal. Aunque, según Offer et al.(2003) la degradabilidad de la MS en el rumen con materiales similares, oscilan en un rango entre el 20 y 55%; por otro lado los resultados en digestibilidad de forrajes fibrosos en otros trabajos utilizando FR fueron cercanos al 70% quizás por un mayor incremento de la población celulítica del rumen, con liberación de la energía contenida en las paredes celulares y la formación basta de proteina microbiana (Puga et al. 2004a; 2004b; 2004c; Ortíz et al. 2007; Galina et al. 2009b).
Como afirmación a lo anterior, los resultados de las regresiones de la degradabilidad de la materia seca en relación con el consumo de fibra en detergente neutro (FDN 0.75), proteína bruta (PB 0.75 ) y la relación de la FDN con el nitrógeno total (FDN-NT -1) durante la cinética, en los tratamientos donde se ha aplicado LAB dejan ver, que la degradabilidad de la materia seca aumenta, mayormente, influenciada por el consumo de FDN, más que por la proteína (Gutiérrez et al., 2012a)
Lo resultados con LAB en la ración, parecen indicar que se producen mayores cambios en la actividad microbiana ruminal, lo que provoca aumento de la capacidad fermentativa de carbohidratos estructurales, al degradar cadenas carbonatadas complejas y liberar cadenas simples que se utilizaron por las bacterias celulolíticas, como fuentes de energía para su crecimiento desde sus inicios, unido a la contribución que hiciera LAB de péptidos y aminoácidos presentes en su proteína verdadera (Elías, 1983 y Galina et al. 2008a; 2008b; 2009b). Esto se demuestra durante el comportamiento cinético de la curva, donde se observó la actividad estimuladora de LAB, quizás asociada a células vivas, más su actividad en el fluido ruminal, desde los inicios de la cinética degradativa y en su extensión (Gutierrez et al., 2012b).
Varios son los modelos que describen los procesos de digestión y pasaje in-situ de los alimentos en el rumen. Estos modelos permiten predecir el valor nutricional de los alimentosfibrosos utilizados. Para mejorar la precisión de su compotamiento, todos tienen como eje común, el ajuste estadístico y biológico de las variables de ingestión, digestibilidad y consumo (Leichtle y Cristian, 2005). Aún cuando es poca la información que se tiene de la aplicación de estos modelos con FR (Puga et al. 2001a; 2001b; 2001c), más cuando utilizan aditivos microbianos como los empleados en este estudio, la digestibilidad con LAB ha sido determinado por el modelo de Ørskov y McDonald (1979) en varios estudios (Gutierrez et al. 2012a; 2012b; Galina et al. 2013).
En trabajos de Gutierrez et al., (2012a; 2012b) utilizando probiticos, la repuesta a las características durante la cinética degradativa de la MS mostro que para fracción soluble (A) fue la misma en todos los tratamientos, debido fundamentalmente a que el material fibroso incubado era el mismo (heno de B. brizantha). Indicador que se estimó a partir del material perdido durante el lavado de la bolsa, a la hora cero, sin incubación ruminal. Al respecto, se pudiera argumentar que los valores de la degradación potencial (A+B) estuvieron determinados, básicamente, por la fracción insoluble, pero degradable (B). Esta fracción, según Ortíz-Rubio et al.(2007)en trabajos desarrollados con gramíneas, expresa el tiempo de permanencia de este tipo de alimento en el rumen, y esta relacionado con el tiempo de adaptación y colonización de los microorganismos para degradar esta fracción. A la vez, que se presenta una alta velocidad de degradación (c), de la fracción insoluble (B) con valores de 2,9 h-1, De igual manera, el mayor valor de la degradabilidad efectiva (DE) de la fracción potencialmente degradable estuvo determinado por la menor tasa de recambio ruminal (2% h).
En esta ultima se aprecia con el aumentó de la tasa de recambio ruminal, disminuye la degradación efectiva. Esto reafirma la importancia de utilizar la degradación efectiva y no la potencial, para el cálculo de la dieta, según lo planteado por Leichtle y Cristian (2005).
De acuerdo con lo anterior, los parámetros calculados para la utilización de probioticos en un volumen de 6 mL kg PV-1 con respecto al resto, podrían estar asociados a los resultados positivos obtenidos en la degradabilidad de MS y su velocidad de degradación (Gutierrez et al. 2001a; 2012b). Esto se pudiera reflejar con el menor tiempo de retención del alimento en el rumen. A lo que se podría argumentar, que la degradación de la MS en gramíneas tropicales de mediana a baja calidad, se relaciona, en general, con la composición de paredes celulares y el bajo contenido de nitrógeno, factores que afectan negativamente el mejoramiento de la digestión ruminal de los nutrientes presentes en los forrajes (Ramírez et al.2002 y Ku Vera, 2010), tal como ocurrió en este experimento. Esto podría variar, si la calidad del forraje fuera mayor o si se administra continuamente como estimulante de la celulolisis ruminal, mediante un aditivo microbiano a partir de levaduras y Lactobacillus, sin interrupción, y durante un tiempo prolongado a la ración.(Elías, 1983; Elías et al., 2008; 2010) como el empleado en este estudio.
Lo que demuestra que mejorar y estabilizar las condiciones del ecosistema ruminal es prioritario para el desarrollo de microorganismos fibrolíticos como agentes deslignificantes, particularmente los Lactobacilos(Elías, 1983 y Galina et al. 2010), pudo ser, no solo una función directa del sustrato que llegó al rumen, de su composición y balance, sino también, de un efecto sincronizado y de sinergia de utilización del sustrato por los microorganismos y el manejo de la ración (Elías et al. 2010). Esto depende de los niveles empleados del aditivo microbiano en la ración (Marrero, 2005; Gutiérrez, 2005 y Elías et al. 2010).
En los que respecta a la calidad de producto el contenido mínimo de ácidos grasos saturados (AGS) se observó en la leche procedente de los animales en pastoreo, siendo significativamente superior cuando se agregó el probiótico, es reconocido en la literatura que un menor contenido de AGS parece favorecer la salud humana, debido a la información acumulada sobre el efecto de bloqueo de los vasos sanguíneas, en las enfermedades coronarias (Pfeuffer y Schrezenmeir., 2000). Los resultados del presente trabajo permiten suponer que el sistema de alimentación, en general, y en específico el pastoreo libre en un ambiente silvopastoril, permite que cada vaca, particularmente en la diversidad de forrajes, formar una dieta de acuerdo a sus propias necesidades, que tienen un efecto sobre las características nutricionales de la leche, favorable a la salud. El mayor contenido de ácidos grasos trans, estuvieron presentes en la leche de pastoreo. Hasta hace poco un efecto negativo de los ácidos grasos trans en la salud fueron considerados similares a los documentados para los ácidos grasos saturados (Sicchiari, 2008). Los efectos negativos de los ácidos grasos trans en patologías coronarias y citotoxicidad, se determino a partir de observaciones sobre el metabolismo de los ácidos grasos hidrogenados, producidos durante la manufactura de alimentos industriales. Los trans derivados de los procesos de biohidrogenación ruminal, como los producidos por el rumen, han mostrado en cambio, efectos positivos sobre la salud humana (Wencelová et al., 2015). En el presente trabajo se observó, de hecho, para la mayoría de los C18:1 trans vaccénicos. Esto ultimo, a través de la acción de la 9 desaturación. dónde se metaboliza en C18: 2 11 trans 9 cis que representa uno de los precursores más importantes del ALC benéfico (Castillo et al., 2013). Por lo tanto, a la luz de este conocimiento relativamente novedosos, el papel de los ácidos grasos trans en el sistema de alimentación de los rumiantes en pastoreo libre, tienen que ser revaluados en el marco de producir una “mejor” leche desde el punto de vista de la salud del consumidor. Fenómeno que en México, es una gran preocupación, debido a que una parte significativa de la población sufre de obesidad o sobrepeso, que se traduce en las enfermedades crónico degenerativas, particularmente los trastornos coronarios (Galina et al., 2008a; 2008b).
Particularmente en efecto benéfico de los ácidos poliinsaturados omega 3 y omega 6 ha sido abundantemente documentados recientemente (Colavilla et al. 2014; Rubino, 2014). Estudiosúltimos han demostrado la importancia de mantener una relación menor a 5:1 entre el omega 6 y el omega 3 ya que concentraciones superiores bloquean los efectos benéficos del omega 3, siendo contraproducentes a la salud (Colavilla et al., 2014), solamente LAB con 3.48 y SP con 4.79 cumplieron con este parámetro mientras que el pastoreo suplementado con concentrados comerciales supera ligeramente esta frontera (5.54) y el promedio de 8 leches comerciales fue de 8.40 lo que significaría que el poco omega 3 contenido, no tendría ningún efecto sobre la salud por ser bloqueado por el omega 6 (Simopoulos, 2002; Strandvik, 2011).
Incluso a pesar de las diferencias que se demostraron entre los dos sistemas, los valores de ALC y la relación de omega3/omega6 fueron favorables para ambos sistemas, lo que permite demostrar la importancia de la biohidrogenación en la producción de la leche, BH que se disminuye con el uso de las bacterias lácticas. Las diferencias significativas en el perfil de ácidos grasos benéficos entre las leches de pastoreo o estabulación con la adición de un suplemento de bacterias lácticas comparados con la leche comercial, demuestra la importancia de la biohidrogenación en el metabolismo ruminal, para la calidad de la leche, en relación a la salud del consumidor (Galina et al. 2013).
La suplementación con probióticos de bacterias lácticas (LAB) puede probablemente disminuir la biohidrogenación (BH) ruminal, fenómeno que se traduce en una saturación de los AGNS, abundantes en las plantas, para ello suplementamos con LAB, queno BH ,aunado a que nos son bacterias metanogénicas, permite no solamente mejorar el perfil de AGV, sino disminuir la contaminación ambiental (Galinaetal.,2012; 2013). Los resultados sobre BH con LAB fueron similares a los obtenidos en dietas suplementadas con ácidos orgánicos o plantas con aceites (Wencelová et a., 2015) lo que permite suponer que las bacterias lácticas tienen una forma de fermentación ruminal que permite tener un efecto similar, que se traduce en una mejor calidad de laleche, (Galina et al., 2012). Para ello se han realizado varias observaciones comparando sistema de alimentación en estabulación o pastoreo con o sin el uso de suplementos de bacterias lácticas. Las diferencias significativas en el perfil de ácidos grasos esenciales entre las leches de pastoreo con la adición de un suplemento de bacterias lácticas comparados con la leche comercial, demostraron la importancia de la BH en el metabolismo ruminal, para la calidad de la leche, en relación a la salud del consumidor, desde luego los animales en sistema silvopastoril con suplementación de PF y probióticos, fueron las que significativamente produjeron una leche de mejor calidad, comparadas con las de pastoreo sin probióticos o las de estabulación con o sin probióticos, (Galinaetal.,2013).
Conclusiones
Los resultados han demostrado que los dos sistemas de alimentación en pastoreo, incluso si ambos se componen principalmente de forrajes frescos verdes, mejoran la calidad de lácteo probablemente debido a un aumento de AGNS de la dieta. No obstante que por la disminución de BH utilizando LAB se produce una leche de mayor calidad, en su perfil de ácidos grasos esenciales, se observó una diferencia significativa favorable aún comparandola con el SP (P ≤ 0,05), lo que significó que con una caída de BH producto de la flora láctica, que se disminuye cuando existe un substrato de mayor diversidad de forrajes, como fue el caso de los animales en LAB.
Referencias
Calsamiglia, S.; Ferret, A. &Devant, M. 2002. Effects of pH and pH fluctuations on microbial fermentatation and nutrient flow from a dual-flow continuous culture system. J. Anim. Sci. 85:574.
Castañeda, A.; Díaz, L.H.; Muro, A.; Gutiérrez, H.; García, D.M.; Lozano; A.R. & Ortiz, U. 2010. Parámetros de fermentación ruminal en ovinos y caprinos sometidos a cambios de dietas. III Congreso de Producción Animal Tropical y I Simposio FOCAL. La Habana. Cuba. Memoria en soporte electrónico. ISBN:978-959-7171-31-7.
Castillo, C.Y. 2009. Fermentación in-vitro para obtener la levadura Candida norvengensis en mezcla de alfalfa con bagazo de manzana fermentado y sus efectos sobre la actividad microbiana ruminal. Tesis de Doctor en Philosophia. Universidad Autónoma de Chihuahua. México
Castillo, J., Olivera, M., & Carulla, F. 2013. Descripción del mecanismo bioquímico de la biohidrogenación en el rumen de ácidos grasos poliinsaturados: Una revisión. Rev. U.D.CA. Act & Div. Cient 16 (2): 459-468
Colavilla, G., Amadoro, C., & Mignona, R. 2014. Rapporto omega6/omega3 e GPA nel Latte Nobile in Molise en R.Rubino Il Modello Latte Nobile un ´altra vie è possibile. Caseus Italia: 118-128
Elías, A.; Chilibroste, P.; Michelena, J.B.; Iriñiz, J. & Rodríguez, D. 2010. Evaluación de ACTIVIOL y MEBA con ensilaje de sorgo y despunte de caña de azúcar: valor nutritivo, fermentabilidad in- vivo e in- vitro y pruebas con animales en crecimiento y vacas lecheras. Informe de avance Proyecto: “Potencial de uso de forrajes de baja calidad en la alimentación de rumiantes, con énfasis en subproductos de la caña de azúcar” República de Uruguay.
Elías, A. & Herrera, F.R. 2008. El VITAFERT en el tracto gastro intestinal. En. Producción de alimentos para animales a través de procesos biotecnológicos sencillos con el empleo de microorganismos beneficiosos activados (MEBA) p. 8.
Elías, A. 1983. Digestión de pastos y forrajes tropicales. En: Los pastos en Cuba. Tomo 2. Instituto de Ciencia Animal. Cuba. p. 187.
Elias, A. 1971. The rumen bacteria of animalsfeedon molases-urea diet. Tesis en opción al grado de Doctor en Ciencias. Universidad Aberdeen. Escocia. p. 180.
Flores, M.N. 2000. Elaboración de cultivos microbianos a partir de coco, su utilización en dietas para borregos en engorde. Tesis para obtener el grado de Maestro en Ciencias Pecuarias. Instituto Nacional de Nutrición. Salvador Zubiran. México.
Galina, M., Guerrero, M., Pineda, J., Ortíz, M., Osnaya, F. 2013. Efecto de la biohidrogenación ruminal de probióticos lácticos, en la engorda de bovinos. Memorias del XXXVII Congreso Nacional de Buiatría, Acapulco, Guerrero: 533-538
Galina, M.A., Guerrero, M., Pineda, J., Ortíz, Ma., Osnaya, F. 2012. Efecto de la biohidrogenación ruminal de probióticos lácticos en la calidad de la leche. XXXVI Congreso Nacional de Buiatría Mérida, Yucatán, México. Memorias: 753-761
Galina, M.; Pineda, L.J. & Morales, R. 2010. Suplementación en pastoreo de cabras lecheras con una fuente de liberación lenta de nitrógeno (SLNN) con o sin la adición de un probiótico de bacterias lácticas. III Congreso de Producción Animal Tropical y I Simposio FOCAL. La Habana. Cuba. Memoria en soporte electrónico. ISBN: 978-959- 7171-31-7.
Galina M.A., M.A. Ortiz-Rubio, Mondragón, F., Delgado-Pertiñez, M & Elías A. 2009a. Rendimiento de terneros alimentados con silo de maíz o láctico con un promotor de la fermentación ruminal. Archivos de Zootecnia. 58
Galina, M.A.; Delgado-Pertiñez, M.; Ortíz-Rubio, M.A.; Pineda, L.J. & Puga, D.C. 2009b. Cinética ruminal y crecimiento de cabritos suplementados con un probiótico de bacterias ácido-lácticas. Rev. Pastos y Forrajes. Estación experimental de Pastos y Forrajes. Indio Hatuey. 32: 4.
Galina M.A., M.A. Ortiz-Rubio, Guerrero, M., Mondragón, D. F., Franco N.J.L., & Elías A. 2008a. Engorda de ovinos con silo de maíz, silo inoculado con un probiótico láctico, solo o adicionado con un suplemento de liberación lenta de nitrógeno.Av. Inves. Agropecuarias 12(2):23-34
Galina, M.A.; Ortiz –Rubio, M.A.; Gerrero, M. & Elías, A. 2008b. Efecto de un ensilado de maíz solo o inoculado con probióticos lácticos y adicionado con un suplemento nitrogenado de lento consumo en ovinos. En: REDALYC . 12: 23.
Galina, M.A.; Ortiz-Rubio, M.A. & Guerrero, M. 2007a. Desarrollo de cabras con o sin suplementación, con un probiótico de bacterias lácticas. Vº Congreso de Especialistas en Pequeños Rumiantes y Camélidos Sudamericanos. Mendoza. Argentina. p. 11.
Galina, M.A.; Ortiz –Rubio, M.A.; Delgado- Pertínez, M. & Pineda, L.J. 2007b. Effect of a lactic probiotic supplementation on goat kids growth. 12th Seminar of the sub-NY FAO-CIHEAM on Sheep and Goat Nutrition. October. Thessaloniki (Greece). p.11.
Galina, M., Guerro M., Puga, D.C. &Haenlein, G.F.W. 2004a. Effect of slow intake urea supplementation on Goat kids pasturing natural Mexican rangeland. Ruminal fermentation, feed intake and digestibility. Small Rum. Res. Vol 55:85-95
Galina, M.A., Guerrero, M., Puga, D.C. & Haenlein, G.F.W. 2004b. Effect of a slow intake urea supplementation on growing kids feed corn stubble or alfalfa with a balanced concentrate. Small Rum Res.Vol 53, Núm 1-2:29-38
Galina, M.A., Hummel, J. Sanchez, M., &Haenlein, G. 2004c. Fattening rambouillet lambs with corn stubble or alfalfa hay, slow urea intake supplementation or balanced concentrate.Small Rum Res.Vol 53, Núm 1-2:89-98
Galina, M., F. Perez-Gil, F., Hummel, J.D., Ortiz, R.M.A. &Ørskov, E.R., 2003.Effect of slow intake urea supplementation on fattening of steers feed sugar cane tops (Saccarumofficinarum) and maize (Zea mays) with or without SIUS, ruminal fermentation, feed intake and digestibility. LivesProdSci. 83 (1): 1-1
Galina, M., Ruiz, G. & Ortiz, M.A. 2002. Ceba de bovinos con punta de caña y planta de maíz suplementados con bloque de urea o concentrado. Fermentación ruminal, consumoy digestibilidad. Pastos y Forrajes. 25 (3) 209-221
Galina, M.A., Guerrero, C.M., Serrano, G., Morales, R. & Haenlein, G. 2000. Effect. complex catalytic supplementation with non protein nitrogen on ruminal ecosystem of growing goats pasturing shrub land in Mexico. Small Rum. Res. (36):33-42
Galindo, J.; Marrero Y.; González, N. & Sosa, A. 2001. Uso de microorganismos viables y productos microbiales. En Manipulación de la fermentación microbiana ruminal. pp. 70- 83.
Gutierrez,D., Elías, A., Galina,M., García, R., Herrera, F., Jordán, H., & Sarduy, L. 2012a. Efecto del aditivo VITAFERT en el consumo de la materia seca y fibra en detergente neutro de cabras alimentadas con heno de Brachiaria Brizanta. II Foro internacional de Ciencia e Innovación Tecnlológica: FOCAL, Colima, México. Memorias. 318-322 ISBN 978-607-95853-7-2
Gutierrez,D., Elías, A., Galina,M., García, R., Herrera, F., Jordán, H., & Sarduy, L. 2012b. Influencia de un aditivo microbiano en el consumo voluntario de materia seca e indicadores de la ferementacion ruminal en cabras alimentadas con heno de Brachiaaria Brizanta. II Foro internacional de Ciencia e Innovación Tecnlológica: FOCAL, Colima, México. Memorias. 312-317 ISBN 978-607-95853-7-2
Gutiérrez, B.R. 2005. Actividad probiótica de un producto biofermentado (VITAFER), en pollos de ceba. Tesis en Opción al Titulo de Master en Producción Animal para la Zona Tropical. ICA. La Habana. Cuba. p. 52.
Hartfoot, C.G. &Hazlewood, G.P. 1997. Lipid metabolism in the rumen. In: Hobson, P.N., Stewart, C.S., (eds). The rumen Microbial Ecosystem, Ed Chapman and Hall, London, U.K: 382-426
Herrera, J.A., Shahbudin, A.K.M., Faisal, M., Ersheng, G., Wei, J., Lixia, D., Gandaho, T., &López, P. 2004. Efecto de la suplementación oral con Calcio y ácido linoléico conjugado en primigrávidas de alto riesgo. Colombia Médica 35(1): 1-8
INRA, 1995. Nutritions de ruminants domestiques. Ingestion et digestion. INRA. Paris 905 p Jin,G.L., Choi, S.H., Lee, H.G., Kim, Y.J., & Song, M.K. 2008. Effects of monensin and fish oil on conjugated linoleic acid production by rumen microbes in Holstein cows fed diets supplemented with soybean oil and sodium bicarbonate. Assian-Aust. J. Anim. Sci. 21:1728-1735
Khanal, R.C. 2004. Potential health benefits of conjugated linoleic acid (CLA): A review. Assian-Australian J. Anim. Sci 17(9):1315-1328
Krause, K. M. &Oetzel, G. R. 2006. Understanding and preventing subacuteruminal acidosis in dairy herds: A review. Animal. Feed Sci. and Techn. 126: 215–236.
Ku Vera, J.C. 2010. Requerimientos de energía en ruminates en el trópico. Implicaciones del concepto de mantenimiento. Taller de fisiología y procesos fermentaivos. III Congreso de Producción Animal Tropical y I Simposio FOCAL. La Habana. Cuba. Memoria en soporte electrónico. ISBN: 978-959-7171-31-7.
Leichtle, S. & Cristian, J.2005. Degradabilidad ruminal de henos de praderas de la zona sur de Chile. Tesis Lic. Agro. Univ. Austral de Chile. Fac. Cienc. Agrarias. Chile. p. 18.
Lila, Z.A.; Mohammed, N. ; Ysui, T.; Kutokawa, Y.; kanda, S. & Itabashi, H. 2004. Effects of Saccharomyces cerevisiaetwin of live cells on mixed ruminal microorganism fermentation in vitro. J. Dairy Sci. 82: 1847.
López, R. J. 2009. Efecto de la suplementación con concentrado en indicadores de la fisiología digestiva y consumo de nutrientes en becerros (Bubalus bubalis) alimentados con pasto estrella (Cynodon nlemfuensis). Tesis en Opción al grado de Doctor en Ciencias Veterinarias. ICA, La Habana. Cuba. p. 140.
Marrero, Y.R. 2005. Las levaduras como mejoradoras de la fermentación ruminal de dietas con alto contenido de fibra. Tesis presentada en opción al grado científico de doctor en Ciencia Veterinaria. Inst. Ciencia Animal. Habana. Cuba. pp. 93-104.
Newbold, C.J., López, S., Nelson, N., Ouda, J.O., Wallace, R.J., &Moss, A.R. 2005. Propionate precursors and other metabolic intermediates as posible alternative electron acceptors to methanogenesis in ruminal fermentation in vitro. Br. J. Nutr. 94:27-35
O´Shea, M., Lawless, F., Staton, C., &Devery, R. 1998. Conjugated linoleic acid in bovine milk fat: a food-based approach to cáncer chemoprevention. Trends in Food Sci& Technol. 9:192-196
Offer, N.W.; Bach, A. &Sauvant, D. 2003.Quantitative review of in situ starch degradation in the rumen.Anim. Feed. Sci: Techn. 106:81.
Ørskov, E.R. & McDonald, I. 1979.The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage. J. Agric. Sci. Camb. 92:499.
Ortiz-Rubio M. A., Ørskov, E. R.,Milne, J., & Galina, M. A. 2007. Effect of different sources of nitrogen on in situ degradability and feed intake of Zebu cattle fed sugarcane tops (Saccharumofficinarum) Feed Sciencie and Technology. (139) 143-158
Ortíz, R.M.A., Galina, M.A., & Carmona, M.M.A. 2002.Effect of a slow non-protein nitrogen ruminal supplementation on improvement of Cynodonnlemfuensisor Brachiariabrizantautilization by Zebu steers. LivestockProductionSci.78 (2) 125-131- 245
Ortíz, R.M.A., Haenlein, G.F.W & Galina, M. 2001. Effects on feed intake and body weight gain when substituting maize with sugar cane in diets for Zebu steers complemented with slow release urea supplements. Intern. J. Animal Sci 16(2):239-
Pérez-Infante, F. 2010. Estimado de la calidad del pasto y los forrajes verdes cuando la disponibilidad no es limitante. En: Ganadería del Futuro Producción y Eficiencia. Ed. Palcogra. La Habana. Cuba. p. 33.
Peters, M.; Van der Hoek, R. &Schultze-Kraft, R. 2010. Los pastos y forrajes en el trópico - retos en el marco de un desarrollo sostenible. V Foro Latinoamericano de Pastos y Forrajes. III Congreso de Producción Animal Tropical. La Habana. Cuba. Memoria en soporte electrónico. ISBN: 978-959-7171-31-7.
Pfeuffer, M.&Schrezenmeir, J., 2000. Bioactive substances in milk with properties decreasing risk of cardiovascular diseases. British Journal of Nutrition, 84, 155–159.
Puga, D.C. Galina, M.A., Pérez-Gil,F., Rosado, J. & Murillo, J.C. 2001c. Efecto de un Alimento Complejo Catalítico sobre el pH, amoníaco (N-NH3) ruminal y la desaparición in situ de Cynodonnlemfuensis, Cynodondactylon, Panicum máximum y Brachiariabrizanta en bovinos en Pastoreo en el Trópico Mexicano. Pastos y Forrajes Cuba. Vol 24, Número 2:157-166
Puga, D.C., Galina, M., Peréz-Gil, R. F., Sanguinés, G.L., Aguilera, B. A., Haenlein, G.F.W., Barajas, C.R. & Herrera, H.J. 2001b. Effect of a controlled-release urea supplementation on feed intake, digestibility, nitrogen balanced and ruminal kinetics of sheep fed low quality tropical forage. Small Rum. Res. 41 (1):9-18
Puga, D.C., Galina, M.A., Pérez-Gil, R.F., Sanguinés, G.L., Aguilera, B.A. &Haenlein, G.F.W. 2001a. Effect of a controlled-release urea supplement on rumen fermentation in sheep fed a diet of sugars tops (saccharumofficinarum), corn (Zea mays) and king grass (Pennisetumpurpureum).Small Rum. Res. 39 (3):269-276
Ramírez, R.O.; Gonzalo, R. L. & López, F.G. 2002. Factores estructurales de la pared celular del forraje que afectan la digestibilidad. CIENCIA UANL. 2: 180.
Ramos, N. y Antonio, J. 2009: Acidosis Ruminal y su Relación con la Fibra de la Dieta y la Composición de Leche en Vacas Lecheras. Seminario Avanzado de investigación Cajamarca. Sistema de Revisiones en Investigación Veterinaria de San Marcos (Sirives) pp. 2-3.
Rubino, R. 2014. Ilmodellolattenobile. Un’altravia é possibile. Casueus Edit. Anfosc. Italia 191 p
Secchiari, P.L. 2008. Nutritional and neutraceutical value of foods of animal origin. Italian Journal Agronomy, 1,73-101.
Shen, X., Dannenberger, D., Nuernberg, K., Nuernberg, G., & Zhao, R. 2011. Trans 18:1 and CLA isomers in rumen and deudenaldigesta of bulls fed n-3 and n-6PUFA- based diet. Lipids, 46:831.841
Simalopus, A.P. 2002. The importance of the ratio of omega6/omega3 essential fatty acids. Biomedical Pharmacoter 56:365-379
Smith, R.H. 1975. Nitrogen metabolism in the rumen and the composition and nutritive value of nitrogen compounds entering the duodenum. En: Digestion and metabolism in the Ruminant. (W. McDonald, A.C.I. Warner Eds.) New England University.Publishing Unit.Armidale, Australia. pp. 399-415.
Strandvik, B. 2011. The omega-6/omega-3 ratio its of importance. Prostaglanins, Laukotrienes and Essential Fatty Acids 85:405-406
Tittonell, P.; Rufino, M.C.; Janssen, B.H. &Giller, K.E. 2010. Carbon and nutrient losses during manure storage under traditional and improved practices in smallholder crop livestock systems – evidence from Kenya. Plant and Soil.328: 253.
Van Soest, P.J. 1982. Nutritional ecology of the ruminant: metabolism, nutritional strategies, the cellulolytic fermentation and the chemistry of forages and plant fibers. O. & B. Books. Corvallis. Oregon.p. 24.
Vergara-López, J. y Araujo-Febres, O. 2006: Producción, composición química y degradabilidad ruminal in-situ de Brachiaria humidicola (rendle) schweick en el bosque seco tropical. Revista Científica. FCV-LUZ .Venezuela. 16:3 pp. 239-248
Wencelová, M., Várdayová, M., Mihalikova, Z., Cobanová, K., Placha, I., Pristas, P., Jalac, D., & Kisidayová, S. 2015. Rumen fermentation pattern, lipid metabolism and the microbial community of sheep fed a high-concentrate diet supplemented with a mix of medicinal plants. Small Rum Res on line
Williams, P.E. &Newbold, C.J 1990. Rumen probiotics: The effects of novel microorganisms on rumen fermentation and ruminant productivity En: Harassing, W and A, D.J. Recent Advances in Animal Nutrition 3. Cornwall. 14:211.
Zened, A:,Enjalbert, F., Nicot, M.C., &Troedeler-Maynadier, A. 2013. Starch plus sunflawer oil addition to the diet of dairy cows resulted in a trans-11 to trans-10 shift of.