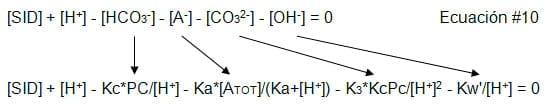I. Introducción al balance ácido-básico
Durante los últimos dos siglos, la bioquímica ha avanzado a pasos gigantescos, especialmente en las últimas décadas, con el advenimiento de la ingeniería genética. Sin embargo, es justo decir que algunas áreas no han avanzado con la misma firmeza, de hecho, no se había re-evaluado algunos conceptos utilizados hace un siglo bajo la luz de los nuevos recursos tecnológicos con que se cuenta hoy en día. Tal es el caso del agua, su biofísica y el balance ácido-básico en los sistemas biológicos (Häubi Segura, 2004).
El agua es el elemento de la vida, el más frecuente sobre nuestro planeta y sin embargo todavía guarda secretos. La rareza del agua apenas ha empezado a ser tomada en cuenta como una de las bases físico-químicas de la vida, de manera que cualquier cambio en ésta producirá cambios en las unidades primordiales de la vida: las células.
La capacidad de ionización del agua, es decir, la disociación de la misma para formar iones de hidrógeno (H+) y/o hidroxilo (OH-) es una de las facetas más estudiadas, y sin embargo, más incomprendida de la misma. Es el propósito de este artículo demostrar que los conceptos “modernos” del pH y los ácidos en el organismo están basados en teorías muy viejas y que su aplicación a la biología y la medicina pueden estar causando grandes problemas en las ciencias básicas y en la clínica.
En este artículo se presentará una nueva teoría del balance ácido base (Teoría de Stewart) que implica un cambio completo en nuestro entendimiento del agua, y por lo tanto ofrece nuevas oportunidades de comprender los eventos físico-químicos que ocurren en los organismos vivos. Es posible que este nuevo conocimiento ayude a algunos de los investigadores en las ciencias biomédicas a proponer nuevas hipótesis sobre el mecanismo de acción de las células que controlan el balance ácido-base en el cuerpo (Häubi et al., 2006).
1. Breve historia de las teorías de ácidos
Desde la antigüedad se conocían los ácidos, por sus características organolépticas y por su capacidad de corroer los metales. Con el advenimiento de la química moderna iniciaron las teorías para explicar su composición y su mecanismo de acción.
Químicos de gran renombre, como Lavoisier, Davy, Dulong, Berzelius y von Liebig estudiaron el fenómeno de los ácidos, pero no fue hasta finales del siglo XIX que se empezó a comprender las bases físicas y químicas de los mismos (Bynum et al., 1981).
Arrhenius y Ostwald establecieron la Teoría de la Disociación en 1887. En 1923, Brønsted y Lowry ampliaron la teoría de Arrhenius para incorporar moléculas neutras e iones, así como reacciones en ausencia de un disolvente o un disolvente distinto al agua. Su definición de ácidos y bases se base en la capacidad de donar o recibir protones y extiende el término para definir los ácidos y bases conjugados. En 1923, Lewis amplio la definición de Brønsted-Lowry, que a su vez incluía la definición de Arrhenius-Ostwald, para reacciones que no implican átomos ácidos (“ácidos de Lewis”).
Basados en Arrhenius-Ostwald, Sörensen propuso la escala logarítmica del pH en 1909:
pH = - log([H+]
y en 1916 se presentó la ecuación de Henderson-Hasselbalch:
pH = pKa + log [A-]/[HA]
mismas que se siguen utilizando hoy en día para calcular el pH de un medio simple, pero no sirven cuando se trata de un fluido complejo como la sangre o el líquido ruminal
En medicinia humana y veterinaria se utilizan ampliamente los conceptos de de balance ácido-base (Astrup & Severinghaus, 1982), lo cual ya se ha denominado la escuela danesa, en contraposición a la nueva Teoría de Stewart, que se considera la escuela americana. Las diferencias entre ambas tienen sus raíces a nivel fisico-químico, por lo que es necesario retomar otras teorías de ácidos no tradicionales (Atkins, 1986)
De todas las teorías alternativas de ácidos, que se oponen a las teorías “clásicas” de ácidos, la más importante es la de las Definiciones Generales de Solventes, que se basa en las reacciones que ocurren en sistemas específicos de solventes (Germann, 1925; Cadey & Elsey, 1928). Para ácidos protónicos en solventes anfotéricos, éstos son idénticos a la definición de ácidos de Brønsted-Lowry, sin embargo, a veces es conveniente dar nombres específicos para los cationes y aniones de la molécula del solvente producidos por la adición y remoción de un protón. Al cation se le llama "Lionio" (H3O+ en agua) y al anión "Liato" (OH- en agua).
De esta manera, un ácido puede ser definido como una substancia que incrementa la concentración de "Lionio" y que reduce la concentración de "Liato" en el medio. Una base puede ser definida como una substancia que incrementa la concentración de "Liato" y que disminuye la concentración de "Lionio".
Para el caso del agua como solvente, un ácido puede ser definido como una carga eléctrica negativa que produce una mayor disociación en el agua de [H+], mientras que una base se define como una carga positiva que produce una mayor disociación en el agua de [OH-].
Es importante recordar que la constante de disociación del agua es muy pequeña (10-14M) por lo que su constante de asociación es altísima (reciproco de la constante de disociación: 1/10-14 M = 1014 M). Esto explica porque un ion de hidrógeno o un ion hidroxilo en solución se unirán con mayor preferencia a otras moléculas de agua, y no a aniones débiles (e.g. bicarbonato, acetato, lactato) como predice la Teoría de Brønsted-Lowry de donadores de protones. Por esto y su altísima concentración (55.5 M), elagua es el primero y más importante donador y receptor de protones en las soluciones acuosas.
II. La Teoría de Stewart
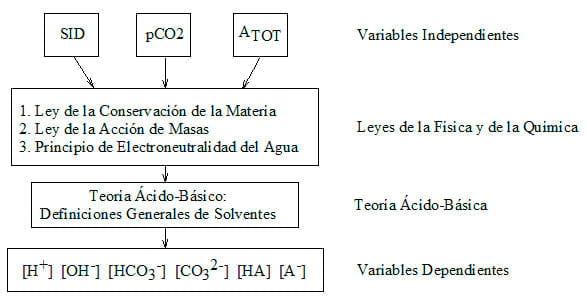
En 1981, el fisiólogo canadiense Peter A. Stewart (1921-1993), estableció un método cuantitativo para analizar fenómenos del balance ácido-base no comprendidos en su momento (Kellum & Embers, 2009). La Teoría de Stewart propone que el comportamiento y concentración de ciertos iones y moléculas (variables dependientes: ([H+], [OH-], [HCO3-], [CO32-], [HA], [A-]) en un medio acuoso está determinado por la acción de las leyes de la química sobre las variables independientes: la diferencia entre iones fuertes (Strong Ion Difference: SID), la presión parcial de bióxido de carbono (pCO2) y el total de aniones débiles en la solución (ATOT, ácidos orgánicos disociados y no disociados). Asimismo, está basada en el efecto de tres principios básico de la química sobre el balance de las cargas eléctricas en las soluciones acuosas:
1) La ley de la conservación de la masa, establece que la cantidad de substancia se mantiene constante, a menos de que sea añadida, removida, generada o destruida:
[HA] + [A-] = [ATOT]
El total de un ácido débil (ATOT) es una variable independiente, y puede estar presente como ácido disociado (A-) o no-disociado (HA), siendo ambas variables dependientes.
2) La ley de acción de masas, que establece que toda substancia incompletamente disociada alcanza un equilibrio de disociación:
[A] * [B] = K * [C]
donde K es la constante de la tasa de la reacción.
El agua tiene una constante de disociación KW muy pequeña (KW = 1*10-14) pero una constante de asociación muy grande (1/KW = 1*1014)
3) Principio de electro-neutralidad, que establece que la suma de los iones cargados positivamente debe ser igual a la suma de los iones cargados negativamente:
[Na+] + [K+] + [Ca2+] + [Mg2+] + [H+] - [Cl-] - [Anion-] - [OH-] - [HCO3-] - [CO32-] = 0
El agua se disocia en iones cargados positivamente (H+) o negativamente (OH-) para mantener un balance electro-neutral.
Basadas en estas variables independientes y en estas tres leyes se desarrolla el análisis de las ecuaciones de Stewart para determinar las variables dependientes (Figura 1):
Figura 1. Las bases teóricas de la Teoría de Stewart
La solución matemática de todo esto se lleva a cabo por una serie de seis ecuaciones simultáneas que pueden ser solucionadas con cualquier computadora moderna. Sólo es posible obtener una predicción de la concentración de las variables dependientes si se conocen todas y cada una de las variables independientes.
Las seis ecuaciones simultáneas de Stewart
El tratamiento matemático de la Teoría de Stewart puede ser revisado en sus obras originales (Stewart, 1981, 1983) o en el sitio oficial de Internet (http://www.acidbase.org) o directamente con el autor (drhaubi@yahoo.com). En este artículo se presentan únicamente las seis ecuaciones simultáneas tal y como pueden utilizarse en una hoja de cálculo o en un programa formal para calcular cada una de las variables dependientes: H+ (pH), OH-, HCO3-, A-, HA, CO2(d), CO32-, H2CO3:
[H+] * [OH-] = KW’ Ecuación #0
[H+] * [A-] = KA * [HA] Ecuación #4
[HA] + [A-] = [ATOT] Ecuación #5
[H+] * [HCO3-] = KC * pCO2 Ecuación #8
[H+] * [CO32-] = K3 * [HCO3-] Ecuación #9
y finalmente, para mantener la neutralidad eléctrica:
[SID] + [H+] - [HCO3-] - [A-] - [CO32-] - [OH-] = 0 Ecuación #10
Donde las constantes utilizadas son:
KW = 4.40*10-14 (Eq/L)2
KC = 2.34 * 10-11 (Eq/L)2 mmHg-1
K3 = 6.0*10-11 Eq/L
KA = 1.64*10-7 Eq/L (en reposo)
KA = 1.98*10-7 Eq/L (en ejercicio)
KC = K * S
Las variables para calcular KC, son K, la constante de disolución (K = 7.42*10-7 Eq/L); y S, la constante de Solubilidad (S = 0.0351 Eq/L mmHg-1 a 37°C y 300 mOsm).
Una forma de obtener resultados exactos para todos los iones es sustituyendo cada valor con un valor inicial de [H+] y por medio de iteraciones encontrar el valor que de una electronegatividad de cero. Esto hace posible la solución para la concentración del ion de hidrógeno [H+] posible con la ayuda de las computadoras Sustituyendo [H+] por cada valor en la ecuación #10:
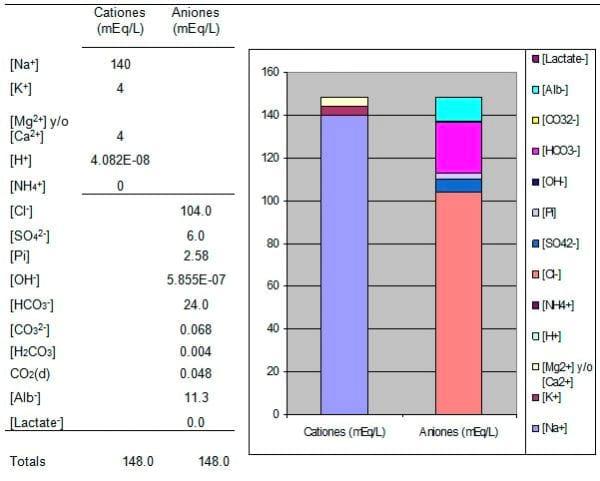
Una vez obtenido el valor de [H+] es muy fácil encontrar el valor de todas las variables dependientes y graficarlas en forma de “Gamblegrama” (Cuadro 1).
Cuadro 1. Programa para calcular el pH según la Teoría de Stewart. Ejemplo de tabla de resultados de la simulación y respectivo Gamblegrama, presentando los cationes en una columna y los aniones en otra.
Nota: Para crear la gráfica con el asistente de Excel© es necesario marcar (highlight) toda la Cuadro y pedir al asistente Columnas, luego Columnas “stacked” (por niveles), datos por filas, hasta obtener una gráfica similar al Cuadro 1.
II. Implicaciones biológicas y clínicas de la Teoría de Stewart
Stewart vs. HendersonHasselbalch
La principal consecuencia de la Teoría de Stewart es que pone en duda la validez de la ecuación de Henderson-Hasselbalch (Hasselbalch, 1916). En esta última se calcula el pH del plasma a través de la concentración de bicarbonato y ácido carbónico, siendo que el bicarbonato no se mide directamente en laboratorio, y aún cuando se pudiera determinar en forma directa, éste seguiría siendo una variable dependiente. En cambio Stewart permite la predicción de los cambios en pH en diferentes situaciones fisiopatológicas así como en respuesta a diferentes terapias de hidratación intravenosa.
Por ejemplo, el uso de solución salina fisiológica (SSF: NaCl 0.9%) debe ser restringida a casos de alcalosis metabólica, ya que en sí misma la solución salina tiene un efecto acidificante (Kellum, 2002). La SSF provee 154 mEq/L de Na+ y Cl- ([SID] = 0) siendo que el plasma únicamente contiene únicamente 104 mEq/L de Cl-, por lo que la SSF provee un exceso de 50 mEq/L de Cl- . Hay que recordar que [SID] del plasma es de +38 a +42 mEq/l y que la relación entre iones Na+ y Cl- debe ser por lo menos de +22 mEq/L. En la clínica veterinaria y humana se olvida este aspecto tan importante, lo que lleva a una acidosis electroquímica iatrogénica por el uso equivocado de soluciones parenterales.
La no existencia de los protones (H+)
En la teoría de Stewart los protones no tienen una existencia real (como las bolitas o pelotitas que se pintan en los libros de bioquímica H). Por un lado, el tiempo de vida de un protón aislado es de 10-11 segundos (es inmediatamente atrapado dentro de la matriz de agua, formando cristales sin carga), por lo que no puede ser considerado como una entidad propia. Más bien, los protones deben ser considerados como eventos probabilísticos, o como simples cargas eléctricas positivas, que una vez disociadas de una molécula (ácido fuerte, débil o de la misma agua) son atraídos por otras cargas negativas, principalmente por el oxígeno del agua. Entonces, si no existen los protones como tales, muchas de las teorías de fisiología de membrana, que estipulan el transporte de protones específicos a través de la misma, no pueden ser correctas.
Un ejemplo muy claro es la hipótesis quimiosmótica de Mitchell (1961), la cual explica la producción de ATP por medio de la generación de un gradiente de protones en el espacio intermembranal de las mitocondrias y que esto establece una fuerza motiva de protones (FMP) y que es el paso de los protones a través de de la F1F0 ATP-sintasa lo que lleva a cabo la síntesis de ATP. Sin embargo, de la discusión anterior queda claro que no pueden existir protones en forma libre, sino que se disocian constantemente del agua por la presencia de cargas negativas en el medio. La hipótesis de Mitchell no reconoce este principio fisicoquímico del agua y por lo tanto no explica cómo pueden existir protones en forma libre sin una carga negativa que los “acompañe”.
Según Haubi Segura (2004b), en la Teoría de Stewart, los cambios de pH (una variable dependiente) en ambos lados de la membrana interna de la mitocondria son en realidad efectos derivados del incremento relativo en cargas eléctricas negativas en el espacio intermembranal, mismas que pueden deberse al transporte de electrones en las proteínas de la membrana y/o a la entrada de aniones al espacio intermembranal. También es posible que la acidificación en el espacio intermembranal sea debido a la interacción de cationes (Na+) con la enzima y por lo tanto un cambio en el pH en ese espacio.
La acidez del ion bicarbonato
Tradicionalmente, el ion bicarbonato (HCO3-) es considerado como un buffer dentro de los fluidos corporales. Sin embargo, hay que recordar que el bicarbonato es un anión, por lo cual reduce el pH en el organismo (pKa 6.1), lo que ha causado controversia sobre el efecto real del bicarbonato en el rumen (Russell & Chow, 1993). Sin embargo, cuando se añade la sal de bicarbonato de sodio a una solución sí hay un incremento en el pH, pero esto se debe realmente al sodio, el cual aumenta el SID de la solución y por lo tanto hay una disminución en la concentración de iones de hidrógeno y un incremente en la concentración de iones hidroxilo.
La volatilidad de los iones bicarbonato
Asimismo, el ion bicarbonato es una variable dependiente. Por esto, no tiene ningún efecto importante expulsarlo de una célula o reabsorberlo a la misma. El ion bicarbonato cambiará de acuerdo a las otras variables independientes. De esta manera resulta necesario revisar los conceptos de “reabsorción de bicarbonato” en los riñones, o en su “excreción” en el jugo pancreático.
III. La Teoría de Stewart en la Nutrición Animal
El balanceo de raciones en ganado lechero ha seguido una evolución paulatina. Inicialmente se buscó balancear para cubrir los requerimientos energéticos y proteicos de las vacas en sus diferentes etapas productivas (NRC, 1988). Posteriormente se buscó optimizar el balance de amino ácidos limitantes (NRC, 2001). Recientemente se está buscando crear modelos de fermentación ruminal que permitan predecir la producción de ácidos grasos volátiles (AGV) de acuerdo a los substratos disponibles para los microorganismos ruminales y según las características físico-químicas del medio ruminal (Russell et al., 1993, Pitt et al. 1996). Para este fin, se han incorporado ecuaciones de predicción del pH en los modelos de fermentación ruminal (Pitt & Pell, 1997), sin embargo, dichas ecuaciones están basadas en las ecuaciones de Henderson-Hasselbalch, y por lo tanto no pueden predecir el efecto de todas las variables independientes en el rumen.
La Teoría de Stewart permite crear un modelo cuantitativo de la fermentación ruminal basado en las variables independientes del rumen:
- SID (diferencia de iones fuertes): Na+, K+, Mg2+, Ca2+, Cl-, SO42-
- Presión parcial de CO2: PCO2 (ca. 65% de los gases en el medio = 500 mmHg)
- Acidos orgánicos: Acético, propiónico, butírico, láctico, etc.
- Amonia: Como NH4+ y urea (precursor de amoniaco)
- Fosfatos: todas las especies de iones fosfatos (PO43-, HPO42-, H2PO4-)
El modelo de fermentación ruminal es más complejo que el del plasma, pero es posible incluir todas las variables en el sistema de ecuaciones simultáneas (Häubi Segura, 2004b).
Una vez que una dieta ha sido balanceada para cumplir con los requerimientos energéticos, proteicos y de macro-minerales (relación calcio-fósforo), el nutriólogo animal necesita balancear la dieta para mantener un balance electroquímico de la misma, ya que de esto dependerá que el rumiante no desarrolle un proceso de acidosis ruminal subclínica y clínica. La ración debe proveer suficientes cationes minerales (Na+, K+, Mg2+, Ca2+) para compensar la producción de aniones durante la fermentación (incremento en AGV, lactatos y CO2).
La saliva, producida en cantidades de hasta270 litrospor día, es el principal aporte de estos cationes (el bicarbonato no cuenta en la Teoría de Stewart; es un anión, pKa = 6.1) y éstos serán continuamente absorbidos por la pared ruminal y por el intestino y reciclados en la glándula salival.
Por otro lado, el reciclaje de urea provee un aporte importante de cationes orgánicos (NH4+) que incrementará si el aporte nutricional de cationes minerales no es el suficiente.
Los forrajes tienen un mayor contenido de minerales que los granos, y una mayor cantidad de cationes, especialmente potasio, calcio y magnesio, lo que les confiere un balance electroquímico positivo. Los granos y subproductos de cereales tienen bajos niveles de minerales, y en general son bajos en cationes y altos en sulfatos, lo cuales les confiere un balance electroquímico bajo, incluso negativo (ver tablas de nutrientes en NRC, 1988 y 2001). El balance electroquímico de la dieta implica mantener un SID positivo durante todo el proceso de fermentación, para evitar la acidificación del medio ruminal.
Un caso especial es la alimentación de la vaca lechera próxima al parto, a la cual se le ofrece una dieta aniónica (alta en iones cloruro y sulfato) para producir una acidosis metabólica ligera que sea compensada por la reabsorción de iones calcio de los huesos, con el objetivo de evitar la hipocalcemia o fiebre de leche (Oetzel et al., 1988). Sin embargo, la tradicional forma de medir el balance catiónico-aniónico en la dieta (DCAD) no toma en consideración el efecto electroquímico de todos los iones fuertes (Vagnoni & Oetzel,1998):
DCAD = [Na+] + [K+] – [Cl-] – [S2-])
DCAD = 1000 x (K/39 + Na/23 – Cl/35.5 –S/16) (g/kg MS)
por lo cual se considera más correcto utilizar el SID (Strong Ion Difference):
SID = [Na+] + [K+] + [Mg2+] + [Ca2+] – [Cl-] – [S2-]
Los fosfatos deben ser medidos aparte, ya que una gran parte de éstos se encuentran en forma de ácido fítico y no son disponibles para las bacterias o para el organismo.
Todavía no se han realizado los experimentos para ver en qué proporción son estos iones liberados al medio ruminal y que en proporción son utilizados por los microorganismos y/o absorbidos por el epitelio ruminal.
Si el valor resultante del balance electroquímico (en mEq/L) es suficientemente alto (>140 mEq/L), el rumen mantendrá un pH relativamente alto durante la fermentación (pH >6.2) que permitirá a las bacterias celulolíticas fermentar la fibra de manera más eficiente (Mould & Orskov, 1983, Mouriño et al., 2001). Por otro lado, si el valor de SID es ligeramente más bajo (<110 mEq/L) el pH del rumen disminuirá significativamente (pH <5.5) conforme se acumulen AGV, lactatos y CO2 (Djikstra et al., 1993).
Una dieta alta en granos (50% de la dieta) puede incrementar el SID del rumen entre 7 y 10 mEq/L, mientras que una dieta que incluya alfalfa en heno (aprox. 6 kg de materia seca) lo incrementará en más de 18 mEq/L. Esta pequeña diferencia de 10 mEq/L puede traducirse en un aumento de 0.3 puntos de pH (calculado según el programa AcidBasics II©, Watson, 2003), lo cual es sumamente importante para mantener la salud del rumen (Meschy y Bravo, 1998, Sauvant et al., 1999).
La adición de bicarbonato de sodio (NaHCO3) o de óxido de magnesio (MgO) ayudará a mantener alto el SID en el rumen y prevenir la acidosis láctica (Counotte et al., 1979). La suplementación de 250g NaHCO3 por día (3 moles) equivale a un incremento de 42 mEq/L de sodio, lo que permitiría un acumulo similar de ácidos sin cambios en el pH. Es necesario recalcar que el ion bicarbonato debe ser eliminado como CO2 antes de que exista un incremento en el pH del rumen. Esto explica porque las vacas timpanizadas también cursan con acidosis ruminal.
Durante la acidosis clínica (Dunlop, 1972, Owens et al., 1998), el rumiante deja de rumiar y salivar, lo cual reduce el aporte de cationes al rumen, reduciendo el pH en el mismo. Sin embargo, esto implica un mecanismo de sobrevivencia, ya que al mantener a los cationes en la sangre, la vaca mantiene un SID plasmático normal y puede sobrevivir a la acidosis metabólica producida por la absorción de AGV, CO2 y lactatos.
Según Häubi-Segura (2004a), el organismo de la vaca buscará eliminar los aniones minerales (iones cloruro, principalmente) por diferentes vías: eliminación de cloruros por diarrea, excreción renal, o por flujo transepitelial de fluido plasmático. Durante la acidosis ruminal hay un incremento en la osmolaridad del rumen, lo cual produce una entrada de plasma al rumen, acarreando iones cloruro en altas concentraciones (110 mEq/L en plasma vs. 20 mEq/L en rumen). De esta manera, el rumen, como compartimento fisiológico, es sacrificado para salvar a la vaca. Es posible que el proceso de acidificación extrema del rumen sea un mecanismo intencional para reducir la actividad bacteriana. Esto podría ser útil si las únicas bacterias lácticas presentes en el rumen fueran Streptococcus bovis, las cuales son inhibidas a pH menores a 5.0 (Russell & Dombrowski, 1980); sin embargo, las dietas modernas incluyen ensilajes de maíz, lo cual mantiene altas las poblaciones de Lactobacillus spp., que son resistentes a pH por debajo de 4.0.
La prevención de la acidosis ruminal debe basarse en una generosa fuente de forrajes y reducir la cantidad de grano en la dieta (Enemark et al., 2002). Tradicionalmente se ha manejado que el rumen debe tener un mínimo de 17% de fibra cruda (NRC, 1988) para evitar una caída en el pH. Esto esta basado en el trabajo de Kaufmann (1976) en el cual desarrolla una correlación linear entre el porcentaje de fibra cruda y pH ruminal, sin embargo, no se toma en cuenta que el pH es un valor logarítmico, pero que a niveles menores de 17% de FC la concentración de iones de hidrógeno ([H+]) en realidad incrementa exponencialmente (Häubi Segura, 2004a). Es por esto que la nutrición de la vaca lechera debe mantenerse fiel a los orígenes evolutivos de los rumiantes: las vacas deben ser alimentadas con forrajes de calidad y el grano debe ser utilizado como suplemento únicamente.
IV. Conclusiones
En nutrición de rumiantes, la Teoría de Stewart demuestra que el balance electroquímico de la ración, y por lo tanto, el balance ácido-báse del rumen, es afectado simultáneamente por todas las variables independientes: diferencia entre cationes y aniones fuertes (SID), presión parcial de CO2 y producción de ácidos orgánicos durante la fermentación. El balanceo de la dieta debe hacerse tomando en cuenta el aporte de electrolitos de forrajes y granos para evitar problemas de acidosis ruminal.
V. Referencias
Astrup, P.B., Severinghaus, J.W. (1982). The History of Blood Gases, Acids, and Bases. Munsgaard,Copenhagen.
Atkins, P.W. (1986).Physical Chemistry. 3rd ed.OxfordUniversity Press,Oxford,UK.
Bynum, W.F., Browne, E.J. and Porter, R. (1981).Dictionary of the History of Science. The MacMillan Press Ltd.,London.
Cady, H.P. & Elsey, H.M. (1928). A general conception of acids, bases and salts. Journal of Chemical Education, 5, 1425-1428).
Counotte, G. H., van't Klooster, A. T., van der Kuilen, J. and Prins, R. A. (1979). An analysis of the buffer system in the rumen of dairy cattle. Journal of Animal Science, 49:6, 1536-1544.
Dijkstra, J., Boer, H., Van Bruchem, J., Bruining, M. and Tamminga, S. (1993). Absorption of volatile fatty acids from the rumen of lactating dairy cows as influenced by volatile fatty acid concentration, pH and rumen liquid volume. British Journal of Nutrition, 69:2, 385-396.
Dunlop, R. H. (1972). Pathogenesis of ruminant lactic acidosis. Advances in Veterinary Science & Comparative Medicine, 16: 259-302.
Enemark, J. M. D., Jorgensen, R. J. and St. Enemark, P. (2002). Rumen acidosis with special emphasis on diagnostic aspects of Subclinical Rumen Acidosis: a review. Veterinarija ir Zootechnika, 20: 16-29.
Germann, A.F.O. (1925). A general theory of solvent systems. Journal of the American Chemical Society, 47, 2461-2468
Hasselbalch, K.A. (1916). Die Berechnung der Wasserstoffzahl des Blutes aus der freien und gebundenen Kohlensäure desselben, un die Sauerstoffbindung des Blutes als Funktion der Wasserstoffzahl. Biochemische Zeitung, 78:112-144.
Häubi Segura, C.U. (2004).Use of the Rumen Simulation Technique (RUSITEC) to model clinical and subclinical rumen acidosis in dairy cattle. PhD Thesis, Department of Agriculture, The University of Reading, UK.
Häubi Segura, C.U. (2004).Teoría Ácido-Básico de Stewart: Aplicaciones prácticas de una nueva teoría del balance del pH en los sistemas biológicos. Editorial Cigome, Toluca, México.
Häubi S. C., Moreno-Santillán, A. Diaz de León-Ponce, Briones-Veja C.G., Meneses-Calderón, J., Orenday-Aréchiga, M.E., Torres-Pérez, J., Briones-Garduño, J.C. (2006). Teoría ácido-básico de Stewart, un nuevo paradigma en medicina crítica. Revista Mexicana de Anestesiología, 29:4, 240-244.
Kaufmann, W. (1976). Influence of the composition of the ration and the feeding frequency on pH-regulation in the rumen and on feed intake in ruminants. Livestock Production Science, 3:2, 103-114.
Kellum, J. A. (2002). Fluid resuscitation and hyperchloremic acidosis in experimental sepsis: improved survival and acid-base balance with a synthetic colloid in a balanced electrolyte solution compared to saline, Critical Care Medicine, 30: 300-305
Kellum, J.A. and Elbers, P.W.G. (2009).Stewart´s Textbook of Acid-Base.
Meschy, F. and Bravo, D. (1998). L'apport alimentaire de substances tampons. Doc. CAAA-INAPG, INRA,Paris,France.
Mitchell, P. (1961). Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. Nature, 191: 144-148.
Mould, F. L. and Ørskov, E. R. (1983). Manipulation of rumen fluid pH and its influence on cellulolysis in sacco, dry matter degradation and the rumen microflora of sheep offered either hay or concentrate. Animal Feed Science & Technology, 10:1, 1-14.
Mouriño, F., Akkarawongsa, R. and Weimer, P. J. (2001). Initial pH as a determinant of cellulose digestion rate by mixed ruminal microorganisms in vitro. Journal of Dairy Science, 84:4, 848-859.
NRC. (1988). Nutrient requirements of dairy cattle. 6th revised edition, National Academy Press,Washington,D.C.,USA.
NRC. (2001). Nutrient requirements of dairy cattle. 7th Edition, NationalAcademy Press,Washington,D.C.,USA.
Oetzel, G.R.., Olson, J.D., Curtis, C.R., Fettman, M.J. (1988). Ammonium Chloride and Ammonium Sulfate for Prevention of Parturient Paresis in Dairy Cows. Journal of Dairy Science.71: 3302-3309.
Owens, F. N., Secrist, D. S., Hill, W. J. and Gill, D. R. (1998). Acidosis in cattle: a review. Journal of Animal Science, 76:1, 275-286.
Pitt, R. E. and Pell, A. N. (1997). Modeling ruminal pH fluctuations: interactions between meal frequency and digestion rate. Journal of Dairy Science, 80:10, 2429-2441.
Pitt, R. E., Van Kessel, J. S., Fox, D. G., Pell, A. N., Barry, M. C. and Van Soest, P. J. (1996). Prediction of ruminal volatile fatty acids and pH within the net carbohydrate and protein system. Journal of Animal Science, 74:1, 226-244.
Russell, J. B. and Chow, J. M. (1993). Another theory for the action of ruminal buffer salts: decreased starch fermentation and propionate production. Journal of Dairy Science, 76:3, 826-830.
Russell, J. B. and Dombrowski, D. B. (1980). Effect of pH on the efficiency of growth by pure cultures of rumen bacteria in continuous culture. Applied & Environmental Microbiology, 39:3, 604-610.
Russell, J. B., O'Connor, J. D., Fox, D. G., Van Soest, P. J. and Sniffen, C. J. (1992). A net carbohydrate and protein system for evaluating cattle diets: I. Ruminal fermentation. Journal of Animal Science, 70:11, 3551-3561.
Sauvant, D., Meschy, F. and Mertens, D. (1999). Components of ruminal acidosis and acidogenic effects of diets. [French] Original Title Les composantes de l'acidose ruminale et les effets acidogenes des rations. Productions Animales (Paris), 12:1, 49-60.
Stewart, P.A. (1981). How to understand acid-base: a quantitative acid-base primer for biology and medicine / Peter A. Stewart.Elsevier,New York
Stewart, P.A. (1983). Modern quantitative acid-base chemistry. Canadian Journal of Physiology and Pharmacology, 61:12, 1444-1461.
Vagnoni, D.B. and Oetzel, G.R. (1998). Effects of Dietary Cation-Anion Difference on the Acid-Base Status of Dry Cows. Journal of Dairy Science, 61:6, 1643-1652.
Watson, P. D. (2003). Acid Basics II. ( ver. 4.0.8). University ofSouthern Carolina, Department of Physiology, Southern Carolina,USA. URL: http://www.med.sc.edu:96/watson/Acidbase/Acidbase.htm