Perfil endocrino y reproductivo durante la lactación relacionado con el anestro postparto y la modulación ovárica para mejorar la eficiencia en la vaca lechera
Publicado: 30 de marzo de 2010
Por: Juan Ramón Batista, Ingeniero Zootecnista y Edil Enrique Araúz, M. Sc. Ciencia Lechera y Fisiología Animal, Profesor, Dpto. de Zootecnia, Facultad de Ciencias Agropecuarias, Vicerrectoría de Investigación y Postgrado, Univ. de Panamá.
Durante las últimas semanas de la gestación, la placenta bovina aumenta la síntesis de estradiol; superando varias veces la cantidad que se produce durante el estro. Este alto nivel de estradiol produce una retroalimentación negativa prolongada sobre el hipotálamo, que inhibe la síntesis y liberación de hormona liberadora de gonadotropinas (GnRH) y por lo tanto en la sangre no circulan las hormonas hipofisiarias que estimulan el crecimiento folicular. Bajo esta condición hormonal, los folículos ováricos se pueden desarrollar hasta formar antro, pero debido a la ausencia de estímulo gonadotrópico; su crecimiento es limitado y no alcanza a formar ondas foliculares que culminen con el folículo de Graaf y la ovulación. Con la expulsión de la placenta durante el parto, se termina la producción de estradiol y el hipotálamo inicia la recuperación de la capacidad de sintetizar GnRH. Esta secuencia permite restablecer paulatinamente la sensibilidad a los estrógenos ováricos para facilitar el mecanismo de retroalimentación positivo que controla la liberación de las hormonas folículoestimulante (FSH) y luteinizante (LH). Ambas hormonas son requeridas para estimular el crecimiento y la maduración final del folículo, la síntesis de estradiol, la expresión del estro y la ovulación. Después del parto, las altas demandas de nutrientes requeridos para la síntesis de grandes volúmenes de leche, la limitada capacidad de consumo de alimentos y las inadecuadas concentraciones de nutrientes; conducen al balance energético negativo (BEN). Esta condición determina una respuesta compensatoria (homeorresis) que incluye el tejido adiposo, el hígado, los músculos y los huesos. El balance energético negativo retarda la reanudación de los ciclos estrales postparto y dependiendo de su intensidad, puede limitar el crecimiento de los folículos ováricos. Sin embargo, paulatinamente se restablece el equilibrio energético requerido para que el hipotálamo reanude la síntesis y liberación de los pulsos altos y frecuentes de GnRH, los cuales estimulan la hipófisis; produciéndose la liberación del pico preovulatorio de LH que se relaciona con la primera ovulación postparto. La subnutrición, la producción de leche y el estrés calórico son limitantes de la reactivación ovárica postparto; aunque los metabolitos energéticos y las hormonas metabólicas también pueden afectar el desempeño reproductivo; aunque se desconocen muchos de los mecanismos de cómo las sustancias energéticas y hormonales como la leptina limitan la fisiología glandular hipotalámica, la pituitaria y los ovarios para reanudar el ciclo estral postparto en la vaca lechera.
ABSTRACT
During the last weeks of gestation, the bovine placental estradiol synthesis increased to a level exceeding many times the amount produced during estrous. This high level of estradiol produced a prolonged negative feedback on the hypothalamus, which inhibits the synthesis and releasing of the gonadotropin-releasing hormone (GnRH) and therefore does not circulate in the blood the pituitary hormones that stimulate follicle growth. Under this hormonal condition, ovarian follicles can develop to form antrum, but due to the absence of gonadotropic stimulation, their growth is limited and fails to form follicular waves; including Graaf's follicle development and ovulation. With the expulsion of placenta during delivery, estradiol production ended and the hypothalamus initiates recovery of the ability to synthesize GnRH and gradually restore sensitivity to ovarian estrogens to restore the positive feedback mechanism that controls the release of FSH and LH to stimulate growth and final maturation of one follicle, the synthesis of estradiols, the expression of estrus and ovulation. After delivery the high demands of nutrients required for the synthesis of large amounts of milk, limited capacity of food consumption and inadequate serum concentrations of nutrients produce a negative energy balance (NEB). This condition generates a compensatory response (homeorrhesis); involving adipose tissue, liver, muscles and bones. The negative energy balance delayed the resumption of postpartum estrous cycles and depending on its intensity, it may limit the growth of ovarian follicles. Gradually, in time-varying genetics, milk production, adaptation to environment and heat stress, health and availability of nutrients energy balance is restored. Therefore, hypothalamus is able to initiate synthesis and release of high and frequent pulses of GnRH, which stimulates the pituitary release of a preovulatory surge of LH to allow first ovulation postpartum. Low nutrition, high milk production and heat stress limit ovarian reactivation after parturition; however, energetic metabolites and metabolic hormones do influence on ovarian and reproductive performance; even when specific mechanisms are unknown yet in order to explain their influences on hypothalamus, pituitary and ovarian functions to restore the normal estrous cycle in lactating dairy cows.
Key words: anoestrus, GnRH, negative energy balance, ovulation, dairy cattle, reproduction, lactation.
INTRODUCCIÓN
La eficiencia de la reproducción del ganado es muy dependiente del comportamiento reproductivo de las hembras (Webb et al., 1999), las cuales tienen una constitución orgánica adecuada para parir cada año. La expresión del potencial lactacional y reproductivo de la vaca lechera requiere del establecimiento de la preñez entre los 45 y 120 días postparto como parte del ciclo de la producción (Araúz, 2009). No obstante, es difícil lograr este ideal fisiológico debido a los múltiples factores que afectan el crecimiento folicular postparto (Webb et al., 1999; Greenwald and Roy, 1994;) y la ovulación (Lucy et al., 1992) en la medida que la producción de leche ha aumentado producto del mejoramiento genético y por una manejo que favorece la eficiencia lactacional.
No hay duda de que el factor que más influye sobre la eficiencia reproductiva del ganado es la nutrición (Thatcher et al., 1996; Butler and Smith, 1989), Además, el estrés calórico es un importante modulador del ovulación en el trópico (Araúz, 2006; Hansen y Arechiga, 1999; Jordan, 2003). Sin embargo, se desconocen muchos mecanismos a través de los cuales los componentes de la dieta afectan la síntesis y secreción de las hormonas de la reproducción y la eficiencia reproductiva (Gwazdauskas et al., 2000). En las vacas lecheras el pico de producción se presenta entre seis y diez semanas después del parto. El tiempo de la máxima producción de leche no coincide con la capacidad máxima para consumir alimentos (Senatore, 1996) y ese tiempo es la época en la cual los ovarios se están preparando para producir la primera ovulación postparto (Butler and Smith, 1989).
La actividad ovárica postparto de las vacas parece estar relacionada directamente con el consumo de nutrientes y con la producción de leche (Butler y Smith, 1989; Lucy et al., 1992), aunque algunos estudios no encuentran esta relación. La dinámica folicular postparto se relaciona con el balance energético. El número de folículos en cada onda folicular, el diámetro máximo alcanzado por el folículo dominante, el período parto-primera ovulación y la cantidad de progesterona producida por el primer cuerpo lúteo parecen depender de la cantidad de nutrientes ingeridos y de la capacidad homeorrética de las vacas (Staples et al., 1998; Senatore et al., 1996; Lucy et al., 1992).
Muchas investigaciones recientes en reproducción de ganado lechero se han enfocado hacia el estudio del crecimiento y desarrollo de los folículos en los ovarios por medio de ultrasonografía y medición de niveles hormonales con el propósito de mejorar la comprensión de la función ovárica durante el postparto. Una mayor cantidad de investigaciones en nutrición se han desarrollado con el objetivo de valorar el consumo, la digestibilidad y la producción y calidad de la leche, pero pocas evalúan el crecimiento folicular, el retorno al estro o la eficiencia de la fertilidad (Senatore et al., 1996). A pesar de la intensa actividad investigativa sobre la fisiología del anestro postparto, la ovulación, la gestación y la nutrición en las vacas lecheras; aún falta aclarar aspectos fundamentales que permitan reducir significativamente el período abierto y mejorar la tasa de preñez.
Dinámica folicular en el bovino adulto.
Las opiniones científicas sobre la foliculogénesis en el bovino han variado a través de la historia de la investigación. Si bien algunos autores apoyaban la teoría de que los folículos se desarrollaban en periodos u ondas, la mayoría de los investigadores estaban de acuerdo con la noción de que el crecimiento folicular era continuo e independiente de las fases del ciclo. Numerosos trabajos demuestran que el patrón de ondas se repite en casi todos los estadios de la vida de la vaca, incluyendo la preñez y el periodo posparto (Mapletoft et al., 1999).
Una onda de crecimiento folicular involucra el desarrollo sincrónico de un grupo de folículos y esta caracterizada por el desarrollo de un gran folículo, llamado dominante y varios folículos subordinados; en lo cual, el folículo dominante será anovulatorio si ocurre durante la fase lúteal y ovulatorio si ocurre en la fase folicular (Mapletoft, 2001). Para el patrón de dos ondas, la primera onda comienza, en promedio, en el día 0 (día de la ovulación) y la segunda onda comienza en el día 10. Para el patrón de tres ondas, la emergencia de las ondas ocurre en promedio en el día 0, 9, y 16, siendo las dos primeras anovulatorias.
Las características del folículo dominante de la primera onda entre el patrón de dos ondas y el patrón de tres ondas no es diferente, pero la segunda onda emerge 1 a 2 días mas temprano en los animales con tres ondas que en los animales de 2 ondas. Existe una gran variabilidad individual en cuanto al día de emergencia de cada onda, especialmente la segunda onda que puede comenzar entre los 6 a 12 días (Bó et al., 2001).
El cuerpo lúteo comienza su regresión más temprano en los ciclos de dos ondas (día 16) que en los de tres ondas (día 19) afectando correspondientemente el intervalo interovulatorio (20 día y 23 días respectivamente). En ambos casos, el folículo dominante en el momento que ocurre la lúteolisis se torna en folículo ovulatorio y la emergencia de la onda siguiente se produce el día o muy cerca del día de la ovulación. (Macgowan, 1999). Si bien se ha descrito que en el 95 % de los ciclos estrales hay dos o tres ondas de desarrollo folicular, hay diferencias entre los estudios en cuanto a la preponderancia de animales con dos o tres ondas. Durante los dos primeros años de vida, el patrón de desarrollo folicular se mantiene en cada individuo, aunque aparentemente no hay diferencias en cuanto a fertilidad en vacas de dos o tres ondas. Sin embargo, factores como el nivel nutricional, stress calórico, y anestro lactacional pueden modificar el patrón de desarrollo folicular (Mapletoft et al., 1999).
Endocrinología y características del desarrollo folicular durante el ciclo estral
Las hormonas hipofisiarias folículoestimulante (FSH) y luteinizante (LH) son las responsables de la emergencia de las ondas foliculares y la selección de un folículo dominante (Hafez, 1989). Las elevaciones de la concentración plasmática de FSH son responsables de la emergencia de una onda folicular, la que posteriormente es suprimida por productos de los folículos en crecimiento. El folículo que primero adquiere receptores para LH llega a adquirir la condición de folículo dominante; presentando una ventaja competitiva sobre los otros folículos destinados a ser subordinados, que le permite sobrevivir sin FSH mientras que los restantes se convierten en folículos subordinados y van a sufrir atresia.
La secreción de progesterona por el cuerpo lúteo suprime la acción de la LH y como consecuencia, produce que el folículo dominante cese sus funciones metabólicas y que sufra una regresión; sin embargo, cuando ocurre la regresión del cuerpo lúteo, permite un incremento de la frecuencia de los pulsos de LH y unido a altas dosis de estradiol facilita la ovulación (Bo et al., 2001).
El mecanismo que regula la dinámica folicular esta basado en respuestas diferenciales a la FSH y LH; y los aumentos periódicos de FSH circulantes son responsables de las emergencias de las ondas foliculares; por lo tanto las vacas con dos ondas tienen dos aumentos y las de tres ondas tienen 3 aumentos de FSH (Mapletoft et al, 1999). A su vez, la FSH circulante es suprimida por el feed back negativo de los productos foliculares en crecimiento principalmente estradiol e inhibina; previniendo la emergencia de una nueva onda. Además de los factores endocrinos, se han estudiado factores reguladores intragonadales que intervienen en el control autócrino y parácrino de la función ovárica (Cutaia et al., 2003).
La supresión periódica de la FSH favorece las reservas del ovario previniendo el reclutamiento continuo de folículos antrales grandes, ya que el 99% de ellos sufrirán atresia. El aumento de FSH permite el crecimiento folicular suficiente para que algunos (no todos) de los folículos adquieran la capacidad de responder a la LH (Bo et al., 2001).
Sin embargo, la respuesta a la LH y la habilidad de convertirse en folículos dominantes no son un proceso de todo o nada y parece ser más una diferencia cuantitativa y no absoluta entre los folículos de una onda. Los folículos subordinados pueden convertirse en dominante si el folículo dominante original es removido (Mapletoft, 2001). Además, la competencia por la LH entre muchos folículos dominantes se manifiesta en animales súper estimulados con altas dosis de FSH por el menor diámetro máximo que alcanzan comparados con un solo folículo dominante.
Los factores de crecientes similares a la insulina I y II (IGF-1, IGF-II) potencian la acción de la FSH y LH a nivel ovárico en los folículos dominantes (FD); mientras que las proteínas fijadoras de dichos factores (IGFBP2, 3, 4, 5) secuestran a dichos factores de crecimiento en los folículos subordinados (FS) y por lo tanto dicha acción no se manifiesta (Wiltbank, 2003). Además, la expresión de un mayor número de receptores de LH y la necesidad de menores concentraciones de FSH en los FD pero no en los FS que permite a los FD expresar y mantener la dominancia (Bo et al., 2001).
La supresión continua de LH como consecuencia de la secreción de progesterona de la fase lúteal causa que el folículo pare sus funciones metabólicas y comience a regresar. Este cese de la secreción de los productos foliculares (estrógenos, inhibina) produce el aumento de FSH que va a ser el responsable del comienzo de la emergencia de la siguiente onda folicular repitiéndose el ciclo. Por último, la liberación de la supresión progestacional en la lúteolisis permite el incremento en la frecuencia de los pulsos de LH, un mayor crecimiento del folículo dominante y concentraciones muy altas de estradiol, que induce finalmente el pico de LH que es seguido por la ovulación.
Utilización de progestágenos para la sincronización de la onda folicular
Existen en la actualidad en el mercado productos eficientes que liberan progestágenos con la finalidad de sincronizar el celo y la ovulación. Estos productos son implantes vía auricular subcutáneos (Crestar) y dispositivos intravaginales CIDR. La finalidad de estos productos es mantener altos los niveles sanguíneos de progestágenos para suprimir la liberación endógena de la hormona luteinizante, simulando la fase lúteal del ciclo estral. La regresión lúteal es provocada por la aplicación inicial de estradiol (Baruselli, 2001).
Los implantes auriculares de progestágeno contienen norgestomet (17a- acetoxi 11b- metil-19-norpreg-4-en-3,3-diona), que presenta una potencia de alrededor de 200 veces superior a la progesterona natural. El implante silástico crestar contiene 3 mg de norgestomet, además viene acompañado de una inyección que contiene 5 mg de valerato de estradiol y 3 mg de norgestomet que se aplican al mismo momento de aplicar el implante. El propósito original de la inyección de valerato de estradiol es provocar la lúteolisis y que el norgestomet permita tener altos niveles inmediatos del progestágeno; que luego serán mantenidos con la liberación lenta del implante subcutáneo, el cual es extraído a los nueve días de implantado.
Uso de la PMSG al final de un protocolo con progestágenos
La PMSG es una glicoproteína de larga vida media, producida por la yegua preñada con actividad de FSH en vacas (Hafez, 1989). La utilización de PMSG al momento de retirar el crestar para estimular el desarrollo folicular en vaquillas prepuberes, vacas con cría, o vacas lecheras en lactancias, aumenta los porcentajes de preñez y significativamente la proporción de vacas en celo (Mapletof et al., 1999).
En un estudio realizado en vaquillonas Brahman tratadas con 10 días de crestar + PMSG, el promedio de extracción del implante hasta el estro fue de 47 horas (variando de 30 a 90 horas) con un 90 % de hembras detectadas en celo entre las 30 y 66 horas. La tasa de concepción después de la inseminación artificial a tiempo fijo vario de 37 a 54 % (McGowan, 1999). En otro estudio en Argentina se buscó determinar el efecto de 300 UI de eCG en vacas Angus Rojas, 60 a 90 días postparto con cría al pie. Se determinó que los porcentajes de preñez fueron de 57 a 63 %; aunque, el grado de ciclicidad de los animales influye drásticamente en los porcentajes de preñez (Bó et al., 2001).
El uso de estradiol en la sincronización de celo
Los estrógenos cumplen distintas funciones en el ciclo estral: estimulación del comportamiento estral (signos externos de celo), inducción de la lúteolisis e inicio de la onda pre ovulatoria de LH. Cuando se combinan con progesterona (P4), ejerce un feed back negativo sobre el soporte gonadotrófico (LH y FSH) para el crecimiento folicular, produciendo la atresia del folículo ovárico dominante y originando la emergencia de una nueva onda folicular 4 a 5 días después (Bó et al., 2001). En estudios diseñados para dilucidar si el valerato de estradiol provoca atresia folicular se encontró que dicho tratamiento causa la supresión prolongada del pico de FSH previo a la onda y demora la emergencia de la siguiente onda folicular (Bo et al., 2001).
Los estrógenos naturales son esteroides de 18 carbonos y un anillo fenolito A (anillo aromático con un grupo hidrófilo carbono 3) y un grupo hidrófilo b cetónico en el carbono 17 del anillo D. El estradiol- 17 b es el más potente de los principales estrógenos que se encuentran tanto en humanos como en animales. Es el principal producto secretado por el ovario y se oxida fácilmente y se transforma en estrona en el hígado y esta ligado en más del 50% a proteínas plasmáticas.
El éster es una cadena compuesta principalmente por átomos de carbono que están típicamente adheridos a la hormona esteroide matriz en la posición del carbono 17. La esterificación del grupo hidroxilo de 17b de estradiol-17b lleva a la protección de este grupo contra el ataque metabólico y a la prolongación del efecto. Por lo tanto el cipionato de estradiol tiene una actividad biológica más sostenida que el estradiol 17b, el benzoato de estradiol tiene un periodo de acción mas corto y el valerato de estradiol es de acción inmediata (Mapletoft, et al., 2003).
Periodo posparto y la Involución Uterina
Siguiendo el parto y la expulsión de la placenta fetal, el útero inicia el proceso de la regresión o involución. Este proceso es caracterizado por una marcada reducción en el tamaño uterino y cambios histológicos en el endometrio. Durante los primeros 4 a 10 días posparto la reducción es lenta, aunque el peso del útero se reduce al 70 % del parto a los 10 días posparto. Entre los días 10 al 14, la reducción en el tamaño uterino es rápida, el tono es incrementado y la descarga de loquios esta al máximo. En este momento, el diámetro del cuerno previamente preñado, es reducido de 120 a 70 mm. Siguiendo en este momento el tamaño del cuerno que continúa decreciendo pero este nunca alcanzara el tamaño previo a la preñez (Risco, 2000).
Durante la involución del útero, las carúnculas con consistencia principalmente de masas arrugadas de tejidos y vasos sanguíneos están bajo la necrosis debido a la vasoconstricción. Como un resultado de esta necrosis, la PGF2a en la circulación periférica incrementa al máximo su concentración de 1 a 4 días posparto y declina a niveles básales a los 17 días posparto.
Una larga duración y altas magnitudes de las concentraciones plasmáticas de PGF2a posparto, tienden a ser asociadas con una rápida tasa de involución uterina. Del día 10 a 12 posparto, la superficie de la carúncula es desnudada de los tejidos necróticos y se inicia la regeneración del epitelio de las carúnculas; la cual es completada para el día 25 a 30 posparto. El promedio de intervalo parto a completar la involución del útero es cerca de 18 a 22 días en vacas primíparas y 25 a 35 días en vacas multíparas.
Manejo reproductivo posparto con PGF2a y GnRH
La secreción de la hormona luteinizante (LH) después de la administración de GnRH es restablecida en ganado lechero a los diez días posparto. Esto es consistente con la ocurrencia temprana de la actividad folicular posparto. La administración de GnRH por el día 14 posparto, a sido demostrada que induce la actividad cíclico y la ovulación.
La inducción de la ovulación fue asociada con un incremento en la tasa de involución uterina, seguida de la administración de GnRH.
El cuerpo lúteo (CL) formado después del tratamiento con GnRH de los 10 a 14 días posparto, puede responder a la PGF2a 10 días mas tarde, pero con una baja tasa luteolítica. Stevenson et al. (1986), encontraron una tasa luteolítica de 47 % después de la inyección de PGF2a , aplicada alrededor de los 24 días posparto en vacas tratadas con GnRH 10 días antes. Sin embargo, esta tasa no fue diferente a la obtenida en las vacas control que recibieron PGF2a alrededor del día 24 posparto, sin el tratamiento previo de GnRH. Esto sugiere que la respuesta luteolítica del Cuerpo lúteo a la inyección de prostaglandina, puede ser mas baja durante el periodo posparto (Risco, 2000).
Mecanismos que vinculan la partición de los nutrientes con la actividad ovárica
Muchos de los mecanismos que controlan la reproducción están directamente relacionados con la nutrición. Las hormonas y metabolitos desde el tracto gastrointestinal y los tejidos sensibles a los nutrientes afectan la secreción de GnRH y LH a través de su acción sobre el sistema nervioso central e hipotálamo. Las mismas hormonas y metabolitos pueden tener efectos directos sobre la función ovárica (folículos y cuerpo lúteo); así como sobre el ovocito, oviducto y útero. Los efectos combinados de cada eje determinan la fertilidad postparto en la vaca lechera.
El crecimiento folicular en el postparto está controlado por una combinación de LH y FSH. Los mecanismos esenciales que controlan el crecimiento de los folículos son similares en vacas cíclicas y en anestro. Como fuera descrito clásicamente, la FSH es responsable de iniciar el crecimiento y la LH es responsable de la maduración final del folículo dominante/preovulatorio. La secreción de LH y FSH es controlada primariamente (LH) o en parte (FSH) por la GnRH desde el hipotálamo. Los factores que controlan la liberación de GnRH son los principales componentes del modelo conceptual de secreción de LH (Wiltbank, 2003).
La duración del anestro postparto depende del estímulo de mamado, condición corporal y profundidad del balance energético negativo (BEN). Las vacas lecheras pueden no experimentar el estímulo del mamado pero sí un período de BEN en el postparto temprano. Los requerimientos energéticos para la producción de leche y mantenimiento exceden la energía consumida con el alimento. El BEN resultante está asociado con una disminución en la pulsatilidad de LH; lo cual es necesario en el periodo postparto para comenzarán a ciclar una vez que la pulsatilidad de LH alcance el nivel crítico. El incremento en la pulsatilidad de LH estimula la maduración de un folículo dominante, el cual es capaz de producir estradiol que alcanza un nivel umbral para desencadenar el pico de LH. Se produce una serie coordinada de eventos que actúan para promover el desarrollo folicular y eventualmente la ovulación (Lucy, 2003).
Las concentraciones de insulina e IGF-1 aumentan gradualmente durante el postparto. Las vacas en BEN tienen menor concentración de insulina e IGF1. La insulina e IGF-1 influencian la secreción de GnRH y LH. El control endocrino está influenciado por los tejidos que responden al estado metabólico o nutricional del animal (ej. insulina desde el páncreas e IGF-1 desde el hígado). Parece ser que esta influencia periférica podría actuar sobre el hipotálamo para transmitir información de tejidos metabólicamente importantes. Varios metabolitos (glucosa, ácidos grasos, etc.) y otras hormonas que actúan como mensajeros pueden también estar involucrados (Bo et al., 2001).
Los mismos metabolitos y hormonas que influencian la secreción de GnRH y secundariamente de LH y FSH pueden actuar directamente en el ovario influyendo sobre la sensibilidad a las gonadotrofinas. Las células ováricas tratadas con insulina o IGF-1 tienen un mayor número de receptores gonadotróficos y una mayor activación de la vía del segundo mensajero en respuesta a las gonadotrofinas. También existen efectos de la insulina y de IGF- 1 que son completamente independientes de la LH y FSH. Es imposible separar la importancia relativa de las gonadotrofinas, los factores de crecimiento producidos local y periféricamente a los metabolitos en el control de la reproducción de la vaca durante el postparto. Las vacas cuya nutrición está comprometida tienen una menor concentración de metabolitos y hormonas metabólicas en la sangre. La menor concentración de hormonas metabólicas teóricamente reduce la respuesta ovárica a las gonadotrofinas. Al mismo tiempo, las vacas postparto tienen baja concentración de LH, en parte debido a los efectos de las hormonas metabólicas sobre la secreción de GnRH desde el hipotálamo. Por lo tanto, los efectos de la subnutrición sobre la reproducción se manifiestan en el ovario y en el hipotálamo/hipófisis; afectando la función ovárica en principio (Lucy, 2003).
Ciclos Estrales Anormales y el Anestro Postparto
El reinicio de la ciclicidad no es necesariamente sinónimo de reinicio de la fertilidad normal. Existen "ciclos estrales cortos" de menor fertilidad cuya fisiología ha sido extensamente estudiada. Si bien los especialistas en fisiología reproductiva han descripto la ocurrencia de ciclos estrales de fertilidad normal luego de ciclos cortos, sabemos que el reinicio de la ciclicidad no es sinónimo de reinicio de los ciclos estrales regulares con fertilidad normal, al menos en vacas de alta producción. Los factores que controlan la ciclicidad regular con fertilidad normal representan el mayor desafío para los científicos que trabajan en el biotipo lechero moderno.
Varios estudios han identificado un aumento en la incidencia de ciclos estrales anormales o irregulares en vacas lecheras. Estas anormalidades pueden manifestarse a través de una variedad de patologías del ciclo estral, que incluyen desde la interrupción de las fases luteales hasta el alargamiento de las mismas. El Balance energético negativo, los desórdenes peripartales y las enfermedades puerperales son otros factores de riesgo conocidos para demorar la ciclicidad y prolongar las fases lúteales (Lucy, 1992; Butler y Smith, 1989).
La mayor incidencia de anestro, los ciclos estrales anormales y los mellizos comparten un mismo mecanismo que es mediado por la LH. El incremento del anestro es causado por una disminución en la pulsatilidad de LH que es secundaria al BEN en vacas lecheras con alta producción. Sin embargo, estas no son las únicas causas que determinan una prolongación del periodo postparto en el cual los ovarios no evidencian actividad folicular, ovulatoria y luteinizante. Las menores concentraciones de hormonas metabólicas (ej. insulina e IGF-1) pueden contribuir a disminuir la respuesta ovárica a la LH y crear una insensibilidad gonadotrófica en el ovario. Es posible que el estado comprometido en la secreción de LH y en la sensibilidad continúe en el animal cíclico y afecte aspectos funcionales del folículo dominante (Hafez, 1989).
Los mecanismos asociados con la pobre secreción de LH y el crecimiento folicular subóptimo durante el ciclo estral y anormalidades ováricas. Las bajas concentraciones de estradiol pueden ser generadas por una reducida secreción folicular (secundario a baja pulsatilidad de LH y/o baja concentración de factores de crecimiento) y por un aumento del metabolismo del estradiol durante la alta ingesta de nutrientes. Una variedad de ciclos estrales alterados y de anormalidades ováricas pueden estar relacionados con bajas concentraciones.
Las fases tempranas de la lúteolisis son iniciadas por el estradiol. Las fases luteales alargadas en vacas lecheras seleccionadas por alta producción, por lo tanto, pueden ser causadas por folículos dominantes que están comprometidos en su desarrollo y producen insuficiente cantidad de estradiol para iniciar la cascada luteolítica. La interrupción de los ciclos estrales podría ser causada por un mecanismo similar al mediado por el estradiol, en el cual los folículos dominantes no fueran capaces de producir suficiente estradiol para estimular el pico ovulatorio de LH.
Figura 1: Mecanismos asociados con la pobre secreción de LH y crecimiento folicular subóptimo durante el ciclo estral y anormalidades ovárica.
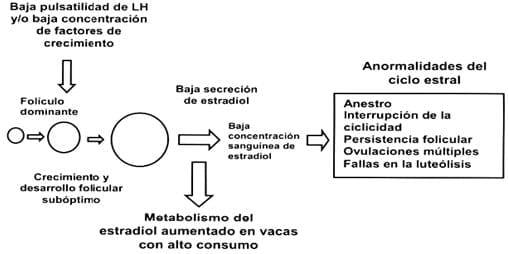
Fuente: Lucy (2003).
Actividad ovárica durante la gestación y el postparto temprano
Durante la gestación y después del parto las vacas tienen cambios fisiológicos desfavorecen el reinicio temprano de la actividad ovárica necesaria para manifestación de estro, la ovulación y la nueva concepción y deben restablecer equilibrio neuroendocrino antes de que esto suceda (Nett, 1987). Durante los primeros tres meses de la gestación bovina, los ovarios continúan desarrollando ondas foliculares sucesivas con atresia del folículo dominante. En la primera onda folicular formada después de la concepción se forma un folículo dominante de diámetro similar a un folículo ovulatorio, pero los folículos dominantes de ondas sucesivas disminuyen su diámetro, acercándose cada más al diámetro de los folículos subordinados (Henao y Trujillo, 2000; Ginther al., 1989).
Figura 2: Desarrollo folicular post concepción
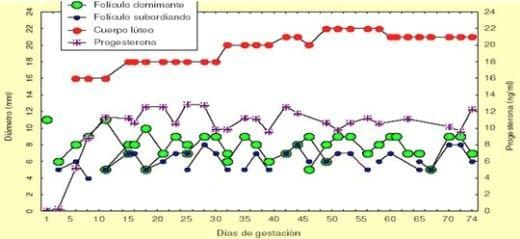
Fuente: Henao, 2001.
La dinámica folicular y lútea durante los primeros 74 días de la gestación de una vaca Cebú, construida mediante 33 ecografías transrectales y las evaluaciones hormonales seriadas efectuadas en el Centro Cotové, Universidad Nacional de Colombia, Sede Medellín. Se observa el folículo ovulatorio (cuyo oocito fue fecundado), la formación de nueve ondas foliculares secuenciales con establecimiento de dominancia y atresia del folículo dominante y la formación de un cuerpo lúteo que persiste y produce niveles normales de progesterona (Henao y Trujillo, 2000).
Representación esquemática de la dinámica folicular postparto de un bovino. Se representa la emergencia temprana de la primera onda folicular, conformada por una cohorte de ocho folículos antrales en los que se establece divergencia, dominancia y atresia, seguida por la emergencia de nuevas ondas con atresia del folículo dominante y primera ovulación a partir del folículo dominante de la cuarta onda postparto el día 45 (ver figura 3); descrito por Henao (2001).
Figura 3: Representación esquemática de la dinámica folicular posparto de un bovino
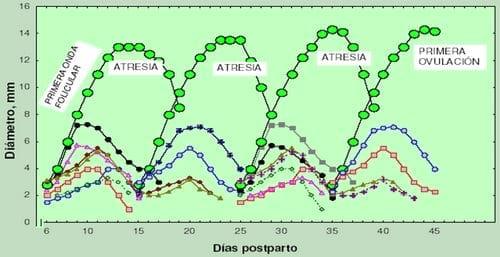
(Henao, 2001).
La condición corporal, el estado nutricional y la calidad del ovocito
Snijders y col. (2000) encontraron que los ovocitos fertilizados in vitro recuperados de vacas lecheras con baja condición corporal tenían una menor tasa de fertilización y una menor tasa de desarrollo comparadas con las de ovocitos procedentes de vacas lecheras en buena condición corporal. El período exacto de influencia nutricional sobre el ovocito no es conocido, pero muchos han especulado que ocurre en los dos meses que le lleva al folículo progresar desde primordial hasta preovulatorio.
La probabilidad de que una vaca lechera moderna tenga un ovocito de pobre calidad y una menor capacidad de fertilización in vivo ha sido estudiada recientemente, comparando los embriones procedentes de vacas lecheras en lactancia y secas. El porcentaje de embriones normales 4 a 5 días después del celo fue bajo (58 %) en vacas lecheras y menor a los valores históricamente reportados en la bibliografía. Las vacas lecheras no lactantes tuvieron un porcentaje de embriones normales comparable a los valores históricos en vacas lecheras normales (82 %).
El porcentaje de embriones en estadios tempranos en vacas lactantes se aproximó al esperado en "vacas repetidoras" de la década del '70 (vacas con cuatro o más inseminaciones que fallan en quedar preñadas). La pobre calidad del ovocito y el pobre desarrollo embrionario pueden ser un reflejo del estado comprometido del desarrollo folicular en la vaca en el postparto. El compromiso del desarrollo folicular puede estar asociado a factores que vinculan la nutrición con la reproducción (Lucy, 2003); en especial el balance negativo de energía (Butler y Smith, 1989) y positivo de proteína (Fergusson y Chalupa, 1989).
Tamaño del cuerpo lúteo, esteroidogenesis y función uterina según la nutrición
La subnutrición puede comprometer la preñez a través de sus efectos sobre el cuerpo lúteo. Hay una asociación positiva entre la concentración de progesterona en sangre y la preñez. Los animales que son subalimentados tienen un cuerpo lúteo más chico y presentan menores concentraciones de progesterona. El efecto de la nutrición sobre el tamaño del cuerpo lúteo parece ser consecuencia de efectos nutricionales sobre el folículo antes del servicio. Las vacas cíclicas que son subalimentadas tienen progresivamente folículos dominantes más chicos y menos estrogénicos antes de llegar al anestro. Los folículos dominantes más chicos producen cuerpos lúteos más chicos. La capacidad esteroidogénica de las células luteales también depende de hormonas tales como: la Hormona del crecimiento (GH), insulina y el factor de Crecimiento Epidérmico I (IGF- 1); que son controladas por la nutrición de la vaca.
Parecería que los embriones normales pueden fallar en su desarrollo dentro del útero de las vacas con baja a extrema condición corporal debido a que no sintetizan cantidades adecuadas de factores de crecimiento embriotróficos. Mapletoft y col. (2001) encontraron que las tasas de preñez logradas en embriones transferidos a las receptoras con baja condición corporal fueron menores al ser comparadas con las receptoras en buena condición corporal. Las pérdidas embrionarias luego del día 28 fueron mayores en vacas que perdían más peso por razones del desbalance energético frente a la mayor producción de leche.
El sistema IGF es regulado nutricionalmente y actúa claramente sobre el útero y el embrión. Las vacas tratadas con GH luego de la inseminación tuvieron mayores tasas de concepción por mecanismos embriotróficos relacionados con IGF-1. Por lo tanto, el IGF puede actuar sobre el embrión a través de la mayor actividad de las células endometriales uterinas al producir una mayor producción de embriótrofo; cuya secreción resulta crítica para la nutrición del embrión y para el mantenimiento de las condiciones bioquímicas ideales durante el periodo antes de la fijación a la pared uterina.
Efectos del balance energético negativo sobre la actividad folicular.
En varios estudios se ha reconocido la importancia del balance energético sobre la reanudación del ciclo ovárico postparto en vacas lecheras de alta producción Gwazdauskas et al., 2000; Staples et al., 1998; Butler and Smith 1989, 1997; Lucy et al., 1991; García-Bojalil, 1988) y en vacas de carne (Stagg et al., 1995). El balance energético se define como la diferencia entre el consumo de energía de un animal y la energía requerida para el mantenimiento y la secreción de leche. Las vacas lecheras desarrollan un balance energético negativo (BEN) en las primeras semanas de la lactación debido a que la máxima producción se alcanza antes de lograr la máxima capacidad de consumo.
El pico de producción se alcanza varias semanas antes que el pico de consumo y como resultado se produce un BEN que persiste durante 4 a 12 semanas (Senatore, 1996). Esta situación induce una respuesta compensatoria reconocida como homeorresis, la cual induce un incremento de la lipólisis, glucogénesis, gluconeogénesis y movilización ósea de minerales. Cerca de 50 días postparto las vacas adquieren la máxima capacidad de consumo de alimento, tienden a incrementar el consumo de energía y entran en un balance energético positivo (Lucy et al., 1991).
El tiempo transcurrido entre el parto y el restablecimiento del balance energético positivo se afecta por la cantidad de reservas de tejido graso y la eficiencia con la cual se movilizan; las vacas con mejor condición corporal reanudan más temprano el ciclo estral postparto (Gallo et al., 1996). El tiempo y la magnitud del balance energético pueden ser reguladores importantes de la reanudación del ciclo estral postparto. Butler and Smith (1989) encontraron una correlación positiva entre el número de días desde el parto a la primera ovulación y los días que se demoran las vacas para alcanzar el nadir del balance energético y mostraron que mientras más corto sea el nadir, más temprano ocurrirá la primera ovulación.
La transición entre el uso de reservas corporales y su depósito en el organismo animal se cree que es causada por cambios en la habilidad de los tejidos para responder a la insulina y a otras hormonas (Rose et al., 1996). Durante la lactación, la función mamaria tiene prioridad metabólica sobre la función ovárica, sin embargo, el comienzo de la actividad cíclica ovárica ocurre mientras las vacas están en BEN. Durante el período de déficit energético el eje hipotálamo-hipófisis-ovarios se recupera de la influencia de la gestación anterior y desarrolla cambios activos que conducen a la reanudación de los ciclos estrales (Nett, 1987). Los ovarios de las vacas inician la formación de ondas foliculares a partir de la primera o segunda semanas postparto; aún cuando el déficit energético no parecen presentar deficiencias de FSH (Henao et al 2001).
Durante las primeras semanas postparto la mayoría de las vacas incrementan paulatinamente la síntesis y liberación de LH en forma de pulsos. La habilidad de un animal para sostener una liberación de LH en forma de pulsos de alta frecuencia está relacionada con el estado metabólico (Schillo, 1992). En algunas vacas se produce la liberación de un pico preovulatorio de LH durante el primer mes y pueden manifestar estro; los intervalos prolongados entre el parto y la primera ovulación se han asociado con alta producción y con un BEN pronunciado (Senatore et la., 1996; Lucy et al., 1992). Un balance energético extremadamente negativo disminuye la frecuencia de liberación de pulsos de LH, disminuye el diámetro de los folículos dominantes y retarda la ovulación; lo cual está asociado directamente con el anestro postparto prolongado (Butler and Smith, 1989).
Factores determinantes del anestro postparto y su relación biológica y económica
La condición no ovulatoria prolongada en la vaca lechera puede ser determinada por múltiples factores que en principio son considerados de riesgo anestrico; dado que en la mayoría de los casos la inactividad ovárica incluyendo foliculogenesis, desarrollo del folículo de Graaf, ovulación y luteinogenesis conforman procesos cuyas deficiencias pueden reflejar limitaciones endocrinas, nutreceuticas, metabólicas, de salud y regresión por longevidad en los animales de edad avanzada. En consecuencia, el anestro postparto prolongado (superior a los 60 días) debe entenderse como la incapacidad del complejo glandular reproductivo para restablecer su modulación hormonal sobre la citología y bioquímica del ovario; el cual es identificado por la falta de un tamaño apropiado, del desarrollo del Folículo de Graaf, limitación esteroidogenica, fallas en la ovulación, alteración de la formación y funcionamiento del cuerpo lúteo. No obstante, la condición de anestro no debe ser considerada como una falla ovárica si existen fallas por enfermedades en el tracto genital, fallas en el manejo técnico como en la detección del celo oportuna y problemas de mortalidad embrionaria con bloqueo parcial o total sucesivo del hipotálamo y/o pituitaria.
El anestro prolongado es una condición de importancia biológica (producción de leche) y económica; por lo cual es preciso destacar que elementos internos y foráneos a la vaca pueden contribuir o definir la falta de la función oportuna en los ovarios. Es de importancia biológica y económica porque el anestro determina la mayor parte de los problemas de la infertilidad (Nebel, 1997; Fricke, 1999).
Medidas para mejorar el desempeño reproductivo postparto y la eficiencia
El enfoque de la reproducción y la eficiencia lechera requieren del establecimiento y uso de medidas de manejo tendientes a facilitar el normal funcionamiento metabólico y glandular; al mismo tiempo que se favorezca alcanzar y mantener el techo lactacional aun con un balance energético y proteico negativo hasta tanto se alcance el techo de consumo de materia seca.Varias son lasmedidas que favorecen un mejor desempeño reproductivo postparto y por ende reducen el periodo abierto, mejoran la función ovárica y luteal y reducen las pérdidas por fallas reproductivas en la vaca lechera.
Las medidas preventivas más sobresalientes para favorecer la reproducción postparto efectiva son:
1º. Utilice el programa de alimentación preparto para rehabilitar el ambiente bacteriano ruminal que demanda la dieta lactacional; garantizando la salud metabólica.
2º. Programe su alimentación para que la vaca llegue al parto con una condición corporal entre 3.5 y 3.75 preferiblemente.
3º. De seguimiento al parto y especialmente al puerperio para prevenir y tratar oportunamente aquellos procesos que pueden afectar el medio uterino.
4º. Utilice la evaluación reproductiva periódica en la secuencia parto, puerperio, actividad ovárica, tratamiento del anestro postparto, programación folicular y ovulatoria, detección de celo natural, programación de la inseminación artificial a tiempo fijo, inseminación, diagnóstico de la preñez y examen exhaustivo de las muertes embrionarias y fetales.
5º. Mantenga un plan de nutrición ajustada por mantenimiento y producción con énfasis en energía, proteína, minerales y vitaminas; evitando que uno o más nutrientes presenten deficiencias simultáneas (ejemplo: estado energético negativo con subnutrición mineral por fósforo).
6º. Evite la sobre condición corporal de las vacas al parto, durante la fase critica lactacional y en el periodo seco para prevenir los desordenes metabólicos que limitan la actividad glandular y las fallas orgánicas y sistémicas reproductivas.
7º. Utilice los métodos de diagnostico de la preñez como la ultrasonografía y el seguimiento por progesterona que permiten confirmar el estado gestacional temprano para ganar tiempo en lo posible e implementar correctivos en el manejo reproductivo.
8º. Considere los factores limitantes en las vacas cuyos ovarios no evidencian actividad cíclica normal entre los 40 y 75 días postparto para hacer los ajustes nutricionales y hormonales que contribuyan con la reactivación ovárica efectiva.
9º. Utilice los registros biológicos efectivos en forma eficiente para mantener el seguimiento reproductivo de la vaca en la fase crítica de la lactación.
10º. Mantenga un programa de salud reproductivo preventivo y curativo eficiente; que reduzca la influencia negativa sobre las funciones reproductivas.
11º. Utilice la estrategia para prevenir y/o reducir el estrés calórico en la vaca lechera; en especial, en las vacas abiertas, recién servidas y con alto potencial lechero.
El perfil reproductivo y lactacional están relacionados con la eficiencia de la vaca lechera; tomando en cuenta la gestación, periodo abierto obligatorio y electivo para el servicio, duración lactational, extensión del descanso preparto y el intervalo entre partos (Nebel, 1997; Araúz, 2009). El desempeño reproductivo postparto en la vaca lechera es influenciado por factores genéticos, nutricionales, metabólicos, hormonales, micro ambientales, lactacionales y la salud. En consecuencia, el aumento del potencial lechero y la intensificación del estrés inherente del manejo en el periodo crítico de los primeros 100 días postparto conforman un reto científico y técnico para evitar un bajo desempeño reproductivo y las grandes pérdidas económicas en la ganadería de leche.
BIBLIOGRAFÍA
Araúz, E. E. 2006. Impacto del estrés calórico sobre la producción de leche y el desempeño reproductivo de la vaca lechera en lactación en el trópico y sus implicaciones productivas en Panamá.
Araúz, E. E. 2009. Principales registros biológicos para evaluar la capacidad funcional de la vaca lechera y su importancia para mejorar el manejo y la eficiencia en la producción. Publicación en Internet, Engormix.com, Sección: Ganadería de Leche.
Butler, W. R.; Smith, R.D. 1989. Interrelationship between energy balance and postpartum reproductive function in dairy cattle. Journal of Dairy Science. 72: 767-783
Baruselli P. S. Madureira E.H., Marques M. O., 2001. Programa de inseminación artificial a tiempo fijo en bovinos indicus. IV Simposio internacional de reproducción animal. Córdoba. Argentina.
Bó G., Cutaia L., Brogliatti G. M., Median M., Tribulo H. 2001. Programas de inseminación artificial a tiempo fijo en ganado bovino utilizando progestágenos y estradiol. IV Simposio internacional de reproducción animal. Córdoba. Argentina.
Fricke, P. M. 1999. Reproductive Management of Dairy heifers and Cows. Department of Dairy Sciences, University of Wisconsin, USA.
Gallo, L.P.; Carnier, M.; Cassandro, M.; Manitovani, R.; Bailoni, L.; Contiero, B. and Bittante, G.1996 Changes in body condition score of Holstein cows as affected by parity and mature equivalent milk yield. Journal of Dairy Science Vol. 79; p. 1009-1015.
García-Bojalil, C.M.; Staples, C.R., Risco, C.A.; Savio, J.D. and Thatcher, W.W. 1998 Protein degradability and calcium salts of long-chain fatty acids in the diets of lacting dairy cows: Reproductive responses. Journal of Dairy Science Vol. 81; p. 1385-1395.
García-Bojalil, C.M.; Staples, C.R., Risco, C.A.; Savio, J.D. and Thatcher, W.W. 1998 Protein degradability and calcium salts of long-chain fatty acids in the diets of lacting dairy cows: Reproductive responses. Journal of Dairy Science Vol. 81; p. 1385-1395.
Ginther, O.J.; Knopf, L.; and Kastelic, P. 1989. Ovarian follicular dynamics in heifers during early pregnancy. Biology of Reproduction. 41: 247.
Greenwald, G.S. and Roy, S. 1994. Follicular development and its control. The Physiology of Reproduction. Edited by E. Knobil and J.D. Neil. Raven Press.New York; p 629-723.
Gwazdauskas, F.C.; Kendrick, K.W.; Prior, A.W. and Bailey, T.L. 2000. Symposium. Folliculogenesis in the bovine ovary. Impact of follicular aspiration on folliculogenesis as influenced by dietary and stage of lactation. Journal of Dairy Science Vol. 83; p. 1625-1634.
Hafez E. S. E.; 1989. Reproducción e inseminación artificial en animales. 5ta edición. INTERAMERICAN. McGRAW- HILL. México. 694 p
Hansen, P.J.; Arechiga, C.F. 1999. Strategies for managing reproduction in the heat- stressed dairy cow. Journal of Animal Science. 77: 36-50.
Henao, G. 2001. Reactivación ovárica posparto en bovinos. Revisión. Revista de la Facultad de Agronomía de la Universidad de Medellin.
Jordan, E. R. 2003. Effects of heat stress on Reproduction. J. Dairy Science 86:E104-E114.
Lucy, M. C. 2003. Mechanisms linking nutrition and reproduction in post partum dairy cows. Reproductive Supplement 61:415-427.
Lucy, M.C.; Savio, J.D.; Badinga, L.; De La Sota, R. L. and Thatcher, W. W. 1992. Factors that affect ovarian follicular dynamics in cattle. Journal of Animal Science. 70: 3615-3626.
Mapletoft R.J., Bó G.A., Martínez M., Colazo, Caccia M. y Adams G.P. 1999 Control del desarrollo folicular y su uso en programas de inseminación artificial a tiempo fijo en ganado de carne. . III Simposio internacional de reproducción animal. Córdoba. Argentina.
Mapletoft, R., Colazo, M., Martínez, M., Kastekic J. 2003. Esteres de estrógenos para la sincronización de la emergencia de la onda folicular y la ovulación en animales tratados con dispositivo de progesterona. V Simposio internacional de reproducción animal. Córdoba. Argentina.
Mapletoft, R., Kastelic, J., 2001. Inseminación artificial a tiempo fijo en ganado Bos taurus. IV Simposio internacional de reproducción animal. Córdoba. Argentina.
McGowan M.R.; 1999. Sincronización de celo y programas de inseminación artificial a tiempo fijo en ganado Bos indicus y cruza Bos indicus. III Simposio internacional de reproducción animal. Córdoba Argentina.
Nebel, R., 1998. Your Herd's Reproductive Status. Virginia Cooperative Extension, Virginia State University, Publication Number 404-005, USA.
Nett, T.M. 1987. Function of the hypothalamic-hypophysial axis during the postpartum period in ewes and cows. Journal of Reproduction and Fertility. Vol. 34, suppl. p. 201-213.
Risco, C.A. 2000. Management of the postpartum dairy cow to maximize pregnancy rate. Buiatrics Congress. Punta del Este. Uruguay.
Rose, M.T.; Obara, Y.; Fuse, H.; Itoh, F.; Ozawa, A.; Takahashi, Y.; Hodate. K.; and Ohashi, R. 1996. Effect of growth hormone-releasing factor on response to insulin of cows during the early and late lactation. Journal of Dairy Science Vol. 79 p. 1734-1745.
Schillo, K.K. 1992. Effect of dietary energy on control of luteinizing hormone secretion in cattle and sheep. Journal of Animal Science. Vol. 70, p. 1271-1282.
Senatore, E.M; Butler, W.R. and Oltenacu, P.A. 1996. Relationship between energy balance and post-partum ovarian activity and fertility in first lactation dairy cows. Animal Science Vol. 62; p. 17-23.
Snijders, S.E., Dillon, P, O'Callaghan, D., Boland, M.P. 2000. Effect of genetic merit, milk yield, body condition and lactation number on in vitro oocyte development in dairy cows. Theriogenology 53:981-989.
Stagg, K.; Diskin, M.G.; Sreenan, J.M. and Roche, J.F. 1995. Follicular development in long-term anestrous suckled beef cows fed two levels of energy postpartum. Animal Reproduction Science Vol. 38; p. 49-61
Staples, G.R.; Burke, J.M. and Thatcher, W.W. 1998. Influence of supplemental fats on reproductive tissue and performance of lacting cows. Journal of Animal Science, Vol. 81; p. 856-871.
Thatcher, W.W.; de la Sota, R.L.; Schmitt E.J.-P.; Diaz, T.C.; Badinga, L.; Simmen, F.A.; Staples, C.R. and Drost. M. 1996. Control and management of ovarian follicles in cattle to optimize fertility. Reproduction Fertility and Development. Vol. 8; p. 203-217.
Webb, R.; Gosden, R.G.; Telfer, E.E. and Moor, R.M. 1999. Factors affecting folliculogenesis in ruminants. Journal of Animal Science. 68: 257-284.
Wiltbank, M., 2003. Nuevos conceptos sobre los efectos de la nutrición en la reproducción. V Simposio internacional de reproducción animal. Córdoba. Argentina.
Temas relacionados:
Autores:
Universidad de Panamá
Universidad de Panamá
Recomendar
Comentar
Compartir
Universidad de Panamá
4 de abril de 2010
El desempeño hormonal después del parto de la vaca de leche en el trópico esta influenciada por numerosos factores de los cuales los mas importantes son la nutrición (balance energético negativo) y el ambiente (temperatura ambiental y humedad relativa). Es una realidad que la producción de leche afecta negativamente la fertilidad principalmente prolongando el anestro pos parto y aumentando los días abiertos, la selección de animales mas productivos nos lleva a obtener animales que son mas difíciles de preñar, recordemos que para obtener intervalos entre partos apropiados de 13 meses debemos de tener un periodo abierto de 85 a 110 días, sin embargo, este periodo coincide con el pico de producción de leche de la vaca, en este momento la demanda de nutrientes de la vaca esta al máximo por lo que ella no puede cubrir esta demanda consumiendo solo alimento por lo que hace uso de sus reservas corporales. Esta situación lleva a la vaca a dejar la reproducción en segundo plano por lo que no hay ovulaciones efectivas o hay celos silenciosos por una falla hormonal principalmente de GnRH por el hipotálamo, esta situación mejora cuando la producción de leche disminuye y el balance energético negativo pasa a positivo. Algunas medidas simples para el ganadero incluyen:
1. Proporcionar dietas de transición por lo menos 15 días antes del parto para maximizar el consumo de materia seca al pico de producción, ademas, la alimentación debe suplir la minerales importantes como el P, Zn, I, Se, Ca, Mn, Cu y otros, asi como también vitaminas, proteínas y energía. 2. monitorear condición corporal al parto. 3. utilizar aditivos a la dieta como grasa sobre-pasante, levaduras. 4. monitoreo pos parto de enfermedades metabólicas hipocalcemia, cetosis, etc. 5. minimizar el estrés calórico. 6. el uso de hormonas o protocolos de sincronización deben ser considerados luego de corregir los problemas nutricionales y alimentarios. 7. correcta y oportuna identificación de celo (manejo).
Este articulo fue una revisión del anestro posparto y como se puede mejorar esta situación para maximizar las ganancias en una lechería.
Muchas Gracias
Juan Ramón Batista
Recomendar
Responder
Universidad Federal Ensino Octávio Bastos - UNIFEOB
24 de abril de 2010
Mudando un poco el enfoque dado en la otra particpación, me gustaria que me permitan comentar algunos puntos de vista sobre el tema de Anestro P. e Modulación de la función averían. El anestro p., principalmente el bovinos lecheros, es sin duda el mayor problema, que afecta la ofensión reproductiva en estos animales. Es de etiología multifactorial(síndrome) y que aumenta su incidencia, conforme se aumentan los nivele de producción por animal. Como la reproducción no se restringe al eje Hipotálamo- Hipófisis y Gónadas y su interacción con el medico ambiente. resulta difícil, principalmente
el diagnóstico de su causa. Normalmente, es el reflejo de una serie de factores, dentro de los cuales estan los metabólicos,endocrino y ambientales en sus diferentes grados de interacciones. Por la literatura existente,podemos decir que los problemas se inician, por lo menos 30 dias antes del parto, cuando se inicia, teóricamente, el período de transición. Los resultados de investigaciones han observado disminución del consumo de materia seca, de hasta 30[percent]. En este período, se comienzan a configurar una serie de mudanzas endocrina, que objetiva la preparación para el parto, principalmente una caída de lo niveles circulantes de progesterona y una subida de los estrógenos, junto con el cortisol. Podemos,asi, pensar que el parto es un proceso de estrés. Algunos autores, atribuyen a estas mudanzas, parte de la pérdida de la capacidad de consumo(apetito), sumado a una disminución de la capacidad física de los compartimientos gástricos, desencadenados por el crecimiento absoluto de el feto.
Si este animal,viene de una deficiencia de consumo, naturalmente, tiene deficiencias en todos los nutrientes, que deferíamos ser aportados por la materia seca, no consumida. Entonces, seria lógico pensar, que si no continúa a comer lo necesario, como de hecho ocurre, este problema se acentuará, y es lo que ocurre.
Como son seleccionados para producir leche, su metabolismo se duración para esta función. la energía líquida de lactación, oriunda del alimento no suple, y entonces el metabolismo usa sus reservas de gordura como suplemento. Como eso,la vaca producirá gran parte de la leche, en esta fase, a costas de esta gordura. Esta gordura, llamada ahora de gordura metabólica, deberá ser oxidada por el hígado. Este órgano, tiene una capacidad pre-establecida, para oxidar esta gordura. Cuando
llega su límite, esta gordura se acumula, formado el hígado graso(esteatose hepática pos-parto). El hígado también lo podemos considerar un órgano secundario de la reproducción. En primer lugar porque es él que metaboliza los esteroides sexuales y en segundo lugar porque es él que transforma el ácido propiónico en glucosa. Este azúcar es de suma importancia indirecta,para que los hormonas proteicos,( LH,FSH,GnRH etc.) funcionen. La forma mas clásica es que la glucosa 6 fosfato inicia el ciclo de krebs, y este tiene, entre otras funciones,la incumbencia de producir ATP, que es el primer mensajero para la función estimulante del crecimiento folicular.
A glucogénesis en el pos-parto, atiende primero a la producción de leche. La cetosis, común en ganado de leche de alta producción, explica en parte este fenómeno. El GH, en altos niveles,también ayuda a direccionar mayor producción de leche por varios mecanismos. El hígado no produce IGF1 y otros estimulantes de crecimiento folicular. Las infecciones puerperales,afecciones podales, comunes en vacas lecheras, acentúan mas la disminución de consumo de alimentos, lo que acentúa el BEN. Sumados a los hormonas metabólicos Insulina, Glucólisis, Leptina y otros,y sus efectos
negativos, nos da una noción de lo complejo que es el p. en ganado lechero y que se refleja como ANESTRO. Gracias.
Recomendar
Responder
24 de abril de 2010
felicidades ingenieros arauz y batista, es muy acertado su articulo, ya que es la principal problemática que nos encontramos profesionales y productores en el desarrollo de la lechería en el trópico.
Recomendar
Responder
Universidad Federal Ensino Octávio Bastos - UNIFEOB
24 de abril de 2010
Mis felicitaciones a los autores por este artículo. Sobre algunas observaciones de los foristas Ing. Rafael C. Gutierrez y de Sr Ruben Rodríguez, Venezuela, le puedo decir. Es normal que para quien no tenga la reproducción bovina como su rutina de trabajo, algunos términos, le sean novedad. Como tambien, el artículo,creo, no tiene la intención de informar cuestiones prácticas. Con relaci[on a lo que pide e Ing. Gutierrez, me parece que pudo ayudara. Como manejo, entendemos, una serie de actividades, de rutina, con el objetivo de alcanzar lass metas trazadas.La primera es la de obetener buena eficiencia reproductiva.Lo que en letra menuda es hacer que las vacas, en sua mayoria, param con intervalos de 12 meses ó próximo a esto. Buscamos un mayor número de animales en lactac ión, que en ganado especializado deve estar cerca de 83-84 [percent], el resto secas y preñadas. No es una tarea fácil, pero existen herramientas, capazes de ayudarnos. La primera que considero, son buenas anotaciones, que pueden ser simples pero bien hechas. Fecha de nacimiento, peso y edad a la primera iseminación, monta naural, repeticiones de celo y parto previsto. En secuencia, manejo alimentar y sanitário pré y pós parto. Al parto,fecha, tipo de parto(normal - distocico), liberación de la placenta(horas)y tambien cualquier evento que considere de importancia para un eventual diagnóstico, etc.. Si hay datos,podemos analisar, caso contrário, lo veo muy difícil. Estas anotaciones, serán utilizadas por el profesional, para diagnóstico de gestación, tratamientos y lo mejor y mas importante, es sua análise y tomada de decisión. Porque cuando gerenciamos datos em busca de metas, ellos son, de hecho la prueba de, si estamos bien o no. A seguir, de comun acuerdo, técnico y propietário, mudan su estratégia o continúam con ella. Acostumbro decir que, para quien no sabe para donde vá, cualquier camino le sirve. Muchas gracias por la oportunidad y mis disculpas, si no fui ,lo suficentemente claro. A sus órdenes, Elias Tuñón Villarreta.
Recomendar
Responder
19 de abril de 2010
muy bueno su articulo ingeniero pero estoy de acuredo con el amigo del estado miranda - venezuela que deveria utilizar palabras que no sean tan tecnicas, mas entendibles para nosotros los productores.Grasias.
Recomendar
Responder
7 de abril de 2010
exelente un verdadero trajajo cientifico, de alta relevancia,las cual nos honrra,a todo panamà y nivel latinoamericano, de nuestra Universidad Nacional, Facultad de Ciencias Agropecurias,una gran avanzada en nuetra reproducciòn animal.la cual ayudara, mucho a todos los productores en especial a nuestra ganaderia,en hora buena felicitaciones,exhortando a continuar en estos valiosisimos aporte y en especial a todos los productores a que contribuyamos con nuestros esfuerzos a la produccòn de alimentos sanos en esta crisis alimentaria a nivel mundial.
Recomendar
Responder
5 de abril de 2010
Mis felicitaciones a los autores de este artículo.Aunque muy técnico en la mayoria de su desarrollo, sí muy bien finalizado con recomendaciones tan buenas y prácticas. Como aporte por experiencia personal, deseo comentar la implementación de una rutina en la visita mensual del veterinario a cada lechería: estimar la condición corporal de las vacas y novillas. Esto ha permitido detectar problemas nutricionales en algunos grupos, a tiempo, pero especialmente en vacas de 6 meses de preñes, que al mostrar baja condición corporal en este momento, me permite decidir estrategias para superar esta condición antes del secado y durante este.Los resultados han sido muy satisfactorios.
Recomendar
Responder
3 de abril de 2010
Cordial saludo:
Muy interesante y bien fundamentado el articulo, teniendo en cuenta la incompatibilidad que se presenta en el trópico cuando manejamos bovinos tipo leche descendientes cercanos genéticamente de Bos tauros que por su grado de adaptabilidad genera una serie de trastornos endocrinos con grandes desequilibrios que se reflejan de manera negativa en la capacidad Productiva y Reproductiva de las hembras especialmente.
De manera muy didáctica para Los Profesionales de la Medicina Veterinaria se comprende claramente el efecto negativo de dichos cambios hormonales.
Felicitaciones al autor por tan valioso artículo.
Recomendar
Responder
1 de abril de 2010
Increible artículo,es una gran información para tomar en cuenta y con ello mejorar el manejo,sobre todo en el trópico
Recomendar
Responder

31 de marzo de 2010
Un cordial saludo y felicitaciones al colega Ramón Batista y al Profesor Edil Araúz por este artículo técnico que detalla muy bien lo que sucede cuando no manejamos de una forma correcta el periodo de transición y luego la etapa de lactancia normal.
Estos problemas los tenemos a diario en muchas de las fincas de la cuenca, por lo que necesitamos hacer una labor de educación constante al productor para que entienda que la base de la reproducción de las vacas es el buen manejo de la alimentación y de la nutrición.
saludos..
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.












