Criopreservación de semen tomado del epidídimo
Publicado: 31 de diciembre de 2007
Por: Juan Carlos Franco Ayala - Médico Veterinario y Zootecnista de la Universidad del Tolima, Colombia. Diplomado en Biotecnología Reproductiva y Transferencia de Embriones Bovinos; Universidad del Tolima-CGR Biotecnología, Ibagué, Tolima-Colombia.
Desde hace algo más de 20 años, se han buscando medios que permitan mantener la diversidad biológica y que impidan la perdida de especies de alto valor comercial o genético; el concepto -"Banco de genes"-, ha adquirido gran aceptación actualmente (Leibo et al., 2002; fuente Internet). Recuperar y criopreservar espermatozoides tomados de epidídimo se constituye en una manera útil de rescatar el germoplasma de especímenes que estén en peligro de extinguirse, o que hayan muerto por causas naturales o accidentes (Brooke, 2000; fuente Internet). Esta técnica es particularmente útil en casos donde la colecta de semen es difícil, como sucede en los animales salvajes, campo en el cual tiene mayor aplicación (Anel et al., 2002).
Muchos trabajos han sido desarrollados para crear técnicas de criopreservación de esperma extraído a partir del epidídimo, aunque se ha limitado su uso en algunas especies. En los bovinos esta práctica fue reportada inicialmente por Wattson (1978); en el gato el primer informe fue dado por Grodrowe y Hay, 1993 y en el cerdo Nagai et al., 1988; en otras especies se ha adelantado con gran velocidad aunque el informe de trabajos está orientado primordialmente a la preservación de especies silvestres en vía de extinción (Hewitt et al., 2001). En el humano hay muchos estudios en los que se ha logrado la fertilización de oocitos e incluso la preñez usando gametos recuperados del epidídimo luego de la muerte del hombre (Yu et al., 2002).
CRIOPRESERVACIÓN DE ESPERMATOZOIDES EPIDIDIMARIOS EN BOVINOS
La congelación de espermatozoides bovinos para su uso en inseminación artificial es una tecnología que ha logrado grandes progresos en el campo de la reproducción y en el mejoramiento genético poblacional.
La recolección de semen de toros por métodos convencionales, como la vagina artificial y el electro-eyaculador, ha permitido el establecimiento de bancos de germoplasma provenientes de machos reproductores seleccionados (Barrios, 2002).
Por otro lado, es importante establecer un método que permita recolectar espermatozoides de toros élites que hayan muerto repentinamente, de manera tal que pueda obtenerse descendencia de esos toros, mediante la inseminación artificial o la fertilización in vitro (Barrios, 2002). Así que podría implementarse la recolección de espermatozoides de la cola del epidídimo para propagar la calidad genética de toros post-mortem, puesto que los espermatozoides que se encuentran allí, según se ha reportado (Chung, 1997; Reyes Moreno et al., 2000; Reyes Moreno et al., 2002; citado por Barrios, 2002), tienen capacidad fertilizante.
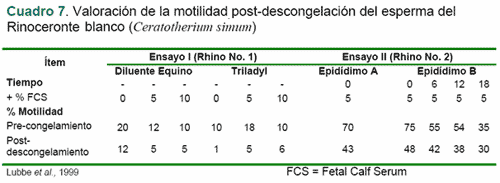
Hasta el presente no se ha reportado en la literatura científica el nacimiento de becerros originados de espermatozoides frescos o congelados, recolectados de la cola del epidídimo de toros; aunque ha habido algunos avances con espermatozoides bovinos epididimarios usados en fresco para fertilización in vitro (De Pauw et al., 2003; Chung, 1997; citado por Barrios, 2002), y en la congelación de la cola del epidídimo en ratas (Nakatsukasa et al., 2001), primates [Macaca fascicularis](Ng, Soon Chye et al., 2002), gacelas [Gacella dorcas neglecta](Pérez-Garnelo et al., 2002), ciervos [Cervus nipón y C. elaphus hispanicus](Hishinuma et al., 2003; Anel et al., 2002), rumiantes salvajes (Kilian et al., 2000; Gerber et al., 2002), ungulados salvajes (Pérez de la Fuente, INIA, Madrid; citado por Barrios, 2002), rinocerontes [Ceratotherium simum](Lubbe et al., 1999), cerdos (Kikuchi et al., 1998), caninos (Hewitt et al., 2001) y felinos (Axnér, et al., 1999; Luvoni et al., 2002).
EL TESTICULO
Anatomía del Testículo
Muchos trabajos han sido desarrollados para crear técnicas de criopreservación de esperma extraído a partir del epidídimo, aunque se ha limitado su uso en algunas especies. En los bovinos esta práctica fue reportada inicialmente por Wattson (1978); en el gato el primer informe fue dado por Grodrowe y Hay, 1993 y en el cerdo Nagai et al., 1988; en otras especies se ha adelantado con gran velocidad aunque el informe de trabajos está orientado primordialmente a la preservación de especies silvestres en vía de extinción (Hewitt et al., 2001). En el humano hay muchos estudios en los que se ha logrado la fertilización de oocitos e incluso la preñez usando gametos recuperados del epidídimo luego de la muerte del hombre (Yu et al., 2002).
CRIOPRESERVACIÓN DE ESPERMATOZOIDES EPIDIDIMARIOS EN BOVINOS
La congelación de espermatozoides bovinos para su uso en inseminación artificial es una tecnología que ha logrado grandes progresos en el campo de la reproducción y en el mejoramiento genético poblacional.
La recolección de semen de toros por métodos convencionales, como la vagina artificial y el electro-eyaculador, ha permitido el establecimiento de bancos de germoplasma provenientes de machos reproductores seleccionados (Barrios, 2002).
Por otro lado, es importante establecer un método que permita recolectar espermatozoides de toros élites que hayan muerto repentinamente, de manera tal que pueda obtenerse descendencia de esos toros, mediante la inseminación artificial o la fertilización in vitro (Barrios, 2002). Así que podría implementarse la recolección de espermatozoides de la cola del epidídimo para propagar la calidad genética de toros post-mortem, puesto que los espermatozoides que se encuentran allí, según se ha reportado (Chung, 1997; Reyes Moreno et al., 2000; Reyes Moreno et al., 2002; citado por Barrios, 2002), tienen capacidad fertilizante.
Hasta el presente no se ha reportado en la literatura científica el nacimiento de becerros originados de espermatozoides frescos o congelados, recolectados de la cola del epidídimo de toros; aunque ha habido algunos avances con espermatozoides bovinos epididimarios usados en fresco para fertilización in vitro (De Pauw et al., 2003; Chung, 1997; citado por Barrios, 2002), y en la congelación de la cola del epidídimo en ratas (Nakatsukasa et al., 2001), primates [Macaca fascicularis](Ng, Soon Chye et al., 2002), gacelas [Gacella dorcas neglecta](Pérez-Garnelo et al., 2002), ciervos [Cervus nipón y C. elaphus hispanicus](Hishinuma et al., 2003; Anel et al., 2002), rumiantes salvajes (Kilian et al., 2000; Gerber et al., 2002), ungulados salvajes (Pérez de la Fuente, INIA, Madrid; citado por Barrios, 2002), rinocerontes [Ceratotherium simum](Lubbe et al., 1999), cerdos (Kikuchi et al., 1998), caninos (Hewitt et al., 2001) y felinos (Axnér, et al., 1999; Luvoni et al., 2002).
EL TESTICULO
Anatomía del Testículo
Los testículos son las gónadas masculinas y están contenidas en una bolsa de piel denominada escroto (Sisson, 1993) que los protege y soporta. La función principal del escroto es regular la temperatura interna de las gónadas mediante la contracción involuntaria del músculo dartos, que recubre el escroto interna y basalmente (Salisbury et al., 1978; citado por Barrios, 2002).
Los testículos están recubiertos por dos capas serosas de la túnica vaginalis, y una capa de tejido conectivo denso e irregular, que constituye la túnica albugínea (Wrobel y Dellmann, 1993). De la túnica albugínea emergen trabéculas de tejido conectivo que convergen en el mediastino ubicado en el parénquima testicular, y dividen al testículo en un número variable de lobulillos testiculares que contienen de 1 a 4 túbulos seminíferos contorneados. Los túbulos seminíferos se unen a la salida de cada lobulillo, y forman los túbulos rectos agrupados en el mediastino, que a su vez conforman la rete testis(Sisson, 1993). De la rete testis sale una docena de túbulos llamados vasos eferentes que convergen en la porción dorsal del mediastino para luego llegar a la cabeza del epidídimo (Salisbury et al., 1978, citado por Barrios, 2002).
EL EPIDÍDIMO
Anatomía del epidídimo
Los testículos están recubiertos por dos capas serosas de la túnica vaginalis, y una capa de tejido conectivo denso e irregular, que constituye la túnica albugínea (Wrobel y Dellmann, 1993). De la túnica albugínea emergen trabéculas de tejido conectivo que convergen en el mediastino ubicado en el parénquima testicular, y dividen al testículo en un número variable de lobulillos testiculares que contienen de 1 a 4 túbulos seminíferos contorneados. Los túbulos seminíferos se unen a la salida de cada lobulillo, y forman los túbulos rectos agrupados en el mediastino, que a su vez conforman la rete testis(Sisson, 1993). De la rete testis sale una docena de túbulos llamados vasos eferentes que convergen en la porción dorsal del mediastino para luego llegar a la cabeza del epidídimo (Salisbury et al., 1978, citado por Barrios, 2002).
EL EPIDÍDIMO
Anatomía del epidídimo
El epidídimo es un túbulo alongado y tortuoso empaquetado en un saco de tejido conectivo que es una extensión de la túnica albugínea; mide alrededor de 30 a 35 metros de largo en el toro (Salisbury et al., 1978; citado por Barrios, 2002).
Anatómicamente el epidídimo consta de tres partes bien definidas: cabeza, cuerpo y cola (Sisson, 1993, Chenoweth, 1997; citado por Barrios, 2002). La cabeza es la parte más grande, recorre el polo dorsal del testículo y desciende en forma de asa unos 2.5 a 3 cm de la superficie dorso lateral del testículo. El cuerpo del epidídimo se extiende hacia el polo distal del testículo como una banda de 1 cm de ancho y se une firmemente a la cara caudo-medial del testículo. La cola del epidídimo tiene forma cónica y se une estrechamente por su base mayor al polo distal del testículo (Zemjanis, 1994; citado por Barrios, 2002).
Las convoluciones del epidídimo van disminuyendo en amplitud progresivamente desde la cabeza al cuerpo, en el cual se aprecia una constricción delgada de la túnica albugínea; pero al nivel de la cola aumentan el diámetro del túbulo y el tamaño de las convoluciones (Salisbury et al., 1978, citado por Barrios, 2002).
Funciones del Epidídimo
Las funciones del epidídimo son el transporte y la maduración de los espermatozoides (Chenoweth, 1997; citado por Barrios, 2002), los cuales, a través del pasaje por los conductos eferentes y el epidídimo, adquieren la habilidad de tener movimiento progresivo lineal y la capacidad de fertilizar (Johnson y Everitt, 1980; citado por Barrios, 2002). Durante ese proceso, en la célula espermática ocurren cambios funcionales, bioquímicos y morfológicos (Johnson y Everitt, 1980; Chenoweth, 1997; citados por Barrios, 2002; Amann y Schanbacher, 1983). También ocurre la reabsorción e intercambio de fluidos (Salisbury et al., 1978; citado por Barrios, 2002). Específicamente, en la cabeza del epidídimo ocurre la reabsorción de solutos y fluidos, en el cuerpo del epidídimo la maduración espermática, y en la cola del epidídimo el almacenamiento de los espermatozoides fértiles (Amann y Schanbacher, 1983). Con esta consideración, es importante señalar que se podrían obtener espermatozoides viables provenientes de la cola del epidídimo que tengan motilidad y capacidad de fertilizar, poco tiempo después de la muerte del animal, que podrían ser congelados para su posterior uso en inseminación artificial (Barrios, 2002).
En su origen, los espermatozoides son incapaces de moverse, de allí que el transporte inicial a la retetestis es dependiente del fluido secretado por las células de Sertoli. En los conductos eferentes, cabeza y cuerpo del epidídimo el transporte es mediado por el epitelio del epidídimo, especialmente las células ciliadas y las principales, y contracciones peristálticas de la musculatura lisa de los conductos eferentes y la cabeza y cuerpo del epidídimo, mas la presión hidrostática interna (Johnson y Everitt, 1980; Chenoweth, 1997; citados por Barrios, 2002; Amann y Schanbacher, 1983).
Un solo epidídimo tiene capacidad para almacenar 4 ml de fluido rico en espermatozoides, con una concentración de 3.55 x 109 espermatozoides/ml, que ocupa la mitad de su volumen total (Salisbury et al., 1978, citado por Barrios, 2002). Se han reportado resultados variables en las concentraciones espermáticas de los dos epidídimos de toros adultos (Cuadro 1). Allí hay una concentración de 15 a 40 x 109 espermatozoides/ml, suficientes para proveer 20 eyaculados normales consecutivos en un periodo de 3 a 4 horas (Salisbury et al., 1978; citado por Barrios, 2002).
El ambiente al que se enfrentan las células espermáticas cuando llegan al epidídimo es diferente al de los túbulos seminíferos y los conductos eferentes. Tal diferencia se debe a los cambios en la composición del fluido drenado por la rete testis, debido a que la presencia de la barrera hemotesticular es incompleta en esta región (Johnson y Everitt, 1980; citado por Barrios, 2002). Además, en todo el trayecto del epidídimo hay células secretoras cuyas secreciones afectan a los espermatozoides (Amann y Schanbacher, 1983); vale decir que la porción de la cabeza del epidídimo está revestida internamente por un epitelio seudoestratificado cilíndrico ciliado (Salisbury et al., 1978; citado por Barrios, 2002).
El fluido producido por las células secretoras del epidídimo es rico en carnitina, glicerofosforilcolina y varias glicoproteínas; generalmente es amarillento (Johnson y Everitt, 1980; citado por Barrios, 2002), pero en toros fértiles adquiere apariencia blanco-cremosa debido a la concentración de espermatozoides (Salisbury et al., 1978; citado por Barrios, 2002).
La maduración espermática en el epidídimo es dependiente de las secreciones epiteliales, del transporte de sodio y potasio, de los andrógenos, y de la temperatura escrotal (Amann y Schanbacher, 1983). Los cambios estructurales de los espermatozoides se deben a la utilización de fosfolípidos y colesterol como sustratos durante la maduración en el epidídimo. En estos cambios se completa el proceso de condensación nuclear, los espermatozoides pierden la gota citoplasmática, aumentan la negatividad de la carga superficial, y ocurren ligeros cambios en la morfología del acrosoma (Johnson y Everitt, 1980; citado por Barrios, 2002).
La testosterona ejerce influencia directa en la maduración espermática. En el epidídimo los receptores intracelulares captan andrógenos y la enzima 5alfa-reductasa convierte la testosterona en dihidrotestosterona (Brooks, 1983; Jonson y Everitt, 1980; Amann y Schanbacher, 1983). Si los andrógenos son removidos por castración, las secreciones cesan y el epidídimo involuciona. La inyección de testosterona reestablece las secreciones (Johnson y Everitt, 1980; citado por Barrios, 2002).
En un estudio realizado en Venezuela (Rodríguez et al., 2000) con toros mestizos (5/8 Holstein y 5/8 Pardo Suizo), se demostró que el desarrollo y mantenimiento estructural y funcional de las células del epitelio, en la cabeza del epidídimo, dependen de la función testicular y por lo tanto los andrógenos testiculares, pero en la cola del epidídimo los mismos aspectos dependen de los andrógenos sanguíneos.
ESPERMATOZOIDES EPIDIDIMARIOS FRENTE A LAS TÉCNICAS DE REPRODUCCIÓN ASISTIDA (ART)
Los espermatozoides del epidídimo tienen la capacidad de fertilizar oocitos, pero las tasas de preñez son significativamente bajas cuando se realiza la fertilización in vitro (In Vitro Fertilization).
La inyección intracitoplasmática de espermatozoides (IntraCytoplasmic Sperm Injection) se ha usado en humanos como una técnica de reproducción asistida (Assisted Reproductive Techniques) para superar problemas relacionados con una baja calidad del esperma. Combinando la ICSI con los espermatozoides extraídos del epidídimo se han logrado tasas de fertilización y preñez comparables a las logradas con los espermatozoides de un eyaculado (Schlegel, 1999; fuente Internet).
Es notable que la ICSI no es muy exigente en cuanto a los requerimientos sobre calidad de los espermatozoides en función del número, motilidad y morfología para lograr una preñez; sólo es necesario que los espermatozoides sean viables, así la fertilización puede lograrse. Esta técnica se ha vuelto una rutina practica en dentro de las técnicas de reproducción asistida (ART) en muchos laboratorios humanos; la congelación y descongelación de espermatozoides del epidídimo, asegura la disposición de los gametos del macho para que sean usados en ICSI.
Largos estudios retrospectivos sobre ICSI dentro de las ART, reportan que no hay incremento en el riesgo de adquirir malformaciones congénitas, pero sí hay un aumento ligero de aberraciones en los cromosomas ligados al sexo. Por estos motivos hay una urgente necesidad de emprender investigaciones que concluyan por anticipado cuáles son las consecuencias de la ICSI dentro de las técnicas de reproducción asistida (Ng et al., 2002)
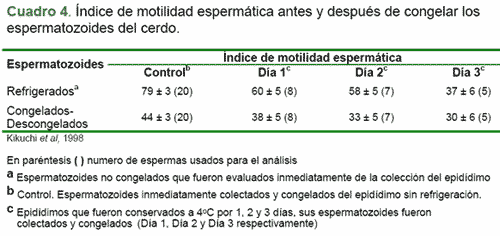
Los espermatozoides tomados del epidídimo en el jabalí muestran una mayor resistencia al choque ejercido por el frió que las células espermáticas tomadas del eyaculado, sugiriendo que estas pueden ser usadas más convenientemente para la criopreservación. Dichos espermatozoides han sido utilizados post-descongelación para realizar ICSI en oocitos porcinos. Este estudio (Cuadros 4 y 5) muestra que la criopreservación de espermatozoides del epidídimo es una técnica promisoria para conservar los recursos genéticos tanto en cerdos como en las diferentes especies animales (Kikuchi et al., 1998).
CRIOPRESERVACIÓN A PARTIR DEL EPIDÍDIMO
Cuando se pretenden congelar y descongelar gametos de un macho, es importante considerar las diferencias que existen entre los espermatozoides del eyaculado y los que son extraídos del epidídimo, tanto morfológico como funcional; tales diferencias, en el momento de la congelación, pueden influir en la estabilidad de la membrana frente al choque térmico y a la presión osmótica. Por lo tanto los métodos empleados para criopreservar espermatozoides eyaculados no son convenientes para ser usados con los espermatozoides obtenidos del epidídimo, a menos que sean añadidos componentes similares a los encontrados dentro del epidídimo, en la solución de congelamiento (Hewitt et al., 2001).
En la actualidad pueden encontrarse múltiples alternativas para preservar los espermatozoides dentro de los que se incluyen: congelación de células (gametos), de tejidos (epidídimo), la refrigeración de epidídimos obtenidos luego de la muerte y otras en las que se pretenden simular las condiciones fisiológicas del epidídimo in vitro. Muchas investigaciones se han hecho especialmente con esperma bovino para entender la influencia de diferentes factores que limitan la vida de los gametos y diseñar un medio útil de conservación para mantener los espermatozoides vivos en un estado diferente al de congelación.
Hasta ahora ha sido muy difícil imitar las condiciones del epidídimo in vitro (pH bajo, altas concentraciones de células, baja tensión de oxigeno, etc.), aunque algunos reportes muestran que los espermatozoides pueden exhibir la capacidad de fertilizar después de ser almacenados por varios días en epidídimos refrigerados de diferentes especies. Desafortunadamente, ésta no es una alternativa práctica para almacenar espermatozoides (De Pauw et al., 2003), tomando así la criopreservación y no la refrigeración como una forma viable de conservar el material genético.
Hay muchas variables que afectan la fertilidad y la supervivencia de los espermatozoides mamíferos cuando son congelados, por lo tanto hay que considerar algunos factores esenciales para establecer el procedimiento de congelación (Brooke, 2000; fuente Internet):
Intervalo entre la muerte, recolección y procesamiento del epidídimo
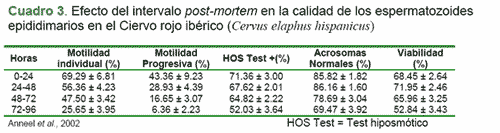
Dentro de los factores que determinan la viabilidad de los espermatozoides, el tiempo transcurrido desde la muerte del animal hasta la congelación de los gametos y el manejo que se le de al epidídimo durante ese tiempo, van a ser unos de los factores más condicionantes para la supervivencia y capacidad fecundante de los espermatozoides en el futuro (Anel et al., 2002).
La viabilidad de los espermatozoides depende del tratamiento dado al epidídimo. En ratones, el 30% de los espermatozoides conservan su motilidad cuando son mantenidos a 4oC por 10 días, considerando que la motilidad decrece de 10 a 15% en las 24 h siguientes a la muerte en cadáveres que son conservados a temperatura ambiente.
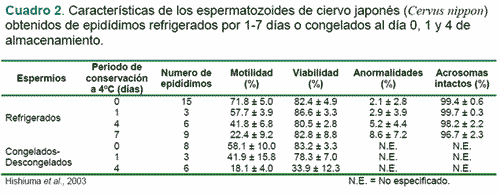
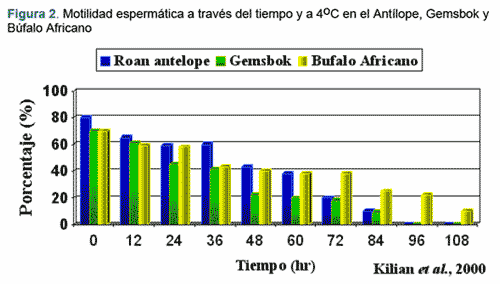
El ciervo (Cervus nippon) ha sido usado como un modelo potencialmente bueno para aplicar estas técnicas asistidas de reproducción con el fin de evitar que siga en peligro de extinguirse (Cuadros 2 y 3). En él ciervo, los espermatozoides han sido recuperados y usados para la criopreservación y posterior inseminación artificial y fertilización in vitro. Sin embargo, la información sobre el almacenamiento de los epidídimos es limitada. Aún no ha sido reportada ninguna investigación sobre la criopreservación de espermatozoides de ciervo colectados de epidídimos refrigerados por varios días. (Hishinuma et al., 2003).
En ratones se han producido fertilizaciones in vitro (FIV) de oocitos con espermatozoides tomados en la cola del epidídimo de cadáveres que fueron conservados en un cuarto a temperatura fija por 24 horas. También en ratones han sido recuperados del epidídimo gametos viables después de haberse refrigerado por 7 días post-mortem; ulteriormente fueron producidos embriones jóvenes derivados de la FIV.
Usando la inyección intracitoplasmática de espermatozoides, Kishikawa et al. (2001), produjeron fetos normales de ratón usando espermatozoides recuperados después de 20 días de la muerte del ratón. Marks et al. (1989) recuperaron y congelaron esperma a partir de los testículos de un perro que fue sometido a eutanasia a causa de una enfermedad generalizada con daños progresivos. Cuando ellos descongelaron el esperma e inseminaron una hembra sana, nació un cachorro normal.
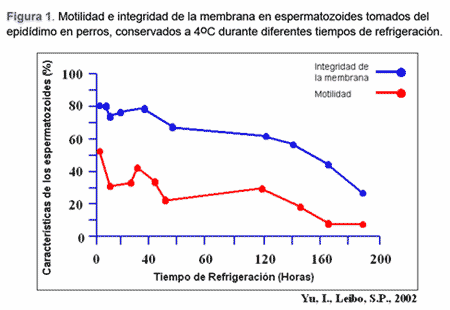
Estos estudios muestran que los espermatozoides recuperados de especimenes luego de su muerte, incluso muchas horas después, mantienen su función normal (Yu et al., 2002). Espermatozoides del epidídimo con una motilidad de 70 a 90% pueden ser obtenidos varias horas después siempre y cuando los órganos sean refrigerados inmediatamente (Gerber et al., 2002).
Anatómicamente el epidídimo consta de tres partes bien definidas: cabeza, cuerpo y cola (Sisson, 1993, Chenoweth, 1997; citado por Barrios, 2002). La cabeza es la parte más grande, recorre el polo dorsal del testículo y desciende en forma de asa unos 2.5 a 3 cm de la superficie dorso lateral del testículo. El cuerpo del epidídimo se extiende hacia el polo distal del testículo como una banda de 1 cm de ancho y se une firmemente a la cara caudo-medial del testículo. La cola del epidídimo tiene forma cónica y se une estrechamente por su base mayor al polo distal del testículo (Zemjanis, 1994; citado por Barrios, 2002).
Las convoluciones del epidídimo van disminuyendo en amplitud progresivamente desde la cabeza al cuerpo, en el cual se aprecia una constricción delgada de la túnica albugínea; pero al nivel de la cola aumentan el diámetro del túbulo y el tamaño de las convoluciones (Salisbury et al., 1978, citado por Barrios, 2002).
Funciones del Epidídimo
Las funciones del epidídimo son el transporte y la maduración de los espermatozoides (Chenoweth, 1997; citado por Barrios, 2002), los cuales, a través del pasaje por los conductos eferentes y el epidídimo, adquieren la habilidad de tener movimiento progresivo lineal y la capacidad de fertilizar (Johnson y Everitt, 1980; citado por Barrios, 2002). Durante ese proceso, en la célula espermática ocurren cambios funcionales, bioquímicos y morfológicos (Johnson y Everitt, 1980; Chenoweth, 1997; citados por Barrios, 2002; Amann y Schanbacher, 1983). También ocurre la reabsorción e intercambio de fluidos (Salisbury et al., 1978; citado por Barrios, 2002). Específicamente, en la cabeza del epidídimo ocurre la reabsorción de solutos y fluidos, en el cuerpo del epidídimo la maduración espermática, y en la cola del epidídimo el almacenamiento de los espermatozoides fértiles (Amann y Schanbacher, 1983). Con esta consideración, es importante señalar que se podrían obtener espermatozoides viables provenientes de la cola del epidídimo que tengan motilidad y capacidad de fertilizar, poco tiempo después de la muerte del animal, que podrían ser congelados para su posterior uso en inseminación artificial (Barrios, 2002).
En su origen, los espermatozoides son incapaces de moverse, de allí que el transporte inicial a la retetestis es dependiente del fluido secretado por las células de Sertoli. En los conductos eferentes, cabeza y cuerpo del epidídimo el transporte es mediado por el epitelio del epidídimo, especialmente las células ciliadas y las principales, y contracciones peristálticas de la musculatura lisa de los conductos eferentes y la cabeza y cuerpo del epidídimo, mas la presión hidrostática interna (Johnson y Everitt, 1980; Chenoweth, 1997; citados por Barrios, 2002; Amann y Schanbacher, 1983).
Un solo epidídimo tiene capacidad para almacenar 4 ml de fluido rico en espermatozoides, con una concentración de 3.55 x 109 espermatozoides/ml, que ocupa la mitad de su volumen total (Salisbury et al., 1978, citado por Barrios, 2002). Se han reportado resultados variables en las concentraciones espermáticas de los dos epidídimos de toros adultos (Cuadro 1). Allí hay una concentración de 15 a 40 x 109 espermatozoides/ml, suficientes para proveer 20 eyaculados normales consecutivos en un periodo de 3 a 4 horas (Salisbury et al., 1978; citado por Barrios, 2002).
El ambiente al que se enfrentan las células espermáticas cuando llegan al epidídimo es diferente al de los túbulos seminíferos y los conductos eferentes. Tal diferencia se debe a los cambios en la composición del fluido drenado por la rete testis, debido a que la presencia de la barrera hemotesticular es incompleta en esta región (Johnson y Everitt, 1980; citado por Barrios, 2002). Además, en todo el trayecto del epidídimo hay células secretoras cuyas secreciones afectan a los espermatozoides (Amann y Schanbacher, 1983); vale decir que la porción de la cabeza del epidídimo está revestida internamente por un epitelio seudoestratificado cilíndrico ciliado (Salisbury et al., 1978; citado por Barrios, 2002).
El fluido producido por las células secretoras del epidídimo es rico en carnitina, glicerofosforilcolina y varias glicoproteínas; generalmente es amarillento (Johnson y Everitt, 1980; citado por Barrios, 2002), pero en toros fértiles adquiere apariencia blanco-cremosa debido a la concentración de espermatozoides (Salisbury et al., 1978; citado por Barrios, 2002).
La maduración espermática en el epidídimo es dependiente de las secreciones epiteliales, del transporte de sodio y potasio, de los andrógenos, y de la temperatura escrotal (Amann y Schanbacher, 1983). Los cambios estructurales de los espermatozoides se deben a la utilización de fosfolípidos y colesterol como sustratos durante la maduración en el epidídimo. En estos cambios se completa el proceso de condensación nuclear, los espermatozoides pierden la gota citoplasmática, aumentan la negatividad de la carga superficial, y ocurren ligeros cambios en la morfología del acrosoma (Johnson y Everitt, 1980; citado por Barrios, 2002).
La testosterona ejerce influencia directa en la maduración espermática. En el epidídimo los receptores intracelulares captan andrógenos y la enzima 5alfa-reductasa convierte la testosterona en dihidrotestosterona (Brooks, 1983; Jonson y Everitt, 1980; Amann y Schanbacher, 1983). Si los andrógenos son removidos por castración, las secreciones cesan y el epidídimo involuciona. La inyección de testosterona reestablece las secreciones (Johnson y Everitt, 1980; citado por Barrios, 2002).
En un estudio realizado en Venezuela (Rodríguez et al., 2000) con toros mestizos (5/8 Holstein y 5/8 Pardo Suizo), se demostró que el desarrollo y mantenimiento estructural y funcional de las células del epitelio, en la cabeza del epidídimo, dependen de la función testicular y por lo tanto los andrógenos testiculares, pero en la cola del epidídimo los mismos aspectos dependen de los andrógenos sanguíneos.
ESPERMATOZOIDES EPIDIDIMARIOS FRENTE A LAS TÉCNICAS DE REPRODUCCIÓN ASISTIDA (ART)
Los espermatozoides del epidídimo tienen la capacidad de fertilizar oocitos, pero las tasas de preñez son significativamente bajas cuando se realiza la fertilización in vitro (In Vitro Fertilization).
La inyección intracitoplasmática de espermatozoides (IntraCytoplasmic Sperm Injection) se ha usado en humanos como una técnica de reproducción asistida (Assisted Reproductive Techniques) para superar problemas relacionados con una baja calidad del esperma. Combinando la ICSI con los espermatozoides extraídos del epidídimo se han logrado tasas de fertilización y preñez comparables a las logradas con los espermatozoides de un eyaculado (Schlegel, 1999; fuente Internet).
Es notable que la ICSI no es muy exigente en cuanto a los requerimientos sobre calidad de los espermatozoides en función del número, motilidad y morfología para lograr una preñez; sólo es necesario que los espermatozoides sean viables, así la fertilización puede lograrse. Esta técnica se ha vuelto una rutina practica en dentro de las técnicas de reproducción asistida (ART) en muchos laboratorios humanos; la congelación y descongelación de espermatozoides del epidídimo, asegura la disposición de los gametos del macho para que sean usados en ICSI.
Largos estudios retrospectivos sobre ICSI dentro de las ART, reportan que no hay incremento en el riesgo de adquirir malformaciones congénitas, pero sí hay un aumento ligero de aberraciones en los cromosomas ligados al sexo. Por estos motivos hay una urgente necesidad de emprender investigaciones que concluyan por anticipado cuáles son las consecuencias de la ICSI dentro de las técnicas de reproducción asistida (Ng et al., 2002)
Los espermatozoides tomados del epidídimo en el jabalí muestran una mayor resistencia al choque ejercido por el frió que las células espermáticas tomadas del eyaculado, sugiriendo que estas pueden ser usadas más convenientemente para la criopreservación. Dichos espermatozoides han sido utilizados post-descongelación para realizar ICSI en oocitos porcinos. Este estudio (Cuadros 4 y 5) muestra que la criopreservación de espermatozoides del epidídimo es una técnica promisoria para conservar los recursos genéticos tanto en cerdos como en las diferentes especies animales (Kikuchi et al., 1998).
CRIOPRESERVACIÓN A PARTIR DEL EPIDÍDIMO
Cuando se pretenden congelar y descongelar gametos de un macho, es importante considerar las diferencias que existen entre los espermatozoides del eyaculado y los que son extraídos del epidídimo, tanto morfológico como funcional; tales diferencias, en el momento de la congelación, pueden influir en la estabilidad de la membrana frente al choque térmico y a la presión osmótica. Por lo tanto los métodos empleados para criopreservar espermatozoides eyaculados no son convenientes para ser usados con los espermatozoides obtenidos del epidídimo, a menos que sean añadidos componentes similares a los encontrados dentro del epidídimo, en la solución de congelamiento (Hewitt et al., 2001).
En la actualidad pueden encontrarse múltiples alternativas para preservar los espermatozoides dentro de los que se incluyen: congelación de células (gametos), de tejidos (epidídimo), la refrigeración de epidídimos obtenidos luego de la muerte y otras en las que se pretenden simular las condiciones fisiológicas del epidídimo in vitro. Muchas investigaciones se han hecho especialmente con esperma bovino para entender la influencia de diferentes factores que limitan la vida de los gametos y diseñar un medio útil de conservación para mantener los espermatozoides vivos en un estado diferente al de congelación.
Hasta ahora ha sido muy difícil imitar las condiciones del epidídimo in vitro (pH bajo, altas concentraciones de células, baja tensión de oxigeno, etc.), aunque algunos reportes muestran que los espermatozoides pueden exhibir la capacidad de fertilizar después de ser almacenados por varios días en epidídimos refrigerados de diferentes especies. Desafortunadamente, ésta no es una alternativa práctica para almacenar espermatozoides (De Pauw et al., 2003), tomando así la criopreservación y no la refrigeración como una forma viable de conservar el material genético.
Hay muchas variables que afectan la fertilidad y la supervivencia de los espermatozoides mamíferos cuando son congelados, por lo tanto hay que considerar algunos factores esenciales para establecer el procedimiento de congelación (Brooke, 2000; fuente Internet):
Intervalo entre la muerte, recolección y procesamiento del epidídimo
Dentro de los factores que determinan la viabilidad de los espermatozoides, el tiempo transcurrido desde la muerte del animal hasta la congelación de los gametos y el manejo que se le de al epidídimo durante ese tiempo, van a ser unos de los factores más condicionantes para la supervivencia y capacidad fecundante de los espermatozoides en el futuro (Anel et al., 2002).
La viabilidad de los espermatozoides depende del tratamiento dado al epidídimo. En ratones, el 30% de los espermatozoides conservan su motilidad cuando son mantenidos a 4oC por 10 días, considerando que la motilidad decrece de 10 a 15% en las 24 h siguientes a la muerte en cadáveres que son conservados a temperatura ambiente.
El ciervo (Cervus nippon) ha sido usado como un modelo potencialmente bueno para aplicar estas técnicas asistidas de reproducción con el fin de evitar que siga en peligro de extinguirse (Cuadros 2 y 3). En él ciervo, los espermatozoides han sido recuperados y usados para la criopreservación y posterior inseminación artificial y fertilización in vitro. Sin embargo, la información sobre el almacenamiento de los epidídimos es limitada. Aún no ha sido reportada ninguna investigación sobre la criopreservación de espermatozoides de ciervo colectados de epidídimos refrigerados por varios días. (Hishinuma et al., 2003).
En ratones se han producido fertilizaciones in vitro (FIV) de oocitos con espermatozoides tomados en la cola del epidídimo de cadáveres que fueron conservados en un cuarto a temperatura fija por 24 horas. También en ratones han sido recuperados del epidídimo gametos viables después de haberse refrigerado por 7 días post-mortem; ulteriormente fueron producidos embriones jóvenes derivados de la FIV.
Usando la inyección intracitoplasmática de espermatozoides, Kishikawa et al. (2001), produjeron fetos normales de ratón usando espermatozoides recuperados después de 20 días de la muerte del ratón. Marks et al. (1989) recuperaron y congelaron esperma a partir de los testículos de un perro que fue sometido a eutanasia a causa de una enfermedad generalizada con daños progresivos. Cuando ellos descongelaron el esperma e inseminaron una hembra sana, nació un cachorro normal.
Estos estudios muestran que los espermatozoides recuperados de especimenes luego de su muerte, incluso muchas horas después, mantienen su función normal (Yu et al., 2002). Espermatozoides del epidídimo con una motilidad de 70 a 90% pueden ser obtenidos varias horas después siempre y cuando los órganos sean refrigerados inmediatamente (Gerber et al., 2002).
Según Anel et al. (2002), dependiendo del intervalo entre la recuperación de los espermatozoides y la muerte, la motilidad espermática disminuirá significativamente entre las 24 y 48 horas. Después de las 48 horas post-mortem, todas las medidas de calidad del esperma declinan progresivamente. Este autor, también sugiriere que el tejido del epidídimo debe refrigerarse antes de las 48 h después de la muerte con el fin de asegurar una mayor probabilidad de vida de los espermatozoides.
LOS DILUENTES
En bovinos y otras especies superiores, el grado de maduración y supervivencia espermática durante su tránsito por el epidídimo es dependiente, principalmente de andrógenos; paralelo a los andrógenos, existen otro gran número de sustancias producidas por el epitelio epididimario, que tienen como objeto crear un ambiente luminal especifico. Durante su tránsito a través del epidídimo, se remodelan proteínas de la membrana; proceso que es crítico, ya que de él, depende que el espermatozoide adquiera su motilidad y sea fecundante (Reyes-Moreno et al., 2002).
A pesar de que es poco conocido aun el papel de ejerce el epitelio secretor del epidídimo sobre los espermatozoides, es importante estar al tanto de cuales son las condiciones especiales que debe tener el medio destinado a criopreservar el esperma del epidídimo.
Muchos son los efectos atribuidos al fluido del epitelio epididimario bovino (Bovine Epididymal Epithelium Fluid - BEEF) sobre la motilidad de los espermatozoides, congelados/descongelados, que han sido evaluados in vitro (Reyes-Moreno et al., 2002).
Aminoácidos
Componentes del epidídimo como la Taurina, Hipotaurina, Inositol, Carnitina y Ácido Ascórbico, han sido adicionados a medios como el Tris-glicerol con el fin de determinar su efecto post-descongelación sobre la morfología y fertilidad de los espermatozoides en carneros. En este experimento en particular, logró demostrarse que si en el medio de dilución existen concentraciones de Taurina entre 25 y 50 mM, las tasas de fertilidad posteriores a la inseminación aumentaban. Cuando la Taurina se añade al diluente por encima de 50 mM, se reduce el porcentaje de células mótiles, comparado con unas menores concentraciones del aminoácido (Sánchez-Partida et al., 1997; Luvoni et al., 2002). La presencia de Carnitina, Inositol y Ácido ascórbico, tuvieron efectos negativos sobre la motilidad de los espermatozoides. Esto puede explicarse, teniendo en cuenta las propiedades de osmoregulación que ejerce la Taurina sobre las células espermáticas, propiedad que no posee la carnitina y ácido ascórbico (Luvoni et al., 2002).
En un estudio realizado en corderos por Kundu et al., (2001), quiso evaluarse la eficacia de algunos aminoácidos cuando son disueltos en soluciones de Ringer para criopreservar los espermatozoides del epidídimo. Pudo demostrarse que en ausencia de aminoácidos, las células espermáticas pierden completamente su motilidad flagelar. De todos los aminoácidos probados, la Alanina (135 mM) mostró el mayor potencial del crioprotección. En presencia de la Alanina, logro recuperarse la motilidad progresiva y total del esperma en 14 ± 2% y 19 ± 2%, respectivamente. En segundo lugar, aminoácidos como Glutamina, Prolina y Glicina, demostraron en los espermios una motilidad total de 11 a 17%. Otros aminoácidos como Arginina, Lisina e Histidina ofrecieron a las células un menor margen de protección (0 a 5%).
Cuando todos los aminoácidos fueron mezclados con glicerol, la tasa de recuperación de células mótiles fue del 52%; la concentración de glicerol requerida para la dilución fue mucho menor, y se demostró que podía sumarse, a los aminoácidos y el glicerol, el dimetilsulfóxido, aumentando así el porcentaje de espermatozoides motiles post-descongelación; por esta observación se concluyó que existía un efectoaditivo de los aminoácidos con el glicerol, aumentando su potencial de criopreservación en esperma del epidídimo (Kundu et al., 2001).
Polisacáridos
En otro trabajo realizado por Kundu et al., (2002), se empleo el Dextrán como criodiluente de espermatozoides epididimarios. Las concentraciones óptimas para la criopreservación estaban entre 10 y 20 kDa, con las cuales los espermatozoides no perdían su motilidad luego de la descongelación (tasas entre 21 y 23% de motilidad). Según Kundu, el Dextrán también puede ser utilizado junto al Glicerol (0.87 mol) y el Dimetil-Sulfóxido (6.27 mol). En presencia de los tres crioprotectores, la recuperación de células con motilidad progresiva era tan alta como del 58%, y 60% de motilidad total.
Medios sintéticos
Existen también otros tipos de diluentes que contienen los factores de supervivencia (SF) encontrados en el epidídimo. Tales diluentes son utilizados en laboratorios de investigación con el fin de evitar la perdida de espermatozoides epididimarios tras su dilución en medios convencionales. Un ejemplo de tales diluentes es el HCE (Hamster Caudal Epididymal) que es un extracto de epidídimos del hámster (Morton et al., 1979). En la actualidad, se están desarrollando químicamente medios sintéticos con el fin de reemplazar el diluente HCE (Reyes-Moreno et al., 2002).
pH y Osmolaridad
No es desconocido por nosotros, que existe un efecto inhibitorio por parte del fluido de la cola del epidídimo (Cauda Epididymal Fluid - CEF), sobre la motilidad de los espermatozoides. Más importante aún, es que el proceso inhibitorio es reversible. En muchas especies, dentro del CEF, pueden descartarse como sustancias inhibitorias para la movilidad, la mucina, inmovilina, carnitina, calcio y la glicerilfosforilcolina, ya que dentro del epidídimo bovino, no juegan un papel importante sobre la movilidad de los espermios. La verdadera inmovilidad producida por el CEF en los bovinos es ocasionada por el pH extracelular; es decir, se inhibe motilidad a pH 5.5 pero no a pH 7.6 o superior. Por estas razones, es necesario que los diluentes destinados para congelar semen extraído del epidídimo, posean un pH superior a 7.5 (Carr et al., 1984).
La osmolaridad del diluyente también puede considerarse como un factor primordial en la congelación de semen; esto es debido a que junto al pH y la viscosidad, la osmolaridad va a determinar el inicio de la motilidad espermática. La osmolaridad conveniente del diluyente para iniciar la motilidad está entre 130 a 600 mOsm/kg. Cuando se agregan sustancias como Hg2+ mas que Cu2+, o más que Cd2+, clorpromazina, y otros, la motilidad de los espermatozoides es inhibida puesto que es alterada la presión que ejerce la solución sobre los espermatozoides. (Chulavatnatol et al., 1982).
En general, los medios usados para criopreservar espermatozoides tomados del epidídimo pueden ser similares a los empleados para preservar espermatozoides eyaculados; solamente, debe tenerse presente que dentro del epidídimo, las células espermáticas se encuentran inmóviles por lo que el medio debe estar enriquecido con sustancia que activen su motilidad.
FORMAS DE CRIOPRESERVAR EL SEMEN DEL EPIDÍDIMO
Existen varios protocolos de criopreservación de esperma a partir del epidídimo. Muchos de ellos son aún experimentales y en su mayoría están dirigidos a preservar gametos de especies en vía de extinción.
En general los testículos pueden ser transportados en soluciones de PBS (phosphate buffered saline) a temperatura ambiente hasta el laboratorio. El tejido debe ser procesado por lo menos 2 a 4 horas después de la recolección; el transporte puede realizarse en bolsas plásticas o cualquier otro medio que impida que se seque la muestra (Hewitt et al., 2001).
En caso de permanecer aún en el saco escrotal, los testículos deben ser removidos de él. A continuación debe separarse la cola del epidídimo, y hacer varias incisiones. Hecho ésto deben enjuagarse con una solución de Tris-glucosa-ácido cítrico que consiste en 198 mM de Citrato Trisódico (Sigma, St. Louis, Mo), 44 mM de Glucosa (Sigma), 67 mM de Acido Cítrico (Sigma) y 50 μg/ml de Gentamicina (Sigma). Los espermatozoides que son obtenidos del lavado deben incubarse a 37oC por 15 minutos.
La suspensión obtenida se diluye en una nueva solución de Tris-glucosa-ácido cítrico que contiene además de lo anterior 10% de yema de huevo (v/v) y 8% de glicerol. Una vez llenas, las pajillas son pasadas por los vapores del nitrógeno líquido (LN2) por 10 min. (Aproximadamente -5oC/min. hasta -20oC/min., -130oC), posteriormente se introducen en el nitrógeno líquido. La descongelación debe hacerse a 34oC por 40s (Hishinuma et al., 2003).
Otra forma de criopreservar los espermatozoides ha sido descrita por Gerber et al. (2002) en un trabajo realizado con búfalos africanos. Luego de extraer los epidídimos son lavados con TriladylTM (Minitüb, Alemania), se pasan a un medio de conservación (Holding) por 5 horas a 25oC, acto seguido, deben refrigerarse a 4oC antes de congelar.
REFERENCIAS
LOS DILUENTES
En bovinos y otras especies superiores, el grado de maduración y supervivencia espermática durante su tránsito por el epidídimo es dependiente, principalmente de andrógenos; paralelo a los andrógenos, existen otro gran número de sustancias producidas por el epitelio epididimario, que tienen como objeto crear un ambiente luminal especifico. Durante su tránsito a través del epidídimo, se remodelan proteínas de la membrana; proceso que es crítico, ya que de él, depende que el espermatozoide adquiera su motilidad y sea fecundante (Reyes-Moreno et al., 2002).
A pesar de que es poco conocido aun el papel de ejerce el epitelio secretor del epidídimo sobre los espermatozoides, es importante estar al tanto de cuales son las condiciones especiales que debe tener el medio destinado a criopreservar el esperma del epidídimo.
Muchos son los efectos atribuidos al fluido del epitelio epididimario bovino (Bovine Epididymal Epithelium Fluid - BEEF) sobre la motilidad de los espermatozoides, congelados/descongelados, que han sido evaluados in vitro (Reyes-Moreno et al., 2002).
Aminoácidos
Componentes del epidídimo como la Taurina, Hipotaurina, Inositol, Carnitina y Ácido Ascórbico, han sido adicionados a medios como el Tris-glicerol con el fin de determinar su efecto post-descongelación sobre la morfología y fertilidad de los espermatozoides en carneros. En este experimento en particular, logró demostrarse que si en el medio de dilución existen concentraciones de Taurina entre 25 y 50 mM, las tasas de fertilidad posteriores a la inseminación aumentaban. Cuando la Taurina se añade al diluente por encima de 50 mM, se reduce el porcentaje de células mótiles, comparado con unas menores concentraciones del aminoácido (Sánchez-Partida et al., 1997; Luvoni et al., 2002). La presencia de Carnitina, Inositol y Ácido ascórbico, tuvieron efectos negativos sobre la motilidad de los espermatozoides. Esto puede explicarse, teniendo en cuenta las propiedades de osmoregulación que ejerce la Taurina sobre las células espermáticas, propiedad que no posee la carnitina y ácido ascórbico (Luvoni et al., 2002).
En un estudio realizado en corderos por Kundu et al., (2001), quiso evaluarse la eficacia de algunos aminoácidos cuando son disueltos en soluciones de Ringer para criopreservar los espermatozoides del epidídimo. Pudo demostrarse que en ausencia de aminoácidos, las células espermáticas pierden completamente su motilidad flagelar. De todos los aminoácidos probados, la Alanina (135 mM) mostró el mayor potencial del crioprotección. En presencia de la Alanina, logro recuperarse la motilidad progresiva y total del esperma en 14 ± 2% y 19 ± 2%, respectivamente. En segundo lugar, aminoácidos como Glutamina, Prolina y Glicina, demostraron en los espermios una motilidad total de 11 a 17%. Otros aminoácidos como Arginina, Lisina e Histidina ofrecieron a las células un menor margen de protección (0 a 5%).
Cuando todos los aminoácidos fueron mezclados con glicerol, la tasa de recuperación de células mótiles fue del 52%; la concentración de glicerol requerida para la dilución fue mucho menor, y se demostró que podía sumarse, a los aminoácidos y el glicerol, el dimetilsulfóxido, aumentando así el porcentaje de espermatozoides motiles post-descongelación; por esta observación se concluyó que existía un efectoaditivo de los aminoácidos con el glicerol, aumentando su potencial de criopreservación en esperma del epidídimo (Kundu et al., 2001).
Polisacáridos
En otro trabajo realizado por Kundu et al., (2002), se empleo el Dextrán como criodiluente de espermatozoides epididimarios. Las concentraciones óptimas para la criopreservación estaban entre 10 y 20 kDa, con las cuales los espermatozoides no perdían su motilidad luego de la descongelación (tasas entre 21 y 23% de motilidad). Según Kundu, el Dextrán también puede ser utilizado junto al Glicerol (0.87 mol) y el Dimetil-Sulfóxido (6.27 mol). En presencia de los tres crioprotectores, la recuperación de células con motilidad progresiva era tan alta como del 58%, y 60% de motilidad total.
Medios sintéticos
Existen también otros tipos de diluentes que contienen los factores de supervivencia (SF) encontrados en el epidídimo. Tales diluentes son utilizados en laboratorios de investigación con el fin de evitar la perdida de espermatozoides epididimarios tras su dilución en medios convencionales. Un ejemplo de tales diluentes es el HCE (Hamster Caudal Epididymal) que es un extracto de epidídimos del hámster (Morton et al., 1979). En la actualidad, se están desarrollando químicamente medios sintéticos con el fin de reemplazar el diluente HCE (Reyes-Moreno et al., 2002).
pH y Osmolaridad
No es desconocido por nosotros, que existe un efecto inhibitorio por parte del fluido de la cola del epidídimo (Cauda Epididymal Fluid - CEF), sobre la motilidad de los espermatozoides. Más importante aún, es que el proceso inhibitorio es reversible. En muchas especies, dentro del CEF, pueden descartarse como sustancias inhibitorias para la movilidad, la mucina, inmovilina, carnitina, calcio y la glicerilfosforilcolina, ya que dentro del epidídimo bovino, no juegan un papel importante sobre la movilidad de los espermios. La verdadera inmovilidad producida por el CEF en los bovinos es ocasionada por el pH extracelular; es decir, se inhibe motilidad a pH 5.5 pero no a pH 7.6 o superior. Por estas razones, es necesario que los diluentes destinados para congelar semen extraído del epidídimo, posean un pH superior a 7.5 (Carr et al., 1984).
La osmolaridad del diluyente también puede considerarse como un factor primordial en la congelación de semen; esto es debido a que junto al pH y la viscosidad, la osmolaridad va a determinar el inicio de la motilidad espermática. La osmolaridad conveniente del diluyente para iniciar la motilidad está entre 130 a 600 mOsm/kg. Cuando se agregan sustancias como Hg2+ mas que Cu2+, o más que Cd2+, clorpromazina, y otros, la motilidad de los espermatozoides es inhibida puesto que es alterada la presión que ejerce la solución sobre los espermatozoides. (Chulavatnatol et al., 1982).
En general, los medios usados para criopreservar espermatozoides tomados del epidídimo pueden ser similares a los empleados para preservar espermatozoides eyaculados; solamente, debe tenerse presente que dentro del epidídimo, las células espermáticas se encuentran inmóviles por lo que el medio debe estar enriquecido con sustancia que activen su motilidad.
FORMAS DE CRIOPRESERVAR EL SEMEN DEL EPIDÍDIMO
Existen varios protocolos de criopreservación de esperma a partir del epidídimo. Muchos de ellos son aún experimentales y en su mayoría están dirigidos a preservar gametos de especies en vía de extinción.
En general los testículos pueden ser transportados en soluciones de PBS (phosphate buffered saline) a temperatura ambiente hasta el laboratorio. El tejido debe ser procesado por lo menos 2 a 4 horas después de la recolección; el transporte puede realizarse en bolsas plásticas o cualquier otro medio que impida que se seque la muestra (Hewitt et al., 2001).
En caso de permanecer aún en el saco escrotal, los testículos deben ser removidos de él. A continuación debe separarse la cola del epidídimo, y hacer varias incisiones. Hecho ésto deben enjuagarse con una solución de Tris-glucosa-ácido cítrico que consiste en 198 mM de Citrato Trisódico (Sigma, St. Louis, Mo), 44 mM de Glucosa (Sigma), 67 mM de Acido Cítrico (Sigma) y 50 μg/ml de Gentamicina (Sigma). Los espermatozoides que son obtenidos del lavado deben incubarse a 37oC por 15 minutos.
La suspensión obtenida se diluye en una nueva solución de Tris-glucosa-ácido cítrico que contiene además de lo anterior 10% de yema de huevo (v/v) y 8% de glicerol. Una vez llenas, las pajillas son pasadas por los vapores del nitrógeno líquido (LN2) por 10 min. (Aproximadamente -5oC/min. hasta -20oC/min., -130oC), posteriormente se introducen en el nitrógeno líquido. La descongelación debe hacerse a 34oC por 40s (Hishinuma et al., 2003).
Otra forma de criopreservar los espermatozoides ha sido descrita por Gerber et al. (2002) en un trabajo realizado con búfalos africanos. Luego de extraer los epidídimos son lavados con TriladylTM (Minitüb, Alemania), se pasan a un medio de conservación (Holding) por 5 horas a 25oC, acto seguido, deben refrigerarse a 4oC antes de congelar.
REFERENCIAS
- Amann, R.P., Schenbacher, B.D. Physiology of male reproduction. Animal Science 1983; 57: 380-403
- Anel, L., Gerra, C., Alvarez, M., Anel, E., Martinez, A.F., Boixo, C.J., Kaabi, M., Herraez, P., and Paz, P. Effect of postmortem interval in quality of epididymal spermatozoa in Iberian Red Deer (Cervus elaphus hispanicus). Theriogenology 2002; 57: 577
- Attia, K.A., Zaki, A.A., Eilts, B.E, Paccamonti, D.L., Hosgood, G., Dietrich, M.A., Horohow, D.W., And Blouin, D.C. Anti-sperm antibodies and seminal characteristics after testicular biopsy or epididymal aspiration in dogs. Theriogenology 2000; 53:1355-1363.
- Axnér, E., Linde-Forsberg, G., Einarsson, S. Morphology and motility of spermatozoa from different regions of epididymal duct in the domestic cat. Theriogenology 1999; 52: 767-778
- Barrios, DA. Evaluación de la calidad y capacidad fecundante de espermatozoides de la cola del epidídimo de toros Post-Mortem. IX Congreso venezolano de Producción e Industria Animal. Valera 2002.
- Bartels, P., Lubbe, K., Killian, I., Friedmann, Y., Van Dyk, G. and Mortimer, D. In vitro maturation and fertilization of Lion (Pantera leo) oocytes using frozen-thawed epididymal spermatozoa recovered by cauda epididymectomy of an inmobilized Lion. Theriogenology 2000; 53: 325
- Brooke, Fahrig, 2003: Cryopreservation by pellet freezing of epididymal and ejaculated spermatozoa from male dogs. M.Sc. Thesis. Louisiana State University. [En línea]. URL: http://etd.lsu.edu:8085/docs/available/etd-0405103-193813/unrestricted/BFahrigThesis.pdf
- Brooks, D.E. Epididymal functions and their hormonal regulation. Australian Journal Biol Sci. 1983; 36(3): 205-21.
- Carr, D.W., Acott, T.S. Inhibition of bovine spermatozoa by caudal epididymal fluid: I. Studies of a sperm motility quiescence factor. Biol Reprod. 1984 May;30(4):913-25.
- Chulavatnatol, M. Motility initiation of quiescent spermatozoa from rat caudal epididymis: effects of pH, viscosity, osmolality and inhibitors. Journal Andrology. 1982; 5(4): 425-36.
- Chye Ng, S., Martelli, P., Liow, S.L., Herbert, S. and Oh, S.H. Intracytoplasmic injection of frozen-thawed epididymal spermatozoa in a nonhuman primate model, the Cynomolgus Monkey (Macaca fascicularis). Theriogenology 2002; 58: 1385-1397
- Cisale, H., 2003: [Comunicación Personal] Laboratorio de Espermatología, Facultad de Ciencias Veterinarias de la Universidad de Buenos Aires [Argentina]. E-mail: cisale@fvet.uba.ar
- De Pauw, I.M.C., Van Soom, A., Mintiens, K., Verberckmoes, S., Kruif, A. In vitro survival of bovine spermatozoa stored at room temperature under epididymal conditions. Theriogenology 2003; 59: 1093-1107.
- Gerber, D., Irons, P., Herold, F.C., and Cooper, D. Quality and freezability of epididymal sperm from African Buffalo (Syncerus caffer) following prolonged exposure to ambient temperatures or delayed flushing. Theriogenology 2002; 57: 582
- Hafez, E.S.E. 1996. Anatomía Funcional de la Reproducción. En: Reproducción e Inseminación Artificial en Animales. Interamericana. 6ª edición, Pág. 8-9
- Hewitt, D.A., Leahy, R., Sheldon, I.M., and England, G.C.W. Cryopreservation of epididymal dog sperm. Animal Reproduction Science 2001; 67: 101.
- Hishinuma, M., Susuki, K., and Sekine, J. Recovery and cryopreservation of Sika Deer (Cervus nippon) spermatozoa from epididymes stored at 4oC. Theriogenology 2003; 59: 813
- Kashiwazaki, N., Nakatsukasa, E., Katsumi, A., Tachi, C., Shino, M., 2001: Freezing epididymal spermatozoa of Japanese Serow (Capricornis Crispus) in liquid nitrogen. Journal of Reproduction and Development, Vol. 47, No. 6, 359-363 [En línea] URL: http://www.nirs.go.jp/ENG/nirs2002_e.pdf
- Kikuchi, K., Nagai, T., Kashiwazaki, N., Ikeda, H., Noguchi, J., Shimada, A., Soloy, E., and Kaneko, H. Cryopreservation and ensuing in vitro fertilization ability of boar spermatozoa from epididymides stored at 4oC. Theriogenology 1998; 50: 615-623
- Kilian, I, Lubbe K., Bartels, P., Friedmann, Y., And Denniston, R.S. Evaluating epididymal sperm of African wild ruminants: longevity when stored at 4oC and post-thaw viability following cryopreservation. Theriogenology 2000; 53: 336
- Kundu, C.N., Chakrabarty, J., Dutta, P., Bhattacharyya, D., Ghosh, A., Majumder, G.C. Effect of dextrans on cryopreservation of goat cauda epididymal spermatozoa using a chemically defined medium. Reproduction. 2002;123(6):907-13.
- Kundu, C.N., Das, K. y Majumder, G.C. Effect of amino acids on goat cauda epididymal sperm cryopreservation using a chemically defined model system. Cryobiology 2001; 42(1): 21-27
- Leibo P.S., Picton H.M., Gosden R.G., 2000: Cryopreservation of Human Spermatozoa. Human Reproduction [En línea] URL: http://staging.mc.vanderbilt.edu/vicc/userfiles/transgenic/sperm_cryo_service_form.pdf
- Leibo, S.P. and Songsasen, N. Cryopreservation of gametes and embryos of non-domestic species. Theriogenology 2002; 57: 303-326
- Lubbe, K., Smith, R.L., Barrels, P., And Godke, R.A. Freezing epididymal sperm from White Rhinoceros (Ceratotherium simum) Treated whit different cryodiluents. Theriogenology 1999; 51: 288
- Luvoni, G.C., Ruggiero, C., Marinoni, G., and Kalchschmidt, E. Effect of taurine-containing diluent for cryopreservation of domestic cat epididymal spermatozoa. Theriogenology 2002; 57: 466
- Mariani, A.R., Billi, A.M., 2000: Anatomia Microscópica. Istituto Di Anatomia Umana Normale. Universita' Degli Studi Di Bologna. [En línea] URL: http://www.biocfarm.unibo.it/aunmicro/genmas/genitalemaschileindice.html
- Nakastsukasa, E., Inomata, T., Ikeda, T., Shino, M., Kashiwazaki, N. Generation of live rat offspring by intrauterine insemination whit epididymal spermatozoa cryopreserved at -196oC. Reproduction-Cambridge 2001: 122: 463-467
- Morton, BE., Fraser, CF., Sagadraca, R. Inhibition of sperm dilution damage by purified factors from hamster caudal epididymal plasma and by defined diluents. Fertil Steril. 1979; 32(1): 107-14.
- Okamoto, M., Nakagata, N., Ueda, O., Kamada, N. Suzuki, H., 1999: Cryopreservation of spermatozoa for strain maintenance of gene disrupted mice. [En línea] URL: http://www.nirs.go.jp/report/nene/H9/3_5_2.html
- Perez-Garnelo, S.S., Borque, C., Delclaux, M., Talavera, C., Lopez, M., and De La Fuente, J. Post-thaw seminal quality of spermatozoa obtained from the epididymis in Dorcas Gacelle (Gazella dorcas neglecta). Theriogenology 2002; 57: 589.
- Reyes-Moreno, C., Boilard, M., Sullivan, R., Sirard, MA. Characterization and identification of epididymal factors that protect ejaculated bovine sperm during in vitro storage. Biology of Reproduction 2002; 66: 159-166
- Rodríguez, J., Madrid-Bury, N., Urdaneta, A., Aranguren, J., Quintero, A. Análisis morfométrico del epidídimo en toros jóvenes mestizos 5/8 Holstein y 5/8 Pardo Suizo con testículos pequeños. Revista Científica, FCV-LUZ, 2000; Vol. 10 (6), 458-467
- Sanchez-Partida, L.G., Setchell, B.P., Maxwell, W.M. Epididymal compounds and antioxidants in diluents for the frozen storage of ram spermatozoa. Reproduction Fertil Dev. 1997; 9(7): 689-96.
- Schlegel P.N., 1999: Testicular Sperm Extraction: Microdissection Improves Sperm Yield With Minimal Tissue Excision. Human Reproduction, 14:131-135 [En línea] URL:http://www.maleinfertility.org
- Sisson, S. 1993. Sistema urogenital de los rumiantes. En: Sisson y Grossman: Anatomía de los Animales Domésticos. Salvat, 5ª Edición, Vol. 1, pag. 1043-1044
- Sztein, J.M., Farley, J., Young, A., Mobraaten, L.E., 1997: Motility of cryopreserved mouse spermatozoa affected by temperature of collection and rate of thawing. Cryobiology 35: 46-52. [En línea] URL:http://www.jax.org/cryo/media.html
- Wrobel, K., Dellmann, D. Sistema Reproductor Masculino. En: Histología Veterinaria de D. Dellmann. 2ª Ed. Acribia. Zaragoza 1993: 245-247
- Yu, I. and Leibo, S.P. Recovery of motile membrane-intact spermatozoa from canine epididymides stored for 8 days at 4oC. Theriogenology 2002; 57: 1179-1190.
Autores:
Laboratorios Carval
Recomendar
Comentar
Compartir
Caminos Verdes
26 de febrero de 2008
Dr. Ramiro Martínez, yo estoy interesado en sus resultados. gracias de antemano por la respuesta.
Recomendar
Responder
Caminos Verdes
18 de enero de 2008
Dr. Juan Carlos Franco Ayala: felicitaciones, qué agradable lectura y qué alegría ver estos niveles de profesionalismo en nuestro país.
Recomendar
Responder
8 de enero de 2016
cordiales saludos, os agradezco mucho vuestro aporte, pero estoy interesado en algo especifico.
podría tener la amabilidad de enviarme el articulo (Luvoni, G.C., Ruggiero, C., Marinoni, G., and Kalchschmidt, E. Effect of taurine-containing diluent for cryopreservation of domestic cat epididymal spermatozoa. Theriogenology 2002; 57: 466) o enviarme el DOI, lo necesito con urgencia. De antemano muchisimas gracias por este articulo recopilatorio y estaría muy complacido si pudiese ayudarme con mi solicitud.
Recomendar
Responder
26 de marzo de 2013
mis muy cordiales saludos al Dr, Juan Carlos Franco Ayala y a los compañeros del foro de engormix. y agradeciéndole por el trabajo que se encuentra que es de gran interés para mis investigaciones mucho éxitos doctor
Recomendar
Responder
5 de junio de 2009
Hola nathalie espero que te encuentres super bien bueno acabo de leer tu mensaje donde indicas que de tesis deceas hacer lo que es un congelamiento de semen y es muy interesante y muy bueno pero creo que seria mas interesante si lo hacer con embriones ahora mismo yo estoy trabajando aca en el peru con tramsplante de embriones y la verdad es que no ha nay nada imposible solo necesita un poquito de dedicacion me gustaria que nos contactasemos par haci relacionar ideas y abanses biotecnologicos sobre colombia y peru espero que me respondas gracias ha por sierto tengo 23 años mi correo es jhoseph_td@hotmail.com
Recomendar
Responder
6 de enero de 2009
Un cordial Dr Juan Carlos, soy estudiante de zootecnia de septimo semestre y estuve leyendo su articulo y lo felicito la verdad es que la experiencia que ha tenido en el transcurso de su carrera es digno de admirar. Deseo comentarle que siempre me llamado la atención la parte de biotecnologia reproductiva especialmente andrología en bovinos y me gustaría especializarme en un futuro en aquello ya que vivo en un sector ganadero tanto de leche como carne, ahora estoy en la tarea de buscar el tema de mi tesis y como apción tengo la criopreservación de semen pero no sé como cuadrar el titulo y con que ganado en especial manejarlo, le agradeceria mucho sus aportes.... gracias por su atención prestada ... exitos
Cordialmente Nataly Hortua
Recomendar
Responder
Sincrovac
26 de febrero de 2008
Hola te felicito por tu trabajo, la verdad es muy interesante pero quisiera saber algunos datos en el resultado de las pajuelas: porque el vigor del zoide despues de una extracción por vagina artificial es diferente al de una electroeyaculación, mi pregunta es que calidad de vigor espermático tiene un eyaculado al ser extraido por punción y dos Tienes resultados de fertilidad?.
Espero tu respuesta gracias.
Recomendar
Responder
21 de enero de 2008
LES RUEGO ME DISCULPEN LO CORTO DEL MENSAJE Y LOS ERRORES ORTOGRAFICOS. LES CONTINUO COMENTANDO. LA EXTRACCIÓN ESPERMÁTICA SE OBTUVO POR LAVADO DE LA COLA DE EPIDIDIMO. EL TRABAJO DE PRE-GRADO FUE REALIZADO BAJO LA DIRECCIÓN DEL M.V AGUSTIN GONGORA, Y LOS ESTUDIANTES DE MVZ, SANTOS FELIO CORTES Y RAMIRO MARTINEZ.. TENEMOS LOS RESULTADOS.. EL ESTUDIO FUE PEQUEÑO. QUIEN ESTÉ INTERESADO POR ELLO FAVOR POR MEDIO DEL E-MAIL. GRACIAS
Recomendar
Responder
21 de enero de 2008
BUENOS DÍAS. DEL AÑO 2002 AL 2003, JUNTO CON MI COLEGA Y COMPADRE, SANTOS FELIO CORTES, Y DIRIGIDOS BAJO LA DIRECCIÓN DEL DOCTOR AGUSTÍN GONGORA (DOCENTE DE LA UNIVERSIDAD DE LOS LLANOS), EN VILLAVICENCIO, COLOMBIA, LOGRAMOS LA RECUPERACIÓN DE ESPERMATOZOIDES DE LA COLA DEL EPIDIDIMO DE BOVINOS. SE RECUPERARON 12 HORAS POSTMORTEN, UNA VEZ SACRIFICADO EL ANIMAL LOS TESTÍCULOS SE CONSERVARON EN UNA CABA DE ICOPOR REFRIGERADA. LOS RESULTADOS FUERON SORPRENDENTES Y ESPERANZADORES, EL MAYOR INCONVENIENTE QUE SE OBTUVO FUE UNA MORTALIDAD DEL 50% POS CONGELACIÓN. SE EVALUÓ EN FRESCO Y POS CONGELADO, Y SE REALIZÓ UN TEST DE RESISTENCIA HIPOSMOTICO.. SI LES INTERESA EL RESULTADO DE ESTE TRABAJO DE PRE-GRADO ...LES COMENTAARE CON MAS DETALLES POR ESTE MEDIO O CON EL DOCTOR AGUSTÍN GONGORA, EN VILLAVICENCIO META.
Recomendar
Responder
19 de enero de 2008
Me da mucha alegría, que los trabajos del Dr. Barrios acá en Venezuela hayan tenido seguimiento. El tema es extraordinariamente apasionante, Felicitaciones.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.