INTRODUCCIÓN
La anaplasmosis bovina es una enfermedad infecciosa no contagiosa producida por la rickettsia Anaplas- ma marginale y transmitida por artrópodos hematófagos y por utensilios punzocortantes del hombre. La infección se presenta como una anemia hemolítica severa en animales susceptibles introducidos a zonas endémicas. En México, estas áreas incluyen los trópicos y subtrópicos del Sureste, del Pacífico y del Golfo de México en donde estudios serológicos y moleculares señalan una prevalencia superior al 50% (Fragoso, 1991, Figueroa et al., 1993; Cossío et al., 1997). Asimismo, se le ha responsabilizado como la causa de hasta el 26% de la mortalidad en sementales y vaquillas asegurados e introducidos a zonas endémicas en México (Rodríguez et al., 1999), por lo que la anaplasmosis bovina es considerada como un importante obstáculo para el desarrollo de la ganadería mexicana.
En el bovino, Anaplasma marginale infecta eritrocitos maduros y células endoteliales (Carreño et al., 2007); las garrapatas se infectan al alimentarse en animales portadores de la rickettsia (Futse et al.,2003). En México se considera que los principales vectores biológicos de Anaplasma marginale son las garrapatas Boo- philus y Dermacentor (Piercy, 1956; Solis, 1991; Wagner et al., 1991). La transmisión de A. marginale por garrapatas es de tipo biológica y ocurre de manera intraestadial (dentro del mismo estadio) llevada a cabo por los machos adultos de las garrapatas y la transestadial (de un estadio a otro) (Kocan et al., 2000). La transmisión interestadial de A. marginale se ha documentado ampliamente en garrapatas Dermacentor (Ko- can et al.,1980; Stiller et al., 1989) y más recientemente en Boophilus microplus (Futse et al., 2003; Mora et al., 2007). En México nosotros hemos documentado la transmisión intraestadial y transestadial de dos cepas mexicanas de A. marginale (Aguascalientes y Yucatán) de alta y baja virulencia respectivamente por la garrapata Boophilus al alimentar larvas y ninfas en bovinos infectados, con el subsiguiente cambio de las ninfas y las garrapatas adultas, después de la muda, a bovinos susceptibles (Mora et al., 2007).
La importancia de Boophilus como transmisora de A. marginale al ser de un solo hospedador, se ha minimi- zado, ya que una vez que la larva infesta al bovino, pasa toda su vida en el mismo animal y sólo lo abandona cuando la hembra ingurgitada se desprende para ovipositar y morir. Así, en México se considera sólo al adulto macho de Boophilus como el principal vector de la anaplasmosis bovina en ausencia de Dermacentor (Ueti et al., 2009).
Debido a la aparente dificultad biológica que tiene el macho de la garrapata Boophilus para transmitir la ana- plasmosis y la presencia de brotes de anaplasmosis al inicio de la temporada de garrapatas, se ha postulado la posibilidad de la transmisión transovárica de A. marginale dentro de las garrapatas (Piercy, 1956); Shi- mada y colaboradores en 2004 por ejemplo, observaron lotes de larvas de Boophilus colectadas en campos de Brasil durante los primeros cinco meses del año positivos a A. marginale (10% y 40% por PCR), asimismo larvas obtenidas de hembras ingurgitadas mantenidas a 18 °C, también fueron positivas a A. marginale (10% y 30% por PCR); en contraste, larvas de hembras ingurgitadas mantenidas a 28 °C no presentaron ADN de A. marginale. Los autores hipotetizan que A. marginale requiere mayor tiempo para colonizar los ovarios, y que la incubación a 28 °C no lo permite, sin embargo, la incubación a 18 °C prolonga la oviposición y la rickettsia podría colonizar los ovarios particularmente en las últimas puestas y de esta forma sobrevivir durante el invierno en algunas zonas. A pesar de estos reportes, nadie ha logrado transmitir la anaplasmosis a partir de larvas provenientes de hembras inguritadas de Boophilus, alimentadas sobre bovinos infectados con Anaplasma marginale.
OBJETIVO
En el presente trabajo, nos planteamos como objetivo evaluar la posible transmisión transovárica de Ana- plasma marginale en garrapatas Boophilus microplus y su papel como transmisoras de la anaplasmosis en bovinos susceptibles.
MATERIALES Y MÉTODOS
Para la evaluación de la trasmisión de la rickettsia se usó la cepa mexicana Tlapacoyan 2 de A. marginale, colectada de un brote en el estado de Veracruz y caracterizada respecto de la región variable del gen msp1α (Jiménez-Ocampo et al., 2012). Se emplearon bovinos de 12 meses, libres de tuberculosis, brucelosis, Babe- sia y Anaplasma adquiridos en una zona de baja endemicidad. Para este trabajo se usó la cepa Media Joya de garrapatas B. microplus, susceptible a todos los ixodicidas y que se mantiene rutinariamente en animales libres de enfermedades transmitidas por garrapatas.
Un primer bovino (027) se inoculó con sangre infectada y criopreservada con la cepa Tlapacoyan 2, el animal desarrolló un cuadro clínico que fue controlado sin necesidad de quimioterapia. El animal permaneció como portador durante 15 meses antes de ser infestado con larvas de Boophilus microplus. Larvas provenientes de 1 g de huevos de garrapatas se sobrepusieron en el bovino 027 para que completaran su ciclo y adquierieran la infección con la rickettsia. Durante los días de ingurgitación se colectaron las hembras repletas y se formaron 2 grupos que fueron incubadas, un grupo a 18 °C y a 28 °C el segundo grupo, ambos se mantuvieron en cámara húmeda. Una vez que se completó la oviposición las larvas se mantuvieron a temperatura ambiente para completar la eclosión.
Cuatro bovinos intactos (dos por cada lote) se infestaron con 0.25 g de larvas incubadas a 18 °C (bovinos 1756 y 1776) o a 28° (bovinos 6963 y 6964). Los animales fueron monitoreados clinicamente. Sangre para frotis y suero se tomaron semanalmente para determinar la presencia de la rickettsia en sangre mediante frotis sanguíneo o anticuerpos específicos mediante ELISA indirecta (Rodríguez et al., 1999).
Muestras de sangre de los animales involucrados fueron ensayadas por PCR para la región variable del gen msp1α para mostrar la consistencia entre la cepa que reciben los animales y la que fue transmitida por las garrapatas (Rodríguez et al., 1999; Torioni et al, 1998).
RESULTADOS
El bovino 027 recibió una dosis infectante (8.2 x 109 eritrocitos infectados) con la cepa mexicana Tlapaco- yan 2. Este animal apareció positivo a froitis el día 25 posinfección. Durante el proceso clínico, se determi- nó una rickettsemia máxima de 3.2 % y sufrió una pérdida máxima de paquete celular aglomerado de 50%. El animal contuvo el cuadro clínico de manera espontánea y no requirió quimioterapia permaneciendo como portador, durante ese tiempo se verificó la presencia de A. marginale por PCR específico para Msp5, y se infestó con larvas eclosionadas de 1 g de huevos de Boophilus microplus, cepa Media Joya. Las hembras ingurgitadas se dividieron en dos lotes que se incubaron a 18 °C y 28 °C de acuerdo a lo descrito arriba.
Las garrapatas alimentadas en el bovino 027 e incubadas a 18° C tardaron más de 30 días a partir de su recolección para completar el proceso de oviposición, mientras que las garrapatas incubadas a 28°C, lo completaron en aproximadamente 15 días, que es lo normal bajo esta temperatura.
Larvas maduras provenientes de 0.25 g de masa ovigera de garrapatas que ovipositaron a 18 °C , se infes- taron sobre los bovinos 1756 y 1776, o a 28°C en los bovinos 6963 y 6964. Estos bovinos fueron negativos a A. marginale por serología y PCR previo a la infestación con las larvas. Al seguimiento clínico, ningún animal presentó signos clínicos o presencia de eritrocitos infectados observables al microscopio por las siguientes 8 semanas, tiempo que se consideró suficiente para que desarrollaran la infección. En este mo- mento los animales fueron esplenectomizados para inmunodeprimirlos y se continuó el monitoreo.
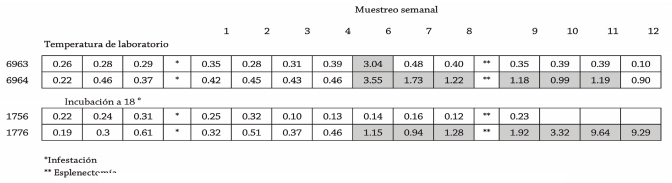
Serologicamente, los 4 animales desarrollaron, de manera intermitente títulos de IgG especícos contra A. marginale (Cuadro 1). Sólo el animal 6964 (larvas de oviposición a 28° C ), presentó rickettsemia de 7.5% 2 días pos-esplenectomía. El animal 6963, no presentó signos clínicos o eritrocitos infectados a frotis y se siguió monitoreando.
De los animales infestados con larvas de garrapatas ovipositadas a 18°C, el 1776 desarrolló anticuerpos es- pecíficos de manera más constante mientras que el bovino 1756 fue negativo hasta que murió (9a semana) de causas ajenas al experimento
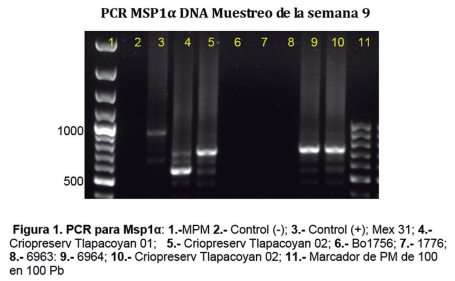
Cuadro 1. Índice de positividad de sueros de bovinos infestados con larvas de Boophilus microplus proce- dentes de garrapatas alimentadas en un bovino portador de Anaplasma marginale.
Al PCR específico para la región variable de msp1α, se observa que el amplicón para la sangre de la cual se tomó para infectar al bovino 027 (carril 5, Figura 1) tiene un tamaño aproximado de 750 pares de bases (pb) igual que la sangre del bovino 6964 (carril 9 que fue el único en presentar la infección de manera patente) en comparación con aproximadamente con un amplicón de aproximadamente 600 pb para la misma región del gen msp1α del aislado Tlapacoyan 01. Asimismo, se observan negativos los bovinos 1756, 1776 y 6963 en el muestreo correspondiente a la 9° semana pos infestación.
DISCUSIÓN
Aún cuando se ha postulado que no existe la transmisión transovárica de Anaplasma marginale por garra- patas del género Boophilus microplus (Wagner et al., 1991), la presencia de ADN de la rickettsia en larvas de la garrapata implica que esta posibilidad existe. En el presente trabajo, mediante la infección con una cepa caracterizada de la rickettsia de un animal portador se muestra que es posible que larvas provenientes de garrapatas libres de la infección alimentadas en él, pueden transmitir la infección por Anaplasma a bovinos libres a la rickettsia. Y contrario a lo esperado, se infectó un bovino infestado con larvas de hembras incuba- das durante la oviposición a 28 °C y no con larvas de hembras que ovipositaron a 18 °C. La razón para que la transmisión se diera en larvas que fueran ovopositadas a una temperatura más alta no la conocemos pero podemos hipotetizar que este fenómeno ocurre de manera poco frecuente a cualquier temperatura. Muy poco se sabe del ciclo de vida de A. marginale en la garrapata, más allá de lo que se ha descrito en la litera- tura para Dermacentor y menos para Boophilus. Los resultados presentados, aunque no contundentes tienen que ser corroborados con más estudios ya que implican que las medidas para el control de la anaplasmosis y para las garrapatas tendrán que tomar en cuenta la posibilidad de la presencia de brotes de anaplasmosis en zonas de inestabilidad enzootica para Boophilus microplus.
CONCLUSIÓN
En este trabajo se demuestra la transmisión transovárica de Anaplasma marginale en garrapatas Boophilus microplus.
LITERATURA CITADA
Carreño AD, Alleman AR, Barbet AF, Palmer GH, Noh SM and Johnson CM, 2007: In vivo endotelial cell infection by Anaplasma marginale. Vet Pathol 44: 116-118.
Cossio BR, Rodríguez SD, García OMA, García TD and Aboytes TR, 1997: Bovine anaplasmosis prevalence in northern Veracruz state, Mexico. Prev Vet Med. 32 (3-4): 165-170.
Figueroa JV, Alvarez JA, Vega CA and Buening GM, 1993: Use of multiplex polymerase chain reaction-ba- sed assay to conduct epidemiological studies on bovine hemoparasites in Mexico. Rev Elev Med Vet Pays Trop., 46 (1-2): 71-75.
Fragoso SH, 1991: La anaplasmosis bovina en México. Garrapatas y enfermedades que transmiten. Segun- do Seminario Internacional de parasitología Animal: 153-160.
Futse JE, Ueti MW, Knowles DP Jr, Palmer GH. Transmission of Anaplasma marginale by Boophilus micro- plus: retention of vector competence in the absence of vector-pathogen interaction. J Clin Micro- biol. 2003;41(8):3829-34.
Jiménez Ocampo R, Vega y Murguía CA, Oviedo Ortega N., Rojas Ramírez EE., García Ortiz MA., Preciado de la Torre JF., Rosario Cruz R., Domínguez García DI.,. Rodríguez Camarillo SD. 2012. Diversi- dad genética de la región variable de los genes msp1α y msp4 en cepas de Anaplasmamarginale de México. Rev. Mex. Cienc. Pecu. 3(3): 373-387.
Kocan MK, Blouin EF and Barbet AF, 2000: Anaplasmosis control: past, present, and future. Ann. N.Y. Acad. Sci. 916: 501-509.
Mora CNN, Pérez MR, García OMA, Rojas REE, Preciado de la TJF, Hernández OR y Rodríguez SD, 2007: Evaluación de la transmisión de dos cepas mexicanas de Anaplasma marginale por la garrapata Boo- philus microplus. XXXI Congreso Nacional De Buiatria. Xiii Congreso Latiniamericano De Buiatria. Dr. Jorge Ávila: 241 – 245.
Piercy PL, 1956: Transmission of anaplasmosis. Ann. N.Y. Acad. Sci. 64: 40-48.
Rodríguez CSD, García OM.A, Cantó AGJ, Hernández SG, Santos CN y Aboytes TR, 1999: Ensayo de un inmunógeno experimental inactivado contra Anaplasma marginale. Tec. Pecu. Méx., 37 (1): 1-12.
Scoles GA, Miller JA, Foil LD. Comparison of the efficiency of biological transmission of Anaplasma margi- nale (Rickettsiales: Anaplasmataceae) by Dermacentor andersoni Stiles (Acari: Ixodidae) with me- chanical transmission by the horse fly, Tabanus fuscicostatus Hine (Diptera: Muscidae). J Med Entomol. 2008 Jan;45(1):109-114.
Shimada MK, Yamamura MH, Kawasaki PM, Tamekuni K, Igarashi M, Vidotto O and Vidotto MC, 2004: Detection Of Anaplasma marginale DNA in larvae of Boophilus microplusmticks by polimerase chain reaction. Ann NY Acad Sci 1026: 95 – 102.
Solís SS, 19991: Epidemiología de garrapatas Boophilus y Amblyoma en México. Garrapatas y enfermedades que transmiten. Segundo Seminario Internacional de parasitología Animal: 19-30.
Stiller D, Kocan KM, Edwards W, Ewing SA and Barron JA, 1989: Detection of colonies of Anaplasma mar- ginale in salivary glands of three Dermacentor spp infected as nymphs or adults. Am J Vet Res. 50(8):1381-1385.
Ueti MW, Knowles DP, Davitt CM, Scoles GA, Baszler TV, Palmer GH. Quantitative differences in salivary pathogen load during tick transmission underlie strain-specific variation in transmission efficien- cy of Anaplasma marginale. Infect Immun. 2009; 77(1):70-75.
Wagner GG, Cruz D, Holman PJ and Waghela S.1991: Epidemiology, diagnosis and control alternatives for anaplasmosis. Garrapatas y enfermedades que transmiten. Segundo Seminario Internacional de Parasitología Animal: 161-171.













.jpg&w=3840&q=75)