Introducción
Los nematodos gastrointestinales (NGI) de bovinos constituyen una amenaza permanente para los ganaderos, dadas las pérdidas económicas que estos parásitos ocasionan en los sistemas de producción ganaderos (1). El uso de compuestos químicos ha sido la base para el control de los parásitos del ganado. Sin embargo, el uso prolongado e inapropiado de antihelmínticos químicos ha traído consigo problemas como: desarrollo de resistencia de estos endoparásitos a las moléculas químicas empleadas, impacto ambiental negativo y residuos de antiparasitarios en los alimentos derivados de los bovinos (2). Por tales razones, este tipo de control es insostenible ambiental, económica y socialmente.
La problemática derivada del control químico impuso la necesidad de cambiar el paradigma del control convencional por enfoques y prácticas de control sustentable, para lo cual el desarrollo y la aplicación de estrategias no químicas de control constituye la principal recomendación en la actualidad, en el contexto mundial (3). Hoy en día, la investigación en el mundo está focalizada en el desarrollo de estrategias basadas en el uso de plantas bioactivas (fitoterapia), el uso de animales resistentes o resilentes a los parásitos (resistencia genética) y el control biológico, mediante el empleo de hongos nematófagos (4).
El uso de hongos nematófagos se considera la alternativa más promisoria para el control de NGI en rumiantes (5,6), debido a que poseen algunas ventajas, entre las que se destacan: ciclo de vida corto; alta capacidad reproductiva; producción de esporas de resistencia y sobrevivencia en la fase saprofítica en ausencia de hospedadores; no son patógenos para los seres humanos y reducen las poblaciones parasitarias, en vez de eliminarlas, lo cual constituye un estímulo inmunológico permanente en los animales.
Estos microrganismos rompen el ciclo de vida de los NGI al atrapar los estados infectivos de estos parásitos en las heces de los bovinos o en el suelo (7), por medio de trampas de captura para posteriormente destruirlos y nutrirse de sus tejidos (8). De esta manera, disminuyen las cargas de larvas L3 en las praderas y, por tanto, reducen la contaminación y la infección de las pasturas y de los animales durante el pastoreo (9).
El objetivo del presente estudio fue aislar, identificar y determinar la capacidad predadora in vitro de dos hongos nematófagos nativos de Colombia sobre las larvas infectivas L3 de nematodos gastrointestinales.
Materiales y métodos
Aislamiento e identificación de hongos nematófagos
Se colectaron 60 muestras de heces de bovinos y suelos de fincas ubicadas en pisos térmicos frío, medio y cálido de Cundinamarca tanto en época de verano como de lluvias. La fase experimental se llevó a cabo en el Laboratorio del Centro de Investigación en Salud Animal de la Corporación Colombiana de Investigación Agropecuaria (Corpoica), Bogotá. Se obtuvieron larvas L3 de NGI mediante coprocultivos de las heces colectadas, con base en la metodología del Manual of Veterinary Parasitological Laboratory Techniques (10).
Se aislaron hongos nematófagos a partir de cultivos de 60 muestras de suelo obtenidas a una profundidad de 5 a 10 cm. De cada muestra se hicieron tres siembras en cajas de Petri con agar-agua mediante la técnica del espolvoreo, y tres días más tarde se agregaron larvas para estimular el desarrollo de los hongos. Los cultivos se incubaron a temperatura (28 ºC en promedio) y luz ambiente durante 30 días, y se revisaba cada dos días para seleccionar los hongos de interés.
Previa selección de los hongos que desarrollaban estructuras de captura de larvas en las muestras de suelo, fueron aislados en papa dextrosa agar (PDA) y harina de maíz (AHM) para asegurar cultivos puros. La identificación de los hongos aislados se hizo mediante las características morfológicas y morfométricas (11) de los hongos y por los tipos de estructuras de captura que exhibieron.
Evaluación de la capacidad predadora de los aislamientos
Para evaluar la capacidad predadora in vitro de los hongos se sembraron 1 × 106 conidios o clamidosporas de A. oligospora y A. musiformis, respectivamente, y 100 larvas L3 de bovinos en cajas de Petri con agar agua, en cinco repeticiones por aislamiento, y se incubaron a temperatura ambiente. Se contaron larvas atrapadas, libres, enroscadas y muertas durante los días cuarto y quinto de incubación por medio de un microscopio óptico invertido a 10X y 40X.
La capacidad predadora de los hongos aislados se evaluó mediante la fórmula (4):
Donde: A = porcentaje de captura, x = número de larvas atrapadas, y = número de larvas libres, w = número de larvas enroscadas, z = número de larvas muertas.
Análisis estadístico
Se realizó un análisis de varianza (Anova) de una vía, en la que cada hongo depredador aislado fue un tratamiento, cada uno con cinco repeticiones, utilizando los resultados obtenidos por la fórmula matemática indicada, y se estimó la diferencia estadística mediante el test Tukey de comparación de medias con nivel de confianza de 95%.
Resultados
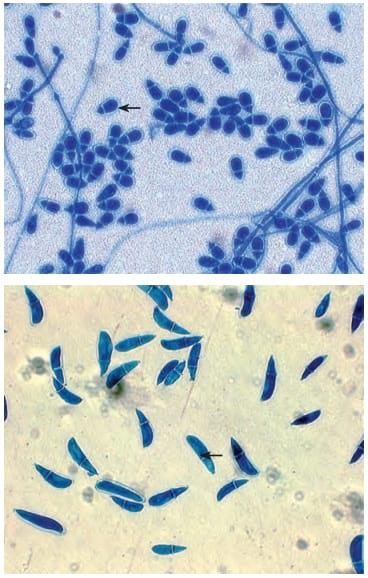
Se identificaron dos especies de hongos nematofagos, correspondientes a A. oligospora, con tres aislamientos (L1, XVIII y XXI), y A. musiformis (aislamiento XXIV), provenientes de suelos de fincas ubicadas en los municipios de Sibaté, Funza y Tenjo, respectivamente, y uno perteneciente a A. musiformis (aislamiento XXIV), de una finca ubicada en el municipio de Viotá. Las estructuras morfológicas observadas fueron conidióforos erectos y simples, los cuales proliferaron repetitivamente generando varios racimos de conidios ovoidales divididos en la parte central, formando las células proximal y distal, con cabezas conidió- genas que agrupaban en promedio 10 conidios (figura 1).
Figura 1. Evaluación morfológica de los conidios (flechas) para hongos nematófagos A. oligospora (arriba) y A. musiformis (abajo) (tinción azul de lactofenol-10X)
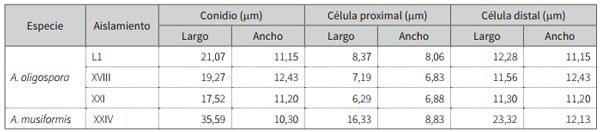
A. musiformis se caracterizó por desarrollar conidióforos erectos y simples, los cuales tenían pequeñas ramas terminales con un único conidio, lo cual les daba la apariencia de candelabros, y agruparon en promedio 10 conidios por conidióforo; estos tenían forma elipsoidal alargada y semicurvas, que estaban dividas por un septo, lo que evidencia así dos células, una proximal y otra distal, esta última de mayor tamaño, cuyo tamaño fue determinado de colonias establecidas en agar PDA (tabla 1).
Tabla 1. Valores promedio de conidios, célula proximal y célula distal de A. oligospora y A. musiformis aislados
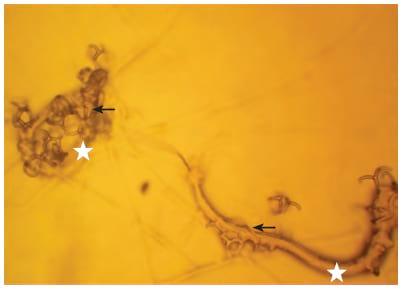
Las estructuras de atrapamiento desarrolladas por A. musiformis fueron redes adhesivas tridimensionales (figura 2). Otra característica importante desarrollada por este hongo fue la rápida y abundante formación de clamidosporas en los tres medios de cultivos utilizados (AA, AHM, PDA). Estas estructuras reproductivas se formaban al poco tiempo de sembrados, y fue además evidente la gran producción de dichas estructuras a lo largo de los cuerpos miceliales.
Figura 2. Larvas atrapadas de nematodos gastrointestinales (estrella) en redes adhesivas tridimensionales (flechas) de A. musiformis
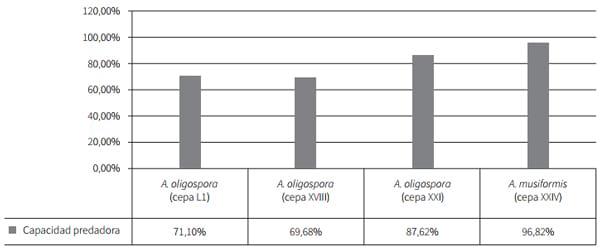
De los cuatro aislamientos evaluados, el hongo que demostró mayor actividad predadora fue A. musiformis con una capacidad de atrapamiento promedio de 96,82%, mientras que de los aislados del hongo A. oligospora el que demostró mayor capacidad de captura fue el aislamiento XXI, con un promedio de captura de larvas de 87,62%, seguido del XVIII, con 71,1% y, por último, el aislamiento L1 fue el que menor actividad predadora tuvo, con 69,68% en promedio (figura 3).
Figura 3. Actividad predadora in vitro de los hongos aislados, sembrados a la concentración de 1 × 106 en cinco repeticiones realizadas
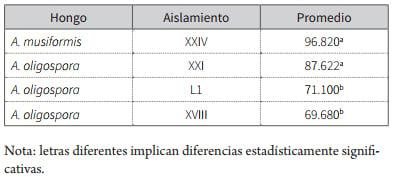
El análisis estadístico (Anova) demostró la existencia de diferencias significativas entre los aislamientos; por tal motivo se procedió con el test Tukey para comparación de medias, con el cual se determinó que estadísticamente los hongos A. musiformis (XXIV) y A. oligospora (XXI) son significativamente más activos contra larvas L3 de nematodos gastrointestinales bovinos respecto a los otros aislamientos evaluados, los aislamientos L1 y XVII de A. oligospora menos predadores (tabla 2).
Tabla 2. Separación de las medias de Tukey de la actividad predadora de los aislamientos evaluados
Discusión
Las características morfológicas evidenciadas en los aislamientos L1, XVIII y XXI concuerdan con los datos encontrados por diversos autores que han identificado A. oligospora: conidióforos erectos y hialinos que proliferan repetitivamente. Cada una de estas proliferaciones agrupaba de 10 a 12 conidios ovoides o piriformes, con un septo medial que forma dos células, una distal y una proximal, de la cual la distal fue 1,5 a 2 veces más larga que la proximal (12-16).
Resultados registrados en la literatura internacional señalan que los principales mecanismos de atrapamiento desarrollados por el hongo A. oligospora en presencia de larvas L3 de NGI son redes tridimensionales (12,15,17-19), tal como se observó en este estudio.
Al igual que con A. oligospora, las características morfoló- gicas de A. musiformis observadas en el presente trabajo son coincidentes con lo encontrado en estudios llevados a cabo en otros países: crecimiento y extensión rápida de la colonia, conidios de 22-44 × 10-14 μm de longitud × 7,5-12,7 μm de ancho, en promedio (20-25). Así mismo, se detectó que la formación de redes tridimensionales es la principal estructura de atrapamiento de estos dos hongos, resultados coincidentes con registros internacionales (12,22,26-29).
Un estudio demostró que la capacidad predadora del hongo A. musiformis frente a NGI de pequeños rumiantes fue, en promedio, de 73,7% (22), mientras que en otro se informa que la capacidad predadora de diferentes cepas de A. musiformis es variable, pues frente a larvas de Strongyloides papillosus los porcentajes de captura fueron de 86,22, 99 y 100% (30).
En relación con el hongo A. oligospora, se conocen resultados de la capacidad predadora de este hongo, que indican una alta variabilidad en los porcentajes de atrapamiento entre diferentes cepas de esta especie (20).
Los resultados de diferentes estudios demuestran que algunas especies del género Arthrobotrys spp. podrían ser empleadas como agentes de control biológico contra NGI de bovinos, como es el caso de A. oligospora, el cual muestra porcentajes de reducción larvaria entre 70 y 90% (18). En Australia, A. oligospora demostró tener una eficiencia depredadora mayor a 90% contra larvas de NGI (19).
Al comparar la capacidad predadora de los dos hongos evaluados, diversos estudios han determinado, al igual que en este trabajo, que el hongo A. musiformis tiene mayor capacidad de atrapamiento de larvas de NGI que el hongo A. oligospora. El hongo A. musiformis tiene mayor capacidad predadora frente a larvas L3 de H. contortus con un porcentaje de captura promedio de 96,6%, mientras que el porcentaje de captura de A. oligospora varió de 9,1 a 93,4% (20). De igual forma, al enfrentar los hongos A. musiformis y A. oligospora a larvas L3 de H. contortus, se encontró una capacidad predadora de 45 y 40%, respectivamente. Aunque A. musiformis fue más eficiente, no hubo diferencias significativas estadísticamente (24). Por otro lado, existen registros de porcentajes de reducción de 97% (± 3,9%) frente a larvas L3 y de 75% (± 13,9%) frente a larvas L4 , y de 90,3%(± 8%) frente a larvas L3 y de 59,7 (± 17,5) frente a larvas L4 ,respectivamente (23).
En un estudio llevado a cabo en Costa Rica (20), cepas del A. oligospora fueron enfrentadas a NGI de ovejas y cabras, lo que dio un porcentaje máximo de atrapamiento de 96,79% y mínimo de 36,66% frente a nematodos de ovejas, y 94,28% como máximo y 61,17% mínimo frente a nematodos de cabras. En dicho estudio se evaluó también la capacidad de nueve cepas de A. musiformis; encontraron diferencias altamente significativas entre estas, con porcentajes de captura frente a nematodos de ovinos de 70,35 a 9,76% y frente a nematodos caprinos de 95,55 a 11,70%, con lo cual se concluye que puede existir variabilidad de atrapamiento entre cepas de un mismo hongo.
Tal como lo demuestran distintos estudios, existe gran variabilidad de la capacidad predadora posiblemente debida a diferentes factores ambientales como la temperatura que influye en la capacidad de predación de los hongos, pues se ha demostrado que temperaturas superiores a 20 ºC favorecen el crecimiento de los hongos, así como incide directamente en la formación o no de mecanismos de atrapamiento (31,32). De igual forma, se ha demostrado que en las regiones de alta humedad y temperatura, o regiones donde hay incrementos en la precipitación en épocas de verano o altas temperaturas, se fomenta el crecimiento de hongos nematófagos (33); es decir que la temperatura incide directamente en el desarrollo de estos hongos al igual que en el desarrollo de estados larvarios de vida libre (L3 ), inhibiendo o aumentando la capacidad de atrapamiento (34).
Las características ecológicas del suelo o del sustrato del cual se aíslan también son factores que influyen en la formación de trampas de atrapamiento y, por consiguiente, en la capacidad predadora de los hongos nematófagos, pues la deficiencia o la restricción de nutrientes pueden inducir en los hongos el cambio de estado saprofítico a parasítico (35). Por lo tanto, resulta importante aislar hongos nativos de las regiones estudiadas con el fin de encontrar mejores resultados en el desempeño antagonista (20).
La relación que llega a existir entre el hongo nematófago y la larva determina la capacidad predadora que puede haber. En general, las larvas de vida libre tienen una compleja cutícula que les ayuda a mantener la integridad morfológica; también es importante para su motilidad, ya que las protege de las condiciones medioambientales en las que se encuentran. Estas estructuras están compuestas por diversas proteínas, en especial colágenos, que determinan la conformación de dicha cutícula (36).
Por tanto, la patogenicidad de las diferentes cepas de hongos nematófagos está determinada por la acción de enzimas hidrolíticas, proteasas, colagenasas, quitinasas y otras enzimas, las cuales, se ha demostrado, están influenciadas por la expresión genética que lleva consigo cada hongo (22,37). De esta forma, se determina que la acción y expresión de las diferentes enzimas producidas por los hongos nematófagos inciden en la inmovilización, penetración y degradación de las larvas; por lo tanto, es importante tener en cuenta la variabilidad genética entre individuos de una misma especie (24).
Otro aspecto que se debe tener en cuenta respecto a la interacción hongo-nematodo es la densidad larvaria, pues se ha evidenciado que la actividad parasítica de un hongo nematófago por estados larvarios de vida libre de parásitos gastrointestinales es dependiente de la densidad poblacional (25); por lo tanto, la relación entre la cantidad de larvas que se encuentra en los suelos y los hongo motivo de estudio condiciona la capacidad de estos por formar o no gran cantidad de trampas de atrapamiento. De esta manera se ha determinado que la capacidad predadora depende del previo contacto con las larvas, el cual favorece el reconocimiento del hongo frente al nematodo (20,38,39).
Otro factor que influye en la patogenicidad de las cepas es la edad de estas, ya que se ha demostrado que hongos viejos muestran menor virulencia que los más recientes; por lo tanto, la variabilidad entre los resultados obtenidos en el presente estudio pudo ser influida por los tiempo en los cuales fueron aisladas las cepas, es así como se evidencia una menor capacidad de atrapamiento en las cepas L1 y XVIII, seguidas de la cepa XXI y por último la cepa XXIV, las dos primeras fueron las más antiguas cepas aisladas y la XXIV la más reciente.
Conclusiones
Se demostró la existencia de dos especies de hongos nematófagos en diferentes fincas ganaderas. Este hallazgo constituye el primer reporte de la presencia, aislamiento e identificación de los hongos A. oligospora y A. musiformis en Cundinamarca y Boyacá.
La alta capacidad nematófaga in vitro del aislamiento colombiano de A. musiformis sugiere que podría ser un buen candidato para ser empleado como agente de control biológico de los NGI en la ganadería bovina colombiana, siempre y cuando esta estrategia de control biológico sea previamente evaluada en condiciones in vivo.
La presente investigación abre el camino para futuras investigaciones sobre estrategias no químicas de control de los parásitos del ganado bovino en Colombia, en particular la relacionada con los hongos nematófagos.
Referencias
- Barger I. The role of the epidemiological knowledge and grazing management for helminth control in small ruminants. Int J Parasitol. 1998;29(1):41-7.
- Márquez D. Resistencia a los antihelmínticos en nematodos de rumiantes y estrategias para su control. Bogotá: Produmedios; 2010.
- Mendoza, P. Control biológico de nematodos gastrointestinales, diagnóstico y control de los nematodosis gastrointestinales y pulmonares de los rumiantes. Huamantla: Tlaxcala; 2002.
- González R, Mendoza P, Torres G, Becerril C, Ortega E, Hernández O. Estudio in vitro de la capacidad depredadora de Duddingtonia flagrans contra larvas de nematodos gastrointestinales de ovinos de pelo. Técnica Pecuaria en México. 2005; 43(3):405-14.
- Ketzis JK, Vercruysse J, Stromberg BE, Larsen M, Athanasiadou S, Houdijk JG. Evaluation of efficacy expectations for novel and non-chemical helminth control strategies in ruminants. Vet Parasitol 2006;139(4):321-35.
- Braga F, De Araújo J. Nematophagous fungi for biological control of gastrointestinal nematodes in domestic animals. Appl Microbiol Biotechnol. 2014;98(1):71-82.
- Waller P. Biological control of sheep parasites using Duddingtonia flagrans: trials on commercial farms in Sweden. Acta Vet Scand. 2006;47:23-32.
- Barron G. The Nematode-destroying fungi. 3a ed. Canadá: Biological Publications; 1977.
- Waghorn T, Leathwick D, Chen L, Skipp R. Efficacy of the nematode-trapping fungus Duddingtonia flagrans against three species of gastro-intestinal nematodes in laboratory faecal cultures from sheep and goats. Vet Parasitol. 2003;118(3-4):227-34.
- Ministry of Agriculture, Fisheries and Food. Manual of veterinary parasitological laboratory techniques. Technical Bulletin (18). Londres: Majesty’s Stationery Office; 1971.
- Cooke R, Godfrey B. A key of nematode-destroying fungi. T Brit Mycol Soc. 1964;47(1):61-74.
- De Lima R, Ferraz S, Couto A, Dias C. Caracterizaçao morfológica e isoenzimática de especies Athrobotrys ocorrentes no Brasil. Nematol Bras. 2002;26(2):181-97.
- Gómez L, Baró G, Sánchez L, Rodríguez M. Identification and characterization of cuban isolates of nematode-trapping fungi. Revista de Protección Vegetal. 2003;18(1):53-57.
- Shams M, Razzaghi M, Ranjbar S, Eslami A, Zare R, Ebrahimi M. Screening of soil and sheep faecal samples for predacious fungi: isolation and characterization of the nematode trapping fungus Arthrobotrys oligospora. Iran Biomed J. 2004;8(3):135-42.
- Singh R, Kumar N, Singh K. Morphological variations in conidia of Arthrobotrys Oligospora on different media. Mycobiology 2005;33(2):118-20.
- Nagesh M, Hussaini, S, Chidanandaswamy B, Biswas S. Isolation in vitro characterization and predaceous activity of an indian isolate of the fungus, arthrobotrys oligospora on the root-knot nematode, meloidogyne incognita. Nematol Mediterr. 2005;33(2):179-83.
- Maciel A, Araujo JV, Campos AK, Lopes EA, Freitas LG. Predation of Ancylostoma spp. dog infective larvae by nematophagous fungi in different conidial concentrations. Vet Parasitol. 2009;161(3-4):239-47.
- Gomes A, Ramos M, Vasconcellos R, Jensen J, VieiraBressan M, Araujo J. In Vitro activity of Brazilian Strains of the predatory fungi Arthrobotrys spp. on free-living nematodes and infective larvae of Haemonchus placei. Mem Inst Oswaldo Cruz. 2000;95(6):873-6.
- Park J, Gams W, Scholler M, Ghisalberti E, Sivasithamparam K. Orbiliaceous nematode-trapping fungi and related species in western Australia and their biological activities. Aust Mycol. 2002;21(2):45-52.
- Soto N, Oliveira J, Vega R, Montero D, Vargas B, Hernández J, Orozco C. In vitro predatory activity of nematophagous fungi from Costa Rica with potential use for controlling sheep and goat parasitic nematodes. Rev Biol Trop. 2011;59(1):37-52.
- Drechsler C. Some hyphomycetes that prey on free living terrricolous nematodes. Mycologia. 1937;29:447-552.
- Graminha E, Costa A, Oliveira G, Monteiro A, Palmeira S. Biological control of sheep parasite nematodes by nematode-trapping fungi: in vitro activity and after passage through the gastrointestinal tract. World J Microb Biot. 2005;21:717-22.
- Alfaro I, Mendoza de Gives P, Liébano E, Eugenia M, Valero R, Hernández V. Nematophagous fungi (Orbiliales) capturing, destroying and feeding on the histotrophic larvae of Haemonchus contortus (Nematoda: Trichostrongylidae). Rev Mex Mic. 2011;33:29-35.
- Acevedo P, Quiroz H, Valero R, Mendoza-de Gives P, Gómez J. Nematophagous fungi from Mexico with activity against the sheep nematode Haemonchus contortus. Rev Ibero-Latinoam Parasitol. 2011;70(1):101-8.
- Yuh G, Yuan Ch. Nematode trapping fungi in Taiwan: Candelabrella musiformis and Artrhobotrys conoides [internet]. 1982 [citado 2013 dic 24]. Disponible en: www. biol.ntnu.edu.tw/download.php
- Ahren D, Tunlid A. Evolution of parasitism in nematodetrapping Fungi. J Nematol. 2003;35(2):194-7.
- Norbring-Hertz B, Mattiasson B. Action of nematode trapping fungus shows lectin mediated hostmicroorganism interaction. Nature 1979;281:477-9.
- Garcia A. Survival and predatory activity of Arthrobotrys musiformis submitted to lyophilization. Ciênc Agrotec. 2007;31(4):1203-06.
- Soares P, Nozaki M, Barbosa B, Santos J, Barbosa J. Growth and sporulation of two species of Arthrobotrys corda in different culture media and two environments. Biosci J Uberlandia. 2009;25(2):63-74.
- Kanadani A. Fungos nematófagos no controle de nematóides Gastrintestinais de ruminantes [tesis de maestría]. Minas Gerias: Universidade Federal de Minas Gerais; 2006.
- Jacobs H, Gray S, Crump D. Interactions between nematophagous fungi and consequences for their potential as biological agents for the control of potato cyst nematodes. Mycol Res. 2003;107(Pt 1):47-56.
- Chandrawanthani P, Jamnah O, Waller P, Hoglund J, Larsen M, Zahari W. Nematophagous fungi as a biological control agent for nematode parasites of small ruminants in Malaysia: a special emphasis on Duddingtonia flagrans. Vet Res. 2002;33(6):685-96.
- Su H, Hao Y, Mo M, Zhang K. The ecology, of nematodetrapping hyphomycetes in cattle dung from three plateau pastures. Vet parasitol. 2007;144(3-4):293-8.
- Santos C, Padilha T, Azevedo, M. Predatory activity of Arthrobotrys oligospora and Duddingtonia flagrans on preparasitic larval stages of cyathostominae under different constant temperaturas. Ciênc Rural. 2001;31(5):839-42.
- Saumel C, Fusé L, Iglesias L, Fernández S, Fiel C. Enfoque bioecológico del potencial de los hongos nematófagos en el control biológico de tricostrongilídeos de rumiantes. Rev Med Vet (Buenos Aires). 2008;89(2):45-54
- Curtis R, Jones J, Davies K, Sharon E, Spiegel Y. Plant nematode surfaces. En: Davies K, Spiegel Y, editors. Biological control of Plant-parasitic nematodes. Nueva York: Springer; 2011. p. 115-44.
- Liu X, Xiang, M, Che, Y. The living strategy of nematophagous fungi. Mycoscience. 2009;50:20-25.
- Jaffee B. Do organic amendments enhance the nematodetrapping fungi Dactylellina haptotyla and Arthrobotrys oligospora. J Nematol. 2004;36(3):267-75.
- Elshafie E, Al-mueini R, Al-bahry S, Akindi A, Mahmoud I, Al-rawahi S. Diversity and trapping efficiency of nematophagous fungi from Oman. Phytopathol Mediterr. 2006;45:266-70.
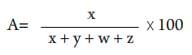











.jpg&w=3840&q=75)