Enfermedades reproductivas en bovinos doble propósito
Frecuencia de enfermedades de impacto reproductivo en bovinos de doble propósito ubicados en Oaxaca, México
La brucelosis, leptospirosis, diarrea viral bovina (DVB) y rinotraqueítis infecciosa bovina (IBR), son enfermedades abortivas que comprometen la eficiencia productiva en hatos bovinos. En diferentes municipios de Oaxaca, México, se han observado problemas reproductivos sugestivos a estas enfermedades. El objetivo del estudio fue determinar la frecuencia de DVB, IBR, brucelosis y leptospirosis en bovinos de doble propósito criados en diferentes regiones de Oaxaca. Se colectaron 2,691 muestras sanguíneas a partir de 127 hatos bovinos para diagnosticar serológicamente brucelosis mediante las pruebas de tarjeta al 8% y Rivanol; aglutinación microscópica (MAT) con una batería de seis serovariedades de Leptospira; ELISA por bloqueo e indirecta para DVB e IBR respectivamente. La frecuencia general aparente de hato fue brucelosis: 2.3%, leptospirosis: 86.6%, IBR: 65.4% y DVB: 56.7%. La frecuencia real para brucelosis, leptospirosis, IBR y DVB fue de -9.1% (IC95= -10.1, -7.9%), 64.3% (IC95= 62.5, 66.1%), 40.1% (IC95= 38.2, 41.9%) y 33.2% (IC95= 31.4, 35.0%) respectivamente. En la región Costa se observó el mayor porcentaje de animales con anticuerpos contra Leptospira, IBR y DVB. El presente estudio evidenció serológicamente la presencia de anticuerpos contra brucelosis, IBR, DVB y seis serovariedades de Leptospira en hatos bovinos doble propósito del estado de Oaxaca, México.
Palabras clave: Brucelosis, leptospirosis, DVB, IBR, Frecuencia.
INTRODUCCIÓN
MATERIAL Y MÉTODOS
Ubicación geográfica y animales de estudio
Diseño de estudio y muestreo
Pruebas serológicas
Análisis estadístico
RESULTADOS
Brucelosis
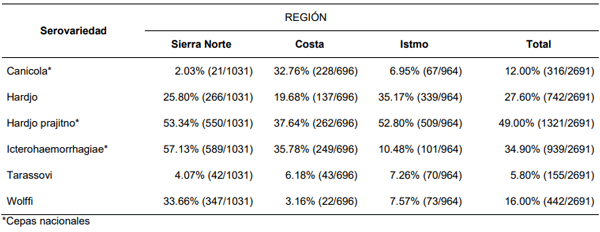
Leptospirosis
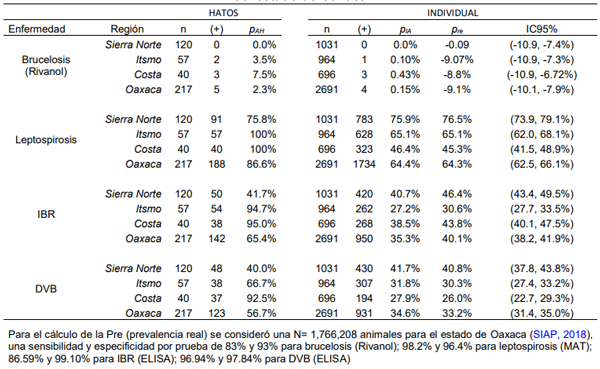
Rinotraqueitis infecciosa bovina
Diarrea viral bovina
DISCUSIÓN
CONCLUSIONES
AGRADECIMIENTOS
BENNETT S, Woods T. Liyanage WM, Smith DL. 1991. A simplified general method for cluster-sampling surveys of health in developing countries. World Health Stat. Quart. 44(3):98-106. https://pubmed.ncbi.nlm.nih.gov/1949887/
BAILLARGEON P, Arango-Sabogal, JC, Wellemans V, Fecteau G. 2017. Determining bovine viral diarrhea and infectious bovine rhinotracheitis infections in dairy cattle using precolostral blood. The Canadian Veterinary Journal. 58(4): 360–364. https://pubmed.ncbi.nlm.nih.gov/28373727/
BRODERSEN WB. 2014. Bovine Viral Diarrhea Virus Infections: Manifestation of Infection and recent advances in understanding pathogenesis and control. Veterinary Pathology. 51(2):453-464. https://doi.org/10.1177/0300985813520250
CARMONA GC, León LL, Castillo SL, Ramírez OJ, Ko A, Lua PC, De la Peña MA. 2011. Detection of Leptospira santarosai y L. kirshneri in cattle: new isolates with potential impact in bovine production and public health. Veterinaria México. 42(4): 277- 288. http://www.scielo.org.mx/pdf/vetmex/v42n4/v42n4a3.pdf
ESCAMILLA HP, Martínez MJ, Medina MC, Morales SE. 2007. Frequency and causes of infectious abortion in a dairy herd in Queretaro, Mexico. Canadian Journal of Veterinary Research. 71(4):314-317. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1940280/pdf/cjvr71_pg314.pdf
GATES MC, Woolhouse ME, Gunn GJ, Humphry RW. 2013. Relative association of cattle movements, local spread, and biosecurity with bovine viral diarrhea virus (BVDV) seropositivity in beef and dairy herd. Preventive Veterinary Medicine. 112(3-4):285- 295. https://doi.org/10.1016/j.prevetmed.2013.07.017
LARGHI M. 2018. Comparative study in the control of bovine viral diarrhea. Animal Health Research Reviews. 19:125–133. https://doi.org/10.1017/S1466252318000129
LILENBAUM W, Martins G. 2014. Leptospirosis in Cattle: A challenging scenario for the understanding of the epidemiology. Transboundary and Emerging Diseases. 61 Suppl 1:63-8. https://doi.org/10.1111/tbed.12233
MAGAÑA UA, Solorio RJL, Segura CJC. 2005. Rinotraqueítis infecciosa bovina en hatos lecheros de la región Cutzio-Téjaro, Michoacán, México. Técnica Pecuaria México. 43(1):27-37. http://www.redalyc.org/articulo.oa?id=61343103
MARTINS G, Lilenbaum W. 2017.Control of bovine leptospirosis: Aspects for consideration in a tropical environment. Research in Veterinary Science. 112:156-160. https://doi.org/10.1016/j.rvsc. 2017.03.021
MELÉNDEZ SR, Valdivia FA, Rangel ME, Díaz AE, Segura CJ, Guerrero BA. 2010. Factores de riesgo asociados a la presencia de aborto y desempeño reproductivo en ganado lechero de Aguascalientes, México. Técnica Pecuaria en México. 1(4):391- 401. http://www.scielo.org.mx/pdf/rmcp/v1n4/v1n4a7.pdf
MILIÁN SF, Hernández OR, Hernández AL, Alvarado IA, Díaz AE, Mejía EF, Palomares RE, Bárcenas RI, Zendejas MH. 2016. Seroprevalence and risk factors for reproductive diseases in dairy cattle in Mexico. Journal of Veterinary Medicine and Animal Health. 8(8):89-98. https://doi.org/10.5897/JVMAH2016.0483
MIYAMA T, Watanabe E, Ogata Y, Urushiyama Y, Kawahara N, Makita K. 2017. Herdlevel risk factors associated with Leptospira Hardjo infection in dairy herds in the southern Tohoku, Japan. Preventive Veterinary Medicine. 149:15-20. doi:10.1016/j.prevetmed.2017.11.008
MOLES CL, Gavaldón D, Torres BJ, Cisneros PM, Aguirre SJ, Rojas SN. 2002. Seroprevalencia simultánea de Leptospirosis y tres enfermedades de importancia reproductiva en bovinos del altiplano central de la República Mexicana. Universidad Autónoma Metropolitana Xochimilco. Revista de Salud Animal. 24(2):106-110. https://biblat.unam.mx/es/buscar/seroprevalencia-simultanea
MUYLKENS B, Thiry J, Kirten P, Schynts F, Thiry E. 2007. Bovine herpesvirus 1 infection and infectious bovine rhinotracheitis. Veterinary Research. 38(2):181–209. https://doi.org/10.1051/vetres:2006059
NANDI S, Kumar M, Manohar M, Chauhan R. 2009. Bovine herpesvirus infections in cattle. Animal Health Research Reviews. 10(1):85-98. https://doi.org/10.1017/S1466252309990028
NOORDHUIZEN JP, Frankena K, Hoofd CM, Graat EA. 1997. Aplication of quantitaive methods in veterinary epidemiology. Published by: Wageningen Pers. (Wagenigen). The Netherlands pp.445. ISBN 0974134351. https://library.wur.nl/WebQuery/wurpubs/109308
OIE. 2004. Manual de la OIE sobre animales terrestres. Leptospirosis. Organización Mundial de Sanidad Animal. https://www.oie.int/doc/ged/d6508.pdf
OJEDA CJ, Espinosa AE, Hernández GP, Rojas MC, Álvarez MJ. 2016. Seroprevalencia de enfermedades que afectan la reproducción de bovinos para leche con énfasis en neosporosis. Ecosistemas y recursos agropecuarios. 3(8):243-249. http://www.scielo.org.mx/pdf/era/v3n8/2007-901X-era-3-08-00243.pdf
Olmo L, Reichel MP, Nampanya S, Khounsy S, Wahl LC, Clark BA, et al. 2019. Risk factors for Neospora caninum, bovine viral diarrhoea virus, and Leptospira interrogans serovar Hardjo infection in smallholder cattle and buffalo in Lao PDR. PLoS ONE 14(8): e0220335. https://doi. org/10.1371/journal.pone.0220335
OTTE MJ, Gumm ID. 1997. Intra-cluster correlation coefficients of 20 infections calculated from the results of cluster-sample surveys. Preventive Veterinary Medicine. 31:147-150. doi: 10.1016/s0167-5877(96)01108-7
POESTER FP, Samartino LE, Santos RL. 2013. Pathogenesis and pathobiology of brucelosis in livestock. Revue Scientifique et Technique Office International des Epizooties. 32(1):105-115. https://pdfs.semanticscholar.org/f889/696c62f6fa0dfa5ac501fd05250aea4fb041.pdf
ROMERO SD, Ahuja AC, Montiel PF, García VZ, Cruz RA; Aguilar DM. 2013. Seroprevalence and risk factors associated with infectious bovine rhinotracheitis in unvaccinated cattle in southern Veracruz, Mexico. African Journal of Microbiology Research. 7(17):1716-1722. http://www.academicjournals.org/app/webroot/article/article1380540810_RomeroSalas%20et%20al.pdf
ROJO RR, Vázquez A JF, Pérez HP, Mendoza MGD, Salem MAZ, Albarrán PB, González RA, Hernández MJ, Rebollar RS, Cardoso JD, Dorantes CEJ, Gutiérrez CJG. 2009. Dual Purpose cattle production in Mexico. Tropical Animal Health and Production. 41:715-721. https://doi.org/10.1007/s11250-008-9249-8
ROSETE FJ, Utrerab RA, Martínez ZJ, Jenkinsa OS, Zuritac GL, Islasa FA, Banda RB, Socci EG. 2018. Prevalencia de anticuerpos contra diarrea viral bovina en vacas no vacunadas en los estados de Puebla, Tabasco y Veracruz, México. Revista Mexicana de Ciencias Pecuarias. 9(3). https://doi.org/10.22319/rmcp.v9i3.4599
SOLIS CJ, Segura CVM, Segura CJC, Alvarado IA. 2003. Seroprevalence of and risk factors for infectious bovine rhinotracheitis in beef cattle herds of Yucatan, Mexico. Preventive Veterinary Medicine. Apr 15;57(4):199-208. https://doi.org/10.1016/s0167- 5877(02)00230-1
SEGURA CV, Solís CJJ, Segura CJ. 2003. Seroprevalence of and risk factor for leptospiral antibodies among cattle in the state of Yucatan, Mexico. Tropical Animal Health and Production. 35, 293-299. https://doi.org/10.1023/a:1025185703587
SEGURA Correa JC, Solorio Rivera JL, Sánchez Gil LG. 2010. Seroconversion to bovine viral diarrhoea virus and infectious bovine rhinotracheitis virus in dairy herds of Michoacan, Mexico. Tropical Animal Health and Production. 42:233-238. https://doi.org/10.1007/s11250-009-9411-y
SEGURA CJ, Zapata CC, Jasso OJ, Martínez BJ; López ZR. 2016. Seroprevalence and risk factors associated with bovine herpesvirus 1 and bovine viral diarrhea virus in North-Eastern Mexico. Open Veterinary Journal. 6(2):143-149. http://doi.org/10.4314/ovj.v6i2.12
SERVICIO Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria. 2014. Dirección general de salud animal. Dirección de campañas zoosanitarias, datos de frecuencias. Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria. SAGARPA. https://www.gob.mx/senasica/documentos/informes-zoosanitarios-semanales-2014
SIAP. Servicio de Información Agroalimentaria y Pesquera. 2018. Bovinos carne y leche, Población ganadera 2008-2017 cabezas. Servicio de Información Agroalimentaria y Pesquera. www.gob.mx/siap/documentos/poblacion-ganadera136762
SOLÍS CJ, Segura CV, Segura CJ, Alvarado IA. 2003. Seroprevalence of and risk factors for infectious bovine rhinotracheitis in beef cattle herds of Yucatan, Mexico. Preventive Veterinary Medicine. 57(4):199-208. https://doi.org/10.1016/S0167- 5877(02)00230-1
VALAS S, Brémaud I, Stourm S, Croisé B, Mémeteau S, Ngwa-Mbot D, Tabouret M. 2019. Improvement of eradication program for infectious bovine rhinotracheitis in France inferred by serological monitoring of singleton reactors in certified BoHV1-free herds. Preventive Veterinary Medicine. 171:104743. https://doiorg.pbidi.unam.mx:2443/10.1016/j.prevetmed.2019.104743
ZAKIA I, Goodwin D, Pascual W. 2016. Brucellosis vaccines for livestock. Veterinary Immunology and Immunopathology. 181 (15): 51-58. https://doi.org/10.1016/j.vetimm.2016.03.011









Estados Unidos de América




