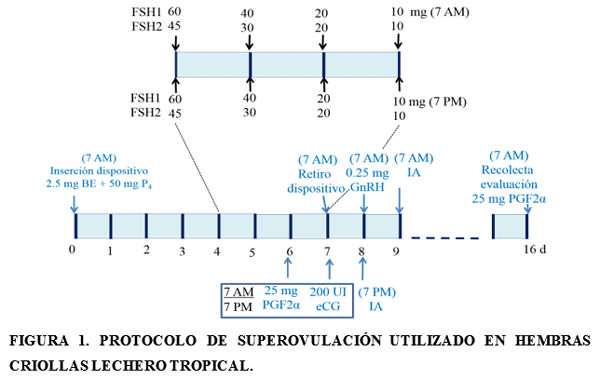
Superovulación de hembras criollas lechero tropical
Las biotecnologías reproductivas se utilizan para la conservación, expansión y mejora genética de bovinos y facilitan la creación de bancos de germoplasma de animales élite y razas en peligro de extinción El objetivo del estudio fue comparar el efecto de dos dosis de hormona folículo estimulante en el comportamiento superovulatorio de hembras criollas Lechero Tropical (LT). El estudio se realizó en Veracruz, México, en un clima cálido. Se utilizaron 25 donadoras Lechero Tropical (47±4 meses y 423,9±12 kg de peso vivo). Se utilizaron dos niveles de hormona folículo estimulante (FSH) de 260 (FSH1) y 210 mg (FSH2) por tratamiento. Las variables de respuesta se analizaron con un modelo lineal de efectos fijos. Los datos fueron procesados con el procedimiento de modelos generalizados con una distribución de Poisson. El peso y la edad influyeron en el número de cuerpos lúteos. El peso influyó en ovocitos no fertilizados, embriones degenerados y total de estructuras recolectadas. Solamente en ovocitos no fertilizados se encontró diferencia estadística (p≤0.004) entre tratamientos, pero no en cuerpos lúteos, embriones degenerados, blastocisto, embriones calidad uno, embriones transferibles y total de estructuras recolectadas (p>0,05). Los tratamientos FSH1 y FSH2 indujeron similar número de embriones transferibles (2,7±0,6 y 3,5±0,7) y embriones calidad uno (2,5±0,6 y 3,4±0.7), por lo que la dosis de 210 mg de FSH1 sería la más recomendable para superovular hembras LT.
Palabras clave: Embriones, FSH, climas cálidos, razas locales.

[1] ALI, M.S.; KHANDOKER, M.A.M.; AFROZ, M.A.; AND BHUIYAN, K.F.H. Ovarian response to different dose levels of Follicle Stimulating Hormone (FSH) in different genotypes of Bangladeshi cattle. Asian-Australus. J. Anim. Sci. 25(1): 52-58. 2012.
[2] ANDRABI, S.M.H.; MAXWELL, W.M.C. A review on reproductive biotechnologies for conservation of endangered mammalian species. Anim. Reprod. Sci. 99: 223-243. 2007.
[3] ASOCIACIÓN MEXICANA DE CRIADORES DE GANADO ROMOSINUANO Y LECHERO TROPICAL, A. C. (AMCROLET). Libro de Registro Raza Criollo Lechero Tropical. Veracruz, México. 129 pp. 2012.
[4] BARATI, F.; NIASARI-NASLAJI, A.; BOLOURCHI, M.; SARHADDI, F.; RAZAVI, K.; NAGHZALI, E.; THATCHER, W.W. Superovulatory response of Sistani cattle to three different doses of FSH during winter and summer. Theriogenol. 66: 1149-1155. 2006.
[5] BARROS, C.M.; NOGUEIRA, M.F.G. Embryo transfer in Bos indicus cattle. Theriogenol. 56: 1483-1496. 2001.
[6] BÓ, A.G.; MAPLETOFT, J.R. Evaluation and classification of bovine embryos. Anim. Reprod. 10(3):344-348. 2013.
[7] BONO, G.; GABAI, G.; SILVESTRELLI, L.; COMIN, A. Superovulatory and endocrinological responses of Simmental cows treated either with PMSG or hMG or in combination. Theriogenol. 35(6): 1179-1190. 1991.
[8] BREUEL, K.F.; BAKER, R.D.; BUTCHER, R.L.; TOWNSEND, E.C.; INSKEEP, E.K.; DAILEY, R.A. LERNER, S.P. Effects of breed, age of donor and dosage of follicle stimulating hormone on the superovulatory response of beef cows. Theriogenol. 36(2): 241-255. 1991.
[9] BÜLBÜL, B.; KIRBAS, M.; KÖSE, M.; DURSUN, S. Investigation of superovulation response in Brown Swiss cows after synchronization using progesterone and oestradiol valerate. Kafkas Univ. Vet. Fak. Derg.16(3): 463-468. 2010.
[10] BÜLBÜL, B.; KIRBAS, M.; DURSUN, S.; KÖSE, M. Superovulation in cows synchronized with two different progesterone + oestradiol protocols. Archiv. Tierzucht. 56(15): 160-168. 2013.
[11] CALLESEN, H.; LOVENDAHL, P.; BAK, A.; GREVE, T. Factors affecting the developmental stage of embryos recovered on day 7 from superovulated dairy cattle. J Anim. Sci.73: 1539-1543. 1995.
[12] DE ALBA, J. El criollo lechero en Turrialba. Boletín Técnico No. 15. (Costa Rica): Imprenta y litografía Grafo Print, S. A. Centro Agronómico Tropical de Investigación y Enseñanza; 59 pp. 1985.
[13] DE ALBA, J. El libro de los Bovinos Criollos de América. Ed. Colegio de Postgraduados (México): Biblioteca Básica de Agricultura. Pp 1-2. 2011.
[14] DONG-SOO, S.; CHANG-YONG, C.; SANG-RAE, C.; SUN-HO, C.; HYUN-JONG, K.; ILL-HWA, K. The effect of reduced dose and number of treatments of FSH on superovulatory response in CIDR-treated Korean native cows. J. Reprod. Dev. 53(6): 1299-1303. 2007.
[15] ESTRADA, J.L.; PACHÓN, L.A.; OLIVERA, M.; PIEDRAHITA, J.; WESTHUSIN, M. Superovulatory response of colombian creole cattle to two doses of FSH. Theriogenol. 49(1):377. 1998.
[16] FOOD AND AGRICULTURAL ORGANIZATION OF THE UNITED NATIONS (FAO). The State of the World’s Animal Genetic Resources for Food and Agriculture. B. Rischkowsky and D. Pilling, editors. Rome, Italy. 38 pp. 2007.
[17] GARCÍA, E. Modificaciones al Sistema de Clasificación Climática de Köppen. Instituto de Geografía. Universidad Nacional Autónoma de México. México, D.F. Pp. 19-21. 2004.
[18] GENZEBU, D. A review of embryo transfer technology in cattle. Glob. J. Anim. Scientif. Res. 3(2):562-575. 2015.
[19] GONZÁLEZ, R.; VELARDE, J.C.; ZAMBRANO, S.; ESTÉ, P. Producción y trasplante de embriones congelados de bovinos Criollo Limonero. Arch. Latinoam. Prod. Anim. 5 (Suppl. 1): 370-372. 1997.
[20] KAFI, M.; MCGOWAN, M.R. Factors associated with variation in the superovulatory response of cattle. Anim. Reprod. Sci. 48: 137-157. 1997.
[21] KANITZ, W.; BECKER, F.; SCHNEIDER, F.; KANITZ, E.; LEIDING, C.; NOHNER, H.P.; PÖHLAND, R. Superovulation in cattle: practical aspects of gonadotropin treatment and insemination. Reprod. Nutr. Dev. 42: 587-599. 2002.
[22] KANUYA, N.; CALLESEN, H.; HYTTEL, P.; ASSEY, R.; GREVE, T. Superovulatory response of dairy cattle (Bos taurus) in a tropical environment. Theriogenol.m47: 1583-1593. 1997.
[23] LEE, W.Y.; SONG, K.Y.; LIM, K.T.; LEE, S.J.; LEE, B.C.; JANG, G. Influence of factors during superovulation on embryo production in Korean Holstein cattle. J. Vet. Med. Sci. 74(2): 167-174. 2012.
[24] LERNER, S.P.; THAYNE, W.V.; BAKER, R.D.; HENSCHEN, T.; MEREDITH, S.; INSKEEP, E.K.; DAILEY, R.A.; LEWIS, P.E.; BUTCHER, R.L. Age, dose of FSH and other factors affecting superovulation in Holstein cows. J. Anim. Sci. 63: 176-183. 1986.
[25] LINDNER, G.M.; WRIGHT JR, R.W. Bovine embryo morphology and evaluation. Theriogenol. 20(4): 407-416. 1983.
[26] LOHUIS, M.M. Potential benefits of bovine embryo-manipulation technologies to genetic improvement programs. Theriogenol. 43: 51-60. 1995.
[27] LOPES DA COSTA, L.; CHAGAS E SILVA, J.; ROBALO-SILVA, J. Superovulatory response, embryo quality and fertility after treatment with different gonadotrophins in native cattle. Theriogenol. 56: 65-77. 2001.
[28] MALHI, P.S.; ADAMS, G.P.; SINGH, J. Bovine model for the study of reproductive aging in women: Follicular, luteal, and endocrine characteristics. Biol. Reprod. 73: 45-53. 2005.
[29] MALHI, P.S.; ADAMS, G.P.; PIERSON, R.A.; SINGH, J. Bovine model of reproductive aging: Response to ovarian synchronization and superstimulation. Theriogenol. 66: 1257-1266. 2006.
[30] MAPLETOFT, R.J.; STOONEY, J.M. General sanitary procedures and welfare considerations associated with in vivo production of embryos. In: Stringfellow, AD; Seidel, SM. Manual of the International Embryo Transfer Society: a procedural guide and general information for the use of embryo transfer technology emphasizing sanitary procedures. 3th. Ed. Savoy (IL USA), Pp 55-56. 1998.
[31] MOTTA, D.P.A.; RAMÍREZ, N.M.Y.; RAMOS, N.C.; VALENCIA, A.F.H.; PERDOMO, W.T. Respuesta superovulatoria en número y calidad embrionaria de vacas y novillas Gyr lechero en clima cálido húmedo. Rev. Electrón. Vet. 12(10):1-14. 2011.
[32] NILCHUEN, P.; RATTANATABTIMTONG, S.; CHOMCHAI, S. Superovulation with different doses of follicle stimulating hormone in Kamphaeng Saen beef cattle. Songklanakarin J. Sci. Technol. 33(6): 679-683. 2011.
[33] NILCHUEN, P.; CHOMCHAI, S.; RATTANATABTIMTONG, S. Superovulation with different doses of follicle stimulating hormone in Kamphaeng Saen beef cattle. J. Anim. Vet. Adv. 11(5): 676-680. 2012.
[34] QUARESMA, M.A.; LOPES DA COSTA, L.; ROBALO SILVA, J. Superovulation of Mertolenga cows with two FSH preparations (FSH-P and Folltropin). Rev. Port. Cienc. Vet. 98(546): 81-84. 2003.
[35] RAJAMAHENDRAN, R.; CALDER, M.D. Superovulatory responses in dairy cows following ovulation of the dominant follicle of the first wave. Theriogenol. 40: 99-109. 1993.
[36] ROA, N.; DENIS, R.; DOMINGUEZ, A.; D´ENJOY, D.; MARÍN, C. Creación de banco de germoplasma vacuno (embriones) de razas autóctonas Criollo Limonero y Siboney existentes en Venezuela. Mundo Pec. 9(3): 129-135. 2013.
[37] ROSENDO-PONCE, A.; BECERRIL-PÉREZ, C.M. Avance en el conocimiento del bovino criollo Lechero Tropical de México. Ecosist. Rec. Agrop. 2(5): 233-243. 2015.
[38] ROUSE, J.E. The Criollo: Spanish Cattle in the Americas. University of Oklahoma, Press. Pp 21-23. 1977.
[39] SALGADO, O.R.; MEJÍA, A.A.; SUÁREZ, S.P. Eficiencia de la respuesta superovulatoria del ganado Brahaman al protocolo P-24. Rev. MVZ Córdoba 16(2): 2521-2527. 2011.
[40] SANTELLANO-ESTRADA, E.; BECERRIL-PÉREZ, C.M.; DE ALBA, J.; CHANG, Y.M.; GIANOLA, D.; TORRES-HERNÁNDEZ, G.; RAMÍREZ-VALVERDE, R. Inferring genetics parameters of lactation in the Tropical Milking Criollo cattle with random regression test-day models. J. Dairy Sci. 91: 4393-4400. 2008.
[41] SANTELLANO-ESTRADA, E.; BECERRIL-PÉREZ, C.M.; CHANG, Y.M.; GIANOLA, D.; TORRES-HERNÁNDEZ, G.; RAMÍREZ-VALVERDE, R.; DOMÍNGUEZ-VIVIEROS, J.; ROSENDO-PONCE, A. Caracterización de la lactancia y evaluación genética del ganado Criollo Lechero Tropical utilizando un modelo de regresión aleatoria. Agrocien. 45: 165-175. 2011.
[42] SCHIEWE, M.C.; LOONEY, C.R.; JOHNSON, C.A.; HILL, K.G.; GODKE, R.A. Transferable embryo recovery rates following different insemination schedules in superovulated beef cattle. Theriogenol. 28(4): 395-406. 1987.
[43] SEGURA-CORREA, J.C.; MONTES-PÉREZ, R.C. Razones y estrategias para la conservación de los recursos genéticos animales. Rev. Bioméd. 12: 196-206. 2001.
[44] SEIDEL JR, E.G.; SEIDEL, S.M. Training Manual for Embryo Transfer in Cattle. FAO. Animal Production and Health. Rome Italy. Paper 77. 164 pp. 1991.
[45] SINGH, S.P.; BROADBENT, P.J.; HUTCHINSON, J.S.M.; WATT, R.G.; DOLMAN, D.F. Follicular dynamics and superovulatory response in heifers. Anim. Reprod. Sci. 43: 183-190. 1996.
[46] STATISTICAL ANALYSIS SYSTEM INSTITUTE. (SAS) 9.3 for Windows. Inc. Cary NC, USA. 2010.
[47] VELÁZQUEZ, A.M. Assisted reproductive technologies in cattle: Applications in livestock production, biomedical research and conservation biology. Ann. Rev. Biomed. Sci. 10: 36-62. 2008.
[48] WILDMAN, E.E.; JONES, G.M.; WAGNER, P.E.; BOMAN, R.L.; TROUT, J.R.; LESCH, T.N. A dairy cow body condition scoring system and its relationship to selected production characteristics. J. Dairy Sci. 65(3): 495-512. 1982.







