Síndrome de movilización grasa en vacas lecheras al inicio de la lactancia y sus efectos en salud y producción de los rebaños
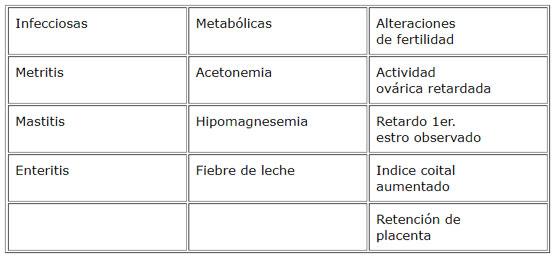
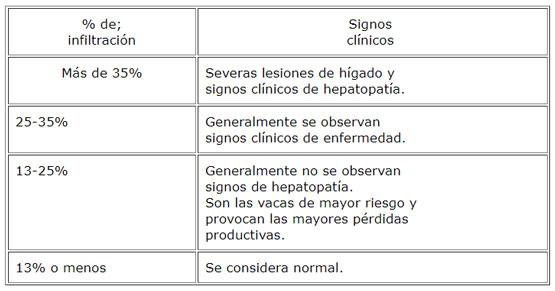
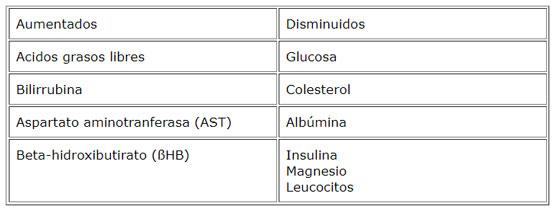
En el inicio de la lactancia las vacas sufren un déficit de energía, por lo cual movilizan grasas desde los tejidos de depósito para mantener la producción de leche. En este período una alta proporción de vacas desarrollan una moderada o severa infiltración de grasa en el hígado. Este proceso de infiltración de grasa también compromete otros tejidos de importancia para el adecuado funcionamiento orgánico. La infiltración de grasas en el hígado se desarrolla cuando las concentraciones de ácidos grasos en la sangre aumentan y la capacidad del hígado para metabolizarlos excede su capacidad para sintetizar y secretar lipoproteínas. Este proceso se inicia en el período preparto junto con un aumento de las concentraciones sanguíneas de ácidos grasos y un descenso en las concentraciones sanguíneas de lipoproteínas. Cuando la infiltración de grasa en el hígado es severa se asocia con problemas clínicos en los rebaños, aumentando la frecuencia de enfermedades infecciosas, metabólicas y problemas reproductivos que se evidencian por aumento del lapso parto-primer estro observado y aumento del índice coital. La manera más exacta para diagnosticar la infiltración de grasa en el hígado es por biopsia hepática, pero para estudiar la situación de rebaños es más práctico utilizar la información de aportes y requerimientos en la ración, considerar los cambios en la condición corporal y estudiar la composición de fluidos corporales, tales como las concentraciones de urea, ßHB y proteínas en la leche o la composición sanguínea de grupos de vacas al final de su gestación y otro grupo de vacas al inicio de la lactancia. Como prevención, las vacas al final de la gestación no deberían estar demasiado gordas y recibir alimentos de buena calidad para satisfacer los requerimientos de energía al inicio de la lactancia.
Con estas medidas se han logrado mayores producciones, pero ello aumenta en las vacas el riesgo de sufrir alteraciones de la salud y si además hay problemas de escasez de alimentos y problemas de manejo, la salud se alterará aun en rebaños que tengan niveles productivos más bajos.
La concentración de urea sanguínea está en relación al aporte de proteínas en la ración y de la proporción energía: proteína existente en ella. Valores bajos de urea en la sangre se encuentran en animales con dietas deficitarias en proteínas y valores altos en aquellos que usan dietas con excesivo aporte de proteínas o con un déficit de energía (Manston y col., 1975; Kaufmann y col., 1982; Klein y col., 1987). La urea sanguínea pasa el epitelio alveolar de la glándula mamaria difundiéndose en la leche, existiendo una alta correlación entre las concentraciones de urea sanguínea y concentraciones de urea en la leche del individuo (Gfrörer y Koch, 1985), esto permite utilizar su medición en la leche como una forma de estudiar este desbalance nutricional.
ADELI, K., A. MAHAMMADI, J. MACRI. 1995. Regulation of apolipoprotein B biogenesis in human hepatocytes: post-transcriptional control mechanisms that determine the hepatic production of apolipoprotein B-containing lipoproteins, Clin. Biochem. 28: 123. [ Links ]
ADIBI, S.A. 1980. Roles of branched chain amino acids in metabolic regulation, J. Lab. Clin. Med. 95: 475-484. [ Links ]
ARMENTANO, L.E., J.W. YOUNG. 1983. Production and metabolism of volatile fatty acids, glucose and CO2 in steers and the effects of monensin on volatil fatty acid kinetics, J. Nutr. 113: 1265-1277. [ Links ]
BASTIDAS, P.S. 1994. Interrelación entre nutrición y desempeño reproductivo postparto. EN: 1er Curso Nacional de Divulgación en Técnicas de RIA y Evaluación de Metabolitos Sanguíneos y Cinéticas Digestivas en la Nutrición y Reproducción en Bovinos. FAO/MEM/UCV, Maracay, Venezuela, pp. 1-20. [ Links ]
BAUCHART, D. 1993. Lipid absorption and transport in ruminants, J. Dairy Sci. 76: 3864. [ Links ]
BAUCHARD, D., D. GRUFFAT, D. DURAND. 1996. Lipid absorption and hepatic metabolism in ruminants, Proc. Nutr. Soc. 55: 39. [ Links ]
BAUMANN, D.E., W.B. CURRIE, W. 1980. Partition of nutrients during pregnancy and lactation: A review of mechanism involving homeostasis and homeorhesis, J. Dairy Sci. 63:1514-1529. [ Links ]
BERGMAN, N.E., W.E. ROE, W. KON. 1966. Quantitative aspects of propionate metabolism and gluconeogenesis in sheep, Am. J. Physiol. 211: 793-799. [ Links ]
BERTICS, S.J., R.R. GRUMMER, C. CADORNIGA-VALIÑO, E.E. STODDAR. 1992. Effect of prepartum dry matter intake on liver triglyceride concentration in early lactation, J. Dairy Sci. 75: 914. [ Links ]
CADORNIGA-VALIÑO, C., R.R. GRUMMER, L.E. ARMENTANO, S.S. DONKIN, S.J. BERTICS. 1997. Effect of fatty acids and hormones on fatty acid metabolism and gluconeogenesis in bovine hepatocytes, J. Dairy Sci. 80: 646-656. [ Links ]
CONTRERAS, P. A., R. MANSTON, B.F. SANSOM. 1982. Calcium mobilization in hypomagnesaemic cattle, Res. Vet. Sci. 33: 10-16. [ Links ]
CONTRERAS, P.A. 1990. Enfermedades metabólicas más frecuentes asociadas al metabolismo energético y mineral en ovejas gestantes. En: Medicina Preventiva en Rebaños Ovinos. Ed. N. Tadich ed. Gráfica Sur. Valdivia-Chile, pp. 69-76. [ Links ]
CONTRERAS, P.A. 1990. Algunas enfermedades asociadas al desbalance mineral y energético en bovinos. En: Diagnósticos Diferenciales de las Principales Enfermedades de las Especies de Producción. Ed. M. Quezada. Universidad de Concepción-Chile, pp. 186-199. [ Links ]
CONTRERAS, P.A., F. WITTWER, W. STEHR. 1991. Composición sanguínea, peso y producción de leche durante los tres primeros meses de lactancia en vacas Friesian de tres genotipos, Arch. Med. Vet. 23 (1): 85-91. [ Links ]
CONTRERAS, P.A., C. LARRAIN, F. WITTWER, J. FLORES, H. BOHMWALD. 1992. Efecto del bicarbonato de sodio solo o asociado a óxido de magnesio en la alimentación, sobre las características de líquido ruminal y producción de leche en vacas, Arch. Med. Vet. 24 (2): 131-139. [ Links ]
CONTRERAS, P.A. 1993. Riesgos en salud en vacas de alta producción de leche. I. Enfermedades de la producción. En: Aspectos Técnicos y Perspectivas de la Producción de Leche. Ed. F. Lanuza y G. Bartolameolli. INIA-Remehue Osorno-Chile, pp. 97-107. [ Links ]
CONTRERAS, P.A. 1997. Caracterización y diagnóstico de desbalances nutricionales que limitan la producción en rebaños bovinos de pequeños productores de leche en Valdivia-Chile. En: I Encuentro de Facultades Latinoamericanas con Servicios de Asistencia Técnica a Pequeños Productores Rurales. Salto, Uruguay, pp. 83-104. [ Links ]
CHILLIARD, Y. 1993. Dietary fat and adipose tissue metabolism in ruminants, pigs and rodents: A review, J. Dairy Sci. 76:3897. [ Links ]
DIRKSEN, G. y W. BREITNER. 1993. A new quick test for semiquantitative determination of ß-hydroxybutiric acid in bovine milk, J. Vet. Med. A. 40: 779-784. [ Links ]
DOBBELAAR, P. 1995. Body condition of cows. Veepro Holland. 23: 12-123. [ Links ]
EDMONSON, A.J., I.J. LEAN, L.D. WEAVER, T. FARVER, G. WEBSTER. 1989. A body condition scoring chart for holstein dairy cows, J. Dairy Sci. 72: 68-78. [ Links ]
FERGUSON, J. D. y K.A. OTTO. 1989. Managing body condition in dairy cows. En: Cornell Nutrition Conference for Feed Manufacturers. Ithaca, New York. [ Links ]
FRONK, T.J., L.H. SCHULTZ, A.R. HARDIE. 1980. Effect of dry period overconditioning on subsequent metabolic disorders and performance of dairy cows, J. Dairy Sci. 63: 1080-1090. [ Links ]
GERLOFF, B.J., T.H. HERDT, R.S. EMERY. 1986. The relationship of hepatic lipidosis to health and performance in dairy cattle, J. Am. Vet. Med. Assoc. 188: 845-850. [ Links ]
GFRÖRER, F. y G. KOCH. 1985. Die Bestimmung des Milchharnstoffgehaltes in der Praxis. Tierärztl. Prax. 13:559-563. [ Links ]
GRUFFAT, D., D. DURAND, Y. CHILLIARD, P. WILLIAMS, D. BAUCHART. 1997. Hepatic gene expression of apolipoprotein B100 during early lactation in underfed high producing dairy cows, J. Dairy Sci. 80: 657-666. [ Links ]
GRUMMER, R.R. 1993. Etiology of lipid-related metabolic disorders in periparturient dairy cows, J. Dairy Sci. 76: 3882. [ Links ]
HERDT, T.H. 1988. Fatty liver in dairy cows, Vet. Clin. N.A.: Food Anim Pract. 4: 269-287. [ Links ]
HERDT, T.H. 1988. Fuel homeostasis in the ruminant, Vet. Clin. N.A.: Food Anim. Pract. 4: 213-231. [ Links ]
HERDT, T.H., L. GOEDERS, J.S. LIESMAN. 1983. Test for estimation of bovine hepatic lipid content, J. Am. Vet. Med. Assoc. 182: 953-955. [ Links ]
HORSTING, M.; H.F. De LUCA. 1969. In Vitro production of 25-hydroxycholecalciferol, Biochem. Biophys. Res. comm. 36: 251-256. [ Links ]
HIBBITT, K.G. 1979. Bovine ketosis and its prevention, Vet. Rec. 105: 13-15. [ Links ]
HUNTINGTON, G.B., R.L. PRIOR. 1983. Digestion and absorption of nutrients by beef heifers fed a high concentrate diet, J. Nutr. 117: 2280-2288. [ Links ]
KAUFMANN, W., K.H. LOTTHAMMER, W. LUEPPING. 1882. Zum Einfluss eines veminderten Proteigehaltes der Ratio (über Verwendung von geschütztem Protein) auf Milchleistung und einige Blutparameter als Kennzeichen der Leberlanstung, Z. Tierphysiol. Tierernährg. Futtermittelkde. 47:85-101. [ Links ]
KLEIN, B., B. SCHMIDT, H. ZUCKER. 1987. Serumharnstoffbestimmungen in Michviehherden zur Beurteilung der Protein und Energieversorgung, Tierärztl. Umsch. 42: 532-539. [ Links ]
KOENIG, M., P.A. CONTRERAS. 1984. Alteraciones del metabolismo energético en rumiantes y sus principales manifestaciones clínicas, Arch. Med. Vet. 16 (1): 7-13. [ Links ]
LARVOR, P., J. VIOLETTE. 1969. Influence de l’ingestion d’herbe tetanique sur le metabolisme mineral (Mg, Ca, P, Na, K) et certains elements du metabolisme energetique (corps cetoniques, acides gras volatiles) chez la brevis. Nouvelle hypotheses pathogenique sur la tetanic d’herbage, Ann. Rech. Vet. : 27-44. [ Links ]
LLOYD, S.S. 1983. Immunosuppression during pregnancy and lactation, Irish. vet. J. 37: 64-70. [ Links ]
LLOYD, S., P.H. AMERASINGHE, E.J.L. SOULSBY. 1983. Periparturient immunosuppression in the bitch and its influence on the infection with Toxocara canis, J. small Anim. Pract. 24: 237-247. [ Links ]
LOMAX, M.A., G.D. BAIRD, C. MALLINSON. 1979. Differences between lactating and non-lactating cows in concentration and secretion rates of insulin, Biochem. J. 180: 281-289. [ Links ]
LOMAX, M.A.; G.D. BAIRD. 1983. Blood flow and nutrient exchange across the liver and gut of dairy cow: effects of lactation and fasting. Br. J. Nutr. 49: 481-496. [ Links ]
MAZUR, A., M. AYRAULT-JARRIER, Y. CHILLIARD, Y. RAYSSIGUIER. 1992. Lipoprotein metabolism in fatty liver dairy cows, Diabetes Metab. 18: 145. [ Links ]
MANSTON, R., A. RUSSEL, S. DEW, J. PAYNE. 1975.The influence of dietary protein upon blood composition in dairy cows, Vet. Rec. 96: 497-502. [ Links ]
McGILVERY, R. 1979. Biochemistry a Functional Approach. 2ed Holt-Saunders International Editions. Philadelphia/London/Toronto. [ Links ]
MIETTINEN, P. y J. SETÄLÄ. 1993. Relationships between subclinical ketosis, milk production and fertility in Finnish dairy cattle. Prev. Med. Vet. 17: 1-8. [ Links ]
NELSON, A.J. 1997. Practical applications of MUN analysis. Proc. 13th Annu. Univ. Wis Vet Food Anim Program. 149-181. [ Links ]
ORELLANA, P. 1994. Bases metabólicas para una estrategia alimenticia en rumiantes de alta producción. En: Simposio Internacional. Relaciones Endocrinas Durante el Crecimiento y la Reproducción. Universidad de Concepción. Chillán-Chile, pp. 78-87. [ Links ]
PAYNE, J.M., S.M. DEW, R. MANSTON, M. FAULKS. 1970.The use of metabolic profile test in dairy herds. Vet. Rec. 87:150-158. [ Links ]
RAYSSIGUIER, Y., A. MAZUR, E. GUEUX, I.M. REID, C.J. ROBERTS, 1988. Plasma lipoproteins and fatty liver in dairy cows, Res. Vet. Sci. 45:389-393. [ Links ]
REID, I.M. 1980. Incidence and severity of fatty liver in dairy cows, Vet. Rec. 107: 281-284. [ Links ]
REID, I.M., C.J. ROBERTS. 1982. Fatty liver in dairy cows, In Practice 4: 164-169. [ Links ]
REID, I.M., S.M. DEW, R.A. COLLINS. 1983. The relationship between fatty liver and fertility in dairy cows, J. Agric. Sci. (Cambridge) 101: 499-502. [ Links ]
ROBERTS, C.J., I.M. REID, G.J. ROWLANDS, A. PATTERSON. 1981. A fat mobilization syndrome in dairy cows in early lactation, Vet. Rec. 108: 7-9. [ Links ]
RODRIGUEZ, N.R., E.C. PRIGGE, D.S. LOUGH. 1985. Glucogenic and hormonal responses to abomasal casein and ruminal volatile fatty acids infusions in lactating goats, J. Dairy Sci. 68: 1968-1975. [ Links ]
ROPSTAD, E., H.J. LARSEN, A.O. REFSDAL. 1989. Immune function in dairy cows related to energy balance and metabolic status in early lactation, Act. Vet. Scand. 30: 209-219. [ Links ]
RUTTER, L.M., R.D. RANDEL. 1984. Postpartum nutrient intake and body condition: Effect on pituitary function and onset of estrus in beef cattle, J. Anim. Sci. 58:265-274. [ Links ]
SEGAL, H.L., A.C. PARKS.1982. Mechanism and regulation of protein turnover in higher animals. Critical Rev. Food. Sci. Nutr.16: 141-148. [ Links ]
SEGLAR, W.J. 1997. Maximizing forage quality, Compend. Contin. Educ. Food Anim. 19(10): S254-S261. [ Links ]
SKAAR, T. C., R.R. GRUMMER, R.M. DENTINE, R.H. STAUFFACHER. 1989. Seasonal effects of prepartum and postpartum fat and niacin feeding on lactational performance of dairy cows in early lactation, J. Dairy Sci. 72: 2028. [ Links ]
TERQUI, M., D. CHUPIN, D. GAUTHIER, N. PEREZ, J. PELAT, P. MAULEON. 1982. Influence of management and nutrition. En: Factors influencing fertility in the postpartum cow. Eds. H. Karg y E. Schallenberger. Martinus Nihjoff. The Hague. pp 384-408. [ Links ]
WATSON, E.D., L.A. WILLIAMS. 1987. Influence of the liver fat on postpartum hormone profiles in dairy cows, Anim. Prod. 45: 9-14. [ Links ]
WITTWER, F., P.A. CONTRERAS. 1980. Empleo de los perfiles metabólicos en el sur de Chile. Arch. Med.Vet. 12: 178-188. [ Links ]
WITTWER, F., A. RIQUELME. 1984. Síndrome de movilización de grasa en vacas lecheras, Monografías Med. Vet. 6: 79-84. [ Links ]
WITTWER, F., J.M. REYES, H. OPITZ, P.A. CONTRERAS, H. BÖHMWALD. 1993. Determinación de urea en muestras de leche de rebaños bovinos para el diagnóstico de un desbalance nutricional. Arch. Med. Vet. 25(2): 165-172. [ Links ]
WITTWER, F. 1996. Diagnóstico de desbalances de energía y proteínas mediante el análisis de muestras de leche y su impacto productivo en rebaños lecheros. En: III Seminario: Aspectos técnicos y perspectivas de la producción de leche. Ed. F. Lanuza y G. Bortolameolli, Serie Remehue Nº 64, pp. 71-84.
YAMAMOTO,T., H. HIRATA, H. TANIGUCHI, Y. KAWAI, A. VEMATSU, Y. SUGIYAMA. 1980. Lymphocyte transformation during pregnancy. An analysis using whole blood culture, Obstet. Gynec. 55: 215-219. [ Links ]










