Impacto de la Leucosis bovina enzoótica sobre la inmunidad del rodeo lechero
Publicado: 27 de julio de 2021
Por: Dr. Rodrigo Puentes. Área Virología - Depto. Ciencias Microbiológicas - Facultad de Veterinaria - Universidad de la República - Uruguay.
El Virus de la Leucosis Bovina (VLB) es el principal patógeno viral que afecta la lechería en muchos países del mundo, causando la enfermedad clínica denominada Leucosis bovina enzoótica (LBE). Es un Retrovirus que afecta a células de la línea linfoide, principalmente a los linfocitos B, pero también puede infectar monocitos y macrófagos. Luego de la infección, el genoma viral se integra al genoma celular en forma de provirus quedando el animal infectado de por vida (Burny et al., 1988; Aida et al., 1989; Kettmann et al., 1994).
El virus se transmite por vía horizontal y vertical, siendo la primera la principal vía de contagio (Fig 1). Los animales portadores asintomáticos son la fuente de infección en los rodeos y la transmisión se da por el traspaso de células infectadas con el virus de un bovino a otro. En las secreciones y fluidos biológicos como leche, sangre, calostro, secreción nasal, saliva, semen y orina, se pueden llegar a encontrar linfocitos infectados, transformando a estos en una fuente potencial de contagio (De la Sota, 2004). Su infectividad dependerá del recuento de linfocitos infectados en el fluido, el cual puede aumentar si ocurre un proceso exudativo (Hopkins y DiGiacomo, 1997). La mayor proporción de linfocitos infectados se encuentran en la sangre, por lo tanto cualquier medida de manejo o práctica veterinaria como extracción de sangre, vacunación, descorne, aplicación de inyectables, palpación rectal que se practiquen sin tomar medidas profilácticas correspondientes, son una importante forma de diseminación de la enfermedad por vía iatrogénica (Mammerickx et al., 1987; Hopkins y DiGiacomo, 1997).
Figura 1. Vías de transmisión del virus de la Leucosis bovina enzoótica. La transmisión horizontal por maniobras veterinarias que transporten sangre con células de un animal infectado a uno libre (agujas, guantes, etc) es la vía más importante para transmitir la infección (DiGiacomo, 1997).
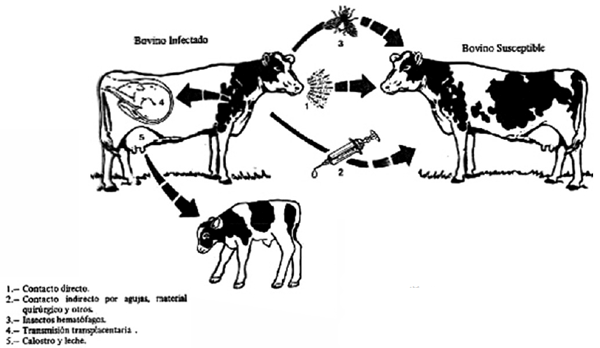
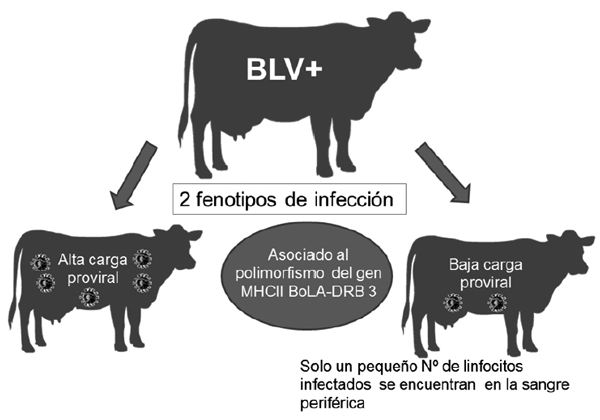
Por otro lado, también se ha demostrado que insectos hematófagos pueden jugar un rol importante en la propagación del VLB. Datos recientemente publicados (Ooshiro et al., 2013) indican que cuando estos insectos son controlados, se logra disminuir la infección a largo plazo. Vinculado a la capacidad de transmisión de un animal a otro, recientemente se ha propuesto dos perfiles o fenotipos de infección vinculados al polimorfismo del gen BoLADRB3, diferenciándose animales con alta y con baja carga proviral (Fig. 2). Esto parece ser muy importante en la transmisión del virus, ya que animales con baja carga proviral, no serían una fuente de infección para rodeos libres de VLB (Juliarena et al., 2016). Finalmente, la transmisión vertical puede ocurrir en hasta un 15 % de los casos y tiene lugar cuando un animal infectado lo transmite a la progenie por vía transplacentaria o vía digestiva a través del calostro (Martín et al., 2000).
Figura 2. Fenotipos de infección con el virus de la Leucosis bovina. Animales de baja carga viral y animales de alta carga viral (Juliarena et a., 2016).
Para el diagnóstico viral, la Organización Mundial de Sanidad Animal (OIE) recomienda el uso de las pruebas de ELISA e Inmunodifusión en gel agar (IDGA) para la detección de anticuerpos o la técnica de nested PCR (nPCR) para la identificación molecular del agente (OIE, 2018). En los últimos años, se han desarrollado técnicas para la cuantificación de la carga proviral en células de animales infectados utilizando Real timePCR (qPCR) (RolaŁuszczak et al., 2013). Si bien hasta el momento, esta técnica no ha sido incluida dentro de los métodos diagnósticos sugeridos por la OIE, puede ser muy útil para asociar la relación existente entre la cantidad de provirus (carga proviral) y el efecto negativo que el mismo produce en los animales infectados.
En Uruguay la prevalencia de VLB en rodeos lecheros es muy alta, estimándose una seroprevalencia nacional alrededor de 7080%. Incluso en animales jóvenes, (vaquillonas de entre 6 y 8 meses), se ha encontrado una prevalencia de cerca del 50% (Puentes et al., 2016a). Cerca del 90% de los animales infectados en un rodeo, son asintomáticos, lo que significa que no se encontrarán síntoma que nos indique a haga sospechar de la presencia del virus. Sin embargo, las pérdidas asociadas en rodeos infectados pueden ser importantes y principalmente están vinculadas a barreras sanitarias que muchos países imponen para la exportación de animales en pie seropositivos para VLB, disminución de la producción láctea, disminución de la longevidad del animal y disfunciones en el sistema inmune (Bartlett et al., 2013). En Uruguay no se han calculado las pérdidas que produce la presencia de este virus en el rodeo nacional. Sin embargo, en Estados Unidos se ha estimado que la infección subclínica produce pérdidas de 95Kg/vaca/ año de leche por cada 10% de aumento de la prevalencia de VLB en los tambos infectados. Esto representa pérdidas de 285 millones de dólares anuales a los productores de ese país (Bartlett et al., 2013).
El impacto del virus en la longevidad de la vaca también se ha estudiado, demostrándose que las vacas con mayores títulos de anticuerpos contra VLB tienen un 40% más de probabilidad de ser refugadas (Bartlett et al., 2013). En relación con aspectos reproductivos, si bien los resultados de las investigaciones que se han realizado hasta el momento son contradictorios, algunos autores han encontrado una disminución en la tasa de concepción en vacas seropositivas al VLB (Vanleeuwen et al., 2010, Puentes et al., 2016a). Históricamente en Uruguay, la tasa de procreo se ha situada en torno al 6070%, lo que significa aproximadamente 2.500.000 terneros menos cada año. Las causas de estas pérdidas son múltiples y muchas veces relacionadas entre sí. Sin embargo, se desconoce por completo si la infección con VLB en los rodeos participa directa o indirectamente en ese resultado, teniendo en cuenta la alta prevalencia de este virus y que el mismo puede interferir en respuestas inmunes contra otros patógenos.
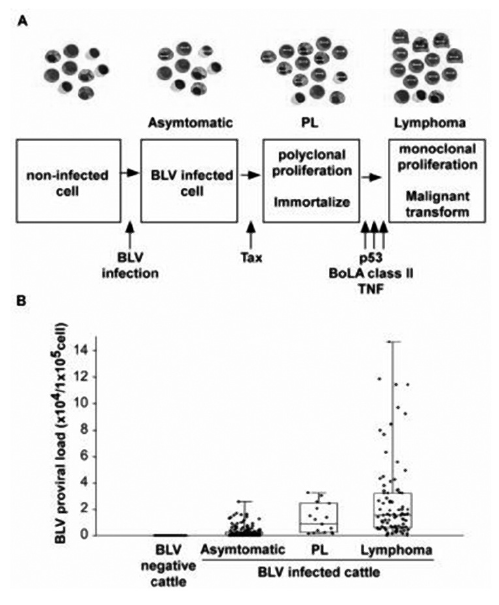
En lo que tiene que ver con la inmunidad, se ha demostrado que la infección subclínica causa disfunciones importantes del sistema inmune tanto en la respuesta inmune innata como adaptativa, que impactan directamente en la sanidad (Bartlett et al., 2014). Por ejemplo en animales seropositivos a VLB, se ha observado una disminución de la función de los neutrófilos in vitro inducido por Escherichia coli (E. coli)en vacas infectadas (Souza et al., 2012). La importancia de esto radica en que estas células del sistema inmune, son cruciales para combatir patógenos bacterianos mediante fagocitosis. Por otro parte, en fases tempranas de la infección, los animales infectados desarrollan una respuesta celular a predominio de linfocitos T helper tipo 1 (Th1), con producción de interferón gamma. En fases más crónicas con presencia de linfocitosis persistente (LP), se produce una respuesta Th2. Las alteraciones en la expresión de citoquinas muestran estar correlacionadas con la progresión de la enfermedad en infecciones crónicas, sugiriendo que el balance de las citoquinas puede contribuir a la progresión de la enfermedad. Pyeon y col. (1996) examinaron los perfiles de citoquinas en células mononucleares de bovinos de cada estadio de la enfermedad y demostraron que la producción de citoquinas Th1 (como IL2), eran promovidas en animales serológicamente positivos pero aleucémicos, más que en aquellos con LP. Los animales serológicamente positivos también expresan más IL12, clave para una respuesta Th1, pero esta disminuye en estadios más avanzados, cuando se detecta un aumento en la expresión de citoquinas Th2 como IL10. La susceptibilidad a la expansión clonal de los linfocitos B infectados por el virus está asociada con alelos específicos del complejo mayor de histocompatibilidad (Nagaoka y col., 1999). Adicionalmente, las células T infectadas con el VLB aumenta la expresión de receptores inmunoinhibitorios, lo que aumenta la habilidad de los patógenos que causan infecciones crónicas a evadir la respuesta inmune del hospedador. Y más recientemente se ha visto que la expresión de los receptores inmunoinhibitorios está correlacionado positivamente con la carga proviral (Bartlett y col., 2014), siendo esta mayor a medida que la infección progresa (Fig 3).
Figura 3. Imagen que muestra la progresión de la carga proviral del virus de la Leucosis bovina a medida que avanza la enfermedad. Extraído de Aida et al., 2013.
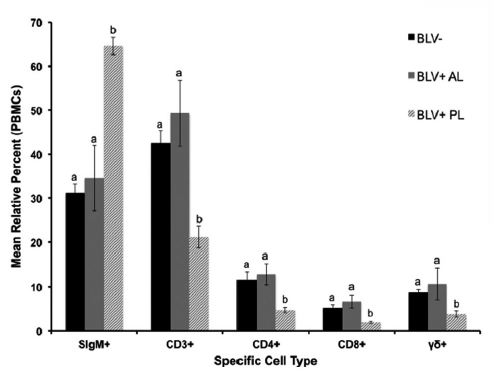
Por lo tanto, se puede decir que el virus de la Leucosis bovina no sólo causa inmunosupresión sino que además genera disturbios inmunológicos a nivel de la inmunidad celular, modificando el número y perfil de las células T (Fig. 4), que son claves en la regulación del sistema inmune tanto en infecciones naturales como en la respuesta a inmunizaciones por vacunación (Frie y Coussens, 2015). Estas alteraciones del sistema inmune podrían tener un impacto negativo en la capacidad de ganado para resistir al avance de una enfermedad infecciosa o a la respuesta a vacunas; en este sentido algunos estudios reportaron una correlación positiva entre VLB y otras enfermedades (Emanuelson y col., 1992; Trainin y col., 1996) o cuestionan la habilidad de bovinos infectados con VLB para responder inmunológicamente contra otros patógenos. Erskine y col. (2011), en ensayos a campo, encontraron que vacas infectadas con VLB tuvieron un menor título de un determinado isotipo de anticuerpos IgG (específicamente IgG2) contra E. coli J5 (vacuna utilizada contra la mastitis) en comparación con vacas no infectadas. En este mismo sentido y en otro ensayo, se encontró que vacas infectadas con VLB produjeron menor títulos de IgM e IgG2 pomona (Frie et al., 2016). La respuesta a la vacunación contra la Fiebre Aftosa también se ha estudiado en animales infectados con VLB. En este caso, Puentes et al. (2016b) encontraron que las vacas infectadas produjeron significativamente un menor título de IgM e IgG1 a los 15 días post vacunación contra el virus de la Fiebre Aftosa. Sin embargo, más recientemente Jaworsky et al. (2018) demostró que el nivel total y la afinidad de los anticuerpos específicos contra el virus de la Fiebre Aftosa, no difieren entre animales libres e infectados con VLB, cuando se realizan vacunaciones repetida en los animales adultos.
Figura 4. Imagen que muestra la relación de las distintas poblaciones celulares según el estadío de la infección con el virus de la Leucosis bovina. BLV: Animales negativos; BLV+AL: Animales infectados pero aleucémicos; BLV+PL: Animales infectados y con Linfocitosis persistente. SIgM+: Linfocitos B; CD3+: Linfocitos T; CD4+: Linfocitos T CD4 o “helper”; ɣẟ+: Linfocitos T gamma deltas. Extraído de Vet Immunol Immunopathol. 2014;163(34):10314.
En conclusión y en base a lo expresado, podemos decir que el virus de la Leucosis bovina, causa trastornos importantes en las funciones de las células del sistema inmune tanto innato como adaptativo. Eso se ha demostrado en experimentos in vitro y en ensayos in vivo con bovinos. En este caso, las principales investigaciones han demostrado la interferencia de VLB con distintas vacunaciones contra otros patógenos de interés productivo. Sin embargo, las investigaciones que intentan demostrar la predisposición de animales infectados con VLB para contraer otras enfermedades infecciosas, aún son pocas y no concluyentes, necesitando más información para demostrar o descartar esta hipótesis.
Referencias
- Aida Y, Murakami H, Takahashi M, Takeshi-ma SN. (2013) Mechanisms of pathogenesis induced by bovine leukemia virus as a model for human T-cell leukemia virus. Front Micro-biol. 8;4:328.
- Aida Y, Miyasaka M, Okada K, Onuma M, Ko-gure S, Suzuky M, Minoprio P, Levy D, Ikawa Y. (1989). Further phenotypic characteriza-tion of target cells for bovine leukemia virus experimental infection in sheep. American Journal of Veterinary Research 50:1946-1951.
- Bartlett PC, Norby B, Byrem TM, Parmelee A, Ledergerber JT, Erskine RJ. (2013) Bovine leukemia virus and cow longevity in Michigan dairy herds. J Dairy Sci. 96(3):1591-7.
- Bartlett PC, Sordillo LM, Byrem TM, Norby B, Grooms DL, Swenson CL, Zalucha J, Erskine RJ. (2014) Options for the control of bovine leukemia virus in dairy cattle. J Am Vet Med Assoc. 244(8):914-22.
- Burny A, Cleuter Y, Kettmann R, Mammeric-kx M, Marbaix G, Portetelle D, Van den Broeke A, Willems L, Thomas R. (1988). Bovine leu-kemia: facts and hypotheses derived from the study of an infectious cancer. Adv Vet Sci Comp Med. 32:149-170.
- De la Sota, MD. (2004). Manual de procedi-mientos Leucosis Bovina Enzootica, Dirección Nacional de Sanidad y Calidad Agroalimen-taria, SENASA, Argentina. Disponible:http:// www.intranet.senasa.gov.ar/intranet/image-nes/archivos/dnsa/manuales_de_procedi-miento/09%20Leucosis.pdf Fecha de consul-ta: 28/07/16.
- Emanuelson y col., 1992
- Erskine RJ, Bartlett PC, Sabo KM, Sordillo LM. (2011). Bovine Leukemia Virus Infection in Dairy Cattle: Effect on Serological Respon-se to Immunization against J5 Escherichia coli Bacterin. Vet Med Int. 3:915747.
- Frie M, Sporer K, Wallace J, Maes R, Sordillo L, Bartlett P, Coussens P. (2016). Reduced hu-moral immunity and atypicall cell-mediated immunity in response to vaccination in cows naturally infected with bovine leukemia vi-rus. Vet Immunol Immunop. 182:125-135.
- Frie MC, Coussens PM (2015). Bovine leu-kemia virus: a major silent threat to proper immune responses in cattle. Vet Immunol Immunopathol. 163(3-4):103-14.
- Hopkins SG, Digiacomo RF. (1997). Natural transmission of bovine leukemia virus in dairy and beef cattle. Veterinary Clinics of North America: Food Animal Practice. 13:107–128.
- Jaworski JP, Sala JM, Capozzo A. (2018) Short communication: Bovine leukemia virus infection in adult cows does not interfere with foot-and-mouth disease vaccination. J Dairy Sci. 2018 Dec;101(12):11247-11250.
- Juliarena MA, Barrios CN, Ceriani MC, Es-teban EN (2016). Hot topic: Bovine leukemia virus (BLV)-infected cows with low proviral load are not a source of infection for BLV-free cattle. J Dairy Sci. 99(6):4586-9.
- Kettmann R, Burny A, Callebaut I, Droog-mans L, Mammerick M, Willens L, Portetelle D. (1994). Bovine leukaemia virus, in: Levy JA (Ed.), The Retroviridae, Plenum Press. 39-81.
- Mammerickx M, Portetelle D, de Clercq K, Burny A. (1987). Experimental transmission of enzootic bovine leukosis to cattle, sheep and goats: infectious doses of blood and in-cubation period of the disease. Leuk. Res. 11:353-358.
- Martín D, Arjona A, Viana M, Soto I, Barque-ro N, Gómez-Lucía E. (2000). Comparación de métodos serológicos y virológicos para el diagnóstico de la infección por el virus de la leucosis bovina enzoótica. Med. Vet. 17:133-141.
- Nagaoka, Y., Kabeya, H., Onuma, M., Kasai, N., Okada, K., Aida, Y. (1999). Ovine MHC class II DRB1 alleles associated with resistance or susceptibility to development of bovine leu-kemia virus-induced ovine lymphoma. Cancer Res. 59:975-981.
- Ooshiro M, Konnai S, Katagiri Y, Afuso M, Arakaki N, Tsuha O, Murata S, Ohashi K. (2013). Horizontal transmission of bovine leukemia virus from lymphocytotic cattle, and beneficial effects of insect vector control. Ve-terinary Record. 173:527.
- Puentes R, De Brun L, Algorta A, Alvarez JP, Sacco G, Oliveira M, Llambí S. (2016a). Hori-zontal transmission dynamics of Bovine leu-kemia virus (BLV) and negative effect on re-productive performance in naturally infected holstein heifers. Science and animal health. V.4 N.3 SET/DEZ 2016 P. 294-309.
- Puentes R, De Brun L, Algorta A, Da Silva V, Mansilla F, Sacco G, Llambí S, Capozzo AV. (2016b). Evaluation of serological response to foot-and-mouth disease vaccination in BLV infected cows. BMC Vet Res. 12(1):119.
- Pyeon D, Diaz F, Splitter G. (2000). Prosta-glandin E2 Increases Bovine Leukemia Virus tax and pol mRNA Levels via Cyclooxygenase 2: Regulation by Interleukin-2, Interleukin-10, and Bovine Leukemia Virus. Journal of Viro-logy. 74:5740-5745.
- Rola-Łuszczak M, Finnegan C, Olech M, Choudhury B, Kuźmak J. (2013). Development of an improved real time PCR for the detec-tion of bovine leukaemia provirus nucleic acid and its use in the clarification of inconclusi-ve serological test results. J Virol Methods. 189(2):258-64.
- Souza F, Blagitz M, Latorre A, Sanchez E, Ba-tista C, Weigel R, Renno F, Sucupira M, Della Libera A. (2012) Intracellular reactive oxygen species production by polymorphonuclear leukocytes in bovine leukemia virus-infected dairy cows. J Vet Med Sci. 74(2):221-5.
- Trainin Z., Brenner J., Meirom R., Ungar-Waron H. (1996) Detrimental effect of bovine leukemia virus (BLV) on the immunological state of cattle. Vet.Immunol. Immunopathol. 54, 293–302.
- Vanleeuwen JA, Haddad JP, Dohoo IR, Kee-fe GP, Tiwari A, Tremblay R. (2010). Associa-tions between reproductive performance and seropositivity for bovine leukemia virus, bovi-ne viral-diarrhea virus, Mycobacterium avium subspecies paratuberculosis, and Neospora caninum in Canadian dairy cows. Preventive Veterinary Medicine. 94:54–64.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación



