INTRODUCCIÓN
En la ganadería lechera intensiva es necesario mantener correctos valores sanitarios para así poder generar ganancias y darle rentabilidad a este negocio. Dadas las condiciones actuales, cualquier falla en aspectos sanitarios que afecten directamente la calidad de la leche o en parámetros reproductivos generará para la empresa pérdidas de toda índole, disminuyendo su competitividad, rentabilidad y margen de ganancia.
La Mastitis Bovina es considerada una enfermedad altamente prevalente en el ganado lechero, y es una de las más importantes que afecta mundialmente la industria lechera; pues ocasiona pérdidas económicas muy fuertes a todos los productores de leche en el mundo debido a la disminución de la calidad y cantidad de leche producida y un aumento en los costos de tratamiento y servicios veterinarios, y pérdida de animales (Fernández et al., 2012).
Asimismo, las fallas reproductivas afectan a la totalidad del sistema productivo, pues dependen de los factores reproductivos para mantener la producción o en todo caso aumentarla con un mayor número de animales en producción. Las fallas en este aspecto acarrean problemas a mediano y largo plazo, comprometiendo la existencia del hato productivo.
Estudios anteriores indicaron que existía una relación entre la Mastitis Bovina y el aumento de los intervalos reproductivos como Intervalo Parto – 1° Servicio e Intervalo Parto – Concepción y Número de Servicios por Concepción, como es el caso de Gunay et al., 2008, quien reporta que existe una relación entre la mastitis y el desempeño reproductivo, y la ocurrencia de la mastitis aguda retrasa el intervalo parto – 1° servicio, aumenta el intervalo parto – concepción y aumenta el número de servicios para la concepción, más no se muestran valores en cuanto a número de pariciones o intervalo entre Partos.
A sabiendas que el parto es necesario para la producción natural y eficiente de leche, este estudio tuvo como objetivo establecer la relación entre la mastitis clínica con el número de partos en vacas Holstein de crianza intensiva.
GENERALIDADES
La mastitis bovina es una compleja enfermedad que afecta a la glándula mamaria, con graves consecuencias económicas especialmente en las regiones con una producción lechera intensiva. Las pérdidas causadas por mastitis se clasifican en:
- La pérdida por baja producción del animal enfermo.
- Eliminación de la leche por uso de medicamentos.
- Aumento en los costos de medicamentos.
- Reestructuración del trabajo establecido por el Médico Veterinario y personal encargado de la sanidad.
- Aumento en los costos de la mano de obra por alteración de los procesos de manejo.
- Modificación de la rutina de ordeño de forma negativa y mayor número de horas/hombre por vaca (Fetrow, 2000).
Los problemas de la glándula mamaria son la causa más común para un sacrificio temprano de las vacas, además de los problemas de fertilidad reduciendo la vida productiva de los animales. En los Estados Unidos se estima que el costo que ocasiona la mastitis a los productores de leche es entre 1.2 y 1.7 billones de dólares por año o aproximadamente el 6% del valor total de la producción del país (Concha, 2004). En nuestro país no existen estudios específicos y exactos que cuantifiquen la pérdida por mastitis en predios lecheros.
LA MASTITIS
Es la inflamación en la glándula mamaria, la cual reduce la producción de leche, altera la composición de la misma, pudiendo clasificarse en aguda o crónica según la duración, puede ser clínica o sub-clínica según las manifestaciones clínicas (Gasque, 2008). La mastitis se caracteriza por alteraciones físicas, químicas, organolépticas y casi siempre, contaminación microbiológica de la leche, con modificaciones patológicas del tejido glandular (DC.Blood – OM, Radostits, 1993). Las consecuencias de la mastitis incluyen:
- La disminución de la producción, debido a la inflamación.
- Desecho de leche por mala calidad y uso de antibióticos.
- Mayor demanda de tiempo para el tratamiento de las glándulas afectadas.
- Mayores honorarios para el personal encargado; exigencias logísticas y económicas de esta enfermedad.
Una de las consecuencias adversas de la mastitis es la formación de tejido conjuntivo dentro de la ubre como resultado del intento de la glándula de bloquear la infección; la presencia de dicho tejido limita el área en la que los alveolos y los conductos pueden proliferar, y por tanto reduce el potencial de la glándula para la producción de leche. La glándula mamaria es el ejemplo de un órgano en el que la respuesta inflamatoria suele ser perjudicial para su función (Fisiología Veterinaria Cunningham 2007).
ANATOMÍA Y FISIOLOGÍA DE LA GLÁNDULA MAMARIA
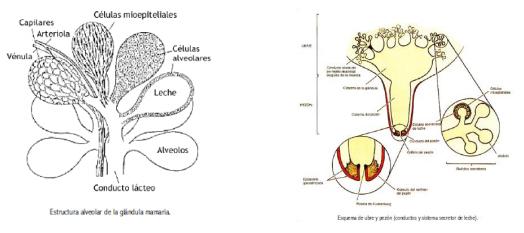
La glándula mamaria es clasificada como una glándula de composición túbuloalveolar, que está formada por tejido intersticial, parénquima (epitelio secretor), ductos, vasos y nervios (Anatomy and Physiology of Farm Animals, 2009). Posee una ubicación inguinal con mitades derecha e izquierda diferenciadas, y cada mitad posee un cuarto anterior y posterior. Cada mitad es independiente con su contra parte en lo que respecta al suministro de sangre, nervios, drenado linfático y aparato suspensorio. Un surco longitudinal marca la separación ventral de las mitades.
La unidad secretora de leche es el alveolo. Un número de éstos, agrupados juntos y rodeados por una capa de tejido conectivo, es conocido como lobulillo. Una gran división de tejido conectivo rodea a un número de lobulillos para formar un lóbulo. Las unidades secretoras de la glándula mamaria están divididas en lobulillos y lóbulos, estos están rodeados por células mioepiteliales contráctiles, que son también llamadas células canasta; estas células se contraen para expulsar leche (llamada bajada de la leche) en respuesta a la liberación en oxitocina. Los alveolos convergen en conductos que conducen la leche a la cisterna dentro de la glándula y finalmente a la cisterna de cada pezón. La expulsión de la leche de cada pezón ocurre a través del canal del pezón, que se mantiene bien cerrado por un esfínter muscular. (Functional Anatomy and Physiology of Domestic Animals, 2005).
La glándula mamaria posee una serie de mecanismos de defensa para hacerla menos accesible como son:
- La piel de la glándula y su estrato córneo.
- El músculo liso y la elasticidad del conducto del pezón.
- La lactoferrina y lactoperoxidasa.
- El complemento sérico.
- Las inmunoglobulinas, las células somáticas y citoquinas contenidas en la leche y en la propia glándula mamaria.
Sin embargo debe considerarse que los puntos vulnerables de infección de la glándula son el meato del pezón que debe impedir el ingreso ascendente de microorganismos, y por soluciones de continuidad de la piel, las cuales permiten el ingreso al tejido glandular de agentes nocivos, favoreciendo la invasión, infección e inflamación de la glándula mamaria (Meglia et al., 2001).
MASTITIS – FACTORES DE RIESGO:
Al estar identificada como una enfermedad multifactorial, depende de diversos aspectos para que el cuadro pueda progresar como:
Factores de riesgo animal;
- Edad y número de parto: A mayor edad o número de partos el sistema inmunológico del animal tiende a ser menos activo, repercutiendo en la eficiencia de la respuesta inmune frente al agente causal.
- Estado de lactación: La prevalencia de la enfermedad es mayor durante el pico de lactación, pues un aumento productivo y los requerimientos reproductivos, acarrean una mayor demanda energética con consecuencias negativa en la homeostasis del animal.
- Balance Energético Negativo-BEN: Esto se da al principio de una nueva lactación, donde las exigencias productivas hacen que la vaca movilice sus reservas de grasa y glucosa, debido a que el consumo de alimento no basta para poder suplir los requerimientos propios del animal. Esto íntimamente relacionado con la funcionabilidad hepática, pues el hígado es el encargado de no sólo la conversión de metabolitos en energía sino también la desintoxicación corporal; Balances energéticos avanzados, complicaciones hepáticas, y mal manejo de minerales en la ración no sólo pueden complicar el estado sanitario del animal en el aspecto nutricional y energético, sino que este mismo estado puede contribuir a desbalances homeostáticos con repercusiones sanitarias, inmunológicas, reproductivas y productivas.
- Prevalencia de infecciones en el rebaño: A mayor cantidad de animales enfermos con mastitis, sean clínicos o sub-clínicos, se incrementan las probabilidades de infección por mayor carga de agentes microbiológicos, sea en la ubre como en la máquina de ordeño.
- Raza: Las razas especializadas en la producción lechera son más propensas a presentar cuadros de mastitis clínica por las exigencias genéticas, productivas y por el manejo (constantes ordeños).
- Características del ordeño: Una mala rutina de ordeño, la mala desinfección y el mal estado de los equipos de ordeño.
- Morfología del pezón, condición física del pezón: Los pezones que presentan daños tisulares, resquebrajamientos, resequedad, así como fallas en el esfínter del pezón son más propensos a infecciones bacterianas por pérdida de las barreras físicas de defensa.
- Estado nutricional: En los animales con Balance Energético Negativo-BEN, así como en los animales débiles y de bajas condiciones corporales, se presenta depresión en el sistema inmunológico, favoreciendo la aparición de la enfermedad.
- Medio ambiente: La mala desinfección de corrales, la distribución y exceso de animales dentro de los corrales, así como el exceso de guano en los corrales hacen de medio de cultivo para los agentes patógenos que producen la mastitis.
- Condiciones y características de manejo: Mecanismos de trabajo que producen estrés en los animales, instalaciones pensadas en el ahorro de espacio, descuido por parte de los operarios, mala visión sobre el estado sanitario del animal, favorecen la aparición de la enfermedad, debido a que son agentes depresivos indirectos. (Radostits, 1999).
AGENTES CAUSALES
La principal causa de la mastitis es infecciosa; siendo los agentes comúnmente encontrados bacterias como: Streptoccocus agalactiae, Streptoccocus dysgalactiae, Streptoccocus uberis, Escherichia coli, Pasteurella sp, Staphyloccocus aureus, Clostridium perfringens, Nocardia asteroides, Mycoplasma bovis, Corynebacterium pyogenes, Pseudomonas, Leptospira sp, Serratia sp, Klebsiella sp, Fusobacterium sp. Sumados a estos agentes se ha podido encontrar: Algas como Prothoteca, hongos como Aspergillus fumigatus, Trichospora sp y Candida, además de levaduras como Cryptococcus neoformans. Es importante mencionar que generalmente son agentes patógenos mixtos y se aíslan de acuerdo al agente que predomine en la infección (Radostits, 1993). Las bacterias de los Géneros Staphyloccocus, Streptoccocus, Corynebacterium y algunos gram negativos son responsables de más del 90% de casos clínicos y sub-clínicos. Staphyloccocus aureus y Streptoccocus agalactiae están asociados a ubres infectadas, lesiones de pezones y colonización del canal del pezón, transmitiéndose de vaca a vaca y de cuarto a cuarto al momento del ordeño, tanto en mastitis clínica como en mastitis crónica o sub-clínica. Los llamados patógenos ambientales (coliformes, Streptoccocus uberis y Pseudomona aeruginosa están diseminados en donde viven los animales, este tipo de infecciones ocurren por lo general en el período de seca y especialmente en el período de transición, etapa que comprende entre 30 y 21 días antes y después del parto, con presentación clínica o subclínica. (Corbellini, C., 2001)
MECANISMOS DE AFECCIÓN DE LA GLÁNDULA MAMARIA
Se produce generalmente durante las primeras semanas de lactación, la glándula es sensible a la infección o por el desarrollo de grietas y fisuras en los pezones, desde esta puerta de entrada, las bacterias pueden invadir el tejido mamario (Robbins y Cotran 2005); o por la infección siguiendo la vía del conducto del pezón. La inflamación después de la infección se considera un fenómeno natural, siguiendo tres etapas:
- Fase de invasión, dependiente de:
- Presencia y densidad poblacional de microorganismos en el medio.
- Frecuencia con que los pezones de la vaca se hallan contaminados con estos microorganismos dependiendo en gran medida de la higiene en el ordeño
- Grado de lesión de los esfínteres de los pezones, la máquina de ordeño y su estado funcional, el cuidado de los pezones y el reflujo de leche están relacionados con este factor.
- Tono del esfínter de los pezones. La debilidad de estos facilita la invasión.
- Presencia de sustancias antibacterianas en el conducto glandular
- Fase de infección, relacionada a:
- Tipo de bacteria. Su virulencia y capacidad de adhesión.
- Susceptibilidad de los microorganismos a los tratamientos utilizados y su correcto uso.
- Presencia de sustancias protectoras en la leche.
- Leucocitosis intensa preexistente, a consecuencia de mastitis recurrente o a traumatismo físico.
- Etapa de lactación: La infección se produce más fácilmente en el periodo de seca por ausencia de flujo físico.
- Fase de inflamación, generada debido a:
- Patogenicidad y capacidad invasora de los tejidos por parte de los microorganismos causales.
- Susceptibilidad del tejido mamario.
Si las bacterias no son totalmente destruidas pueden continuar multiplicándose y empezar a invadir los conductos y áreas alveolares; así las células secretoras de leche que son dañadas por las toxinas bacterianas van liberando sustancias irritantes que conducen a un incremento en la permeabilidad de los vasos sanguíneos y la agregación de células de respuesta inflamatoria que son movilizados a la zona de infección penetrando en el tejido alveolar. Las sustancias liberadas por los leucocitos conducen a una destrucción completa de las estructuras alveolares que son reemplazadas por tejido conectivo y cicatricial. A medida que la infección persiste y los conductos se mantienen cerrados, la leche atrapada genera que las células secretoras pasen a una etapa de descanso y el alveolo comienza a reducir su tamaño. Algunas veces los microorganismos son eliminados y la infección no progresa, en este caso los conductos tapados se abren y la composición y producción de leche retorna a la normal en varios días (Wattiaux, 1998).
La evolución del cuadro dependerá además del agente patógeno causal, es así que en una infección por Staphyloccocus aureus o por Streptoccocus agalactiae durante los estadios tempranos de lactación; el daño tisular es mínimo y generalmente reversible. Si las bacterias sobreviven formaran micro-abscesos que irán creciendo hasta ser clínicamente palpables. En el curso crónico de la mastitis por S. aureus o St. Agalactiae se da la destrucción de alveolos, taponamiento de conductos galactóforos y regresión del epitelio alveolar que es reemplazado por tejido fibroso afuncional (Corbellini, 2008).
Si la multiplicación de microorganismos no supera los mecanismos intrínsecos de defensa inespecífica de la glándula mamaria, se instaura la infección sub-clínica que es detectada por unas pruebas indirectas; la prueba más utilizada en nuestro medio es la California Mastitis Test (CMT). La prueba consta de un reactivo, el cual produce la lisis de los neutrófilos a medida que el compuesto se vuelve más denso; se explica que es debido a una mayor cantidad de células somáticas, puesto que a mayor densidad, mayor lisis celular.
LA PREÑEZ
RECONOCIMIENTO MATERNO DE LA PREÑEZ
En los vacunos el reconocimiento de la preñez ocurre entre los días 16 y 19 después de la fecundación, el embrión bovino produce un número de proteínas de bajo peso molecular que incluye la proteína – 1 trofoblástica bovina (bTP-1) la cual se clasifica como un interferón – tau (IFN – τ) y se denomina IFN-τ bovino (bIFN-τ). Debido a que el embrión es un cuerpo extraño para el sistema inmunológico materno, produce estas proteínas para poder impedir la destrucción del embrión y así pueda ser reconocido por la madre. Como factor complementario para proteger la preñez, el endometrio de vacas preñadas produce un inhibidor de la síntesis de prostaglandina endometrial (EPSI) que específicamente reduce la síntesis de PGF2α (Hafez, 2000), con el objetivo de evitar la luteólisis y permitir la implantación, reconocimiento y crecimiento embrionario.Para el día 42 de vida después de la fecundación, termina el período embrionario al completarse la diferenciación. El producto es llamado entonces feto, en el cual, la mayoría de tejido, sistemas y órganos se encuentran ya formados (Thatcher, 2004).
FECUNDACIÓN, SEGMENTACIÓN E IMPLANTACIÓN
- Fecundación: es el proceso por el cual el óvulo recibe al espermatozoide para fusionar sus núcleos y formar el huevo o cigoto, volviéndose una célula diploide.
- Segmentación: consiste en la división vertical de las células del cigoto a lo largo del eje principal, las células hijas resultantes son llamadas blastómeros. En una segunda división se producen cuatro blastómeros y en una tercera división se producen ocho blastómeros. Cuando el embrión se ha desarrollado hasta las etapas de 8 a 16 células es transportado al útero en donde continúa su división. Los óvulos son transportados al útero, estando el óvulo fecundado o no (Hafez, 2000).
- Migración intrauterina: El escape del blastocisto de la zona pelúcida da el primer contacto de célula a célula entre el embrión y el epitelio uterino materno, inicialmente el embrión de especies domésticas debe cubrir físicamente una gran parte del endometrio materno para regular la liberación de prostaglandina F2α y prevenir con ello la luteólisis.Al parecer, las prostaglandinas de la serie F que actúan localmente, impiden el tránsito del embrión hasta el útero, mientras que las de la serie E posiblemente aceleran dicho transporte (Hafez, 2000).
- Implantación: La fijación del embrión al endometrio comienza aproximadamente en el día 19. La sobrevivencia del embrión y el establecimiento de la gestación involucran la comunicación activa y pasiva entre el embrión y el útero. En esta etapa es importante la manutención del cuerpo lúteo como resultado de las señales embrionarias para la madre, garantizando la producción continua de progesterona, la cual es necesaria para preparar el endometrio para la implantación y nutrición embrionaria (Sartori, 2004). El embrión sintetiza y secreta esteroides y proteínas para señalar su presencia al sistema materno, estas sustancias sirven para modular la síntesis y liberación de prostaglandina F2α y evitar la regresión del cuerpo lúteo. Durante el período crítico de la liberación de PGF2α uterina, el embrión debe cubrir una gran parte del endometrio materno para regular la producción de PGF2α. Una glucoproteína transmembranosa, llamada Muc-1 es abundante durante la fase no receptiva de la preñez y puede servir como factor antiadherente contra el embrión fecundado. Después de 8 a 10 días de exposición a la progesterona, la disminución de receptores nucleares para dicha hormona en el epitelio uterino conduce a la pérdida del efecto directo de la progesterona en este tipo de célula. Como la síntesis epitelial de Muc-1 es estimulada por la progesterona la pérdida del receptor de progesterona del epitelio uterino reduciría la producción de Muc-1 y se abriría un estado receptivo para la adhesión del embrión.
DURACIÓN Y MANTENIMIENTO DE LA GESTACIÓN
La gestación bovina dura un aproximado de 280 días regularmente. Pueden existir variaciones en este período, como por ejemplo la edad al parto, el estado nutricional y sanitario, problemas de manejo, etc. Toda condición que genere estrés en los animales puede provocar un acortamiento en los días de gestación. El cuerpo lúteo es necesario exclusivamente para el mantenimiento de la preñez hasta alrededor de los 200 días de gestación. Los dos últimos meses de gestación la placenta debe ser capaz de mantener la preñez por la síntesis de estrógenos y progesterona, mientras que el cuerpo lúteo continúa produciendo progesterona pero en menor cantidad. Si por alguna razón la hembra recibe una dosis adecuada de prostaglandina F2α, sea endógena o exógena, se puede producir la pérdida de la gestación por luteólisis y contracción del miometrio (Gädicke et al., 2008).
PREÑEZ Y PARTO
El feto determina el momento del parto mediante la secreción de factores corticales suprarrenales. Los glucocorticoides estimulan la producción de Prostaglandina F2α (PGF2α) por la placenta, lo cual a su vez provoca la luteólisis o regresión de las células lúteas y da por resultado una reducción de los niveles de progesterona. Estos niveles bajos de progesterona promueven la contracción del miometrio y el aumento consecutivo de la proporción estradiol – progesterona facilitará la liberación de oxitocina de la hipófisis posterior estimulando las contracciones uterinas. Esto a su vez fomenta la liberación adicional de PGF2α a medida que progresa el parto (Hafez, 2000).
INTERRUPCIÓN DE LA GESTACIÓN: LA MASTITIS Y PREÑEZ
PÉRDIDA DE PREÑEZ
La magnitud de las pérdidas varía enormemente en los diferentes períodos de la gestación; en el vacuno el 14% de las inseminaciones pueden dar como resultado fallas en la concepción debido a un mal manejo, gestaciones ectópicas, etc. Un 20% representa muerte embrionaria temprana (antes de los 3 meses) y de un 2 a 4% pérdida de preñez en los últimos seis meses de la gestación (Miller, 1995).La terminación de la preñez puede ocurrir en distintas etapas:
- Antes del reconocimiento materno de la preñez, en cuyo caso no se afecta la duración del ciclo, la cual ocurre entre los días 16 y 19 después de la fecundación.
- Después del reconocimiento materno de la preñez y está relacionado con una alteración en la longitud del ciclo.
- Durante la etapa fetal (Hafez, 2000).
Una gran proporción de estas pérdidas ocurren entre el 8vo y 19no día después del servicio resultando en el retorno al celo 18 a 24 días después del servicio. Otras pérdidas ocurren después del reconocimiento de la preñez por la madre entre los 17 y 19 días después del servicio pero antes de que la preñez pueda ser detectada por palpación rectal entre los 35 a 42 días. Esto da como resultado un tardío o irregular retorno al estro (Moore et al., 2005).
MORTALIDAD EMBRIONARIA
Es la pérdida del embrión ocurrida entre la fertilización y el período final de la diferenciación de las estructuras fetales, en la actualidad se considera que la mortalidad embrionaria en bovinos constituye un problema que causa importantes pérdidas económicas en las industrias ganaderas. Las pérdidas embrionarias son difíciles de diagnosticar ya que se indica que la mayoría de las vacas involucradas retornan al celo entre los 20 a 22 días después del servicio, por lo que se supone que la muerte embrionaria se originó entre los 7 y 17 días, periodo correspondiente entre el trasplante embrionario y el reconocimiento materno de la preñez. De acuerdo con lo anterior se define un período crítico entre los días 15 y 17, en donde el endometrio podría estar recibiendo una señal anti-luteolítica para ejercer un bloqueo del mecanismo de síntesis de PGF2α endometrial (Tovio et al., 2006).
FACTORES ASOCIADOS A MORTALIDAD EMBRIONARIA
- Factores endocrinos: El transporte acelerado o lento del óvulo como resultado del desequilibrio entre estrógenos y progesterona causa la muerte del embrión antes de su implantación. Un período crítico para supervivencia embrionaria es la etapa de blastocisto tardía, al parecer en bovinos la muerte es causada por deficiencia de progesterona durante la fase de cuerpo lúteo del ciclo.
- Lactación: Durante la lactación en la vaca se observa mortalidad embrionaria que se caracteriza por ciclos estrales prolongados después del apareamiento (Hafez, 2000). La secreción sub-normal de progesterona es común en vacas en lactación que se encuentran en balance energético negativo durante las siguientes seis semanas postparto (Hernández et al., 1998).
- Nutrición de la hembra: En vacas lecheras, el consumo alto de proteína degradable en el rumen conduce a mortalidad embrionaria, este efecto puede deberse a la reducción del pH del ambiente uterino durante la fase lútea del ciclo en el que el embrión debe crecer; así también el bajo consumo energético en la ración así como y deficiencias nutricionales específicas afectan las tasas de ovulación y de fecundación, además de causar la muerte prenatal (Hafez, 2000).
- Estrés térmico: El estrés térmico entre los días 8 y 17 de la preñez puede alterar el ambiente uterino así como el crecimiento y la actividad secretora del embrión; al parecer el estrés térmico antagoniza los efectos inhibitorios del embrión sobre la secreción uterina de PGF2α (Hafez, 2000).
- Mastitis: El crecimiento celular y la lisis de las bacterias luego de la infección bacteriana de la ubre, resultan en la liberación de los componentes antigénicos de la pared celular conduciendo al incremento de mediadores inflamatorios. Cada tipo de patógeno podría actuar mediante mecanismos similares para incrementar los mediadores inflamatorios, como cortisol, interleukina-1 y PGF2α dando como resultado la falla reproductiva (Stewart et al., 2004).Concentraciones elevadas de PGF2α en vacas lecheras con mastitis clínica podrían causar disminución del desarrollo y calidad del embrión, resultando en aumento de servicios por concepción y aumento de días abiertos. Las endotoxinas generadas por los agentes Gram negativos productores de mastitis pueden favorecer la síntesis de prostaglandinas F2α, provocando perturbaciones reproductivas relacionadas con anormalidades del ciclo estral, intervalos entre estros alterados y menor duración de la fase luteal del ciclo estral (Córdova et al., 2008). Concentraciones elevadas de PGF2α pueden generar la disminución en el desarrollo embrionario o regresión luteal (Hockett, 2001). Hertl et al., 2010, demostró que la mastitis clínica ocurrida cerca al momento de la inseminación, sea antes o después del servicio, estuvo asociada con una reducción de la probabilidad de concepción.
PÉRDIDAS PRENATALES
Las pérdidas prenatales comprenden a las producidas entre el diagnóstico de preñez y la iniciación de los trabajos de parto. No incluyen por lo tanto, las pérdidas embrionarias que son anteriores al diagnóstico de preñez y los terneros que se encuentran muertos al momento del parto o que mueren durante el mismo (Bavera, 2000). Las causas incluyen: Deficiencia de minerales como fósforo, calcio, proteína y también energía así como exceso de hierro, calidad y cantidad de forrajes, edad y raza de la vaca, problemas de locomoción o desplazamiento en el ambiente, problemas de manejo y causas infecciosas (Avellaneda, 2006).
SÍNDROME DEL ABORTO BOVINO
Las pérdidas sobre la producción que produce el aborto bovino corresponden no sólo a la potencial pérdida del ternero, sino también a todas las acciones que se debieron realizar para lograr la gestación en la vaca, como son gasto de semen, personal, alimentación, espacio ocupado dentro de la infraestructura, etc; así como la pérdida del pico de producción de leche futura no realizado como consecuencia del alargamiento del lapso entre partos y de secuelas como infertilidad o de pérdidas embrionarias tempranas post-aborto y alargamiento del intervalo generacional. Además, son una causa importante de eliminación de vacas del hato (Gädicke et al., 2008).
ABORTO
El aborto es definido como la pérdida del producto de la concepción a partir del período fetal (aproximadamente a los 42 días) hasta antes de los 260 días en el caso del bovino (Rivera, 2001). En el caso de abortos no infecciosos se puede atribuirá a niveles de producción de leche y especialmente factores ambientales y de manejo pueden estar influenciando directa o indirectamente en la supervivencia embrionaria/fetal en bovinos, como por ejemplo anormalidades cromosómicas, estrés, productos tóxicos, teratogénicos o aborticos y nutricionales, desequilibrios hormonales, edad y período lactacional (Sartori, 2004).
FACTORES ASOCIADOS AL ABORTO
FACTORES NO INFECCIOSOS:
- Agentes químicos, fármacos y plantas tóxicas.
- Hormonales, como altas dosis de estrógenos, glucocorticoides, PGF2α.
- Nutricionales, como inanición, malnutrición, deficiencia de vitamina A o yodo.
- Genéticas o cromosómicas que incluyen mortalidad embrionaria, anormalidades fetales.
- Físicas: lavados o inseminación por útero grávido, estrés.
- Diversas: preñez gemelar, alergias, anafilaxia.
- Placentitis inespecífica, en vacunos la progesterona se produce en el cuerpo lúteo hasta cerca del parto, una placentitis leve puede causar poco trastorno en la vida del feto y originar un parto normal con la retención de la placenta como única manifestación clínica notable. Si la placentitis es un proceso crónico puede provocar un placentitis moderada, siendo la lesión grave en partes de la placenta pero limitada en su extensión y sólo progresa levemente. La placentitis progresiva que se desarrolla despacio puede llegar a un punto en que estresa al feto lo suficiente como para que el proceso natural del parto se active por el sistema hipotálamo – hipófisis – adrenal. El resultado final es que el feto consigue su propia expulsión y puede nacer vivo, prematuro, pequeño y débil, pudiendo morir.
- Otras causas de aborto no infecciosos podría ser la hipoxia fetal grave incluyen bajas concentraciones de oxígeno en el compartimiento maternal, circulación maternal defectuosa, alteraciones en el intercambio de oxígeno debido a insuficiencia placental, separación prematura de la placenta y la liberación disminuida de oxígeno de la placenta al feto.
FACTORES INFECCIOSOS
Las causas de origen infeccioso pueden ser por:
- Brucelosis: Enfermedad abortiva por excelencia, la cual puede producir el aborto en cualquier momento de la gestación pero es más común observar el evento en el último tercio. La vaca abortada elimina la bacteria en su descarga genital, feto, envolturas y placenta, y es el principal factor de diseminación de la enfermedad.
- Leptospirosis: Producida por diferentes serovares de Leptospira Interrogans produce abortos en el último tercio de la gestación y provoca también muerte de terneros a término o muerte perinatal.
- Virus de Infección Respiratoria Bovina (IBR): Presenta una forma respiratoria, una conjuntival, una forma encefálitica y las formas genital y abortiva. En la forma genital la hembra presenta pústulas vulvares a veces muy numerosas llamado vulvovaginitis pustular infecciosa con secreción vaginal escasa; esta forma puede afectar al útero y predisponer a la infección bacteriana secundaria que da por resultado una metritis y un período de infertilidad transitorio. Así mismo, el feto bovino es muy susceptible a la infección por el virus de IBR en todos los trimestres, pero por lo general los abortos se presentan en el último tercio.
- Virus de la Diarrea Viral Bovina (BVD): La infección con el virus de la Diarrea Viral Bovina en el momento del servicio produce infertilidad y disminución de la tasa de concepción. Cuando las vacas preñadas se infectan con el virus en el primer tercio de la gestación se puede producir el aborto, si la hembra se infecta entre el día 1 al 45, hay infertilidad por muerte embrionaria, si se infecta entre los 45 a 125 días hay muerte fetal, defectos del desarrollo, infección persistente. La infección trasplacentaria del feto conduce a la muerte y reabsorción fetal, momificación, malformaciones congénitas, muerte perinatal, nacimiento de terneros débiles y de menor tamaño.
- Neospora: Protozoario anteriormente confundido con Toxoplasma gondii. Se ha sugerido que los terneros se infectan en el útero semanas o meses antes del nacimiento. A menudo producen abortos entre los 5 – 7 meses de gestación y en los fetos raramente se ven quistes o taquizoítos (Conigliaro, 1997).
- Mastitis: La probabilidad de presentar abortos es mayor en presencia de mastitis en una proporción de (0.41) que en su ausencia (0.22) (Notcovich et al., 2010). La mastitis clínica impacta negativamente sobre la reproducción ya que produce un descenso en el porcentaje de preñez y aumenta la tasa de abortos en animales preñados que presentan el evento de mastitis clínica que aquellos que no la padecen (Bigatti et al., 2008). Los autores reportaron que en 470 vacas estudiadas, la tasa de abortos en vacas con mastitis clínica entre el parto y el primer servicio fue de 13% mientras que en el grupo control (animales que no presentaron mastitis clínica durante el estudio) fue de 5.9%.
IMPACTO ECONÓMICO DE LA MASTITIS Y LA REDUCCIÓN DE PARTOS
MASTITIS
La mastitis es responsable de las mayores pérdidas económicas en la industria lechera, por lo que es considerada la enfermedad infecciosa más costosa de las vacas en la industria de la leche a nivel mundial. Esta enfermedad causa graves pérdidas económicas a la industria lechera bovina debido a que induce a una disminución en la producción del 4 al 30% de leche y baja su calidad, además de incrementar los costos del cuidado de la salud del hato y un desecho prematuro de animales genéticamente superiores considerándose que en estados unidos representa el 70% de los gastos totales para los ganaderos lecheros (Ponce de León, 2006). En el Reino Unido es una causa importante de la enfermedad en el ganado lechero y continúa siendo una importante carga financiera en la industria lechera, siendo la incidencia de mastitis clínica en ese país de 40 casos por cada 100 vacas por año. Las pérdidas mundiales, anuales debido a mastitis, se han estimado en 35 billones de dólares americanos (Bedolla, 2008).
La eficiencia reproductiva es un componente crítico en una operación lechera exitosa mientras que la ineficiencia reproductiva es uno de los problemas más costosos que enfrenta la industria lechera de hoy, los trastornos reproductivos se presentan con frecuencia en las vacas lecheras lactantes y puede afectar en forma dramática la eficiencia reproductiva de un hato lechero. Hertl et al., 2010, demostró que la mastitis clínica ocurrida cerca al momento de la inseminación, sea antes o después del servicio, estuvo asociada con una reducción de la probabilidad de concepción. Hansen et al., 2004, concluyó que la activación de la cascada inflamatoria o respuesta inmune fuera del tracto reproductivo puede conducir a la muerte embrionaria. Huszenicza et al., 1998, planteó que las mastitis por patógenos Gram negativos que ocurren en el puerperio tardío así como los casos diagnosticados en la fase folicular del ciclo pueden producir degeneración de los folículos dominantes en el ovario con la alteración de su maduración o bloqueando el pico pre-ovulatorio de LH. La mastitis clínica en la fase luteal puede inducir luteólisis. Hockett, 2001 indicó que las vacas con mastitis clínica después del primer servicio pero antes del establecimiento de preñez incrementan el número de servicios requeridos para la concepción, número de días abiertos y días al primer servicio. Bigatti et al., 2008 indicó en un estudio que la tasa de abortos entre vacas con mastitis clínica entre el parto y el primer servicio comparado con el control, vacas sin mastitis clínica fue de 5.9% siendo para el primer grupo de un 13%.
El desarrollo de una ganadería rentable se basa en el logro de adecuados resultados en los parámetros reproductivos, Las causas infecciosas o no infecciosas que interrumpen la preñez o causan muertes perinatales provocan severas pérdidas económicas en los predios productivos (Fernández et al., 2007), Algunos de los trastornos más comunes incluyen quistes ováricos, mellizos, pérdida embrionaria temprana, abortos y placenta retenida (Fricke et al., 2001)
MEDIDAS DE PREVENCIÓN Y CONTROL PARA MINIMIZAR EL IMPACTO CAUSADO POR LA MASTITIS CLÍNICA
Para poder lograr y asegurar una salud estable de las glándulas mamarias del hato, deben ser optimizados en general muchos factores al mismo tiempo. Un aspecto muy importante está relacionado con mejoras sencillas en la técnica de ordeño, en el proceso de ordeño y la higiene; estas acciones no serán efectivas cuando la alimentación, el manejo del hato y las instalaciones no se mejoren al mismo tiempo. Para el proceso del ordeño hay que tener en cuenta la presión de la bomba de vacío, el cual es la presión de aire menor que la atmósfera, siendo esta en la mayoría de las ordeñadoras aproximadamente a media atmósfera. Tener en buenas condiciones las pezoneras y el plástico que las recubre., tener bien calibradas las pulsaciones, el número de pulsos y la proporción de pulsos, siendo la pulsación la apertura y cerrado cíclico de la pezonera.
Proceso de ordeño: las mejores condiciones son en una rutina tranquila, regular y adecuada. Todas las manipulaciones de la ubre deben causar un efecto de preparación, esto es, se debe dar un masaje en los pezones cuidadosamente hasta que aparezcan los primeros chorros de leche. Para poder lograr un flujo óptimo de la leche y un ordeño efectivo con la máquina, se debe colocar el aparato de ordeño después de 45 a 60 segundos de iniciada la manipulación.
Los animales deben ingresar a la sala de ordeño en un orden establecido, esto es determinado primero por el estado de lactación y luego por el volumen productivo promedio de cada lote. Es decir, primero deben ingresar las vacas con pocos días de lactación, para luego ingresar a las vacas de alta producción, producción media y baja producción y finalmente las vacas enfermas, ingresando primero las vacas que tengan problemas sanitarios como cojeras y finalmente las vacas con mastitis clínica.
Es así mismo necesario realizar a la hora del ordeño el despunte, el cual consta de la estimulación para la expulsión de tres chorros de leche en un fondo oscuro. Esto sirve para identificar algún proceso anómalo en la ubre luego de haber aplicado un pre-sellador.
Luego del ordeño, una vez que la totalidad de leche fue retirada de la ubre, es necesario sellar cada pezón, para así evitar nuevas contaminaciones, pues la cisterna del pezón se mantiene dilatada durante las dos horas post-ordeño.
Finalmente, una vez culminada la práctica, se deben retirar todos los animales de forma pausada y sin factores estresantes, para llevarlas nuevamente al lote o corral en el que se encuentran.
MATERIALES Y MÉTODOS
CARACTERÍSTICAS DEL HATO EN ESTUDIO
El estudio se planteó en base a un sistema productivo de crianza intensiva lechera, tomando como condiciones de inclusión que exista el cuadro de mastitis clínica y que todos los animales dentro del predio reciban el mismo tipo de manejo, cuidado sanitario, tratamientos médicos, alimentación, para poder tener como única variable determinante el cuadro de mastitis clínica. Asimismo que el establo tenga un sistema administrativo, de alimentación y sanitario basado en las buenas prácticas pecuarias y en la búsqueda de un producto de calidad dentro de los estándares que el mercado solicita.
Durante el período de estudio, el promedio de producción lechera total del hato fue de 16 500 kilogramos de leche por día, siendo el promedio productivo por vaca en producción de 27.03 kilogramos de leche por día. El historial del hato lechero indica un población total de 1001 animales incluyendo un 36.76% de animales de recría. En general se tenía un promedio de partos por año de 0.55 partos en vacas, un promedio de servicios por preñez de 3.82 servicios.
El estado Sanitario del establo estuvo certificado por Servicio Nacional de Sanidad Agraria – SENASA para Brucella y TBC.
La saca anual por año (% de sacas/ año) está registrado de la siguiente manera:
- Problemas reproductivos: 10%
- Valor genético: 3%
- Mastitis: 13%
- Freemartin: 1%
Ubicación del hato
El hato en estudio está ubicado en el valle bajo de Lurín al sur de Lima Metropolitana, las características de la zona permiten evidenciar un clima templado de temperatura promedio año de 22 grados Celsius.
Animales del hato
La especie utilizada para este estudio es el Bovino (Bos Taurus), de la raza Holstein Fresian.
Los registros productivos y reproductivos fueron evaluados de una población de 90 animales por grupo de estudio (vacas con mastitis clínica vs vacas sin mastitis clínica) tomando en cuenta todos los datos de índole reproductivo a partir de Junio del año 2010 hasta Febrero del año 2012.
Las vacas con mastitis clínica son aquellas vacas que ingresaron a la zona de tratamiento de mastitis del predio, estas vacas se encontraban en un corral separado teniendo el último turno en la rutina de ordeño de acuerdo a las buenas prácticas ganaderas. El criterio de inclusión fue el diagnóstico de mastitis clínica con datos adicionales de la fecha de inicio de tratamiento, el número de arete del animal, el cuarto en donde se encontraba el cuadro de mastitis clínica. Además se obtuvo la información de índole reproductiva correspondiente a la fecha del último parto, el número de servicios hasta lograr la preñez y en todo caso la fecha de aborto si ocurrió el evento mencionado.
Los materiales utilizados fueron:
- Cuadernos para tratamientos de mastitis
- Ficha de tratamiento anti- mastítico
- Ficha de colección de datos
- Cuaderno cuadriculado 200 hojas
- Lapicero
- Computadora
- Microsoft Excel
- Programa Dairy Live
- Ganado bovino Lechero (Raza Holstein).
Tipo de Estudio
De acuerdo a la naturaleza de la investigación se usó un estudio de corte observacional longitudinal; se ha investigado a los animales con mastitis clínica y se contabilizaron cuántas de estas vacas llegan hasta el parto. El estudio es correlacional, porque establecerá si existe alguna relación entre las variables mencionadas.
Establecimiento de Hipótesis
Contribución para la discusión
Hipótesis: ua ≠ ub, existe relación entre la parición y aparición de mastitis
Análisis estadístico
Para el análisis estadístico se empleará la prueba de chi-cuadrado, X², para evaluar la influencia entre las variables especificadas en el objetivo general y específicos.
CALCULO DE LA CHI CUADRADO
El cálculo de la Chi cuadrado se realiza a partir de la fórmula:
X² = ∑ j (oj – ej)²
ej
Donde:
oj = frecuencia observada en la celda J
ej = frecuencia esperada en la celda J
Regla de decisión
Si la X² calculada es menor que la X² tabular, se acepta la hipótesis nula, o sea que el porcentaje de preñez no está influenciado por la aparición de mastitis.
Si la X² calculada es mayor que la X² tabular, se rechaza la hipótesis nula y se acepta la hipótesis alternativa, o sea que el porcentaje de preñez si está influenciado por la aparición de mastitis con un nivel de confianza del 95 % de acierto o 5 % de error.
Nivel de significancia
Elegimos el nivel de significancia de 5 %; P < 0.05, es decir existen aproximadamente 5 posibilidades en 100 de que se rechace la hipótesis cuando debe aceptarse, o sea se tiene una confianza de 95 % de haber tomado la decisión correcta.
RESULTADOS
Culminación de la preñez
De un total de 360 vacas a las que se les tomaron los datos reproductivos, se tomaron 180 vacas preñadas (90 con mastitis y 90 sin mastitis) que cumplían con los siguientes requisitos:
Haber tenido más de un parto al momento del estudio y presentar los datos reproductivos completos.
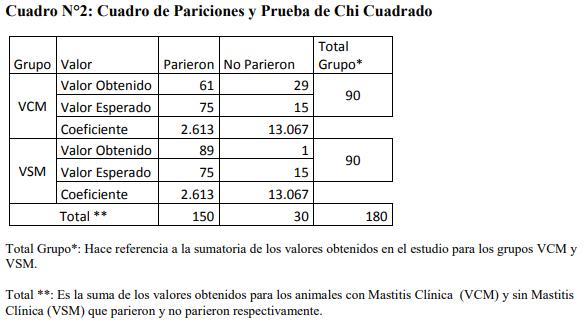
Del total de animales anteriormente mencionados, se evidenció según el grupo de estudio, cuantas vacas parieron y cuantas no parieron según el criterio de evaluación de la siguiente investigación.
Los valores encontrados evidencian que del total de animales examinados, 61 de las VCM llegan a culminar la gestación (parición), mientras que por el contrario 89 vacas sin mastitis (VSM) llegan a parir.
Además de presentarse los valores obtenidos, se muestran los valores esperados según grupo de estudio en relación con la prueba de Chi cuadrado, así como el coeficiente resultante para cada grupo. Este resultado evidencia que para las vacas con Mastitis Clínicas existe un descenso en el número de pariciones, lo cual podría indicar que efectivamente la Mastitis Clínica afecta la culminación de la gestación de manera natural (parto).
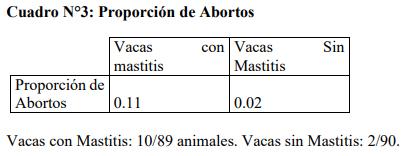
Los abortos
En cuanto a los abortos según los grupos estudiados se puede definir que se considero como aborto en los casos, en los cuales las vacas con diagnóstico de preñez, luego de un tiempo mostraban celo o se le detectaba vacía. Al respecto se puede apreciar que en el grupo de vacas sin mastitis clínica la interrupción de la preñez fue mucho menor que las vacas con el cuadro clínico de mastitis.
OTROS PARAMETROS REPRODUCTIVOS ENCONTRADOS
El Intervalo hasta el nuevo
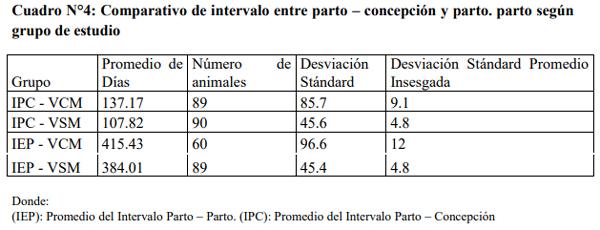
Parto En este cuadro se muestran valores con respecto al Promedio del Intervalo Parto – Concepción y Parto – Parto, observándose diferencias en los valores promedio obtenidos según el intervalo y el grupo estudiado, manteniendo la tendencia de mayor tiempo para las vacas con mastitis clínica.
Valores estadísticos de Intervalo Parto – Concepción
Los resultados indican que existen diferencias significativas entre los intervalos de parto a la concepción de las VCM y VSM a un nivel de significancia del 5%, por lo tanto el intervalo de parto a la concepción es menor en las vacas sin mastitis.
Resultados para los valores analizados de Intervalo Parto – Parto
Existen diferencias significativas entre los intervalos entre partos de las vacas con mastitis y las vacas que no presentaron mastitis a un nivel de significancia del 5%, por lo tanto el intervalo entre partos es menor en las vacas sin mastitis.
DISCUSIÓN
La mastitis no solo incrementa costos productivos y administrativos, horas/hombre, modifica el manejo dentro del hato, genera un trabajo logístico especial, incrementa el descarte de leche por mala calidad y presencia de antibióticos, induce al descarte de animales sino que además afecta de forma negativa los parámetros reproductivos de las vacas de producción intensiva, los cuales son necesarios para la continua producción lechera a lo largo del tiempo.
La mastitis es responsable de las mayores pérdidas económicas en la industria lechera, por lo que es considerada la enfermedad infecciosa más costosa de las vacas en la industria de la leche a nivel mundial. La eficiencia reproductiva es un componente crítico en una operación lechera exitosa mientras que la ineficiencia reproductiva es uno de los problemas más costosos que enfrenta la industria lechera de hoy, los trastornos reproductivos se presentan con frecuencia en las vacas lecheras lactantes y puede afectar en forma dramática la eficiencia reproductiva de un hato lechero.
El parto es la culminación de la gestación en los bovinos y este depende del correcto funcionamiento del cuerpo lúteo; éste es necesario para el mantenimiento de la gestación hasta alrededor de los 200 días de gestación. Si la hembra recibe una dosis suficiente de prostaglandina F2α, sea endógena o exógena, se puede perder la gestación por luteólisis y contracción del miometrio (Gädicke et al., 2008). La mastitis al parecer induce un incremento de PGF2α, el cual actúa en el cuerpo amarillo principalmente, ocasionando luteólisis y la consecuente pérdida embrionaria, existiendo además otros factores desencadenantes de pérdida gestacional como causas no infecciosas, las que pueden tener varios orígenes, sean factores ambientales, traumatismos, exceso de calor, toxinas en plantas, hongos o plaguicidas y causas hormonales, nutricionales o genéticas y causas infecciosas (Brucellosis, Leptospirosis, virus del IBR, virus de BVD, Neóspora, entre otros) (Conigliaro, 1997). Otra causa considerada es la deficiencia de progesterona que podría causar que el endometrio llegue a ser deficiente en la producción de los nutrientes necesarios para la supervivencia del embrión (Tovío et al., 2006).
Huszenicza G et al., 1998, reportó en un estudio realizado sobre mastitis clínica, que, en la fase luteal, en mayor proporción los patógenos Gram Negativos produjeron luteólisis prematura en mayor proporción que en los agentes Gram Positivos (o en patógenos no diagnosticados) y Barker et al., 1997, postuló que la mastitis clínica durante la lactación temprana, particularmente la producida por patógenos Gram – Negativos puede afectar la performance reproductiva de las vacas lecheras.
En el presente estudio se encontró una concordancia con lo encontrado por autores como Kelton et al., 1991, que reportó en una investigación que vacas sin mastitis clínica dentro de treinta días después del servicio tuvieron un rango de concepción de 46%, mientras que aquellas vacas que presentaron mastitis clínica dentro de treinta días después del servicio tuvieron un rango de concepción de 38%. Stewart et al., 2004, demostró en un estudio que se basó en el análisis del efecto del péptidoglucano como un potencial mediador en la interrupción de la gestación en ovejas, que la tasa de preñez combinada de las ovejas control (a quienes no se les aplicó el péptidoglucano) con aquellas con bajas dosis de PTG (100%) fue mayor que en las ovejas con dosis medias y altas (64%).
En los datos encontrados respecto al aborto en este estudio se evidenció que las vacas con mastitis clínica tuvieron fallas relacionadas al cuerpo lúteo, sea en su mantenimiento como en la producción de progesterona; que afectaron de manera significativa a la gestación bovina, pudiéndose producir pérdida embrionaria, fetal o aborto. Cualquier falla en los factores determinantes desencadena la muerte del embrión (Tovío. N, et al., 2008) o del feto. Cullor (1990) reportó que las endotoxinas de la pared celular de las bacterias Gram – Negativas inducían luteólisis, afectando la concepción y la vida del embrión, aparentemente a través de la liberación de mediadores inflamatorios como PGF2α. El incremento de la secreción en respuesta al peptidoglucano bacteriano podría esperarse que reduzca la tasa de preñez por la inducción a la regresión luteal o por compromiso de la función luteal (Stewart A,B., et al.,2004). Las endotoxinas circulantes de una infección por un patógeno Gram Negativo en la madre, esté localizada en patas, ubre, laringe, hígado, glándula mamaria o intestino, pueden causar una endotoxemia. Esta produce probablemente el aborto por provocar una síntesis generalizada de prostaglandinas F (Miller, 1995).
Intervalo entre Partos e Intervalo Parto – Concepción.
A medida que las fallas reproductivas sean más tardías, el intervalo Parto – Parto será mucho mayor, puesto que ya ha habido una gestación previa que no llegó a término, relacionándose este valor con el intervalo Parto – Concepción, Promedio de Abortos, Promedio de Partos y número de animales que llegan a parir, ya que cualquier falla reproductiva que esté relacionada a la fecundación del ovocito incrementará finalmente el intervalo Parto - Parto. Los resultados del Intervalo Parto – Concepción, observados en el estudio indican un menor IPC en el grupo de animales sin Mastitis (IPC 107.82 días), valor corroborado por Barker et al., 1997, quien reportó en un estudio que el intervalo parto – concepción en vacas con mastitis clínica antes de la primera inseminación (136.6) fue mayor que en el grupo control o en aquellas vacas que desarrollaron mastitis clínica luego de la confirmación de preñez (92.1).
Bigatti et al., 2008, observó en un estudio realizado que el intervalo parto – concepción para vacas sanas fue de 95.8 días, mientras que para vacas diagnosticadas con mastitis clínica entre el parto y el 1° servicio fue de 110 días. Además, indicó que en relación al intervalo parto – concepción se encontraron diferencias significativas entre el grupo de vacas sanas y aquellos animales que presentaron mastitis clínica entre el primer servicio o más y la concepción, siendo de 95.82 y 154.82 respectivamente. Gunay et al., 2008, reportó que el intervalo parto – concepción en vacas con mastitis clínica antes del primer servicio (119.1±10.6 días) y en vacas con mastitis clínica después del primer servicio (147.7 ± 14.0 días) fue significativamente mayor que para las vacas sanas o control (94.1 ± 10.3 días).
Se evidencia que la presencia de mastitis, tanto sub-clínica como clínica en las unidades de producción lechera, está ligada al estrés de los animales; tal conjunción es perjudicial para el desempeño reproductivo de las vacas, ya que aumenta los días de intervalo parto – primer servicio, disminuye la fertilidad, incrementa los días abiertos y acrecienta la susceptibilidad al aborto, por lo cual el período entre partos se extiende de manera significativa (Córdova et al., 2008).
Actualmente nos enfrentamos a una eficiencia reproductiva del ganado lechero en descenso, debido parcialmente al mejoramiento genético orientado a un aumento productivo lácteo; pero también a mayor incidencia de casos de mastitis por animal en el primer trimestre de la producción que va en desmedro de la fertilidad.
CONCLUSIONES
- El Promedio de Pariciones fue 31.11% más para los animales sin Mastitis Clínica.
- Se evidencian diferencias significativas entre el grupo de animales que no presentaron mastitis clínica durante el tiempo del estudio respecto a:
- Intervalo Parto – Concepción: Se observan diferencias estadísticas significativas entre ambos grupos estudiados (vacas con mastitis clínica y vacas sin mastitis clínica), reportándose que vacas con mastitis (IPC: 137.17) incrementan en 27.22% este intervalo con respecto a los valores obtenidos para animales sin mastitis clínica (107.82).
- Intervalo Parto – Parto: Se reportan diferencias significativas, hallándose que para vacas con mastitis clínica (415.43 días) este intervalo se incrementa en 8.18% con respecto a vacas sin mastitis clínica.
- Las vacas que presentaron mastitis clínica dentro del período de estudio incrementaron el riesgo de sufrir abortos (Vacas con Mastitis Clínica: 0.11. / Vacas sin Mastitis Clínica: 0.02).
- Se puede identificar a la Mastitis Clínica como un factor perjudicial dentro de la totalidad del sistema productivo intensivo, no sólo desde el punto de vista sanitario ó productivo, sino además reproductivo y administrativo.
- La mastitis está relacionada con el descenso de la eficiencia reproductiva, aumento de intervalos, días abiertos y número de abortos, así como la culminación exitosa de la gestación, que deviene en la parición.
ANEXOS
El Tracto Reproductivo del bovino
Anatomía
Los órganos del aparato reproductor de la hembra incluyen los ovarios, oviductos, el útero, la vagina y los genitales externos. Los ovarios son órganos que permanecen en la cavidad abdominal de tipo glándulas que liberan óvulos y producen y secretan hormonas, estando entre ellas el estrógeno, progesterona e inhibina (Rippe, C., 2009) El flujo de sangre arterial hacia el ovario cambia de manera proporcional con la actividad del cuerpo amarillo; en bovinos, el riego sanguíneo del ovario es máximo durante la fase de cuerpo amarillo, disminuye con la regresión luteal y alcanza un mínimo justo antes de la ovulación (Hafez, 2000).
El oviducto, puede dividirse en cuatro fragmentos funcionales: las fimbrias, el infundíbulo, abertura abdominal en forma de embudo cerca al ovario; la ampolla, dilatada y más distal, y el istmo, la porción proximal estrecha del oviducto, que conecta a éste con la luz uterina (Hafez, 2010). Esta estructura es importante en el momento de la capacitación de los espermatozoides depositados en el tracto reproductivo de la hembra luego de la deposición del semen, en la fecundación del óvulo y en el traslado del huevo o cigoto hacia el lugar de implantación en el útero.
El Útero, es un órgano muscular hueco que consta de un cuerpo corto y dos cuernos relativamente largos. El tamaño de este órgano depende de la edad y número de partos, aumentando su tamaño durante la preñez. El útero está suspendido en la cavidad pélvica por el ligamento uterino ancho en ambos lados. Este ligamento además transporta el flujo sanguíneo y nervioso. La pared uterina consiste de tres capas: El endometrio o mucosa consiste principalmente de glándulas epiteliales agrupadas en carúnculas (Ball, 2004), en el endometrio se produce enzimas como la fosfolipasa A y la ciclooxigenasa, que son indispensables para la síntesis de PGF2α, la cual produce luteólisis (Hernández et al., 1998); una capa muscular que es el miometrio y la capa externa o serosa. En vacas, ovejas y yeguas, el útero es bipartido, en estos animales un tabique separa los dos cuernos y un cuerpo uterino prominente (Hafez, 2000); los cuernos uterinos son el lugar de anidación del huevo fecundado, su función es la protección y nutrición del embrión y feto durante la gestación y la de expulsión del feto a término en el momento del parto.
El cuello uterino, es un órgano fibroso formado predominantemente por tejido conectivo con pequeñas cantidades de tejido muscular liso caracterizado por una pared gruesa y una luz estrecha; en los rumiantes éstas tienen la forma de bordes transversales o alternados en espiral que se conocen como anillos cervicales que se desarrollan en distintos grados en las diferentes especies, son especialmente notables en la vaca (por lo general cuatro anillos).Esta estructura anatómica se encuentra perfectamente cerrada excepto durante el estro, cuando se relaja ligeramente, permite la entrada de espermatozoides en el útero y permite la expulsión del feto en el momento del parto. La secreción mucosa del cuello uterino se expulsa por la vulva.
La Vagina, es el órgano copulatorio en el que se depositan y coagula el semen hasta que los espermatozoides son transportados a través de las macromoléculas de la columna de moco cervical. Constituye un depósito de semen después del coito que suministra espermatozoides a los depósitos cervicales (Hafez, 2000).
Hormonas, factores de crecimiento y reproducción
La hipófisis anterior tiene cinco diferentes tipos de células que secretan seis hormonas. Las somatotrópicas secretan la hormona del crecimiento; las corticotrópicas secretan la hormona adenocorticotrópica (ACTH), las tirotrópicas secretan la hormona estimulante de la glándula tiroides (TSH); las mamotrópicas la prolactina y las gonadotrópicas las hormonas Luteinizante (LH) y la hormona folículo estimulante (FSH) (Hafez, 2000).
Regulación de la secreción hormonal
Retroalimentación endocrina
El control de la retroalimentación ocurre a nivel del hipotálamo y de la hipófisis. Dependiendo de su concentración en la sangre, las hormonas esteroides pueden ejercer una retroalimentación estimulatoria (positiva) o inhibitoria (negativa).Retroalimentación inhibitoria o negativa, este sistema involucra interrelaciones recíprocas entre dos o más glándulas y los órganos blancos. Cuando las hormonas hipofisiarias alcanzan cierto nivel, algunos núcleos hipotalámicos responden disminuyendo la producción de su hormona liberadora particular, un descenso en la secreción de hormona trópica hipofisiaria y un nivel más bajo para la función de la glándula blanco. La retroalimentación positiva o estimulatoria se da cuando las concentraciones crecientes de una hormona causan incrementos subsecuentes de otra hormona.
Hormonas hipotalámicas
Tanto las hormonas hipofisiarias como las esteroideas regulan la síntesis, el almacenamiento y la liberación de las hormonas hipotalámicas a través de dos mecanismos de retroalimentación: una vía larga y una vía corta. La vía larga incluye una interacción entre las gónadas, la hipófisis y el hipotálamo, mientras que el sistema de retroalimentación por la vía corta permite que las gonadotropinas hipofisiarias influyan en la actividad secretora de las hormonas liberadoras sin la mediación de las gónadas (Hafez, 2000).
- Hormona liberadora de gonadotropinas (GnRH)
Actúa como factor estimulador en la adenohipófisis de la hormona folículo estimulante (FSH) y de la hormona Luteinizante (LH).
- Factor inhibidor de la secreción de prolactina (PIF), Factor estimulante de la secreción de Prolactina (PRF)
Actúa sobre la adenohipófisis inhibiendo (PIF) o estimulando (PRF) la producción de prolactina. En los mamíferos predomina el factor inhibidor.
El PIF desaparece al pasar de la gestación a la lactación. En esta etapa la succión estimula las células sintetizadoras de prolactina (PRL), lo que hace que PIF desaparezca.
- Hormona liberadora de corticotropina
Estimula en la adenohipófisis la síntesis de hormona adenocorticotropina (ACTH).
La oxitocina estimula las contracciones uterinas, que facilitan el transporte del espermatozoide al oviducto durante el estro, el estiramiento del cuello uterino durante el parto que es causado por el paso del feto estimula la liberación de oxitocina (reflejo de Ferguson). La oxitocina ovárica está involucrada en la función luteal, actúa en el endometrio para inducir la liberación de prostaglandina F2α (PGF2α), que tiene una acción luteolítica (Hafez, 2000). La acción más conocida es la liberación de la leche.
Hormonas adenohipofisiarias (FSH, LH, LTH y ACTH).
- Hormona Folículo estimulante (FSH): glucoproteína que vía sanguínea llega a la gónada. Estimula el crecimiento y maduración de los folículos ováricos y la producción de estrógenos por estos, no provoca la ovocitación por si sola pero prepara al ovario para la acción de la LH en hembras.
- Hormona Luteinizante (LH): glucoproteína que en hembras ayuda a la maduración de los folículos en su fase final y la producción de estrógenos en el folículo maduro. Provoca la ovocitación, desencadena la formación del cuerpo lúteo y estimula la producción de progesterona por parte de este. Existen dos tipos de secreción. La primera es la basal constante (pulsos de escasa amplitud) mientras que la progesterona permanece alta en sangre o en anestro estacionario. El segundo tipo consta de descargas mayores luego de la luteólisis. Va aumentando su pulsatibilidad y amplitud con lo que estimula el desarrollo folicular y la producción de estrógenos, los que a su vez provocan la descarga pre-ovulatoria o pico de LH.
- Prolactina (PRL) u hormona Luteotropa (LTH): promueve y estimula la producción de leche y además, junto con la LH mantiene el cuerpo lúteo y estimula la secreción de progesterona.
- Hormona Adrenocorticotropa (ACTH): estimula la síntesis de glucocorticoides y andrógenos.
Hormonas esteroides gonadales
Los ovarios y los testículos secretan primordialmente hormonas esteroides gonadales. Estas son de cuatro tipos: andrógenos, estrógenos, progestinas y relaxina (Hafez, 2000), son sintetizados a partir de colesterol y presentan al ciclo pentano perhidrofenatreno como estructura común.
- Estrógenos: La forma natural son: El estriol, 17β-estradiol y estrona, la síntesis se realiza fundamentalmente en el folículo ovárico maduro, concretamente en las células de la granulosa y de la teca. (BASES DE LA PRODUCCIÓN ANIMAL, 2005). El estradiol es el estrógeno primario y biológicamente activo producido por el ovario con pequeñas cantidades de estrona (Hafez, 2000). Localmente el estrógeno actúa en las células de la granulosa incrementando los receptores para FSH y LH y, junto con estas gonadotropinas, promueve adicionalmente la replicación de las células de la granulosa, crecimiento y secreción (Anatomy and Physiology of Farm Animals).Los efectos de los estrógenos en la hembra generan la maduración de los folículos, estimulan el feed-back positivo de la onda pre-ovulatoria de LH, influyen en el comportamiento de celo de la hembra, en cambios anatómicos externos de la vulva, genera una acción epiteliotropa y un incremento de la actividad bactericida del útero. Además, intervienen en la manifestación de características sexuales secundarias, proliferación del sistema de conductos de las glándulas mamarias y están implicados en el mecanismo de parto (BASES DE LA PRODUCCIÓN, 2005).
- Progestágenos
La progesterona es el progestágeno natural más prevalente y es secretada por células lúteas del cuerpo amarillo, la placenta y la glándula suprarrenal, siendo estimulada por la LH, principalmente (Hafez, 2000). Sintetizada en las células de la granulosa luteinizadas del cuerpo amarillo y la teca interna durante la fase luteínica y en la placenta durante la gestación, la que va adquiriendo importancia conforme avanza la gestación.
Efectos: en feed-back negativo y en grandes dosis sobre el hipotálamo e hipófisis, disminuye la síntesis de GnRH, FSH y LH, por lo que detiene la actividad ovárica. Prepara el endometrio para la anidación del embrión, mantiene y desarrolla la gestación, contribuye al mejor funcionamiento de la placenta, produce un estado de reposo de la pared uterina, contribuye a la hiperplasia de la glándula mamaria (BASES DE LA PRODUCCIÓN ANIMAL, 2005).
La relaxina es secretada principalmente por el cuerpo amarillo durante el embarazo, siendo la principal acción biológica la dilatación del cuello uterino y la vagina antes del parto (Hafez, 2000).
- Inhibina: hormona de naturaleza proteica. Se produce en las células de la granulosa del folículo maduro en las hembras y por retroalimentación negativa impide la liberación de FSH (BASES DE LA PRODUCCIÓN, 2005). Actúan como señales químicas a la hipófisis respecto al número de folículos que crecen en el ovario. Al inhibir la liberación de FSH sin alterar la liberación de LH, las inhibinas pueden ser parte las responsables de la liberación diferencial de LH y FSH desde la hipófisis.
- Activinas
Las activinas son potentes dímeros liberadores de FSH y están presentes en líquidos gonadales, por ejemplo, en el líquido folicular.
Inhibe la secreción de FSH y enlaza activina, neutralizando su actividad biológica, es decir, modula la secreción de FSH.
Hormonas placentarias
Son la: gonadotropina coriónica equina (eCG), gonadotropina coriónica humana (hCG), lactógeno placentario (PL) y proteína B.
Es una proteína con propiedades químicas similares a la prolactina y a la hormona del crecimiento. El lactógeno placentario es más importante por sus propiedades de hormona de crecimiento que por sus propiedades de prolactina, pudiendo desempeñar una función en la producción de leche porque su concentración es más alta en vacas lecheras que en vacas cárnicas.
El feto bovino produce numerosas señales durante la preñez temprana. Actualmente, sólo una proteína del tejido placentario se ha purificado de manera parcial, la proteína B específica del embarazo (bPSPB). La acción fisiológica de la proteína B puede estar involucrada en la prevención de la destrucción del cuerpo amarillo en la preñez temprana.
Prostaglandinas
El ácido araquidónico es el precursor de las prostaglandinas relacionadas más estrechamente con la reproducción, principalmente PGF2α y prostaglandina E2. La PGF2α es particularmente potente para finalizar la preñez temprana y está relacionada a la ovulación, en animales preñados, el embrión en desarrollo manda una señal al útero (reconocimiento materno de la preñez), previniendo los efecto luteolíticos de la PGF2α (Hafez, 2000).
Funciones: en la hembra cíclica, si no ha habido fecundación, el útero la produce vía sanguínea, llegando al ovario y produciendo la regresión del cuerpo lúteo, caso contrario si hay fecundación. Al final de la gestación, el aumento de estrógenos producidos en la placenta estimula la síntesis de Prostaglandinas, ya que el estradiol estimula la síntesis de receptores para oxitocina y estimula en el endometrio la producción de enzimas como la fosfolipasa A y la ciclo-oxigenasa, que son indispensables para la síntesis de PGF2α. La secreción de PGF2α depende de la unión de la oxitocina a sus receptores en el endometrio (Hernández et al., 1998).
LITERATURA CITADA
1. Anatomy and Physiology of Farm Animals. Frandson, R., Wilke, W., Fails, A. Seventh Edition. Wiley – Blackwell. Iowa, USA. 2009.
2. Anatomy and Physiology of Farm Animals. Seventh Edition – W.Lee Wilke – Rowen D. Frandson – Anna Dee Fails. 2009
3. Avellaneda, J., Camaripano, L., Mejías H. Relación entre el ambiente, nutrición, preñez y pérdida prenatal en vacas cebú en el llano inundable. X Seminario de Pastos y Forrajes, 2006.
4. BASES DE LA PRODUCCIÓN ANIMAL. Caravaca, F.P., Castel, J.M., Guzmán, J.L., Delgado, M., Mena, Y., Alcalde, M.J., González, P. Universidad de Sevilla – Universidad de Huelva. Sevilla, España. 2005.
5. Bavera, G.A. Producción, Pérdidas o merma y porcentajes. Curso de Producción Bovina de Carne, cap. VI. FAV. UNRC. 2000.
6. A.R. Barker, F.N. Schrick, M.J. Lewis, H.H. Dowlen, A.M Saxton and S.P. Oliver. Influencia de la mastitis clínica durante la lactación temprana en la performance reproductiva de Vacas Jersey. The University of Tennessee. Knoxville, Tennessee 1997.
7. Bedolla, CC., Ponce de León, MER. Pérdidas económicas ocasionadas por la mastitis bovina en la industria lechera. REDVET Revista electrónica de Veterinaria, Vol. IX, Núm . 4, abril-sin mes, 2008, pp. 1 – 26. Veterinaria Organización. España
8. Bigatti, C., García Bouissou, R., Micheo, C., Dick, A. Efecto de la mastitis clínica durante la lactancia temprana sobre la performance reproductiva de rodeos lecheros. 2008.
9. Concha, B. Mastitis Bovina: Nuevos aspectos de diagnóstico, tratamiento y control. Universidad de Chile. 2008.
10. Conigliaro.S. Abortos: Causas, diagnóstico y profilaxis. Texto de la Conferencia dictada durante las Primeras Jornadas de Reproducción bovina. Villa María, Córdoba, 1997.
11. Corbellini, C. La mastitis bovina y su impacto sobre la calidad de la leche. Instituto Nacional de Tecnología Agropecuaria. Proyecto Lechero, E.E.A. INTA Pergamino, 2001.
12. Córdova – Izquierdo, A., Córdova-Jiménez, C.A., Córdova – Jiménez, M.S., Saltijeral – Oaxaca, J.A., Ruíz-Lang, C.G., Xolalpa – Campos, V.M., Cortés – Suárez, S., Guerra – Liera, J.E; Efecto de la mastitis y el estrés sobre la reproducción de la vaca. Rev.vet. 19: 2, 161 – 166, 2008
13. Cullor, J. S. 1990. Mastitis and its influence upon reproductive performance in dairy cattle. Pages 176-180 in Proc. Int. Symp. Bovine Mastitis, Indianapolis, IN. Natl. Mastitis Counc., Inc. and Am. Assoc. Bovine Pract., Arlington, VA.
14. D.C. Blood., O.M. Radostits., Arundel, J.H., Gray, C.C. Medicina Veterinaria. Séptima Edición. Interamericana McGraw – Hill. 1993
15. Enciclopedia Bovina. Universidad Nacional Autónoma de México. Facultad de Medicina Veterinaria y Zootecnia. M.V.Z. Esp. Ramón Gasque Gómez. Ciudad Universitaria, México 04510, DF. 2008
16. Fernández, M.E., Campero, C.M., Morrell, E., Cantón, G.J., Moore, D.P., Cano, A., Malena, R., Odeón. A.C., Paolicchi, F., Odriozola, E.R. Pérdidas reproductivas en bovinos causadas por abortos, muertes prematuras, natimortos y neonatos: casuísticas del período 2006 – 2007. Teriogenología. Rev. Med. Vet. (Buenos Aires) 2007; 88, 6: 246 – 254.
17. Fernández, O.F., Trujillo, J.E., Peña, J.J, Cerquera, J., y Granja, Y.T. 2012. Revista Veterinaria REDVET 13(11).
18. Fisiología Veterinaria. Cunningham, J., Klein, B. Cuarta Edición. ELSIEVER. España. 2009.
19. Fricke, P., Shaver, R. Manejando trastornos reproductivos en Vacas Lecheras. Departamento de Ciencias Lácteas, Universidad de Wisconsin – Madison. 2001.
20. Functional Anatomy and Physiology of Domestic Animals. William O. Reece. Third Edition.Lippincott Williams & Wilkins. Iowa State University of Science and Technology. Ames, Iowa, USA. 2005.
21. Gädicke, P., Monti, G. Aspectos epidemiológicos y de análisis del síndrome de aborto bovino. REVISIÓN BIBLIOGRÁFICA. Arch Med Vet 40, 223 – 234 (2008).
22. Gasque, R., Enciclopedia Bovina. Facultad de Medicina Veterinaria y Zootecnia.Universidad Nacional Autónoma de México, 2008.
23. Hafez, E.S.E., Hafez, B. Reproducción e Inseminación artificial en animales. Séptima Edición. McGraw – Hill Interamericana. México DF, México. 2000
24. Peter J. Hansen, Paolete Soto, Roger P. Natzke. Mastitis y Fertilidad en el Ganado: Posible participación de la inflamación o activación inmunitaria en la mortalidad embrionaria. Department of Animal Sciences, University of Florida, Gainesville, FL, USA. 2004
25. Hernández, C., Zarco, Q. Función del cuerpo lúteo y muerte embrionaria en rumiantes. Departamento de Reproducción. Facultad de Medicina Veterinaria y Zootecnia. Universidad Nacional Autónoma de México. Ciudad Universitaria, 04510, México DF. 1998.
26. J.A. Hertl, Y.T. Gröhn, J.D.G Leach, D.Bar, G.J. Bennett, R.N. González, B.J. Rauch, F.L. Welcome, L.W. Tauer and Y.H. Schukken. Efectos de la mastitis clínica causados por bacterias gram positivas y gram negativos y otros organismos en la probabilidad de concepción en Vacas Holstein lecheras en el estado de Nueva York. 2010.
27. Kumar, V., Abbas, A., Fausto., N. Robbins y Cotran. Patología Estructural y Funcional. Séptima Edición. ElSiever. España. 2010.
28. M.E Hockett. Seguimiento de perfiles endocrinos de vacas lecheras clínicamente inducidas a mastitis durante la lactación temprana. 2001.
29. Huszenicza, J Jánosi, M Kulcsar, P Kóródi, SJ Dieleman, J Bartyik, P Rudas and P Ribiczei – Szabó. La mastitis causada por Gram – Negativos pueden interferir con ciertas funciones ováricas, endocrinas y metabólicas en vacas lecheras. Reprod Dom Anim 33 (1998).
30. Meglia, G.E., Mata, H.T. Mecanismos específicos e inespecíficos de defensa, con referencia a la glándula mamaria de los bovinos productores de leche. Ciencia Veterinaria. Facultad de Ciencias Veterinarias. UNLPam., Gral Pico, La Pampa. 2001.
31. Miller. R. Patología de la Reproducción en el ganado bovino. * Resumen de las conferencias pronunciadas en la escuela agraria de Deria, País Vasco, España. 1995.
32. Moore, D., Kirk, J. Pérdida embrionaria en ganado lechero. Extension Veterinarians – School of Veterinary Medicine. University of California Davis. Tulare, CA. 2005.
33. Notcovich et al., 2010 Notcovich, S., Adrién Ruegger, M.J y Marini, P.R. Efecto de la mastitis sobre la mortalidad embrionaria y abortos en vacas lecheras.Veterinaria Argentina, 27:271, 2010
34. Ponce de León M. Pérdidas económicas ocasionadas por la Mastitis Bovina a la Industria Lechera. Morelia, Michoacán, México. 2006.
35. Radostits. O.M. Medicina Veterinaria. Novena Edición. Harcourt College Publishers. USA. 1999.1999
36. Reproduction in Cattle. Ball P.J.H, Peters, A.R. Third Edition. Blackwell Publishing, Oxford, UK. 2004.
37. Rippe. A. Servicios técnicos, ABS Global Inc. 2009, Minneapolis MN, Boise, ID. 2009 Dairy Cattle Reproduction Conference, 111 – 116.
38. Rivera G. Causas frecuentes de aborto bovino. Rev Inv Vet Perú 2001; 12(2): 117 – 122
39. Romero, J.R., Villamil, L.C., Pinto, J.A. Impacto económico de enfermedades animales en sistemas productivos en Sudamérica: estudios de caso. Rev. Sci. Tech. Off. Int. Epiz., 1999, 18(2), 498 – 511.
40. Sartori, R. 2004. Mortalidad embrionaria en bovinos lecheros. Embrapa Recursos Genéticos e Biotecnologia, Brasília, DF, Brasil. 2004.
41. Stewart, A.B., Inskeep, E.K., Townsend, E.C and Dailey, R.A. Efectos de bacterias patógenas Gram positivas en ovejas: el Péptidoglucano como un potencial mediador de la interrupción de la preñez temprana. Division of animal and Veterinary Sciences, West Virginia University, PO Box 6108, Morgantown. WV 26506 – 6108, USA. 2004.
42. Thatcher, WW., Santos, J.E.P. Caracterización de la Muerte Embrionaria Temprana y Prevención de la Pérdida de Gestaciones. ABS México, S.A. de C.V. Artículos técnicos. 2004.
43. Ten Hag. Programa de Aseguramiento de Calidad de Leche, Ministerio de Agricultura, Alimentación y Asuntos Rurales, Ontario, Canadá. Ontario Milk Producer, Canadá. 2001.
44. Tovio. N., Dulce A., Henry Grajales. H. Mortalidad embrionaria en bovinos. 2006
45. Wattiaux. Mastitis: La enfermedad y su Transmisión. Instituto Babcock para la Investigación y Desarrollo Internacional de la Industria Lechera. Universidad de Wisconsin – Madison. 1998.
46. W. Wolter, Castañeda, V.H*., Kloppert, B y Zschoeck, M. La Mastitis Bovina. Instituto Estatal de Investigaciones de Hesse, *Universidad de Guadalajara. 2001.