Introducción
El ganado lechero presenta un periodo de balance energético negativo durante las primeras 4-8 semanas posparto (Drackley, 1999), lo cual conduce a un incremento en los niveles sanguíneos de la hormona de crecimiento (GH) y de los ácidos grasos no esterificados (NEFA) o b-hidroxibutirato, así como a una disminución en los niveles sanguíneos de insulina, del factor de crecimiento insulínicos tipo I (IGF-I), y de la glucosa (Buttler, 2000), llevando a un retraso en el inicio de la actividad ovárica. En el ganado lechero, el eje somatotrófico, que comprende a la GH, al receptor de la GH y al IGF-I, se encuentra desacoplado durante las primeras semanas posparto, lo cual conduce a la secreción de altos niveles de GH y bajos niveles del IGF-I (Lucy, 2008).
Radcliff et al. (2003) y Kim et al. (2004) sugieren que las deficiencias energéticas durante la lactancia temprana en vacas disminuyen la actividad del promotor del gen del receptor GH-A1, lo cual conduce a una disminución tanto de la síntesis del receptor hepático de la GH, como de la producción del IGF-I. Se ha descrito que vacas lecheras y cerdas que se encuentran sometidas a restricciones nutricionales presentan bajos niveles sanguíneos de insulina y del IGF-I, lo cual, teóricamente, reduce la capacidad de respuesta del ovario a las hormonas gonadotróficas (Lucy, 2008). Butler (2000) señala que el reestablecimiento de la actividad ovárica ocurre cuando se produce el NADIR (cambio a balance energético positivo); esto trae como consecuencia una elevación de los niveles del IGF-I, de insulina, de leptina, de hormona luteinizante (LH) y del est radiol (E2), conduciendo a la producción de folículos dominantes destinados a la ovulación.
La regulación endocrina de la foliculogénesis involucra a las gonadotropinas, además de hormonas y factores de crecimiento producidos localmente (For tune et al., 2004). Los factores de crecimiento parecidos a insulina (IGF-s) funcionan como moduladores de la acción de las gonadotropinas a nivel celular. Las actividades autocrinas- aracrinas del IGF-I y del IGF-II incluyen estímulo del crecimiento celular, incremento de la producción de progesterona y del E2, y un aumento de la sensibilidad de las células de la granulosa al estímulo de la FSH en bovinos (Monget y Monniaux, 1995).
En el postparto, las hembras bovinas deben reiniciar su función reproductiva para poder gestar nuevamente. Para lograr esto son necesarios la normal involución del útero y el rápido restablecimiento de la actividad ovárica (Slama, 1996). Durante la involución uterina, el útero debe recuperar su estado normal para poder soportar una nueva gestación, por lo que el retraso de la misma influiría negativamente sobre el rendimiento reproductivo del animal, incrementando el intervalo entre partos. En vacas Holstein el tiempo requerido para completar la involución uterina es de 29,6-35,8 días (Lindell et al., 1982; Guilbault et al., 1987). A través del monitoreo con ultrasonido se han observado intervalos de 23-42 días (Kamimura et al., 1993; Hajurka et al., 2005) . La primera fase de recuperación se inicia desde la primera semana postparto en vacas que han tenido parto normal o con una buena condición corporal (CC) y que se alimentan equilibradamente; sin embargo, se retarda en aquellas que han presentado distocia, retención de placenta, enfermedades metabólicas durante el periparto o desbalances nutricionales. Algunas de estas afecciones cursan con infecciones uterinas(Mateus et al., 2002), las cuales provocan trastornos en el tejido uterino (endometritis) que a su vez afecta la regulación hipotalámica de la actividad ovárica; además, repercuten sobre la producción y secreción de prostaglandinas (E y F) y de progesterona (Sheldon y Dobson, 2004, Domínguez et al., 2008). Las vacas con severo balance energético negativo durante las dos primeras semanas posparto están sometidas a un mayor estrés metabólico y celular, que retarda la reparación de los tejidos uterinos reduciendo, en consecuencia, la fertilidad (Wathes et al., 2007).
El objetivo de este trabajo fue evaluar el efecto de la condición corporal al parto (CCAP) sobre la involución uterina, presencia de cuerpo lúteo (CL), clases de folículos ováricos, tipos de ovocitos y expresión del IGF-I y su receptor ovárico y hepático, en vacas mestizas hasta los 45 días posparto (DPP).
Materiales y Métodos
Animales y localización
Este estudio se llevó a cabo en el Laboratorio de la Sección de Bovinos, Instituto de Producción Animal, Facultad de Agronomía, Universidad Central de Venezuela,
en Maracay, estado Aragua. La precipitación promedio anual en la zona es de 800mm, con una temperatura promedio de 27ºC. Se utilizó un total de dieciocho (n=18) vacas mestizas (3/4 a 1/2 Holstein × Brahman), con dos o más partos, las cuales fueron sometidas a los protocolos experimentales aprobados por el Comité de Bioética de la Facultad de Ciencias Veterinarias, UCV. Los animales fueron evaluados desde el día 4 hasta el 45 DPP, una vez por semana antes de la detección del primer celo y dos veces por semana a partir del mismo. Alcanzados los 45 DPP, un grupo de ocho animales (dos animales/tratamiento) fueron faenados en un frigorífico industrial (Matadero Industrial de Turmero, estado Aragua), colectándose muestras de hígado y de los ovarios.
Manejo general y alimentación
Las vacas fueron alojadas en puestos individuales techados ubicados en un corral de 18×2m. Cada puesto fue acondicionado con un comedero y un bebedero automático para el consumo de agua a voluntad. La alimentación se basó en el suministro de aproximadamente 2kg de alimento concentrado (AC), bloque multinutricional (BMN) y pacas de heno de pasto estrella (Cynodon nlemf luensis) . El AC y el BMN fueron preparados en el laboratorio. El aporte calculado de la energía metabolizable (EM/kg) del AC y del BMN fue de 3,2 y 0,86 respectivamente. En el caso de la proteína cruda (PC) y proteína degradable en el rumen (RDP, por sus siglas en inglés) los aportes fueron de 23,1 y 19,3% para el AC y de 50,9 y 47,9% para el BMN, respectivamente. El pasto aportó 2,01EM/kg, 8,0% de PC y 4,68% de RDP.
Tratamientos y diseño del experimento
Las 18 vacas fueron asignadas al azar a los diferentes tratamientos (T). Los T quedaron conformados de la siguiente manera: T1 estuvo conformado por cuatro (n=4) vacas con condición corporal al pa r to (CCAP) baja (<2,5) + nivel de al imentación (NA) bajo (BCBA); T2: CCAP baja (<2,5) + NA alto (BCAA) (n= 4) ; T3: CCAP alta (≥2,5) + NA bajo (ACBA) (n= 4); y T4: CCAP alta (>2,5) + NA alto (ACAA) (n=4). La aplicación de los tratamientos se inició a los 4 DPP. La CCAP fue determinada según la escala del 1 al 5 del NIRD (National Institute of Research in Dairying) modificado por Fattet y Jaurena (1988). Las vacas de CCAP alta tuvieron valores de CC ≥2,5 y, las vacas de CCAP baja, valores inferiores a 2,5. El NA alto fue asignado según el aporte de energía metabolizable de las dietas exper imentales. Los requer imientos de las vacas fueron determinados de acuerdo a las tablas del Nat ional Research Council (NRC, 1989), en función del peso corporal y la producción de leche (promedio del total diario hasta los 60 días) de la lactancia anterior de cada una de las vacas. Así, en el NA bajo, la dieta cubría el 85% del requerimiento total de energía del animal (mantenimiento) y en el NA alto, las dietas aportaban el 115% del requer imiento total de energía. Se consideró mantener la relación de la cantidad de nitrógeno fermentable en el rumen (NFR) y la materia orgánica degradable (MODR) en el rumen (g NFR/kg MORD) ent re 25-30, con el propósito de evitar efectos confundidos debido a la variación entre T por dicha causa.
Actividad ovárica
Las evaluaciones de la actividad ovárica se llevaron a cabo a t ravés de la palpación rectal y del uso de ult rasonido por vía t ransrectal (Aloka SSD 900 Co. Ltd., Tokyo, Japan), desde el 15 al 45 DPP, usando una sonda transrectal lineal de 7,5MHz, y se realizaron una vez por semana antes de la detección visual del primer celo y dos veces por semana a partir de dicha detección. Las evaluaciones permitieron clasificar el crecimiento folicular en var ias clases: Clase 1 (≤5mm), Clase 2 (6- 9mm), y Clase 3 (≥10mm; Díaz et al., 1998) y confirmar la presencia de cuerpos lúteos detectados al examen clínico rectal.
Involución uterina
Se evaluó el proceso de involución uterina desde el 15 hasta el 45 DPP, empleando para esto las mismas técnicas de palpación y ultrasonido antes mencionadas. Para esta evaluación se empleó la clasificación de LeBlanc et al. (2002), la cual toma en cuenta la posición del útero (PU) con relación a la pelvis, la simetría de los cuernos uterinos (SCU) y el diámetro del cuerno uterino de la gestación previa y el diámetro del cervix (DC). Se tomaron muestras semanales de las secreciones cervicales utilizando hisopos, para realizar citologías y determinar el porcentaje de leucocitos polimorfonucleares (PMN) presente en la muestra. Las citologías fueron clasificadas en diversos grados que variaron entre de acuerdo a Kasimanickan et al. (2004). Además, se evaluaron las características físicas del moco cervical (CMC), empleando la clasificación de LeBlanc et al. (2002).
Niveles de progesterona en plasma
Se tomaron muestras de sangre en la vena yugular durante los 3, 15, 22, 33, 37 y 45 DPP para la determinación de la concentración de progesterona (P4) en el plasma de las vacas en el experimento. Las muestras de sangre fueron anal izadas mediante la técnica de RIA (Diagnost ic Systems Laboratorios, DSL Inc., TX, EEUU), usando pa ra esto un kit comercial val idado (DSL, 2006) en fase sólida. Los niveles de P4 para considerar el reinicio de actividad ovár ica fueron las concentraciones >0,5ng/ml en dos muest ras consecutivas, o cuando la concent ración de P4 en la muestra fue >1ng/ml (Meikle et al., 2003). Los coeficientes de variación intra-ensayo e inter-ensayo fueron 6,78 y 12,02% respectivamente.
Toma de muestras de tejidos en el matadero
Ocho de los animales fueron faenados a los 45 DPP (2 animales / t ratamiento) . Inmediatamente después de la faena, se procedió a la toma de muestras de ovario e hígado. En el caso de los ovarios se tomaron muestras tanto para la clasificación de los ovocitos como para la expresión del IGF-I y de su receptor, seleccionando el ovario que en la última evaluación ginecológica hubiese tenido el folículo ovárico de mayor diámetro (Clase 3). Las muestras fueron inmediatamente conservadas en N2 líquido y almacenadas a -80ºC hasta ser procesadas.
Clasificación (calidad) de los ovocitos
Durante el sacr if icio de las vacas se recolecta ron los ovarios activos, luego de ~20min del sacr i f icio. La calidad de los ovocitos fue evaluada en el Laboratorio de Biotecnología, Instituto de Reproducción Anima l (IRA), Facultad de Ciencias Veterinarias de la UCV. Los ovarios se diseca ron con bisturí y se coloca ron en termos que contenían 500ml de medio de transporte (solución salina estéril a temperatura de 37-39°C). Cerca de 4h después de recolectados los ovarios se procedió a la aspiración de los folículos con diámetro >2mm. El contenido aspi rado se colocó en tubos cónicos de 50ml (Falcon®, Becton Dickinson, Franklin Lakes, NJ, EEUU) que contenían el medio de cultivo modificado con líquido folicular humano (HTF, Irvine Scientific, RU) a pH 7,4 y 37°C (Ruiz et al., 2008). Este procedimiento sirvió para clasificar los ovocitos de acuerdo a Boni et al. (2002) en ovocitos tipo A (con presencia de un cumulus oophurus claro y compacto y un ooplasma oscuro), B (ovocitos con un cumulus oophurus oscuro y compacto y un ooplama oscuro) y C (con cumulus oophurus oscuro), usando para esto un estereomicroscopio (Stemi SV8; Zeiss Jena GmBH, Alemania) con aumento de 100X.
Expresión del IGF-I y de su receptor por Western Blot
Se prepararon tres minigeles de poliacrilamida-dodecil sulfato sódico (10-5% p/v) del tipo discontinuo (SDSPAGE). En uno de estos geles, se descargó 200μg de proteínas (BCA; Pierce, Rockford, IL, EEUU) del tejido ovárico de los animales de cada tratamiento, así como los diferentes estándares empleados: estándar precoloreado de proteínas (Bio-Rad Laboratories, Hercules, CA, EEUU), muestras de ovario de rata y oveja (200μg, como controles positivos) y una muestra de ganglio bovino (200μg, como control negativo). En los otros dos geles se descargaron muestras de proteína del tejido hepático, usando como control positivo tejido hepático de oveja. Los procedimientos de electroforesis vertical, transferencia de proteínas a las membranas de nitrocelulosa y bloqueo de las membranas se realizaron siguiendo la metodología descrita por Ruiz y Kittok (2008). Dos de las membranas se incubaron con el primer anticuerpo para el receptor de IGF-I de humano producido en cabra (I-7151; Sigma, S. Louis, MI, EEUU) a una dilución 1:500, durante 16-20h a 4°C. La otra membrana, la cual contenía muestras de tejido hepático, se incubó con el primer anticuerpo para el IGF-I de humano producido en cabra (sc: 1422; Santa Cruz Biotechnology, CA, EEUU) a una dilución 1:50 durante 16- 20h. Posteriormente, las tres membranas fueron incubadas con el segundo anticuerpo, IgG (molécula completa) de conejo anti-cabra conjugado con la enzima peroxidasa (A- 5420; Sigma St. Louis, MI, EEUU), durante 1h a 4˚C. Este anticuerpo fue usado a una dilución de 1:160000. Las bandas proteicas inmunoreactivas se visualizaron mediante una reacción de quimioluminiscencia (SignalR West Pico; Pierce, Rockford, IL, EEUU). Finalmente, las membranasse expusieron a películas de rayos X durante 30min.
Análisis estadístico
Los datos fueron analizados utilizando el paquete estadístico SPSS versión 10 (Domínguez et al., 2008; Ruiz et al., 2008). Para evaluar el grado de asociación ent re las var iables CCAP, NA, población folicular, involución uterina (SCU, DC, PU, CMC y citología), tipo de ovocitos y presencia deCL, por ser todas variables respuesta de tipo cualitativo (discretas), se recurrió a un análisis estadístico del tipo no paramétrico. Primero, se calculó una mat r iz de correlación no paramétrica de Kendall para cada periodo de muestreo y posteriormente, se realizó el análisis de varianza no paramétrico de Kruskal-Wal l is, por tener un solo cr iter io de clasif icación. En el caso de la variable clases de folículos, se apl icó el paquete estadíst ico Stat istix 8.0 tanto pa ra DPP, como pa ra los t ratamientos. Las concentraciones de progesterona en plasma (variable continua) fueron analizadas empleando el paquete estadíst ico SPSS, Versión 10, mediante un modelo GLM para medidas repetidas en el tiempo, donde se estudio el efecto de los seis tratamientos en cada uno de los tiempos evaluados (3, 15, 22, 33, 37 y 45 DPP).
Resultados
Involución uterina y actividad ovárica
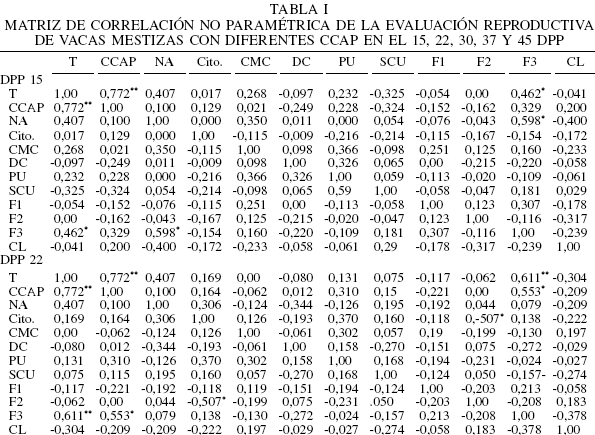
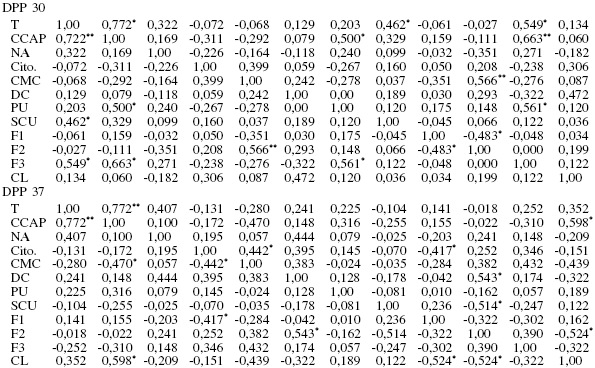
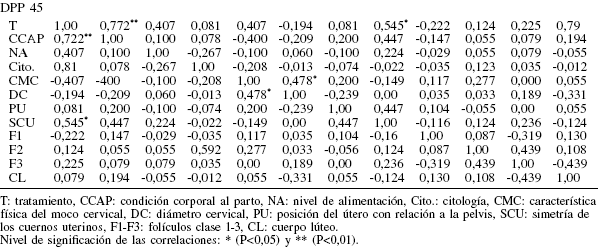
Los resultados de la mat riz de cor relación no pa ramédica sobr e la involución ut er ina y act ividad ovárica a los 15, 22, 30, 37 y 45 DPP se muestran en la Tabla I. Al analizar los datos mediante el análisis de varianza no paramétrico se detectó efecto del tratamient o sobre diámetro del cérvix (p<0,05), sobre la presencia del CL (p<0,05) y sobre el número de folículos Clase 3 (F3; p<0,01). Mientras que el tratamiento solo tendió a afectar el número de folículos Clase 1 (F1; p<0,09).
Concentraciones de progesterona en plasma
El tratamiento T4 afectó en forma altamente significativa la concentración de P4 a lo largo de los diferentes DPP evaluados. En el caso del T3 en 37 y 45 DPP, las vacas con una CCAP alta y NA bajo mostraron una tendencia a que las concentraciones de P4 fuesen mayores, en comparación con aquellos animales con una CCAP baja y un NA bajo o alto (0,2344 ± 0,2161 vs 1,150 ±1,5238ng/ml; P<0,093) y (0,2856 ±0,22995 vs 1,3433 ±1,68925ng/ml; P<0,081), respectivamente.
Calidad de los ovocitos
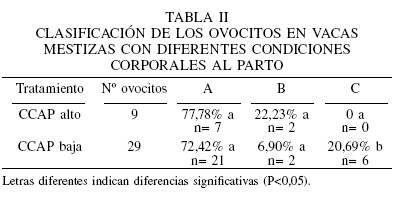
El análisis de la matriz de correlación no paramétrica reveló una asociación negativa significativa de -0,816 (p<0,05) entre ovocitos tipo C y CCAP. El análisis de varianza no paramétrico detectó un efecto altamente significativo entre CCAP y ovocitos tipo C (Tabla II). Los resultados sobre el efecto del nivel de alimentación sobre el tipo de ovocitos fueron previamente publicados (Ruiz el al., 2008).
Expresión del IGF y de su receptor en hígado y ovario
La expresión del IGF en el tejido hepático de la vaca fue evidenciada mediante la aparición de una banda proteica, expresada como valores de densidad óptica, con un peso molecular de ~18kDa (Figura 1) . Se observó una mayor expresión de este factor de crecimiento en el grupo de animales que presentaba una mejor CCAP. La expresión del receptor de IGF-I tanto en el tejido hepático (Figura 2) como ovárico (Figura 3), se evidenció a través de una banda proteica de peso molecular de ~120kDa y ~130 kDa, respectivamente. La expresión del receptor para el IGF-I en las muestras de hígado no parece estar afectado por los tratamientos (Figura 2), mientras que su expresión en las muestras de tejido ovárico, parece ser mayor en los animales que recibieron una buena alimentación, independientemente de la condición corporal del animal al parto (Figura 3).
Discusión
A medida que progresó el periodo postparto se evidenció como el moco cervical alcanzaba sus características normales. El porcentaje de PMN en las muest ras de este moco también estuvo asociada la va r iable de característica del moco cervica l (37 DPP) , coincidiendo con lo reportado por LeBlanc et al. (2002). Se evidenció un efecto del tratamiento (CCAP y NA) sobre la presencia del CL y sobre los niveles circulantes de P4 plasmática después del 37 DPP, momento en el cual la mayoría de las vacas iniciaron su actividad ovárica. Las vacas que parieron con una CCAP alta, aún cuando recibieron un NA bajo (T3), mostraron una tendencia a que las concentraciones de P4 fuesen mayores, en comparación con aquellos animales con una CCAP baja que recibían un NA bajo o alto. Ello permite inferir que el factor que más impactó los niveles plasmáticos de P4 fue la condición corporal con que los animales parieron.
En el periodo comprendido entre los 28 y 35 DPP se evidencia la normalización de las características físicas del moco endometrial y disminución del diámetro cervical (Perea et al., 1997), lo cual se asocia con la aparición del CL. Esto indica el avance en el proceso de involución uterina y en el reinicio de la actividad reproductiva en estos animales. En este estudio el diámetro cervical fue la variable de involución uterina que estuvo afectada por el tratamiento (p<0,05).
Se pudo evidenciar que la CCAP afectó el numero de ovocitos tipo C (p < 0,05) . En las vacas que parieron con una CCAP baja, aproximadamente el 21% del total de sus ovocitos se mantuvieron en su forma menos desarrollada, lo cual condujo a la disminución del porcentaje de ovocitos tipo A, potencialmente ovulables. Esto permite sugerir que las vacas que pa ren con una buena condición corporal son capaces de inicia r su actividad reproductiva después del parto más eficiente que aquel las vacas que paren con una baja reserva corporal. Fihri et al. (2005) recolectaron ovocitos de vacas de diferentes condiciones corporales faenadas en matadero, encontrando que en las vacas de condición corporal alta, el 79% de sus ovocitos fueron de buena calidad (p<0,05); en contraste, las vacas con una condición corporal pobre tuvieron bajo rendimiento en el número de ovocitos colectados, lo cual estuvo relacionado con el nivel de energía de la dieta. Los resultados anteriores coinciden con los publicados por nuestro grupo de investigación, en los que se pudo evidenciar que las vacas al imentadas con alto nivel energét ico presentaron mayor numero de ovocitos tipo A, así como mayores niveles de glucosa pospandrial (p<0,05) y menor expresión del receptor de glucosa tipo- (Glut-1) en el tejido adiposo (Ruiz et al., 2008).
La condición corporal tiene un significativo efecto sobre el número de folículos y sobre el rendimiento y calidad de los ovocitos (Rhind et al., 1989; Domínguez, 1995). Las observaciones de estos trabajos indican que la calidad de los ovocitos está asociada con la reducción de la fertilidad en las vacas de CC baja al parto, las que probablemente se encuentran en un balance energét ico negativo.
En el presente estudio se evidenció un efecto altamente significativo de T sobre el número de folículos Clase 3 (F3) y, en menor grado, con el número de folículos Clase 1 (F1). La CCAP tuvo solo efecto sobre los F3 (p<0,01), mientras que el NA afectó tanto a los F3 (p<0,05) como a los F1 (p<0,05). De lo anterior se puede inferir que la CC al momento del parto es un factor determinante en la activación de las formas más inmaduras de folículos, estimulando el desarrollo de nuevas cohortes foliculares potencialmente ovulables y, por ende, la capacidad de las vacas para reiniciar la actividad reproductiva.
Se evidenció una mayor expresión del receptor hepático del IGF-I en el grupo de animales con una CCAP alta y que están sometidos a un NA alto (Figura 2) . Mient ras que la expresión de los receptores ováricos del IGF-I fue mayor en las vacas que fueron sometidas a un régimen alimenticio alto, en comparación con aquellas sometidas a un régimen bajo, independientemente de su CC al momento del parto (Figura 3), pudiendose sugerir que el consumo alto de nutrientes mejora el balance energético en el postparto de la vaca lechera, lo cual provoca elevación de los niveles sanguíneos de insulina con su correspondiente efecto sobre el eje somatotrófico, descenso de los niveles sanguíneos de la GH y elevación del IGF hepático (Lucy, 2004). Lake et al. (2006) observaron que las vacas con CC bajas tenían niveles más altos de GH y menores del IGF-I, comparadas con aquellas que presentaban una mejor CC. En el presente t rabajo, la expresión del IGF-I hepático fue mayor en el grupo de animales que parieron con una CC alta (Figura 1). Sin embargo, nutricionalmente es posible inducir cambios en la secreción hepática del IGF-I, el cual tiene un efecto directo sobre el ovario a través de su acción endocrina (Lucy, 2004). En la cerda, la síntesis de IGF-I ovár ico es dependiente de la GH (Ki rby et al., 1996), pero este efecto no ha podido aun ser detectado en la vaca. El IGF-I en el ovario interactúa con su receptor localizado en el cumulus oophurus de los folículos pequeños, para acelerar el ciclo celular meiótico de los ovocitos (Sakaguchi et al., 2002). Monget y Monniaux (1995) observaron que las actividades autocrinas-paracrinas de IGF-I y -I I incluyen el estímulo sobre el crecimiento celular, incremento de la producción de P4 y E2, y aumento de la sensibilidad de las células de la granulosa al estímulo de FSH en bovinos.
Conclusiones
La condición corporal al parto es un factor determinante para la reinicio de la actividad reproductiva durante el postparto. El IGF-I funciona como un modulador de la acción de las gonadotropinas a nivel ovárico en esta especie.
Agradecimientos
Al Fondo Nacional de Ciencia Tecnología e Innovación (FONACIT) por aportar los recursos para la realización de esta investigación a través del Proyecto N° G- 005000446 y al Consejo de Desar rollo Científico y Humanístico (CDCH) de la Universidad Central de Venezuela (UCV) por aportar los fondos para la difusión de los resultados de esta investigación.
REFERENCIAS
Boni R, Cuomo A, Tost i E (2002) Developmental potential in bovine oocytes is related to cumulus-oocyte complex grade, calcium cur rent activity, and calcium stores. Biol. Reprod. 66: 836-842.
Butler WR (2000) Nutritional Interactions with Reproductive Performance in Dairy Cattle. Anim. Reprod. Sci . 60- 61: 449-457.
Díaz T, P-Schmitt EJ, de la Sota RL, Thatcher MJ, Thatcher WW (1998) Human chorionic gonadot ropin-induced alterations in ovarian follicular dynamics during the estrous cycle of hei fer s. J. Anim. Sci. 76: 1929-1936.
Dominguez MM (1995) Effects of body condiction, reproductive status and breed on follicular population and oocyte quality in cows. Theriogenology 43: 1405-1418.
Domínguez C, Ruiz AZ, Pérez R, Martinez N, Drescher K, Pinto L, Araneda R (2008) Efecto de la condición corpora l a l pa r to y del nivel de alimentación sobre la involución uter ina, act ividad ovár ica, preñez y la expresión hipotalámica y ovárica de los receptores de leptina en vacas doble propósito. Rev. Fac. Cs. Vets. UCV 49: 23-36.
Drackley JK (1999) ADSA Foundation scholar award. Biology of dairy cows during the t ransition per iod: the f inal f ront ier? J. Dair y Sci . 82: 2259-2273. DSL (2006) Immodiagnostic Assays for Animal Aplications. www.AnimalDx.com. (Cons.: 18/12/2008).
Fattet I, Jaurena M (1988) El Estado Corporal de las Vacas Lecheras. Hemisfer io Sur. Buenos Ai res , Argent ina. 5 pp. Fihr i AF, Lakhdissi H, Derqaoui L, Naci r i M, Gouma r i A (2005) Genetic and nongenetic effects on the number of ovarian follicles and oocyte yield and quality in the bovine loca l (Oulmes Zaer), exotic breeds and their crosses in Morocco. Afr. J. Biotechnol. 4: 9-13.
For tune JE, Rivera GM, Yang MT (20 04) Fol l icula r de - velopment : the role of the follicular microenvironment in selection of the dominant follicle. Anim. Reprod. Sci. 82-83: 109-126.
Gui lbault LA, Thatcher WW, Drost M, Haibel GK ( 1987) Inf luence of physiological infusion of prostaglandin F2a into postpar tum cows wit h par t ial suppressed endogenous product ion of prostaglandin. Uterine and ovaric mor phologica l responses. Theriogenology 27: 931-946.
Hajurka J, Maca k V, Hura V (2005) Inf luence of healt h status of reproductive organs on uterine involution in dairy cows. Bull. Vet. Pulaway 49: 53-58.
Kamimura S, Ohgey T, Ta kahashi M, Tsukamoto T (1993) Postpar tum resumption of ovarian activity and uterine involution monitored by ultrasonography in Holstein cows. J. Vet. Med. Sci. 55: 643-647.
Kasimanickam R, Duf f i ld TF, Foster RA, Gartley CJ Leslie KE, Walton JS, Jhonson WH (2004) Endometrial cytology and ultrasonography for the detection of subclinical endometritis in postpartum of dairy cows. Thereogenology 62: 9-23.
Kim JW, Rrhoads RP, Block SS, Overton TR, Frank SJ, Boisclair YR (2004) Dairy cow exper ience selective reduct ion of the hepat ic growt h hormone receptor during the periparturient period. J. Endocrinol. 181: 281-290.
Ki rby CJ, Thatcher WW, Coll ier RJ, Simmen FA, Lucy MC (1996) Effect of growth hormone and pregnancy on expression of growth hormone receptor, insulin-like growth factor-I, and insulinl ike growth factor binding protein-2 and -3 genes i n bovine uter us , ova r y, and oviduct. Biol . Reprod. 55: 996-1002.
La ke SL, Schol ljegerdes EJ, Hallford DM, Moss GE, Rule DC, Hess BW (2006) Effect of body condit ion score at par tur ition and postpar tum supplemental fat on metabolite and hormone concentration of beef cows and their suckling calves. J. Anim. Sci. 84: 1038-1047.
LeBlanc SJ, Duf f ield TF, Leslie KE, Bateman KG, Keefe GP, Walton JS, Johnson WH (2002) Def ining and diagnosing postpar tum cl inical endometritis and its impact on reproductive performance in dairy cows. J. Dairy Sci. 85: 2223-2236.
Lindel l JO, Kinda hl H, Jans - son L, Edqvi st LE (1982) Postpartum release of prost aglandin F2a and uter ine involution in the cow. Theriogenology 17: 237-245
Lucy MC (20 04) Mechanisms l in k ing the somat rot ropic axis with insul in. Lessons for the postpa r tum cow. Proc. N. Z. Soc. Anim. Prod. 64:19-23.
Lucy MC (2008) Functional differences in the growth hormone and insulin like growth factor axis in cattle and pigs: impl icat ions for the postpartum nutrition and reproduction. Rep. Domest. Anim. 43: 231-239.
Mateus L, Lopez da Cost a L, Bernardo F, Robalo Silva J (20 02) Inf luence of puerpera l uter ine infect ion on uter ine involution and postpar tum ovar ian activity in dai ry cows. Reprod. Dom. Anim. 37: 31-35.
Meikle A, Cavestany D, Blanc J, Kral l E, Ur iar te G, Rodr íguez- Irazoquil M, Ruprechter G, Ferraris A, Chilibroste P (2003) Perfiles metabólicos y endocr inos , pa rámet ros productivos y reproductivos en vacas de leche en condiciones pastoriles. Veterinaria 40: 25-40.
Monget P, Monniaux D (1995) Growth factors and the cont rol of fol l iculogenesis. J. Reprod. Fertil. 49 (Suppl 1): 321-333. NRC (1989) Nutr ient Requirements of Dairy Cattle. 6a ed. rev. National Academy Press. Washington, DC, EEUU. 157 pp.
Perea GF, Cruz AR, González FR, Soto BE, González SC, Rincón UE (1997) Evaluación ult rasonográf ica de la involución uterina en vacas mest izas t ropica les. Arch. Lat inoam. Prod . Anim. 5 (Supl. 1): 368-369.
Radcl i f f RP, Mccormack BL, Crooker BA, Lucy MC (20 03) Growth hormone (GH) binding and expression of GH receptor 1A mRNA in hepatic tissue of periparturient dairy cows. J. Dairy Sci. 89: 3933-3940.
Rhind SM, Mckelvey WAC, Mcmillen SR, Gunn RG, Elston DA (1989) Effect of restricted food intake, before and/ or af ter mating, on the reproduct ive per formance of greyface ewes. Anim. Prod. 48: 149-155.
Ruiz EAZ, Kittok R (2008) Detección de la subunidad NMDAR- 1 del receptor N-metil- D-aspartato (NMDAR) en el hipot á lamo del ovino me - diante el análisis de Western blot. Rev. Cient. FCV-LUZ. 18: 148-153.
Ruiz AZ, Domínguez C, Martínez N, Pinto L, Drescher K, Rossini M, Pérez R, Rojas J, Araneda R, Fernández A, Jerez N (2008) Efecto del nivel de alimentación sobre la actividad ovárica, expresión de transportadores de glucosa y tolerancia a la insulina en vacas mestizas durante el pospar to. Zootec. Trop. 26: 95-104.
Sakaguchi M, Dominko T, Yamauchi N, Leibfried-Rutledge ML, Nagai T, Fi rst NL (2002) Possible mechanism for accelerat ion of meiot ic progression of bovine follicle oocytes by growth factor in vitro. Reproduction 123: 135-142.
Sheldon IM, Dobson H (2004) Postpa r tum uter ine hea lt h in cattle. Anim. Reprod. Sci. 82-83: 295-306.
Slama H (1996) Prostaglandines, leucotrienes et suinvolution utér ine chez la vache. Rec. Med. Vet. 173: 369-381.
Wathes DC, Fenwick M, Cheng Z, Bourne N, Llewellyn S, Mor ris DG, Kenny D, Murphy J, Fitzpatrick R (2007) Influence of negative energy balance on cyclicity and fertility in the high producing dai ry cow. Theriogenology 68: 232-241.