INTRODUCCIÓN
Coronavirus bovino (BCoV) es un importante agente patógeno del ganado bovino, el cual está asociado a tres síndromes clínicos diferentes (Saif, 2004), caracterizándose de forma general por una rápida diseminación, afectando tanto a individuos jóvenes como adultos, siendo responsable de grandes pérdidas económicas anualmente a nivel mundial (Martínez y col, 2002).
La primera notificación de este virus ocurrió en el año 1972 en los Estados Unidos de América, asociado a una enfermedad entérica de los terneros neonatos (Síndrome diarreico neonatal del ternero) (Mebus y col, (1972); el virus fue purificado de heces fecales diarreicas de terneros gnotobióticos inoculados experimentalmente, detectándose por microscopia electrónica y caracterizándose morfológicamente dentro del grupo de los coronavirus (Stair y col, 1972); un año después en 1973 Mebus logró el aislamiento del virus en cultivo primario de riñón de embrión bovino (Mebus y col, 1973a).
Posteriormente en el año 1975 en Nueva Zelanda se relacionó a BCoV con un síndrome diarreico del ganado bovino adulto (Disentería de Invierno) (Horner y col, 1975), aunque esta relación permaneció como un enigma durante algunos años, reportándose por varios investigadores en diversos países (Campbell y Cookingham, 1978; Clark, 1993; Van Kuiningen y col, 1995), lo que fue aclarado en estudios subsiguientes (Smith y col, 1998; Tsunemitsu y col, 1999), reconociéndose a BCoV como el principal agente etiológico de la Disentería de Invierno (Cho y col, 2001; Saif, 2002; Hasoksuz y col, 2002a; Hasoksuz y col, 2005; Jeong y col, 2005a).
Además de infectar el sistema digestivo provocando trastornos entéricos BCoV también posee tropismo por el tracto respiratorio de donde ha sido recuperado a partir de animales convalecientes de enfermedad respiratoria (McNulty y col, 1984; Reynolds y col, 1985; Saif y col, 1986).
En la década de los noventa Storz y col, (1996) comunicaron el aislamiento de BCoV a partir de muestras de secreciones nasales de bovinos jóvenes con signos respiratorios después de la transportación, no siendo hasta el año 2000 cuando se demostró a través de los postulados de Evans su asociación con la Fiebre de Embarque (Storz y col, 2000a); ratificado en ese mismo año cuando Storz y col, (2000b) reportaron que BCoV fue el virus aislado con mayor frecuencia al estudiar dos epizootias de Fiebre de Embarque en más de 100 bovinos.
En la actualidad, BCoV resulta endémico de un gran número de países de Europa (Jactel y col, 1990; Hartel y col, 2004; Dringeliene y col, 2004), Asia (Takamura y col, 2002; Jeong y col, 2005b), Oceanía (Beer, 1983) y América (Dea y col, 1995; Jerez y col, 2002), por lo que puede admitirse su difusión a nivel mundial.
En Cuba este virus no había sido reportado con anterioridad, a pesar de que se habían realizado investigaciones para esclarecer la etiología de la diarrea, tanto del ternero como de bovinos adultos. A principios del 2004 se comenzaron a presentar en rebaños del país, brotes con características clínico-epizoóticas similares a las descritas para la Disentería de Invierno, lo que fue confirmado después de realizarse un diagnóstico de laboratorio que demostró que BCoV fue el agente etiológico de estos brotes.
DESARROLLO
Características generales del virus.
BCoV es un virus ARN, envuelto; ubicado taxonómicamente dentro de la familia Coronaviridae, género Coronavirus y orden Nidovirales (González y col, 2003); y clasifica en el segundo grupo de los tres en que se dividen los coronavirus (Knipe y col, 2001; Brandao y col, 2001), en el cual se incluyen además Coronavirus respiratorio humano 0C43, Virus de la hepatitis murina, Virus de la sialodacrioadenitis y Virus de la encefalomielitis hemoaglutinante porcina; con los cuales está muy relacionado desde el punto de vista de sus secuencias nucleotídicas y reacciones serológicas (Saif, 2004).
A principio de los años dos mil se reportó el hallazgo de un nuevo coronavirus, el cual resultó ser el agente etiológico del síndrome respiratorio agudo severo (SARS); sin embargo, este nuevo virus no pertenece a ninguno de los tres grupos reportados hasta el momento (Ksiazek y col, 2003; Res y Mindell, 2003), lo que incrementa el interés por conocer las propiedades de los coronavirus.
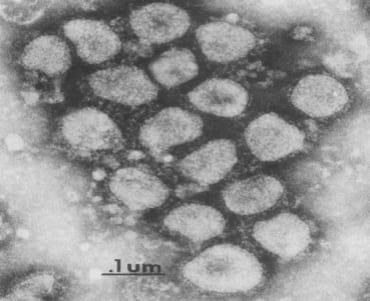
En suspensiones purificadas de BCoV se han observado consistentemente al microscopio electrónico partículas esféricas, con un diámetro de alrededor de 120 nm, apreciándose en la superficie proyecciones dispersas uniformemente, en forma de corona, con un diámetro de alrededor de 12-24 nm. Una envoltura lipoproteica rodea la cápsida, de simetría helicoidal, que posee un diámetro aproximado de 14 a 16 nm (Brandao y col, 2003).
Debido a la presencia de lípidos esenciales en la envoltura viral el virus se inactiva rápidamente con solventes orgánico como éter, cloroformo y deoxicolato de sodio, además con detergentes, como Nonidet P-40. La infectividad es estable a pH 3. El coeficiente de sedimentación de la cepa Mebus y LY-138 es de 1.18-1.20g/mL en sacarosa y de 1.24-1.25 g/mL en solución CsCl (Mebus, 1990).
Figura 1. Microfotografía electrónica de BCoV. Tomada del Benfield y Saif, (1990).
Sharpee y col, (1976) y Soto y col, (1977) investigando sobre la termosensibilidad del virus han planteado que este virus puede permanecer en congelación un tiempo muy largo, incluso a -20°C puede resistir más de dos años; sin embargo al calentarlo a 50°C durante 60 minutos se produjo una inactivación total, lo que puede ser prevenido cuando se incluye MgCl2 1M en el medio durante la incubación.
La supervivencia del virus en la naturaleza es muy baja; a temperatura ambiente el virus disminuye tres logaritmos su título durante un período mayor de 10 días, siendo extremadamente sensible a las altas temperaturas y a las radiaciones solares (Growes, 1982). Se inactiva en fenol al 0.5%, formalina 0.05%, ambos en 30 minutos. La sosa cáustica lo destruye rápidamente al 2%, también muestran una rápida inactivación por la luz ultravioleta (Mebus, 1990).
Investigaciones realizadas sobre el genoma del virus han revelado que el mismo está compuesto por una molécula de ARN de banda simple, con polaridad positiva (Chang y col, 1994; Chang y Brian, 1996; Yoo y Pei, 2001). Estudios previos, que emplearon electroforesis en geles de agarosa después del marcaje metabólico, representaron una molécula de alrededor de 31 kd de longitud (Cavanagh, 1997; Knipe y col, 2001), lo que fue confirmado al clonar y secuenciar tres cepas del virus, 98TXSF-110-LUN y 98TXSF-110-ENT (Chouljenko y col, 2001a) y la cepa Québec (Yoo y Pei, 2001), revelando en todos los casos la presencia en el genoma viral de trece marcos de lectura abiertos, flanqueados por dos regiones no codificantes conservadas.
Las proteínas estructurales del virus incluyen una fosfoproteína (N), la cual se encuentra asociada al ácido nucleico viral, conformando la nucleocápsida (Guy y Brian, 1979). Esta es una proteína de 52 kd, de forma alargada, flexible, que le confiere una simetría helicoidal a la nucleocápsida (King y Brian, 1982). Cuando se libera la partícula viral, la nucleocápsida aparece como una cadena tubular extendida con un diámetro de 14 a 16 nm (Sturman y Holmes, 1983; Daginakatte y col, 1999). La proteína N interactúa con la glicoproteína M, liderando la formación de partículas virales (Sturman y col, 1980).
Estudios realizados utilizando anticuerpos monoclonales dirigidos contra N han demostrado que esta proteína juega un papel importante en la síntesis de ARN viral, debido a que se inhibe in vitro la reacción ARN polimerasa (Deregt y Babiuk, 1987). N también se une a la membrana celular y a fosfolípidos, facilitando el ensamblaje y formación de complejos ARN (Anderson, 1993).
Recubriendo la nucleocápsida, en la parte central del virión, figura la membrana, compuesta por una glicoproteína (M), de 25 kd, la cual da la forma esférica de la partícula viral. El centro de la partícula viral está unido a la envoltura, la que se forma durante la salida del virus de la membrana intracelular (Spaan y col, 1988; Narayanan y col, 2000). La glicoproteína M también atraviesa la capa lipídica de la membrana; dado que la misma es un componente de la estructura interna del virión y de la envoltura (Armstrong y col, 1984).
Anticuerpos monoclonales contra el dominio externo de la proteína M neutralizan la infectividad viral, pero solo en presencia del complemento (Locker y col, 1992).
Dos tipos de espículas se proyectan desde la membrana del virus; la espícula más larga mide alrededor de 20 nm, la cual es una glicoproteína (S), sumamente pesada, su masa molecular es de alrededor de 180 kd (Yoo y Deregt, 2001). Esta proteína contiene dos regiones hidrofóbicas características: una, el extremo N-terminal, que funciona como una simple secuencia y la otra, el extremo C-terminal, que funciona como un ancla a la membrana (Yoo y col, 2000), dando lugar a dos subdominios, S1 y S2 (Knipe y col, 2001).
El subdominio S1 incluye la porción N-terminal, la mitad de la molécula y forma la porción globular de la espícula. Esta contiene la secuencia que es responsable del ligamiento a los receptores específicos de la membrana de la célula susceptible. La secuencia de S1 es variable, ocurriendo mutaciones en diferentes cepas o aislados (Fazakerley y col, 1980; Naylor y col, 2001). Estas mutaciones en la secuencias de S1 han estado asociadas con alteraciones antigénicas y en la patogenicidad del virus (Hingley y col, 1994; Yamada y col, 2000; Vabret y col, 2001).
El subdominio S2 representa la porción C-terminal de la proteína y en contraste sus secuencias son más conservadas y posee una estructura enrollada (De Groot y col, 1987), constituyendo el tallo de la espícula viral (Luo y Weiss, 1998).
Investigaciones realizadas por Collins y col, (1982) y Fleming y col, (1983) empleando anticuerpos monoclonales dirigidos contra S neutralizaron la infectividad viral, debido a que S se une a los receptores celulares permitiendo la penetración del virus (Kubo y col, 1994; Hingley y col, 1994) induciendo fusión de la envoltura viral con la membrana de la célula hospedera y fusión célula-célula (De Groot y col, 1989; Taguchi, 1993). La proteína S de BCoV puede también unirse a 9-0-ácido acetil neuroamínico y posee actividad hemoaglutinante (Vlasak y col, 1988; Schultze y col, 1991a).
La más corta de las dos espículas del virus es denominada hemoaglutinina esterasa (HE), una glicoproteína que posee una masa de 65 kd (Kienzle y col, 1990). La presencia o ausencia de esta proteína es altamente variable, sufriendo mutaciones frecuentemente durante pases sucesivos en cultivo de tejidos (Schultze y col, 1991b), lo que sugiriere que la proteína HE no es esencial para la replicación viral.
Tanto la proteína S como la proteína HE se unen a residuos del 9-0-ácido acetil neuroamínico (Schultze y col, 1991; Schultze y Herrler, 1992), contribuyendo a la actividad de hemoaglutinación y hemoadsorción del virus. HE posee actividad acetil esterasa que cliva grupos acetil del 9-0- ácido acetil neuroamínico (Vlasak y col, 1988; Klausegger y col, 1999); por consiguiente previene o revierte la hemoaglutinación o la hemoadsorción inducida por S o HE.
En este contexto existe contradicción en la literatura. El reporte de Soto y col, (1977) indica que la hemoaglutinación ocurre a 4 °C, a temperatura ambiente y a 37 °C. Por su parte Ellens y col, (1978) reportaron la habilidad del virus de hemoaglutinar a 4 °C pero eluir a 37 °C. La relevancia de este hallazgo radica en que aislados de BCoV británicos eluyen eritrocitos de ratas a 37 °C, sin embargo la cepa Mebus no lo hace. Estas diferencias permiten distinguir entre cepas (Gorwes, 1982).
Sharpee y col, (1976) reportaron que el virus aglutina eritrocitos de ratas, ratones y hámster, pero no aglutina eritrocitos de gato, perro, chivo, carnero, bovino, equino, pavo, curiel, conejo, ganso, cerdo y humano. Soto y col, (1977) confirmaron estos datos, pero encontraron que utilizando eritrocitos de pollo la aglutinación es dudosa.
La envoltura viral también contiene la proteína E, la cual está presente en mucho menos cantidad que otras proteínas de la envoltura (Venneman y col, 1996); esta proteína posee una masa de 8 kd (Yu y col, 1994; Kuo y Masters, 2003) y junto con la proteína M participan en la salida de los viriones (Venneman y col, 1996).
Replicación viral.
Schultze y col, (1991b) y Schultze y Herrler, (1992) refieren que la adsorción del virus a la membrana plasmática de la célula diana ocurre por medio de la glicoproteína HE, la cual se une al 9-0-ácido acetil neuroamínico, común en macromoléculas de la membrana. Experimentos que realizaron la extracción enzimática del 9-0-ácido acetil neuroamínico de membranas celulares o el tratamiento del virus con anticuerpos monoclonales contra HE, demostraron una inhibición de la infección del virus, pero no la bloquean completamente, sugiriendo que la unión de HE y el 9-0-ácido acetil neuroamínico es necesaria para facilitar la infección del virus (Deregt y Babiuk, 1987).
La inhibición por disopropilfluorofosfato de la actividad esterasa de HE también reduce la infectividad del virus, sin embargo esta actividad esterasa probablemente está relacionada más bien en la liberación y entrada porque recién sintetizado los viriones quizás atrapados por residuos del ácido siálico en moléculas de la superficie celular requieren esterasa para ser liberados (Schultze y Herrler, 1992).
Después de la unión del virus al receptor específico, este penetra en la célula, paso que involucra a la proteína S, la cual induce fusión de la envoltura viral con la membrana plasmática o la membrana endosomal. El pH óptimo exhibido por BCoV para este evento está alrededor de lo neutral o ligeramente alcalino (Li y Cavanagh, 1992), lo que sugiere que este virus puede causar fusión de la envoltura viral con la membrana del plasma a pH fisiológico en el ambiente extracelular (Payne y Storz, 1988).
Una vez ocurrido el desnudamiento a nivel del citoplasma, el ácido nucleico del virus actúa como ARN mensajero y es traducido en una poliproteína de alrededor de 800KD (Stephensen y col, 1999), la cual es procesada co- y post- traduccionalmente; precursora de la polimerasa y otras proteínas virales que participan en la síntesis del ARN viral (Knipe y col, 2001).
La polimerasa usa los productos del ARN genómico como plantilla para la síntesis de ARN subgenómico de sentido negativo, el que es a su vez usado para sintetizar ARN genómico y ARNm subgenómico; ambos de polaridad positiva (Spaan y col, 1983). Cada uno de los ARNm es traducido en una sola proteína e incluyen las estructurales N, M, E, S y HE y proteínas no estructurales (NS2 y NS4) (Knipe y col, 2001).
Con el empaquetamiento del ARN genómico progenie y el ensamblaje de los viriones, que ocurre en el retículo endoplasmático y en Golgi el ciclo viral entra en su etapa final. Los virus alcanzan el compartimiento extracelular por transporte vesicular o exocitosis (Schultze y col, 1991b; Griffiths y Rottier, 1992).
Diversidad biológica.
La diversidad de síndromes clínicos a los que está asociado BCoV ha dado al traste con la realización de investigaciones encaminadas a esclarecer las relaciones existentes entre cepas del virus aisladas a partir de procesos entéricos y respiratorios, tanto en individuos jóvenes como adultos.
Hasta el momento ha sido identificado un solo serotipo del virus (Saif, 2004). En estudios iniciales desarrollados con cepas aisladas en diferentes epizootias se observó que la cepa LY- 138 reaccionó en ensayos de inmunoprecipitación con antisueros de la cepa Mebus y cepas aisladas en Inglaterra y Dinamarca y por pruebas de inmunofluorescecia e inhibición de la hemoaglutinación con la cepa Mebus (Gorwes, 1982). De igual forma la cepa Kakegawa aislada en Japón reaccionó por IHA y seroneutralización con antisueros de cepas de diarrea neonatal obtenidas en los Estados Unidos (Espinasse y col, 1990).
Con la utilización de ensayos más discriminatorios como las pruebas de seroneutralización utilizando anticuerpos monoclonales, las pruebas de protección cruzada in vivo y la secuenciación, empleando cepas aisladas a partir de diversos cuadros clínico se han observado diferencias entre aislados (Chouljenko y col, 2001b; Miyaki y col, 2001; Whelan y col, 2001).
Resultados de estudios comparativos indican que el virus se multiplica en el tracto intestinal y respiratorio de terneros gnotobióticos privados de calostro (Saif y col, 1986). Sin embargo, Storz y col, (1996) y Hasoksuz y col, (1999) reportaron que cepas de BCoV aisladas de procesos respiratorios difieren desde el punto de vista biológico y antigénico de cepas de BCoV aisladas a partir de cuadros entéricos; mientras que otros autores reportan la no existencia de diferencias entre cepas respiratorias y entéricas de BCoV (Reynolds y col, 1985; Tsunemitsu y col, 1991).
Fukotomi y col, (1999) encontraron que aislados de BCoV a partir de procesos respiratorios y entéricos en bovinos adultos con Disentería de Invierno pertenecen a grupos antigénicos diferentes, de acuerdo con la reactividad de anticuerpos monoclonales contra la glicoproteina S. Sin embargo en otro reporte Zhang y col, (1994) encontraron que una cepa de BCoV aislada a partir de enfermedad respiratoria fue genéticamente similar a un aislado obtenido de proceso entérico con 98,7% de nucleótidos similares al secuenciar el gen de la espícula en ambos aislados.
Otros reportes indican que terneros recuperados de infección con cepas de BCoV aislados de procesos entéricos en terneros y de Disentería de Invierno en adultos respectivamente, fueron protegidos del desafío con cepas de diarrea neonatal y Disentería de Invierno de BCoV asociadas a diarrea (Saif y col, 1986), pero hubo eliminación de BCoV en secreciones nasales, detectado en 2 de los 4 terneros (El-Kanawati y col, 1996).
Tsunemitsu y col, (1999) demostraron que cepas de BCoV obtenidas de terneros con diarrea neonatal pueden causar el cuadro entérico en bovinos adultos, mientras que cepas de BCoV obtenidas de animales adultos con disentería de invierno pueden causar la enfermedad en terneros, lo que permitió en ambos casos estar protegidos del desafío con cepas del virus asociadas a diarrea.
En experimentos más recientes Cho y col, (2001) comunicaron la existencia de protección cruzada entre terneros inoculados experimentalmente con cepas de BCoV aisladas a partir de enfermedad respiratoria, diarrea neonatal y disentería de invierno respectivamente, los cuales fueron resistentes al posterior desafío con cepas de BCoV asociada a diarrea.
Existen varios reportes de la utilización de métodos moleculares aplicados al estudio de BCoV (Zhang y col, 1994; Kourtesis y col, 2001; Koljesar y Yoo, 2001; Brandao y col, 2003) donde se demuestra la utilidad de estos para la identificación individual y el análisis filogenético de las cepas involucradas en diferentes brotes, así como para comprender la patogénesis, evolución y diseminación del virus.
Para el estudio molecular de cepas y aislados de BCoV se han empleado diversos procedimientos, como análisis de patrones de enlazamiento de anticuerpos monoclonales (Gelinas y col, 2001; Yoo y Deregt, 2001), de enzimas de restricción y de secuenciación nucleotídica (Cho y col, 2001; Chouljenko y col, 2001a; Hegyi y col, 2002).
Entre estos procedimientos la mayor discriminación se reporta con los datos obtenidos del análisis de secuenciación (Woo y col, 2005) los cuales posibilitan que los análisis epizootiológicos se sustenten en un mayor conocimiento del genoma del virus, basados en la posibilidad de secuenciar los ácidos nucleicos, así como establecer relaciones filogenéticas.
Un ejemplo de lo anteriormente planteado lo constituyen los trabajos de Chouljenko y col, (2001a) quienes compararon las secuencias del genoma de dos aislados de BCoV, entérico y respiratorio, obtenido de un individuo con Fiebre de Embarque, demostrando que los dos aislados diferían en 107 posiciones de las 31028 del genoma, lo cual se tradujo en cambios en 24 aminoácidos, que pudiera contribuir a modular cambios genotípicos en aislados de BCoV.
Resultados similares fueron reportados por Hasoksuz y col, (2002b) quienes encontraron diferencias entre aislados de BCoV asociados a enfermedad respiratoria y entérica, al secuenciar la subunidad S1 del gen que codifica para la glicoproteína S, encontrándose cambios en 42 aminoácidos, lo que confiere diferencias significativas en la predicción de la estructura secundaria de esta proteína en aislados respiratorios con respecto a asilados del virus de procesos entéricos, lo que sugiere que existen diferencias a nivel genético entre aislados de BCoV respiratorios y entéricos.
Manifestaciones clínicas.
La enfermedad en terneros fue descrita en una serie de reportes de Mebus y sus asociados (Mebus y col, 1973b; Mebus y col, 1975) y por Doughri y Storz, (1977), en todos los estudios en terneros inoculados experimentalmente el periodo de incubación varía entre 18-24 horas, caracterizándose el cuadro clínico por la presentación de diarreas líquidas, amarillas, dependiendo el volumen de la cantidad de leche ingerida; de 12-24 horas después los terneros muestran tener hambre e ingieren más leche y continúan con diarreas que pueden contener mucus y restos de sangre, las diarreas persisten durante 5-6 días. También se observa una severa deshidratación después de 48-62 horas de comenzar las diarreas (Gorwes, 1982).
Figura 2. a) diarreas amarillas, b) diarreas con coágulos de sangre. Terneros inoculados experimentalmente con una cepa enteropatogénica de BCoV.
La enfermedad natural cursa con diarreas líquidas profusas que pueden persistir durante 2-6 días, anorexia, pirexia y deshidratación; algunos terneros contienen restos de sangre en sus heces. La morbilidad y mortalidad son altas y terneros con diarreas sanguinolentas pueden experimentar una hipovolemia a pocas horas de haber comenzado los signos clínicos (Mc. Arthur, 1997).
En terneros inoculados por vía nasal y traqueal se ha observado infección respiratoria acompañada de diarreas (Mebus, 1990), presentándose al inicio en una rinitis con tos y fiebre, debilidad, inapetencia, lagrimeo y secreción nasal serosa, la cual concluye con una traqueitis (El-Kanawati y col, 1996). La enfermedad dura alrededor de 1-2 semanas (Cho y col, 2003).
En bovinos adultos la enfermedad se caracteriza por una elevada morbilidad (50-100%) aunque la mortalidad es baja (1-2%) (Collins y col, 1987). Clínicamente se manifiesta con severas diarreas líquidas, fétidas, que algunas veces contiene sangre y mucus (Tsunemitsu y col, 1999), decrecimiento de la producción láctea que puede ir desde un 25 a un 95% (Martínez y col, 2002), depresión, anorexia y algunas veces tos y/o descargas nasolagrimales (Callan, 2005).
En algunos casos observamos cólicos leves, otros animales pueden tener aspecto enflaquecido; si la diarrea es grave o persistente por más de un día podrá ocurrir deshidratación, siendo la pérdida de peso evidente (Millaje y col, 1995).
Frecuentemente está presente o aumentada la sed, siguiendo la diarrea que puede ir desde una consistencia pastosa hasta francamente líquida y en muchos casos con abundante presencia de sangre; la cantidad de sangre puede variar desde pocas, invisibles, a grandes coágulos, pudiendo estar uniformemente mezclada con las heces (Rogan y col, 1995). Algunos síntomas respiratorios leves pueden ocurrir consistiendo en secreciones nasolagrimales serosas y tos suave que también puede ser observada precediendo la diarrea (Heckert y col, 1991).
El periodo de incubación puede variar de 2 a 8 días en los animales afectados de forma más grave (Espinasse y col, 1990). La incidencia de diarrea de forma explosiva con surgimiento de los síntomas se aprecia entre el 10 a 15% de los animales en el primer día, el segundo día del 20 a 40% de los animales son afectados hasta alcanzar el 100% del rebaño; típicamente dentro de dos semanas del inicio de la diarrea, todos los animales se recuperan; en grandes rebaños la duración se puede prolongar de 6 a 8 semanas (Heckert y col, 1991).
Características anátomo e histopatológicas.
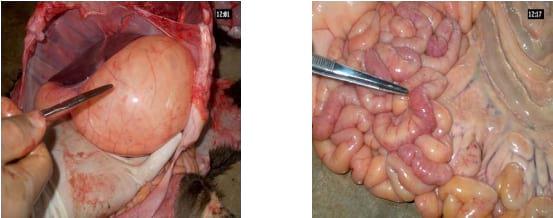
Al realizar la necropsia en terneros con cuadro entérico sacrificados entre 24-48 horas postinoculación, las lesiones no son tan evidentes; después de este tiempo y con el incremento de las diarreas, comienza apreciándose el estómago distendido con leche coagulada en su interior (Kapil y col, 1991).
A lo largo del intestino se puede observar dilatación, flacidez y el aumento del contenido líquido, de color amarillo; los terneros muestran signos de deshidratación, también se observa con frecuencia trastornos circulatorios, básicamente congestión y hemorragias petequiales en ciego y colon espiral; los ganglios linfáticos mesentéricos se observan aumentados de tamaño (Mebus y col, 1973b).
Durante la infección natural usualmente pueden aparecer otras lesiones producto de infecciones mixtas (Langpap y col, 1979; Mebus, 1990).
Figura 3. a) estómago distendido, b) intestinos aumentados de tamaño, hiperémicos, con presencia de contenido de color amarillo. Terneros inoculados experimentalmente con una cepa enteropatogénica de BCoV.
Microscópicamente el examen de intestinos de terneros sacrificados a diferentes intervalos después de la diarrea revela los siguientes cambios: en las primeras horas las células del epitelio del intestino delgado y el epitelio del colon pueden estar con su morfología fisiológica, pero hay muchos antígenos virales en su superficie (Kapil y col, 1991); durante esta fase de la infección del virus puede ser detectada por técnicas inmumohistoquímica (Zhang y col, 1997), en el epitelio del intestino delgado, el colon, la traquea y los pulmones (Kapil y col, 1991).
Cuando la enfermedad progresa las células del epitelio del intestino delgado y del colon cambian por células cuboidales con presencia de vacuolas y las células vecinas se ven fusionadas, lo que termina con la destrucción del epitelio, mostrándose una marcada atrofia (Mebus, 1990; Kapikian, 1994).
En estudios realizados por Garwes, (1982) se cuantificó la atrofia producida en el intestino delgado, apreciándose una relación de 1 en los individuos inoculados experimentalmente con BCoV comparado con los controles en los cuales el valor de esta relación fue de 5.3.
En bovinos adultos el intestino delgado se encuentra dilatado y flácido, pudiendo observarse un contenido oscuro y fluido, algunas veces mezclado con mucus y sangre (Espinasse y col, 1990). También con frecuencia pueden observarse lesiones inflamatorias con presencia de exudado catarral, sangre en la serosa, edema en la pared intestinal y mucosa congestionada (Kapil y Austin, 2000). En el colon las lesiones consisten en hemorragias petequiales y lineares, apreciando un acortamiento de la superficie de la mucosa (Merck, 2003).
Las lesiones microscópicas en bovinos adultos son más evidentes en el colon donde las criptas del epitelio exhiben degeneración, necrosis y atrofia; también se aprecia con frecuencia hemorragias petequiales, que pueden observarse también a lo largo de la mucosa del intestino delgado (Beer, 1983).
En el tracto respiratorio las lesiones pueden extenderse hasta la parte posterior de la cavidad nasal; en la traquea se observa congestión, hemorragias petequiales y exudado serofibrinoide (Espinasse y col, 1990); mientras que desde el punto de vista histopatológico en el tracto respiratorio se observan cambios consistentes en bronquiolitis y alviolitis (Storz y col, 2000b).
Patogenia.
El virus ingresa en el organismo normalmente por ingestión o inhalación. Cuando la puerta de entrada es la vía enterógena el virus infecta células epiteliales del intestino delgado y el colon, donde hace una replicación local, la cual produce atrofia de las vellosidades; debido a esto las enzimas situadas en la membrana de las células epiteliales, especialmente las del intestino delgado no atacan de manera suficiente al alimento ingerido (Mebus, 1990).
La degeneración de las células epiteliales provocadas por el virus motivan la insuficiente absorción de agua y electrolitos, e incrementan la función secretora y con ello se desencadena el cuadro clínico de la diarrea, lo que lleva a la deshidratación, acidosis e hipoglicemia; pudiendo provocar a la muerte, sobre todo en terneros (Mc. Arthur, 1997).
En individuos recuperados de la infección las criptas del epitelio de la mucosa intestinal pueden recuperarse y eventualmente volver a su funcionamiento fisiológico (Espinasse y col, 1990). En estudios realizados por Mebus, (1990) durante las primeras horas de las diarreas las heces fecales pueden contener 1010 partículas infectivas por mL.
Cuando la puerta de entrada es por las vías respiratorias el virus infecta el epitelio respiratorio, fundamentalmente a nivel de vías superiores (Mc. Arthur, 1997), diseminándose desde el punto de entrada hacia las regiones vecinas, ocasionando una inflamación de las vías respiratorias altas y/o una conjuntivitis (Storz y col, (2000a).
Storz y col, (2000b) aislaron el virus a partir de fragmentos de pulmones de individuos con enfermedad respiratoria, encontrando entre 1 × 103 y 1.2 × 107 unidades formadoras de placas por gramo de tejido pulmonar.
Epizootiología.
Las manifestaciones clínicas de las infecciones por BCoV solo ocurren en bovinos (Mebus, 1990), siendo susceptibles animales de todas las edades; sin embargo terneros de 1 día de edad hasta 3 semanas son los más sensibles de padecer el cuadro entérico, mientras que los mayores de 3 semanas son resistentes a la infección (Jaynes y col, 2004).
Los individuos jóvenes son más sensibles a desarrollar la infección respiratoria (Heckert y col, 1991), apareciendo cuadros clínicos con una mayor frecuencia en individuos entre 6-10 meses (Martin, 1985), sobre todo en aquellos casos asociados a estrés de transportación (Lin y col, 2000), mientras que en animales mayores de 2 años es más frecuente el desarrollo de cuadros entéricos (Espinasse y col, 1990).
Experimentalmente han sido inoculados cerdos gnotobióticos con BCoV sin mostrar signos clínicos (Mebus, 1990), mientras que en pavos gnotobióticos se logró reproducir el cuadro entérico y respiratorio (Saif, 2002). Gatos, perros y otros animales han sido descritos como potenciales portadores del virus pero sin presentar manifestaciones clínicas (Gorwes, 1982).
El virus es altamente contagioso y tiende a propagarse rápidamente, existiendo una mayor incidencia en los meses de invierno (nobiembre-abril), ya que el mismo es sensible a la luz solar y a las altas temperaturas (White y col, 1989; Smith y col, 1998).
También pueden jugar a un papel importante en iniciar la enfermedad la simultaneidad de una serie de factores de riesgo, como son, los de tipo estresantes, tales como los cambios en la dieta, deficiencias en el manejo de la masa, aumento de la densidad del rebaño, etapa periparto, lactación o grandes fluctuaciones de las temperaturas (Tsunemitsu y col, 1999). El estatus inmunológico del rebaño y las infecciones mixtas con otros microorganismos pueden contribuir a desencadenar la enfermedad (Smith y col, 1996; Smith y col, 1998).
El promedio de morbilidad, en general, es elevado, oscilando entre 50-100% (Mc. Arthur, 1997), pudiendo afectarse animales de diferentes edades (Takahashi y col, 1980). Es común ver a la madre y a la cría afectadas a la vez entre 2 o 3 días después del parto (Espinasse y col, 1990). A pesar de que la morbilidad suele ser alta la mortalidad en adultos no sobrepasa el 10% (Carman y Hazlett, 1992), no siendo así en terneros que puede alcanzar hasta el 50% (Mc. Arthur, 1997).
Son considerados fuentes de infección los animales enfermos o los portadores asintomáticos del virus que pueden ser los propios bovinos, sobre todo vacas adultas que lo eliminan en época periparto (Martínez y col, 2002), también los perros u otros animales e incluso el propio hombre son vehiculizadores (Mebus, 1990).
Las fuentes de infección secundarias más importantes las constituyen la leche, ya que se eliminan grandes cantidades de virus (Langpap y col, 1979; Rodak y col, 1982), las secreciones respiratorias (Lin, y col, 2000; Lin, y col, 2002; Hasoksuz y col, 2005), las heces fecales (Cho y col, 2003; Cho y col, 2004), los alimentos y el agua de bebida contaminados con los restos de heces fecales, además de las instalaciones, utensilios de trabajo, cadáveres, etc. (Mebus, 1990).
La transmisión del virus puede ocurrir a través de varias vías; transmisión respiratoria, la cual se realiza a través del aire entre lugares cercanos, ya que el virus puede salir por las secreciones nasales, incorporarse al aire y vehiculizarse por medio de este (Storz, 1998), transmisión oral o enterógena, con alimentos o agua contaminadas con el virus o a través de la leche infectada de la madre (Langpap y col, 1979) y la transmisión por contacto directo entre los animales infectados (Reynolds y col, 1985).
Criterios diagnósticos.
El diagnóstico de BCoV basado en el cuadro clínico y las lesiones que se presentan en los animales no es el recomendado, aunque en ocasiones suministran la base para un diagnóstico presuntivo unido a elementos epizoóticos tales como: la época del año, el aumento en la densidad de la masa básica, la historia del rebaño con relación a la enfermedad, entre otros aspectos. No obstante, la confirmación del diagnóstico es imprescindible realizarla a partir de la detección de antígenos virales y/o seroconversión (Smith y col, 1998).
La toma de muestra es uno de los aspectos más importante del diagnóstico, en dependencia de una correcta toma y conservación de las muestra se logrará la supervivencia del virus, teniendo en cuenta aspectos como la sensibilidad del mismo a las altas temperaturas, lo que garantizará una excelente efectividad y rapidez diagnóstica (Hasoksuz y col, 2005).
En individuos con cuadros entéricos la muestra ideal resulta la diarrea, en un periodo de 1-4 días después del comienzo, la cual debe enviarse inmediatamente de colectada al laboratorio de virología animal, envasada en frascos estériles sellados y transportados en neveras virológicas con hielo (Gaber y Kapil, 1999). En el caso de signos clínicos respiratorios se recomienda hacer un exudado de la mucosa nasal (Storz y col, 2000a).
Los órganos de elección para la detección viral son fragmentos de intestino delgado, fundamentalmente yeyuno e ilion, además de colon, recto, ganglios linfáticos mesentéricos, traquea, glándulas nasales y pulmones (Kapil, 2005).
Para la demostración de la seroconverción se deben tomar muestras de sangre sin anticoagulante o suero en el momento de la infección y de 7 a 14 días después (Lin y col, 2000; Lin y col, 2002).
Detección de virus.
Inicialmente la detección de BCoV se basaba en la purificación del virus a partir de muestras de heces fecales diarreicas y el empleo de microscopia electrónica, pero posteriormente con la adición de tripsina a cultivos celulares se logró el aislamiento del virus (Murphy y col, 1999).
Para el aislamiento primario de muchas cepas del virus se emplean en la actualidad una variedad de células animales y humanas, aunque existen cepas no susceptibles a la multiplicación en cultivos celulares (Gorwes, 1982; Pratelli y col, 2000).
Entre los cultivos primarios empleados figuran, los de riñón de embrión bovino, riñón bovino, intestino de terneros, traquea bovina, cultivo fetal de traquea de ternero, cultivo fetal de pulmón bovino y pulmón de hámster (Akashi y col, 1981;Toth, 1982).
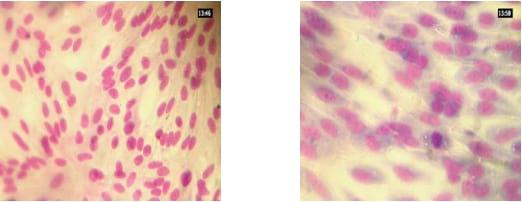
Figura 4. Cultivo primario de riñón de ternero, inoculados con BCoV y teñidos con Giemsa. a) control de célula, b) células redondeadas formando sincitios.
Aislados del virus se han propagado en varias líneas celulares como, BEK-1 (riñón de embrión bovino), VERO (riñón de mono verde africano), MDBK (Madin-Darby riñón bovino), (Mebus, 1990; Matsumoto y col, 2005), PK-15 (riñón porcino), D2BFS (bazo de embrión bovino), BEL (pulmón de embrión bovino) y HRT-18 (tumor rectal humano) (Jerez y col, 2005). En la actualidad para el aislamiento primario se utiliza la línea celular HRT-18, la más sensible para el aislamiento primario (Daginakatte y col, 1999).
En todos los casos el virus se caracteriza por la producción de efecto citopatogénico, básicamente redondeamiento y formación de sincitios y el mismo puede ser identificado por hemoaglutinación y seroneutralización (Benfield y Saif, 1990).
El aislamiento por inoculación de terneros es muy sensible (Cho y col, 2003) pero es costoso y consume mucho tiempo y la infección es confirmada por reaislamiento del virus en cultivos celulares. En los individuos que sobreviven, la infección puede ser confirmada por la respuesta inmune de los terneros inoculados (Cho y col, 2004).
La detección de antígenos virales por técnicas inmunohistoquímicas como inmunofluorescencia e inmunoperoxidasa en cortes criostáticos de órganos afectados, utilizando un panel de anticuerpos monoclonales, disponibles a nivel comercial, puede brindar una respuesta rápida y sencilla (Kapil, 2005).
El empleo de la Hemoaglutinación (HA) de eritrocitos de Hámster a partir de muestras de heces fecales, seguido de la Inhibición de la hemoaglutinación (IHA) (Kapil, 1999; Brandao y col, 2002) y los ensayos inmunológicos ligados a enzimas (ELISA) han sido descritos, demostrando ser métodos rápidos para la detección de BCoV, los cuales resultan adecuados para ensayos a mayor escala y son de fácil manipulación; siendo el ELISA donde se obtienen los mejores resultados Ellens y col, (1978).
El método de Transcripción reversa acoplada a la Reacción en Cadena de la Polimerasa (RTPCR) ha sido desarrollado para la detección de BCoV (Tsunemitsu y col, 1999; Takiuchi y col, 2005) y se debe señalar que además de ser rápido, es simple y muestra elevadas sensibilidad y especificidad (Cho y col, 2001; Brandao y col, 2003).
El ensayo de RT-PCR ha demostrado ser más sensible que el ELISA y permite detectar pequeñas concentraciones del virus (Cho y col, 2001).
Detección de anticuerpos.
La serología es el método de selección para la vigilancia de un área aparentemente libre de la enfermedad. Además constituye una herramienta necesaria en la producción y evaluación de vacunas y en la determinación de los niveles de inmunidad de la masa sometida a vacunación (Takamura y col, 2002).
El diagnóstico de BCoV basado en la serología es de gran utilidad, debido a que los anticuerpos generados por los individuos en respuesta a la infección aparecen en estadios tempranos de la enfermedad; en este sentido Mebus, (1990) plantea que en individuos inoculados experimentalmente con BCoV la respuesta de anticuerpos neutralizantes aparece entre 7-8 días después de la exposición.
Lin y col, (2002) al estudiar una epizootia de Fiebre de Embarque causada por BCoV reportaron que en la infección natural la respuesta de anticuerpos neutralizantes e inhibidores de la hemoaglutinación aparece entre los 7 y 14 días después de la exposición.
Entre los principales ensayos que se emplean para la detección de anticuerpos figuran los test de ELISA, Seroneutralización e IHA; con resultados que satisfacen los requisitos de sensibilidad y especificidad (Smith y col, 1998; Lin y col, 2001; Lin y col, 2002).
Prevención y control.
Como parte de las medidas contraepizoóticas de prevención debemos contemplar las de carácter zootécnico, que implican un adecuado régimen nutritivo de acuerdo a la categoría, raza, edad, etc., fundamentalmente en terneros, donde el consumo de calostro es de vital importancia, debido a la presencia de anticuerpos que pueden generar una protección, además se debe impedir cualquier circunstancia que provoque situaciones de estrés (Martínez y col, 2002).
En los territorios no afectados de países afectados, las medidas deben estar encaminadas fundamentalmente a evitar la introducción de animales provenientes de áreas afectadas (Martínez y col, 2002), dependiendo la prevención, de los procedimientos de aislamiento de los animales y de desinfección durante la epizootia y de la aplicación de programas de vacunación (Espinasse y col, 1990).
En los países afectados se han desarrollado diferentes tipos de vacunas para la protección de los rebaños no afectados clínicamente de la enfermedad, así, se han elaborado y comercializado, para la aplicación tanto a terneros como a individuos adultos, lo que garantiza una adecuada protección (Takamura y col, 2002).
En este sentido se ha comprobado que la administración oral de BCoV atenuado en terneros permite una resistencia al desafío post-inoculación 96 horas después. Investigaciones realizadas por Mebus, (1990) demostraron que a partir de 6-7 días post-inoculación anticuerpos neutralizantes como inmunoglobulina (Ig) M y A aparecen en el lavado del lumen intestinal con altos títulos a los 10 días post-inoculación, los cuales persisten, mientras que los anticuerpos circulantes aparecen de 7-8 días post-inoculación. Por lo tanto la resistencia a la infección por BCoV es primordialmente por la presencia de anticuerpos en calostro y/o en leche o por la producción activa de Ig M e Ig A en el lumen intestinal.
La vacunación oral en terneros induce una inmunidad activa, sin embargo el problema con la vacunación oral es el engranaje de la vacunación en relación con la ingestión de calostro y los anticuerpos en el calostro. La interferencia entre anticuerpos calostrales y vacunas atenuadas puede ser superada por la vacunación de terneros en el útero. BCoV atenuado inoculado en el fluido amniótico de 7-8 meses en el feto no causa efectos adversos y se observó circulación de anticuerpos (Mebus, 1990).
La vacunación de vacas antes del parto genera un incremento de anticuerpos en calostro y leche y reduce la incidencia y/o la severidad de los signos clínicos en las crías (Mebus, 1990). En este sentido Takamura y col, (2002) elaboraron una vacuna obtenida en cultivo de tejido inactivada con Triton X-100 y adyuvada en aceite, obteniendo excelentes resultados en cuanto a los niveles de inmunidad generados en vacas y su transmisión a las crías.
En general la inmunidad generada después de la exposición al virus puede ser protectiva de 6 meses a 2-3 años (Espinasse y col, 1990), con títulos entre 64-256 por seroneutralización y alrededodor de 256-512 por IHA (Lin y col, 2001; Lin y col, 2002).
En cuanto a las medidas contraepizoóticas de recuperación el primer paso a dar en los brotes de la enfermedad es la cuarentena del área afectada para impedir su propagación hacia las áreas no afectadas. En el foco de la enfermedad se debe proceder al aislamiento de los animales clínicamente afectados de los sanos. La mayoría de los animales afectados por BCoV se recuperan espontáneamente entre 7-14 días sin tratamientos específicos quedando portadores que eliminan el virus por periodos prolongados, los que constituyen una fuente potencial para futuras infecciones (Martínez y col, 2002).
Proyecciones
El uso de la tecnología de genes recombinantes por la industria de vacunas, ha revolucionado la generación de antígenos, proporcionando más eficacia en la protección de humanos y animales contra patógenos bacterianos y virales, debido a que éstas vacunas, sólo contienen los componentes necesarios para la inducción de respuesta protectiva (Lamphear y col, 2002; Osorio y Ghiasi 2005; Odeón, 2005).
En este contexto, en los últimos años se ha avanzado mucho en la búsqueda tanto de sistemas de expresión de genes foráneos, como de antígenos, expresados en diferentes sistemas (Harakuni y col, 2005). Numerosos estudios han demostrado que epitopes virales y subunidades de toxinas bacterianas pueden ser expresados y procesados correctamente en células de levaduras, bacterias, plantas, mamíferos e insectos (Song y col, 2004; Dong y col, 2004; Fujii y col, 2004). Estas proteínas recombinantes inducen respuesta inmune y le confieren excelentes ventajas a las tecnologías de las vacunas actuales, incluyendo una creciente seguridad, economía, estabilidad, versatilidad y eficacia (Streatfield y col, 2001; Kang y col, 2004).
Por otra parte, dado que en estas vacunas pueden incorporarse "marcadores", hace posible diferenciar los anticuerpos producidos en respuesta a la vacuna de aquellos causados por una infección natural, aumentando la eficacia de los programas de lucha y control de dichas enfermedades (Odeón, 2005).
Los virus de la familia Coronaviridae han sido utilizados tanto para la expresión de sus estructuras proteicas relacionadas con la inducción de anticuerpos neutralizantes, expresados en diferentes sistemas (Tuboly y Nagy, 2001) como para el desarrollo de sistemas de expresión de genes foráneos (Enjuanes y col, 2003).
Las vacunas recombinantes ya han sido desarrolladas con éxito en el virus de gastroenteritis transmisible del cerdo, a través de la expresión del gen que codifica para la glicoproteína S en diferentes sistemas. Tuboly y Nagy, (2001) expresaron el gen que codifica para la glicoproteína S, utilizando como vector el serotipo 5 de adenovirus, generando una respuesta inmune de anticuerpos neutralizantes de 6-7 días post-inoculación. Por su parte Lamphear y col, (2002) y Streatfield y col, (2001) reportaron la expresión del gen que codifica para la glicoproteína S en sistemas de plantas, específicamente en maíz transgénico, con lo cual generaron una respuesta inmune protectora en cerditos.
También en el ganado bovino se han desarrollado este tipo de vacunas, con las cuales se han obtenido excelentes resultados. Experimentos realizados con vacunas de subunidades proteicas contra Herpesvirus bovino (IBR) han demostrado brindar adecuada protección, ofreciendo un alto potencial para el control del virus (Odeón, 2005). De igual manera para el control de la Peste Bovina se están realizando pruebas en terrenos con vacunas recombinantes termoestables producidas por ingeniería genética (OIE, 2002).
En el caso específico de BCoV, el candidato vacunal a diseñar con mayores perspectivas empleando las herramientas de la ingeniería genética y la biotecnología es la glicoproteína S, ya que esta es el principal antígeno implicado en la inducción de respuesta protectora, tanto humoral, con la generación de anticuerpos neutralizantes, como celular, a través de la inducción de respuesta de linfocitos T citotóxicos (Van Regenmortel, 2001); además de ser la estructura responsable de la penetración en la célula hospedera (Popota y Zhang, 2002), no obstante pudieran emplearse otras proteínas virales también implicadas en la generación de respuesta protectora (Liu, 2002).
REFERENCIAS BIBLIOGRÁFICAS
1. Akashi, H., Inaba, I., Miura, Y., Sato, K., Tokusha, S., Asagi, M., Hayashi, Y. 1981. Propagation of Kakegawa strain of bovine coronavirus in suckling mice, rats and hamster. Arch. Virol. 67: 369-370.
2. Anderson, R. W. F. 1993. Membrane and phospholipid dinding by murine coronaviral nucleocapsid N protein. Virology.194: 224-232.
3. Armstrong, J., Niemann, H., Smeekens, S. 1984. Secuence and topology of a model intracellular membrane protein, E1 glycoprotein, from a coronavirus. Nature. 308: 751- 752.
4. Beer, J. 1983. Enfermedades infecciosas de los animales domésticos. Infecciones por coronavirus. Infecciones de los bovinos por coronavirus. Editorial Acribia. 231-232.
5. Benfield, D. A., Saif, L. J. 1990. Cell culture propagation of a coronavirus isolated from cows with winter dysentery. J. Clin. Microbial. 28 (6): 1454-1457.
6. Brandao, P. E., Birgel, H. E., Gregoril, F., Rosales, C.A.R., Ruiz, V.L.A., Jerez, J. A. 2002. Bovine coronavirus detection in adult cows in Brazil. Arq. Inst. Biol., Sao Paulo. 69 (2): 103-104.
7. Brandao, P. E., Gregori, F., Heinemann, M. B., Lima, C. H. A., Rosales, C. A. R., Ruiz, V. L. A. Jerez, J. A. 2001. Animal coronaviruses. Virus Rev. And Res. 1 (6): 7-13.
8. Brandao, P. E., Gregori, F., Monteleone, G. S., Soares, R. M., Rosales, C. A. R., Jerez, J. A. 2003. Nested PCR assay for detection of bovine coronavirus S1 gene. Arq. Inst. Biol. 70 (1): 1-3.
9. Callan, R. J. 2005. Winter Dysentery. Disponible en: http://ansci.colostate.edu/documents/Dairynews/Jan_05_CDN%20.pdf. En línea enero de 2005. Accedido 1 de Agosto de 2005.
10. Carman, P. S., Hazlett, M. J. 1992. Bovine coronavirus infection in Otario, 1990- 1991. Can. Vet. J. 33: 812-814.
11. Clark, M. A. 1993. Bovine coronavirus. Br. Vet. J. 149: 51-70.
12. Collins, A. R., Knobler, R. L., Buchmeier, M. J. 1982. Monoclonal antibodies to murine hepatitis virus-4 (strain JHM) define the viral glycoprotein responsible for attachment and cell-cell fusion. Virology. 119: 358-371.
13. Collins, J. K., Riegel, C. A., Olson, J. D., Fountain, A. 1987. Shedding of enteric coronavirus in adult cattle. Am. J. Vet. Res. 48: 361-365.
14. Chang, R.-Y., D. A. Brian. 1996. Cis requirement for N-specific protein sequence in bovine coronavirus defective interfering RNA replication. J. Virol. 70:2201-2207.
15. Chang, R.-Y., Hofmann, M. A., Sethna, P. B., Brian, D. A. 1994. A cis-acting function for the coronavirus leader in defective interfering RNA replication. J. Virol. 68: 8223-8231.
16. Cho, K. O., Hoet, S. C., Loerch, T., Wittum, E., Saif, L. J. 2004. "Evaluation of Concurrent Shedding of Bovine Coronavirus Via the Respiratory and Enteric Route in Feedlot Cattle," Am. J. Vet. Res. 62: 1436–41.
17. Cho, K.-O., Hasoksuz, M., Nielsen, P. R., Chang, K.-O., Lathrop, S., Saif, L. 2001. Cross-protection studies between respiratory and calf diarrhea and winter dysentery coronavirus strains in calves and RT-PCR and nested PCR for their detection. Arch. Virol. 146: 2401-2419.
18. Cho, K.O., Nielsen, P. R., Chang, K.O., Lathrop, S., Saif, L.J. 2003. "CrossProtection Studies of Respiratory, Calf Diarrhea and Winter Dysentery Coronavirus Strains in Calves and RT-PCR and Nested PCR for Their Detection," Archives of Virology 146: 2401–2419.
19. Chouljenko VN, Foster TP, Lin X, Storz J, Kousoulas KG. 2001b. Elucidation of the genomic nucleotide sequence of bovine coronavirus and analysis of cryptic leader mRNA fusion sites. Adv Exp Med Biol. 494: 49-55.
20. Chouljenko, V. N, Lin, X. Q., Storz, J., Kousoulas G. K., Gorbalenya A. E. 2001a. Comparison of genomic and predicted amino acid sequences of respiratory and enteric bovine coronaviruses isolated from the same animal with fatal shipping pneumonia. J Gen. Virol. 82: 2927-2933.
21. Daginakatte, G. C., Chard-Bergstrom, C., Andrews, A., Kapil, S. 1999. Production, characterization, and uses of monoclonal antibodies against recombinant nucleoprotein of Elk coronavirus. Clin. Diagn. Lab. Immunol. 6 (3): 341-344.
22. De Groot, R. J., Luytjes, W., Horzinek, M. C. 1987. Evidence for a colied-coli structure in the spike proteins of coronaviruses. J. Mol. Biol. 196: 963-966.
23. De Groot, R. J., Van Leen, R. W., Dalderup, M. J. M. 1989. Stably expressed FIPV peplomer protein induce cell fusion and elicits neutralizing antibodies in mice. Virology. 171: 493-502.
24. Dea, S., Michaud, L., Milane, G. 1995. Comparison of bovine coronavirus isolates associated with neonatal calf diarrhea and winter dysentery in adult dairy cattle in Quebec. Gen. Virol. 76: 1263-1270.
25. Deregt, D., Babiuk, L. A. 1987. Monoclonal antibodies to bovine coronavirus: characteristics and topographical mapping of neutralizing epitopes on the E2 and E3 glycoprotein. Virology. 161: 410-420.
26. Dong X.Y., Yang X.A., Li Y., Xu G.B., Feng Z.R., Wang Y.D., Chen W.F. 2004. The cloning, expression, purification and identification of SARS virus S2 gene and study on its immunological characteristics. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 20: 257-260.
27. Doughri, A. M., Storz, J. 1977. Light and ultraestructural pathological changes in intestinal coronavirus infection of newborn calves. Zentralbl. Veterinaermed. 24: 367-385.
28. Dringeliene, A., Markevieius, A., Aeaite, J. 2004. Cellular immunity of coronavirus-infected bovine from different districts of Lithuania. Ekologija. 4: 1-5.
29. Durham, P. J., Stevenson, D. J., Farquharson, B. C. 1979. Rotavirus and coronavirus associated diarrhea in domestic animals. N. Z. Vet. J. 27: 30-32.
30. El-Kanawati, Z. R., Tsunemitsu, H., Smith, D. R., Saif, L. J. 1996. Infection and cross-protection studies of winter dysentery and calf diarrhea bovine coronavirus strains in calostrum-deprived and notobiotic calves. Am. J. Vet. Res. 57: 48-53.
31. Ellens, D. F., Van Balken, J. A. M., De Leeuw, P. 1978. Diagnosis of bovine coronavirus infections with hemadsorption-elution-haemagglutination assay (HEHA) and with enzyme linked immunosorbent assay (ELISA). Proc. 2nd. Int. Symp. Neonatal diarrhoea, Saskatchewan. 321-330.
32. Enjuanes, L., Almazán, F., Ortego, J. 2003. Gene Transfer and Expression in Mammalian Cells. Virus-based vectors for gene expression in mammalian cells: Coronavirus. Chapter 3.8. Ed. S.C. Makrides.
33. Espinasse, J., Savey, M., Viso, M. 1990. Virus infections of vertebrates. Virus infections of ruminants. Winter Dysentery of adult Cattle Virus. Elsevier Science Publishers. Chapter 28: 301-306.
34. Fazakerley, J. K., Parker, S. E., Bloom, F., Buchmeier, M. J. 1980. The V5A13.1 envelope glycoprotein deletion mutants of mouse hepatitis virus type-4 is neuroattenuated by its reduced rate of spread in the central nervous system. Virology. 187: 178-188.
35. Flemming J. O., Stohlman, S. A., Harmon, R. C. 1983: Antigenic relationship of murine coronavirus: analysis using monoclonal antibodies to JHM (MHV-4) virus. Virology. 131: 296-307.
36. Fujii R., Morihara F., Fukushima K., Oku T., Hifumi E., Uda T. 2004. Recombinant antigen from Helicobacter pylori urease as vaccine against H. pylori-associated disease. Biotechnol Bioeng. 30: 737-746.
37. Fukotomi, T., Tsunemitsu, H., Akashi, H. 1999. Detection of bovine coronavirus from adult cows with epizootic diarrhea and their antigenic and biological diversities. Arch. Virol. 144: 997-1006.
38. Gaber, F., Kapil, S. 1999. Development of an Antigen Spot Test for Detection of Coronavirus in Bovine Fecal Samples. Clin. Diagn. Lab. Immunol. 6: 542-544.
39. Gelinas AM, Boutin M, Sasseville AM, Dea S. 2001. Bovine coronaviruses associated with enteric and respiratory diseases in Canadian dairy cattle display different reactivities to anti-HE monoclonal antibodies and distinct amino acid changes in their HE, S and ns4.9 protein. Virus Res. 76: 4 3-57.
40. González, J. M., Gómez-Puertas, P., Cavanagh, D., Gorbaleya, A. E., Enjuanes, L. A. 2003. A comparative secuence analysis to revise the current taxonomy of the family Coronaviridae. Arch. Virol. 148 (11): 2207-2235.
41. Gorwes, D. J. 1982. Virus infections of the gastrointestinal tract. Coronavirus in animals. Bovine coronavirus enteritis. Marcel Dekker, INC. 334-341.
42. Griffiths, R., Rottier, P. J. M. 1992. Cell biology of viruses that assemble along the biosynthetic pathway. Semin. Cell. Boil. 3: 367-381.
43. Guy, J. S., Brian, D. A. 1979. Bovine coronavirus genome. J. Virol. 29: 293-300.
44. Harakuni T., Sugawa H., Komesu A., Tadano M., Arakawa T. 2005. Heteropentameric cholera toxin B subunit chimeric molecules genetically fused to a vaccine antigen induce systemic and mucosal immune responses: a potential new strategy to target recombinant vaccine antigens to mucosal immune systems. Infect Immun. 73: 5654-5665.
45. Hartel H, Nikunen S, Neuvonen E, Tanskanen R, Kivela SL, Aho R, Soveri T, Saloniemi H. 2004. Viral and bacterial pathogens in bovine respiratory disease in Finland. Acta Vet Scand.45: 193-200.
46. Hasoksuz M, Sreevatsan S, Cho KO, Hoet AE, Saif LJ. 2002. Molecular analysis of the S1 subunit of the spike glycoprotein of respiratory and enteric bovine coronavirus isolates. Virus Res. 84: 101-109.
47. Hasoksuz, M., Kayar, A., Dodurka, T., Ilgaz, A. 2005. Detection of respiratory and enteric shedding of bovine coronaviruses in cattle in Northwestern Turkey. Acta Veterinaria Hungarica. 53 (1): 137-146.
48. Hasoksuz, M., Lathrop, S. L., Gadfield, K. L., ,Saif, L. J. 1999. Isolation of bovine respiratory coronaviruses from feedlot cattle and comparison of their biological and antigenic properties with bovine enteric coronaviruses. Am. J. Vet. Res. 60: 1227-1233.
49. Heckert, R. A., Saif, L. J., Mengel, J. P., Myers, G. W. 1991. Mucosal and systemic antibody responses to bovine coronavirus structural proteins in experimentally challenge - exposed calves fed low or high amounts of colostral antibodies. Am. J. Vet. Res. 52: 700-708.
50. Hegyi, A., Friebe, A., Gorbalenya, A. E., Ziebuhr, J. 2002. Mutational analysis of the active centre of coronavirus 3C-like proteases J. Gen. Virol. 83: 581-593.
51. Hingley, S. T., Gombold J.L., Lavi, E., Weiss. 1994. MHV-A59 fusion mutants are attenuated and display altered hepatotropism. Virology. 200: 1-10.
52. Horner, G. W., Hunter, R., Kirkbride, C. A. 1975. A coronavirus-like particles present in faeces of cows with diarrhea. New Zeland Vet. J. 23 (5): 98.
53. Jactel, B., Espinasse, J., Viso, M., Valiergue, H. 1990. An epidemiology study of winter dysentery in fifteen herds in France. Vet. Res. Commun. 14 (5): 367-379.
54. Jaynes, C., Tyler, H., Quigley, J., Kapil, S., Arthington, J. 2004. The use of bovine serum protein as an oral support therapy following coronavirus challenge in calves. Iowa State University Animal Industry Report. A. S. Leaflet. R1910.
55. Jeong JH, Kim GY, Yoon SS, Park SJ, Kim YJ, Sung CM, Shin SS, Lee BJ, Kang MI, Park NY, Koh HB, Cho KO. 2005b. Molecular analysis of S gene of spike glycoprotein of winter dysentery bovine coronavirus circulated in Korea during 2002-2003. Virus Res. 108: 207-212.
56. Jerez, J. A., Brandao, P. E., Buzinaro, M. G., Gregori, F., Rosales, C. A. R., Ito, F. H., Sakai, T. 2002. Deteccao de rotavirus e coronavirus em fezes de bezerros neonatos com diarréica criados en varios municipios do Estado de Sao Paulo, Brasil. Arq. Inst. Boil. 69: 19-23.
57. Jerez, J. A., Gregori, F., Brandão, P. E., Rosales, C. A. R., Ito, H. I., Buzinaro, M., Sakai, T. 2005. Isolation of bovine coronavirus (BCoV) in monolayers of HmLu-1 cells. Braz. J. Microbiol. 36: 3.
58. Kang T.J., Han S.C., Kim M.Y., Kim Y.S., Yang M.S. 2004. Expression of nontoxic mutant of Escherichia coli heat-labile enterotoxin in tobaccochloroplasts. Protein Expr Purif. 38:123-128.
59. Kapikian, A. Z. Viral infections of the gastrointestinal trac. 1994. 2. ed. New York: Marcel-Dekker, p 780.
60. Kapil, S. 2005. Bovine Coronavirus Monoclonal Antibody. Diagnostic Lab. Virology. En línea Febrero 22 de 2005. Disponible en: http://www.vet.ksu.edu/depts/dmp/service/virology/bcma. Accedido el 29 de Julio de 2005.
61. Kapil, S., Austin, K. M. 2000. Global impact of bovine coronavirus infections. CABI. Animal Health and Production Compendium (AHPC)-Infectious Disease. In Press.
62. Kapil, S., Pomeroy, K. A., Goyal, S. M., Trent, A. M. 1991. Experimental infection with a virulent pneumoenteric isolate of bovine coronavirus. J. Vet. Diagn. Invest. 3: 88- 89.
63. Kapil, S., Richardson, K. L., Maag, T. R. Goyal, S. M. 1999. Characterization of bovine coronavirus isolates from eigth different states in the USA. Veterinary Microbiol. 67: 221-230.
64. Kienzle, T. E., Abraham, S., Hogue, B. G., Brian, D. A. 1990. Structure and orientation of expressed bovine coronavirus hemagglutinin-esterase protein. J. Virol. 64: 1834-1838.
65. King, B., Brian, D. A. 1982. Bovine coronavirus structural proteins. J. virol. 42 : 700-707. Kiss, I., Ros, C., Kecskemeti, S., Tanyi, J., Blingerborn, S. B., Belak, S. 1999. Observation on the quasispecies compostion of three animal pathogenic RNA virus. Acta Vet. Hungarica. 47: 471-480.
66. Klausegger, A., Strobl, B., Regl, G., Kaser, A., Luytjes, W., Vlasak, R. 1999. identification of a coronavirus hemagglitinin-esterase with a substrete specificity different from those of influenza C virus and bovine coronavirus. J. Virol. 73: 3737-3743.
67. Knipe, D. M., Howley, P. M., Griffin, D. E., Lamb, R. A., Martin, M. A., Roizman, B, Straus, S. E. 2001. Fundamental Virology. Part II. Specific Virus Families. Coronaviridae: The Viruses and Their Replication. Fourh Edition. 641-664.
68. Koljesar G., Yoo D. 2001. Targeted RNA recombination of the membrane and nucleocapsid protein genes between mouse hepatitis virus and bovine coronavirus. J Vet Sci. 2: 149-157.
69. Kubo, H., Yamada, Y. K., Taguchi, F. 1994. Localization of neutralizing epitopes and the receptor-binding site within the amino-terminal 330 amino acid of the murine coronavirus spike protein. J. Virol. 68: 5403-5410.
70. Kuo, L; Masters, P.S. 2003. The small envelope protein is not essential for Murine coronavirus replication. J. Virol. 77 (8): 4597-4608.
71. Lamphear BJ, Streatfield SJ, Jilka JM, Brooks CA, Barker DK, Turner DD, Delaney DE, Garcia M, Wiggins B, Woodard SL, Hood EE, Tizard IR, Lawhorn B, Howard JA. 2002. Delivery of subunit vaccines in maize seed. J Control Release. 13:169-180.
72. Langpap, T. J., Bergeland, M. E., Reed, D. E. 1979. Coronaviral enteritis of young calves: virologic and pathologic findings in naturally occurring infections. Am. J. Vet. Res. 40:1476-1478.
73. Li, D., Cavanagh, D. 1992. Coronavirus IBV induced membrane fusion occurs at near-neutral pH. Arch. Virol. 122: 307-316.
74. Lin, X. Q., O'Reilly, K. L., Storz, J. 2002. Antibody Responses of Cattle with Respiratory Coronavirus Infections during Pathogenesis of Shipping Fever Pneumonia Are Lower with Antigens of Enteric Strains than with Those of a Respiratory Strain. Clinical. Diagn Labo. Immunol. 9: 1010-1013.
75. Lin, X. Q., O'Reilly, K. L., Storz, J., Purdy, C. W., Loan, R. W. 2000. Antibody responses to respiratory coronavirus infections of cattle during shipping fever pathogenesis. Arch. Virol. 145: 2335-2349.
76. Lin, X-Q., O'Reilly, K. L., Burrell, M. L., Storz, J. 2001. Infectivity-Neutralizing and Hemagglutinin-Inhibiting Antibody Responses to Respiratory Coronavirus Infections of Cattle in Pathogenesis of Shipping Fever Pneumonia. Clin. Diagn. Lab. Immunol. 8 (2): 357-362.
77. Liu, L. 2002. Expression of the Bovine coronavirus proteins by recombinant Adenovirus Vectors. Department of Virology, National Institute and Department of Veterinary Microbiology, Swedish University og Agricultural Sciences, Uppsala, Sweden. Disponible en: http://xray.bmc.uu.se/Concurses/PT/Project/Project2002/LihongAdenovirusfinal2.htm Accedido 27 de Octubre de 2005.
78. Locker, J. K., Rose, J. K., Horzinek, M. C., Rottier, P. J. M. 1992. Membrane assembly of the triple-spanning coronavirus M protein: individual transmembrane domains show preferred orientation. J. Biol. Chem. 267: 21911-21918.
79. Luo, Z., Weiss, S. 1998. Role in cell-to-cell fusion of two conserved hydrophobic regions in the murine coronavirus spike protein. Virology. 244: 483-484.
80. Martin, S. W. 1985. Analysis and causal interpretation of biologic data. A seroepidemiolgic study of respiratory disease. Fourth International Symposium on Veterinary Epidemiolgy and Economics. Vet. Med. 57: 46-54.
81. Martínez, A., Caballero, M., Silva, S., Jiménez, C. 2002. Aislamiento y caracterización de coronavirus bovino asociado a un brote de diarrea epizoótica (Disentería Bovina) en bovinos adultos en Costa Rica. III Seminario Internacional de Sanidad Animal y I Seminario de Producción Animal. ESPE, Sangolquí 12-15/11/2002.
82. Matsumoto, M.,Mukai, T.,Furukawa, S., Ohori, H. 2005. Inhibitory effects of epigallocatechin gallate on the propagation of bovine coronavirus in Madin-Darby bovine kidney cells. Animal Science Journal. 76 (5): 509.
83. Mc. Arthur, Deborah. 1997. Bovine Coronavirus Infection: Clinical Syndromes in Adult Cattle and Calves. En línea Enero 1997. Disponible en: http://www..addl.purdue.edu/newsletters/1997/spring/bci.shtml Accedido el 28 mayo 2004.
84. McNulty, M. S., Bryson, D. G., Allan, G. M., Logan, E. F. 1984. Coronavirus infection of the respiratory tract. Vet. Microbiol. 9: 425-434.
85. Mebus, C. A. 1990. Virus infections of vertebrales. Virus infections ruminants. Neonatal calf diarrea. Elsevier Science Publishers. Chapter 27: 297-300.
86. Mebus, C. A., Newman, L. E., Stair, E. L. 1975. Scanning electron, light, and immunofluorecent microscopy of intestine of notobiotic calf infection with calf diarrhea coronavirus. Am. J. Vet. Res. 36: 1719-1725.
87. Mebus, C. A., Stair, E. L., Rhodes, M. B., Twiehaus, M. J. 1973a. Neonatal calf diarrhea: Propagation, attenuation, and characterization of a coronavirus-like agent. Am. J. Vet. Res. 34: 145-150.
88. Mebus, C. A., Stair, E. L., Rhodes, M. B., Twiehaus, M. J. 1973b. Pathology of neonatal calf diarrhea induced by a coronavirus-like agent. Vet. Pathol. 10: 45-64.
89. Mebus, C. A., Withe, R. G., Stair, E. L., Rhodes, M. B., Twiehaus, M. J. 1972. Neonatal calf diarrhea: Results of a field trial using a Reo-like virus vaccine. Vet. Med. Small Animal Clinician. 67: 173-178.
90. Merck, 2003. Winter Dysentery. The Merk Veterinary Manual. En línea Enero 2003. Disponible en: http://www.merckvetmanual.com/mvm/index.jsp Accedido el 30 de Junio de 2005.
91. Millane, G., Michaud, L., Dea, S. 1995. Biological and molecular differentiation between coronaviruses associated with neonatal calf diarrhea and winter dysentery in adult cattle. Adv. Exp. Med. Boil. 380: 29-33.
92. Miyaki, C. Y., Russo, C. A. M., Pereira, S. L. 2001. Reconstrucao filogenetica. Introducao e o método de máxima parcimonia. In: Matioli, S. R. Biologia molecular e evolucao. Sao Paulo: Holos, p 97-107.
93. Murphy, F. A., Gibbs, E. P., Horzinek, M., Studdert, M. J. 1999. Veterinary Virology. Coronaviridae. Bovine Coronavirus Enteritis. Third Edition, Academic Press. 501- 502.
94. Narayanan, K., Maeda, A., Maeda, J., Makino, S. 2000. Characterization of the Coronavirus M Protein and Nucleocapsid Interaction in Infected Cells. J. Virol. 74: 8127- 8134.
95. Naylor, M. J., Harrison, G. A., Monckton, R. P., Mcorist, S., Lehrbach, P. R., Deane, E. M. 2001. Identification of canine coronavirus strains from feces by S gene nested PCR and molecular caracterization of a new Australian isolate. J. Clinical Microbiol. 39 (3): 1036-1041.
96. Odeón, A. C. 2005. Vacunas para el control de las infecciones virales de los bovinos. Disponible en: http://www.inta.gov.ar/balcarce/info/documentos/ganaderia/bovinos/sanidad/infecvira.ht m. En línea Agosto de 2002. Accedido Septiembre de 2005.
97. Osorio Y., Ghiasi H. 2002. Recombinant herpes simplex virus type 1 (HSV-1) codelivering interleukin-12p35 as a molecular adjuvant enhances the protective immune response against ocular HSV-1 challenge. J Virol. 79: 3297-308.
98. Payne, H. R., Storz, J. 1988. Analysis of cell fusion induced by bovine coronavirus infection. Arch. Virol. 103: 27-33.
99. Popota, R., Zhang, X. 2002. The spike but not the hemagglutinin/esterase proein of bovine Coronavirus is necessary and sufficient for viral infection. Virology. 294: 222- 236.
100. Pratelli, A., Buonavoglia, D., Martella, V., Tempesta, M., Lavazza, A., Buonavoglia, C. 2000. Diagnosis of canine coronavirus infection using nested-PCR. J. Microbiol Methods. 84: 91-94.
101. Rest, J., Mindell, D. 2003. SARS associated coronavirus has a recombinant polymerase and coronavirus have history of host-shifting. Infect. Genet. Evolut., 3, 219- 225.
102. Reynolds, D. J., Debney, T. G., Hall, G. A., Thomas, L. H., Parson, K. R. 1985. Studies on the relationship between coronavirus from the intestinal and respiratory tracts of calves. Arch. Virol. 85: 71-83.
103. Rodak, L., Babiuk, L. A., Acres, S. D. 1982. Detection by radioimmunoassay and enzyme-linked immunosorbent assay of coronavirus antibodies in bovine serum and lacteal secretions. J Clin Microbiol. 16, 1: 34–40.
104. Rogan, D., Dea, S., Percy, D., Culbert, R. 1995. Ability of winter dysentery isolates of bovine coronavirus to induce bloody diarrhea in newborn calves. Conference of Research Workers in Animal Diseases, ChicagolL, Abstract 107.
105. Saif, L. J. 2004. Animal coronaviruses: what can they teach us about the severe acute respiratory syndrome. Rev. sci. tech. Off. Int. Epiz. 23, (2): 643:660.
106. Saif, L. J., Redman, D. R., Moorhead, P. D., Theil, K. W. 1986. Experimentally induce coronavirus infections in calves: viral replication in the respiratory and intestinal tracts. Am. J. Vet. Res. 47: 1426-1432.
107. Saif, L.J. 2002. "Coronaviruses: Update on Diagnosis, Pathogenesis and Control of Bovine Coronavirus-Associated Calf Diarrhea, Winter Dysentery and Shipping Fever." In Proceedings of the Iowa Veterinary Medical Association Meeting, Iowa State University, College of Veterinary Medicine, Ames, IA, September 12, 2002.
108. Scheultze, B., Gross, H. J., Brossmer, R., Herrler, G. 1991a. The S protein of bovine coronavirus is a hemagglutinin recognizing 9-0-acetylated sialic acid as a receptor determinant. J. virol. 65: 6232-6237.
109. Scheultze, B., Herrler, G. 1992. Bovine coronavirus used N-acetyl-9-0-acetylneuroaminic acid as a receptor determinant to initiate the infections of culture cells. J. Gen. Virol. 73: 901-906.
110. Scheultze, B., Wahn, K., Klenk, H. D., Herrler, G. 1991b. Isolates HE-protein from hemagglutinating encephalomyelitis virus and bovine coronavirus has receptor destroying and receptor-binding activity. Virology. 180: 221-228.
111. Sharpee, R. L., Mebus, C. A., Bass, E. P. 1976. Characterization of a calf diarrheal coronavirus. Am. J. Vet. Res. 37: 1031-1041.
112. Smith, D. R., Fedorka-Cray, P. J., Mohan, R., Brock, K. V., Wittum, T. E., Morley P. S., Hoblet, K. H., Saif, L. J. 1998. Evaluation of Cow-level risk factors for development of winter dysentery in dairy cattle. Am. J. Vet. Res. 59: 986-993.
113. Song H.C., Seo M.Y., Stadler K., Yoo B.J., Choo Q.L., Coates S.R., Uematsu Y., Harada T., Greer C.E., Polo J.M., Pileri P., Eickmann M., Rappuoli R., Abrignani S., Houghton M., Han J.H. 2004. Synthesis and characterization of a native, oligomeric form of recombinant severe acute respiratory syndrome coronavirus spike glycoprotein. J Virol. 78: 10328:10335.
114. Soto, K., Inaba, I., Kurogi, E., Takahashi, Y., Ito, Y., Goto, Y., Omori, T., Matumoto, M. 1977. Physico-chemical properties of calf diarrhea coronavirus. Vet. Microbiol. 2: 73-81.
115. Spaan, W., Cavanagh, D., Horzinek, M. C. 1988. Coronaviruses: structure and genome expression. J. Gen. Virol. 69: 2939-2956.
116. Stair, E. L., Rhodes, M. B., White, R. G., Mebus, C. A. 1972. Neonatal calf diarrhea: Purification and electron microscopy of a coronavirus-like agent. Am. J. Vet. Res. 33: 1147-1156.
117. Stephensen, C. B., Casebolt, D. B., Gangopadhyay, N. N. 1999. Philogenetic analysis of a highly conserved region of the polymerase gene from 11 coronaviruses and developmet of a consensus polymerase chain reaction assy. Virus Res. 60: 181-189.
118. Storz, J., Lin X. Q., Purdy, C. W., Chouljenko, V. N., Kousoulas, K. G., Enright, F. M., Gilmore, W. C., Loan, R. W. 2000a. Coronavirus and Pasteurella infections in bovine shipping fever pneumonia and Evans' criteria for causation. J. Clin. Microbiol. 38 (9): 3291-3298.
119. Storz, J., Purdy, C. W., Lin, X. Q., Burrell, M., Truax, R. E., Briggs, R. E., Frank, G. H., Loan, R. W. (2000b). Isolation of respiratory bovine coronavirus, other cytocidal viruses, and Pasteurella spp. from cattle involved in two natural outbreaks of shipping fever. J. Am. Vet. Med. Assoc. 216: 1599-1604.
120. Storz, J., Stine, A., Liem, C., Anderson, G. A. 1996. Coronavirus isolation from nasal swab samples in cattle with signs of respiratory tract disease after shipping. J. Am. Vet. Med. Assoc. 208: 1452-1455.
121. Streatfield S.J., Jilka J.M., Hood E.E., Turner D.D., Bailey M.R., Mayor J.M., Woodard S.L., Beifuss K.K., Horn M.E., Delaney D.E., Tizard I.R., Howard J.A.. 2001. Plant-based vaccines: unique advantages. Vaccine. 21:2742-2748.
122. Sturman, L. S., Holmes, K. V. 1983. The molecular biology of coronavirus. Adv. Virus. Res. 28: 35-112.
123. Sturman, L. S., Holmes, K. V., Behnke, J. 1980. Isolation of coronavirus envelope glycoprotein and interaction with the viral nucleocapsid. J. Virol. 33: 449-462.
124. Taguchi, F. 1993. Fusion formation by the uncleaved spike protein of murine coronavirus JHMV variant c1-2. j. Virol. 67: 1195-1202.
125. Takahashi, E., Inaba A., Sato K. 1980. Epizootic diarrhea of adult cattle associated with a coronavirus-like agent. Vet Microbiol. 5: 151–154.
126. Takamura, K., Matsumoto, Y., Shimizu, Y. 2002. Field study of bovine coronavirus vaccine enriched with hemagglutinating antigen for winter dysentery in dairy cows. Can. J. Vet. Res. 66: 278-281.
127. Takiuchi, E., Stipp, D.T., Alfieri, A.F., Alfieri, A.A. 2005. Improved detection of bovine coronavirus N gene in faeces of calves infected naturally by a semi-nested PCR assay and an internal control. J Virol Methods. 21.
128. Toth, T. E. 1982. Trypsin-enhanced replication of neonatal calf diarrea coronavirus in bovine embryonic lung cells. Am. J. Vet. Res. 43: 967-972.
129. Travén, M., Naslund, K., Linde, B., Silván, A., Fossum, C., Hedlund, K.O., Larsson, B. 2001. Eperimental reproduction of winter dysentery in lactating cows using BCV infection in milk-fed calves. Veterinary Microbiol. 81 (2): 127-151.
130. Tsunemitsu, H., Smith, D. R., Saif, L. J. 1999. Experimental inoculation of adult dairy cows with bovine coronavirus and detection of coronavirus en feces by RT-PCR. Arch. Virol. 144: 167-175.
131. Tsunemitsu, H., Yonemichi, H., Hirai, T., Kudo, T., Onoe, S., Mori, K., Shimizu, M. 1991. Isolation of bovine coronavirus from feces and nasal swabs of calves with diarrhea. J. Vet. Med. Sci. 53: 433-437.
132. Tuboly T, Nagy E. 2001. Construction and characterization of recombinant porcine adenovirus serotype 5 expressing the transmissible gastroenteritis virus spike gene. J Gen Virol. 82: 183-190.
133. Vabret, A., Mouthon, F., Mourez, T., Gouarin, S.petitjean, J., freymuth, F.2001. Direct diagnosis of human respiratory coronaviruses 229E and OC43 by the polymerase chain reaction. J. Virol. Methods. 97: 59-66.
134. Van Kuiningen, R. J., Hill, S. L., Tilton, R. C., Ryan, R. W. 1995. Winter dysentery in dairy cattle: recent findings. Comp. Cont. Ed. 7: 591-599.
135. Van Regenmortel. 2001. Virus Taxonomy. 7th ed. Academic press.
136. Vennema, H., Godoke, G. J., Rossen J. W. A. 1996. Nucleocapsid-independent assembly of coronavirus-like particles by co-expression of viral envelope protein genes. EMBO J. 15: 2020-2028.
137. Vlasak, R., Luytjes, W., Spaan, W., Palese, P. 1988. Human and bovine coronaviruses recognize sialic acid-containing receptors similar to those of influenza C viruses. Proc. Natl. Acad. Sci. 85: 4526-4529.
138. Whelan, S., Lio, P., Goldman, N. 2001. Molecular phylogenetics: state-of-the-art methods for looking into the past. Trends in Genetics. 17 (5): 262-272.
139. White, M. B., Schukken, Y. H., Tanksley, B. 1989. Space-time clustering of, and risk factors for, farmer-diagnosed winter dysentery in dairy cattle. Can. Vet. J. 30: 948.
140. Woo, P. C. Y., Lau, S. K. P., Chu, C., Chan, K., Tsoi, H., Huang, Y., Wong, H. L., Poon, R. W. S., Cai, J. J., Luck, W., Poon, L. L. M., Wong, S. S. Y, Guan, Y., Peiris, J. S. M., Yuen, K. 2005. Characterization and complete genome secuence of a novel coronavirus, coronavirus HKU1, from patients with pneumonia. J. Virol. 79: 884-895.
141. Yamada, Y. K., Yaba, M., Ohtsuki, T., Taguchi, F. 2000. Unique N-linkeed glycosylation of murine coronavirus MHV-2 variant with mutations in the proteolytic clevage site and the singal sequence of the S protein. Virology 183: 397-404.
142. Yoo D, Deregt D. 2001. A single amino acid change within antigenic domain II of the spike protein of bovine coronavirus confers resistance to virus neutralization. Clin Diagn Lab Immunol. 8: 297-302.
143. Yoo, D., Yanlong, P., Christie, N., Cooper, M. 2000. Primary structure of the sialodacryoadenitis virus genome: sequence of the structural-protein region and its application for differencial diagnosis. Clinical and Diag. Lab. Inmunol. 7 (4): 568-563.
144. Yu, X., Biweiss, S. R., Leibowitz, J. L. 1994. Mouse hepatitis virus gene 5b protein is a new viriuon envelope protein. Virology. 202: 1018-1023.
145. Zhang, X., Herbst, W., Kousoulas, K. G., Storz, J. 1994. Comparison of the S genes and the biological properties of respiratory and enteropathogenic bovine coronaviruses. Arch. Virol. 134: 421-426.
146. Zhang, Z., Andrews, G. A., Chard-Bergstrom, C., Minocha, H. C., Kapil, S. 1997. Application of immunohistochemistry and in situ hybridization for detection of bovine coronavirus in paraffin-embedded, formalin-fixed intestines. J. Clin. Microbiol. 35:2964-5.