INTRODUCCIÓN
Las poblaciones microbianas del suelo están inmersas en un marco de interacción que afecta el desarrollo de las plantas y la calidad del suelo. Ellas están involucradas en actividades fundamentales que aseguran la estabilidad y productividad, tanto de los agroecosistemas como de los ecosistemas naturales. Investigaciones estratégicas y aplicadas han demostrado el interés de ciertas actividades de cooperación microbiana para ser explotadas como una biotecnología de bajo impacto y costo para contribuir con prácticas agro-tecnológicas sustentables y amigables con el ambiente (Richardson et al., 2009).
La utilización de microorganismos benéficos ha tenido una amplia difusión en los últimos años, debido a su efecto positivo sobre el rendimiento de muchos cultivos en distintas situaciones y a la factibilidad de permitir desarrollar una agricultura orgánica (Caballero, 2004; Cassán et al., 2008). La incorporación de organismos seleccionados por sus funciones en diversos procesos que contribuyan a la implantación, desarrollo y producción de cultivos es una alternativa que permite lograr aumentos en el crecimiento radical. Así se favorece la exploración del suelo y se mejora la accesibilidad al agua y nutrientes limitantes para los cultivos. Como consecuencia, se reducen procesos de pérdida de nutrientes móviles, se atenúan períodos de moderado estrés hídrico y se logra mantener tasas de crecimiento activo del cultivo mejorando su capacidad fotosintética (Díaz-Zorita et al., 2008).
Múltiples estudios han publicado que bacterias y hongos como promotores del crecimiento vegetal (PCV) se asocian con cultivos importantes tales como Oryiza sativa, Triticum spp., Sorghum spp, Sacharum officinarum, Zea mays (Okon, 2005; James, 2000; Andrews et al., 2003; Berg, 2009) y pasturas (Lugtenberg y Kamilova, 2009). Dentro de los PCV más referenciados son Azospirillum sp., Bacillus sp., Rhizobium sp., Burkholderia sp., Enterobacter sp., Azotobacter sp., Erwinia sp., Herbaspirillum sp., Klebsiella sp., Pseudomonas sp., y Xanthomonas sp. (Cassán et al., 2009; Bashan et al., 2012).
La inoculación de plantas con Azospirillum puede dar como resultado un cambio significativo en varios parámetros de crecimiento, los cuales pueden afectar o no el rendimiento de la cosecha. Los mecanismos de acción de Azospirillum sobre las plantas no han sido todavía elucidados. La mayoría de los estudios sobre la asociación Azospirillum-planta se han llevado a cabo en cereales y pastos (Patriquin et al., 1983) y, en menor grado, en otras familias de plantas. Los estudios han demostrado los siguientes resultados: a) incremento en peso seco total, concentración de nitrógeno en follaje y grano, número total de espigas, espigas fértiles, y mazorcas; b) floración y aparición de espigas más temprana; c) incremento en el número de espigas y granos por espiga; d) plantas más altas e incremento en el tamaño de la hoja y e) tasas de germinación más altas (Albrecht et al., 1981; Baldani et al., 1987; Bashan, 1986). También se ha observado un incremento en el desarrollo del sistema de raíces, tanto en longitud como en volumen.
La capacidad de adhesión de Azospirillum a las raíces vegetales permite a la bacteria establecer una asociación permanente con la planta. Esto es importante por varias razones: a) si las bacterias no se adhieren a las células radicales, las substancias excretadas por las bacterias se difunden hacia la rizósfera donde son consumidas por otros microorganismos, sin embargo, si las bacterias se adhieren a la superficie radicular, parte de estas sustancias penetran a los espacios intercelulares de la corteza radicular; b) si no se encuentran firmemente adheridas, las bacterias pueden ser fácilmente desprendidas de la raíz por el agua, provocando que mueran en el suelo, ya que se ha demostrado que Azospirillum no sobrevive bien en suelos sin plantas (Bashan y Levanony, 1990; Bashan et al., 1995); c) sin la presencia de Azospirillum, los sitios disponibles de adhesión en raíces son susceptibles de ser colonizados por otras bacterias no benéficas. Las bacterias promotoras del crecimiento se utilizan en la práctica de inoculación de semillas de gramíneas y su cultivo como posibles tecnologías de bajo costo para la incorporación de N2 vía fijación biológica, con beneficios colaterales, como son una mayor efectividad en la producción agrícola-ganadera y un ahorro sustancial en el uso de la fuente no renovable de energía de los combustibles fósiles (Baldani et al., 2008; Boddey et al., 1986).
Conociendo la importancia de éstos microorganismos benéficos es aconsejable realizar estudios en algunas especies forrajeras, ya que se ha visto en los últimos años que también los sistemas de producción animal en pastoreo están siendo afectados por el deterioro de las praderas, pastizales y suelos por el efecto detrimental por varios factores como sobrepastoreo, falta de manejo animal y de las áreas de pastoreo, deterioro de los suelos, especies forrajeras aptas para la región y clima donde se ubica el sistema de producción, entre otros, lo que repercute en una baja producción de materia seca de las especies forrajeras por su bajo crecimiento y por ende en la productividad de los animales, viendo afectado el ambiente y la economía de los productores.
Es por ello que se planteó el objetivo de evaluar la producción de materia seca tres especies forrajeras de clima templado por efecto de la bacteria Azospirillum brasiliense y la Ectomicorriza adicionando diferentes niveles de nitrógeno al suelo.
MATERIALES Y MÉTODOS
La investigación se realizó en el Ejido de La Palma de la Cruz, Municipio de Soledad de Graciano Sánchez, San Luis Potosí, México, a 22°13´39.8” Latitud Norte, 100°50´58.3” Latitud Oeste del Meridiano de Greenwich y a 1,835 m.s.n.m (INEGI, 1985). El clima se considera seco estepario frio BsKw (wi) (García, 1973). La temperatura media anual es de 17.6°C con una mínima de 7.5°C, una máxima de 35°C y una precipitación pluvial media anual de promedio de 335mm.
Se utilizaron tres niveles de fertilización (0. 20 y 40 kg de Nitrógeno/ha) y tres niveles de promotor de crecimiento (Azospirillum brasilense, Ectomicorriza y la combinación de Azospirillum brasilense-Ectomicorriza). Por lo que se tuvieron 9 tratamientos con la combinación de éstos factores.
En una parcela de festuca, rye grass anual y avena forrajera recién establecidas el 4 de diciembre de 2015 con 15, 20 y 100 (respectivamente) kg de semilla/ha aplicadas al voleo en terreno barbechado y rastreado, y se taparon con una rama tirada por el tractor donde no se fertilizó a la siembra ni se aplicó herbicidas ni plaguicidas durante la siembra y crecimiento, el día 20 de marzo de 2016 la parcela de 90.9 m de largo por 25.8 m de ancho se dividió en franjas de 30.3 m de largo por 8.6 m de ancho, y en cada franja se aplicaron los tratamientos de fertilización y en forma trasversal se hicieron tres franjas en la parcela en las que se aplicaron los tratamientos de promotor del crecimiento vegetal (PCV) de la manera siguiente;
El fertilizante se aplicó al voleo dependiendo cual era el tratamiento (0, 20 o 40 kg N), de tal forma que para 20 kg N, se aplicó 1.133 kg/Urea/subparcela, siendo el doble para 40 kg N, 2.266 kg/Urea/subparcela. Para los promotores de crecimiento se preparó una solución vertiendo 100 litros de agua en dos tambos de plástico, agregándole a cada uno 500 ml de bacteria y hongo, respectivamente, y se utilizaron 2 botes de 20 litros cada uno, para vaciar el agua en cada una de las “mochilas” para no contaminar las soluciones. Se aplicaron las soluciones a base bacteria y el hongo y la combinación de ambos, utilizando una aspersora manual de mochila, y se aplicó 2.60 lt de solución/subparcela, por la mañana, directamente a las plantas en forma uniforme, la cual se realizó cada 8 días durante un mes, para posteriormente medir el rendimiento de forraje. El muestreo se realizó el 24 de marzo colocando un cuadrante de 0.5x0.5 m al azar en tres repeticiones en cada parcela con su tratamiento, de tal forma que se obtuvieron 27 muestreos en toda la parcela. Para obtener las muestras de forraje se cosecharon las plantas a 5 cm a ras del suelo con unas tijeras, se limpiaron y se retiró la maleza, para posteriormente colocarlas en una bolsa de papel estraza y se llevaron a una estufa de aire forzado a 55º C durante 72 horas, para después pesarlas en una báscula Ohaus® con exactitud a 1 g y determinar el porcentaje de materia seca. El forraje seco se separó en hojas y tallo para conocer sus componentes morfológicos y se pesaron por separado. Una vez obtenido el peso seco de la muestra total y de sus componentes se hicieron los cálculos respectivos con reglas de tres para obtener el rendimiento de materia seca por hectárea. Las variables evaluadas fueron rendimiento de materia seca de tallo (RMST), de hoja (RMSH) y total o de la planta completa (RMSTOTAL). Los datos fueron analizados mediante el programa estadístico SAS 9.1 con un modelo estadístico completamente al azar en arreglo factorial 3x3 y Tukey con α= 0.05.
RESULTADOS Y DISCUSIÓN
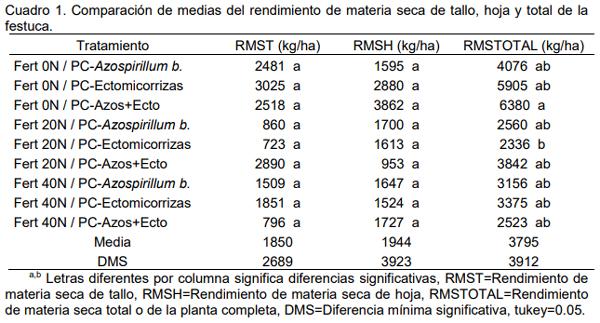
Para el pasto festuca el análisis de los datos permitió observar que solamente se obtuvieron diferencias significativas entre tratamientos para el rendimiento de materia seca total de la planta entera (Cuadro 1), donde se puede apreciar que el tratamiento de cero nitrógeno más la adición de Azospirillum b. más la Ectomicorriza mostró el mayor valor con 6380 kg/ha de materia seca de forraje del pasto festuca, tal y como lo menciona Patriquin et al. (1983) que los promotores del crecimiento vegetal incremental el peso seco total.
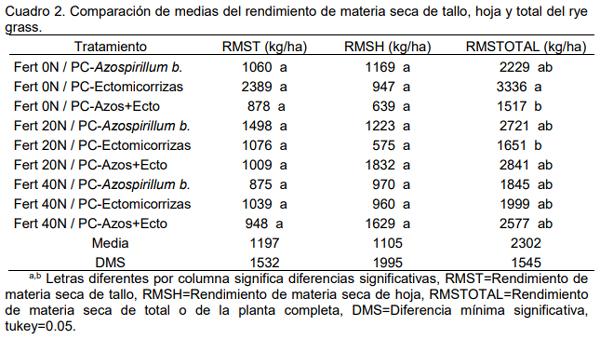
Para el pasto rye grass anual el análisis estadístico mostró diferencias estadísticas significativas (Cuadro 2) solamente para rendimiento de materia seca total o de la planta completa, donde el tratamiento de cero nitrógeno más la adición de el Azospirillum b. más la Ectomicorriza mostró el mayor valor con 3336 kg/ha de materia seca del pasto rye grass, aspecto que coincide con el pasto festuca, y al igual coincide con Patriquin et al. (1983), a así como lo mencionan Azcón et al. (1982) y Stürmer (1998) que los hongos micorrízicos arbusculares pueden influir notablemente en el crecimiento de las plantas y el rendimiento.
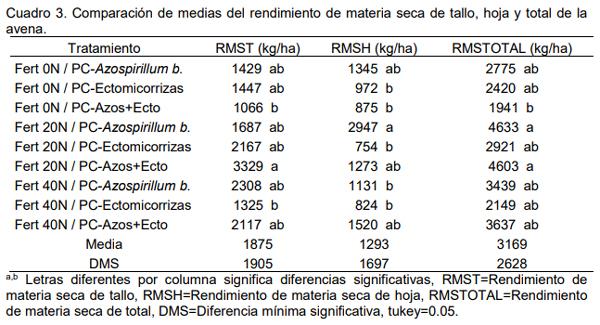
Para la avena forrajera el análisis estadístico mostró diferencias estadísticas significativas (Cuadro 3) para los dos componentes morfológicos tallo y hoja, y para el rendimiento de materia seca total o de la planta completa de la avena, donde es factible apreciar que para el RMST el tratamiento 20 kg de N y con la adición de combinado Azospirillum-Ectomicorriza mostró el mayor valor con 3329 kg/ha de materia seca de tallo de la avena, en cambio el mayor valor para RMSH fue de 2947 kg/ha de materia seca hoja de avena para el tratamiento 20 kg de N y con la adición de Azospirillum b., mientras que para el RMSTOTAL el mayor valor fue de 4463 kg/ha de materia de total o de la planta entera de avena para el tratamiento Fertilización 20kg de N y con la adición de Azospirillum b., aspecto que demuestra que con cierta cantidad de nitrógeno el Azospirillum b.,ya sea solo o combinado con un hongo puede ser capaz de obtener mejores rendimientos de materia seca en la avena, cuestión que no fue igual para las otras dos especies forrajeras, donde no hubo una consistencia en los resultados, por lo que se recomienda realizar más estudios al respecto para definir bien la tendencia o una relación entre el nitrógeno y el promotor del crecimiento vegetal. Aspectos que coinciden con Schweiger et al. (1995), que existen grandes diferencias entre especies con respecto a la respuesta a las micorrizas vasculares y que el efecto positivo de las micorrizas varía según la especie de pasto.
CONCLUSIONES
El rendimiento de materia seca total de la festuca y del rye grass se vio favorecido por la acción de la combinación Azospirillum b.-Ectomicorriza sin aplicar fertilizante que con fertilización. Para la avena forrajera el rendimiento de materia seca total se vio favorecido por Azospirillum b. con la adición de 20 kg de N por hectárea, observándose de esta manera que los promotores del crecimiento pueden trabajar bajo ciertas condiciones con cero o una baja dosis de fertilización nitrogenada.
CITAS
Albrecht, S., L.; Okon, L.; Lonnquist, Y. y Burris, R., H. 1981. Nitrogen fixation by corn-Azospirillum associations in a temperate climate. Crop Sci. 21: 301-306.
Andrews, M.; James, E., K.; Cummings, S., P.; Zavalin, A., A.; Vinogradova, L., V. y McKenzie, B., A. 2003. Use of nitrogen fixing bacteria inoculants as a substitute for nitrogen fertiliser for dryland graminaceous crops: progress made, mechanisms of action and future potential. Symbiosis 35:209-229.
Azcón, A., C.; Barea, J., M.; Azcón, R. y Olivares, J. 1982. Effectiveness of Rhizobium and VA mycorrhiza in the introduction of Hedysarum coronarium in a new habitat. Agriculture, Ecosystem and Environment Journal, 7:199-206.
Baldani, D., V., L.; Silva, F., J.; Dos Santos, T., K., R; Baldani, J., I. y Massena R., V. 2008. Inoculants base on nitrogen-fixing bactéria Azospirillum spp. and their application in tropical agriculture. En: Cassan, F.D., I.E. García de Salamone (Eds.). Azospirillum sp.: cell physiology, plant interactions and agronomic research in Argentina. Asociación Argentina de Microbiología, B.A. pp. 227-237.
Baldani, V., L., D.; Baldani, J., I. y Döbereiner, J. 1987. Inoculation of field-grown wheat (Triticum aestivum) with Azospirillum spp. in Brazil. Biol. Fertil. Soils. 4: 37-40.
Bashan, Y. y Holguin, G. 1995. Inter-root movement of Azospirillum brasilense and subsequent root colonization of crop and weed seedlings growing in soil. Microb. Ecol. 29: 269-281.
Bashan, Y. y Levanony, H. 1990. Current status of Azospirillum inoculation technology: Azospirillum as a challenge for agriculture. Can. J. Microbiol. 36: 591-608.
Bashan, Y.; Salazar, B.; Moreno, M.; Lopez, R. y Linderman, R. 2012. Restoration of eroded soil in the Sonoran Desert with native leguminous tres using plant growth-promoting microorganisms and limited amounts of compost and water. J Environ Manag 102:26-36.
Bashan, Y. 1986. Enhancement of wheat roots colonization and plant development by Azospirillum brasilense Cd. following temporary depression of the rhizosphere microflora. Appl. Environ. Microbiol. 51: 1067-1071.
Berg, G. 2009. Plant–microbe interactions promoting plant growth and health: perspectives for controlled use of microorganisms in agriculture. Appl Microbiol Biotech 84:11-18.
Boddey, R., M.; Baldani, V., L., D.; Baldani, J., I. y Dobereiner., J. 1986. Effect of inoculation of Azospirillum spp. on nitrogen accumulation by field grown wheat. Plant Soil, 90: 265-292.
Caballero, M., J. 2004. Uso de Azospirillum como alternativa tecnológica viable para cultivos de cereales. En: Monzón de Asconegui MA, García de Salamone, IE, Miyazaki SS (eds.). Biología del suelo. Transformaciones de la materia orgánica, usos y biodiversidad de los organismos edáficos. Editoral FAUBA, Universidad de Buenos Aires. Buenos Aires. pp. 45-49.
Cassán, F., D. y García S., I., E. 2008. Azospirillum sp.: Cell physiology, plant interactions and agronomic research in Argentina. Asociación Argentina de Microbiología. Buenos Aires.
Cassán, F.; Perrig, D.; Sgroy, V.; Masciarelli, O.; Penna, C. y Luna, V. 2009. Azospirillum brasilense Az39 and Bradyrhizobium japonicum E109, inoculated singly or in combination, promote seed germination and early seedling growth in corn (Zea mays L.) and soybean (Glycine max L.). Eur J Soil Biol 45:28-35.
Díaz-Zorita, M. y Fernández, C., M., V. 2008. Análisis de la producción de cereales inoculados con Azospirillum brasilense en la República Argentina. En: Cassán F, Garcia de Salamone IE (eds.). Azospirillum sp.: cell physiology, plant interactions and agronomic research in Argentina. Asociación Argentina de Microbiología. Buenos Aires. pp. 155-166.
James, E. 2000. Nitrogen fixation in endophytic and associative symbiosis. Field Crops Res 65:197-209.
Okon, Y. 2005. PGPR - technology cases of application and futureprospects. En: Hartmann A, Schmid M, Wenzel W, Hisinger L, editores. 2004. Rhizosphere—perspectives and Challenges— a Tribute to Lorenz Hiltner. Munich, Alemania. pp. 273-274.
Patriquin, D., G.; Döbereiner, J. y Jain, D., K. 1983. Sites and processes of association between diazotrophs and grasses. Can. J. Microbiol. 29:900-915.
Richardson, A., E; Barea, J., M.; McNeill, A., M.; Prigent-Combaret, C. 2009. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms. Plant and Soil 321:305-339.
Stürmer, S., L. 1998. Characterization of diversity of fungi forming arbuscular endomycorrhizae in selected plant communities. College of Agriculture, Forestry and Consumer Sciences of West Virginia University. EE.UU. 103 p.











