Evaluación del uso de estreptolisina o, como agente permeabilizante de la membrana plasmática del espermatozoide bovino
Publicado: 28 de julio de 2016
Por: Contreras, HG1, Barrientos MM*. 1, Domínguez MB., Cervantes AP1, Hernández BA 1, LammogliaMA.2, Daniel I2.
1Facultad de Medicina Veterinaria y Zootecnia; Universidad Veracruzana, Veracruz.2Facultad de Ciencias Biológicas y Agropecuarias; Universidad Veracruzana, Poza Rica-Tuxpan
En los últimos años los protocolos de criopreservación e inseminación han sido mejorados de manera sustancial lo que ha repercutido positivamente en la calidad espermática tras la descongelación. La mayoría de los diluyentes comerciales y crioprotectores que se encuentran disponibles en la actualidad protegen a los espermatozoides de manera externa sin lograr penetrar a la célula y los que logran permeabilizar la membrana plasmática pueden llegar a resultar tóxicos lo que repercute en daño o muerte celular (Gutiérrez-Pérez et al., 2009). Una alternativa de solución a esta problemática podría ser el uso de la Estreptolisina O (SLO) como agente permeabilizador de membranas. La SLO es una proteína citolítica capaz de formar poros en la membrana plasmática de diferentes tipos celulares como células del sistema inmune, eritrocitos, espermatozoides y ovocitos de ratón; además, se ha experimentado de forma exitosa el uso de esta toxina para obtener células permeables sin alteración en la función de la membrana y viabilidad (Johnson et al., 1999; Walev et al., 2001; Bo Woong et al., 2013; Sim et al., 2013). Así, podemos hacer uso de herramientas bioquímicas y de biología molecular, como la introducción de iones o proteínas exógenas, tales como anticuerpos y neurotoxinas, que por lo general son incapaces de penetrar la membrana y pueden ser utilizadas para identificar la función de la molécula blanco endógena. El objetivo de este trabajo fue determinar el efecto de la Estreptolisina O en diferentes concentraciones, sobre la motilidad y viabilidad de semen bovino antes y después de la incubación con suero fetal bovino.
MATERIALES Y MÉTODOS.
El experimento se llevó a cabo en la Posta Zootécnica Torreón de Molino de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Veracruzana (FMVZ-UV) ubicada en el Municipio de Veracruz. Se realizó este estudio con el fin de evaluar diferentes concentraciones (0.6, 1.2 y 2.4 UI/ml) de Estreptolisina O (SLO) para la formación de poros, sobre la membrana plasmática de los espermatozoides de bovino y determinar cuál de ellas afecta en menor porcentaje la viabilidad del semen. Para el cual se trabajaron eyaculados de 5 sementales bovinos, clínicamente sanos, de la raza Sardo Negro. Como criterio de inclusión se trabajó con eyaculados que tuvieran una motilidad en masa categorizada como ≥ “buena” y motilidad individual ≥70% de movimiento rectilíneo progresivo. Se evaluó la integridad de la membrana mediante el uso de la técnica de tinción supravital Eosina-Nigrosina (EN) por duplicado por tratamiento, después de la incubación son SLO y posterior al cierre de poros con Suero Fetal Bovino (SFB). Los tratamientos fueron: 1) Diluido (Semen fresco diluido 1:1 con Triladyl®), 2) Control (diluido+PBS), 3) 0.6 (Diluido+0.6 UI SLO), 4) 1.2 (Diluido+1.2 UI SLO), 5) 2.4 (Diluido+2.4 UI SLO). Para el análisis estadístico se usó del módulo de no paramétrica del programa STATISTICA V 10 para Windows StatSoft, Inc. (2004).
RESULTADOS.
EVALUACIÓN DE LA MOTILIDAD ESPERMÁTICA ANTES Y DESPUÉS DEL SELLADO DE POROS.
Como se muestra en la Figura 1 al realizar la evaluación de la motilidad espermática no se encontraron diferencias estadísticas después de la incubación de SFB en cada uno de los tratamientos (p<0.05); sin embargo, se encontraron diferencias entre el tratamiento Fresco y lostratamientos Control, 0.6 y 1.2 UI/ml de SLO antes de la incubación con SFB (p>0.05). Se encontraron diferencias entre el tratamiento Fresco y el Control, 1.2 y 2.4 UI/ml de SLO posterior a la incubación con SFB (p>0.05).
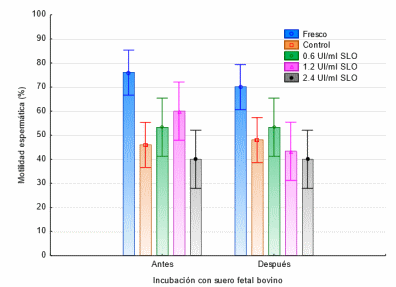
Figura 1. Efecto de la SLO sobre la motilidad espermática antes y después de la incubación con SFB.
Los espermatozoides fueron incubados con SFB, antes y posterior a diferentes concentraciones de la enzima estreptolisina O; los valores son el porciento ± el error estándar de cada tratamiento (n=5). En la figura 2 se muestra que no se encontraron diferencias en los tratamientos antes y después de la incubación con SFB (p<0.05); sin embargo, se encontró que en el tratamiento con 2.4 UI/ml de SLO el porcentaje de células vivas disminuía antes (42%) y después (35%) de la incubación con SFB (p>0.05).
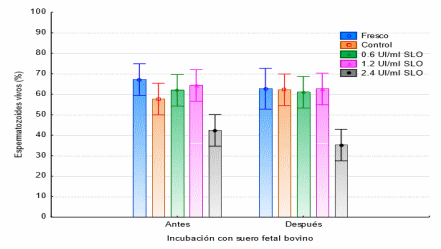
Figura 2. Efecto de la SLO sobre el porcentaje de espermatozoides vivos antes y después de la adición de SFB. Valores obtenidos mediante la técnica de Eosina-Nigrosina.
La permeabilización de las células se evaluó a través del porcentaje de espermatozoides con membrana integra y alterada usando la tinción de eosina nigrosina, el análisis indica que hubo diferencia estadística entre el semen fresco y los tratamientos con Estreptolisina O (P>0.05), a excepción del tratamiento donde se usó 1.2 UI, con un 40% de células de membrana alterada, lo que supone una acción de la enzima (p<0.05); además fue el único que cambia su porcentaje al incubarlo con suero fetal bovino, lo que supone un efecto reversible por este último procedimiento.
Hasta el momento no existen reportes en donde se permeabilicen espermatozoides de bovino con SLO con su posterior sellado de los poros, por lo cual al comparar los resultados obtenidos con los de otros trabajos en diferentes tipos celulares, se encontró, que existió una diferencia muy notoria en cuanto al porcentaje de células permeabilizadas y selladas. Fawcett et al., (1998) en miocitos de rata, con las concentraciones de 0.2Ul/ml de SLO y 0.6 UI/ml de SLO, obtuvieron 50% y 25%, de células permeabilizadas y selladas, respectivamente, lo cual concuerda con los resultados obtenidos por Walev et al., (2001) en células THP. Lo cual se relaciona con el tipo celular a tratar debido a la proporción de colesterol presente en la célula.
En conclusión, la concentración que menor efecto negativo sobre la viabilidad corresponde a 1.2 UI/ml.
REFERENCIAS
Bo-Woong S, 2013. Efficient production of transgenic mice by Intracytoplasmic injection of streptolysin-O-treated spermatozoa. Molecular Reproduction & Development.80: 233-241.
Fawcett JM, Harrison SM, Orchard CH. 1998. A method for reversible permeabilization of isolated rat ventricular myocytes. Experimental Physiology. 83:293 – 303.
Gutiérrez PO. Valoración in vitro de la capacidad fecundante del espermatozoide de cerdo, criopreservado en diluyentes formulados con trehalosa y una baja concentración de glicerol (tesis doctorado) México, D.F.: FMVZ UNAM, 2009.
Johnson LR., Moss SB, Gerton GL. Maintenance of motility in mouse sperm permeabilizabled with streptolysin O. Bio Repro. 1999 Mar; 60(3):683-90.
Contenido del evento:
Temas relacionados:
Autores:
Universidad Veracruzana
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.




.jpg&w=3840&q=75)