Enfermedades monogénicas con impacto en bovinos: de la secuencia a la consecuencia
Publicado: 13 de julio de 2018
Por: Llambí, S1*. 1 Departamento de Genética y Mejora Animal, Área Genética, Facultad de Veterinaria, UdelaR. A. Lasplaces 1620, Montevideo-Uruguay.
INTRODUCCIÓN
El uso intensivo de las técnicas de reproducción asistida y el comercio internacional de un número limitado de toros de élite ha facilitado la diseminación de enfermedades hereditarias recesivas. En Uruguay según los datos del último anuario de estadísticas agropecuarias (DIEA-MGAP, http://www.mgap.gub.uy/ sites/default/files/diea-anuario2017web01a.pdf ) se importaron en el año 2016 un número de dosis de semen de 625.967 y 780 embriones bovinos mientras que se exportó un número de dosis de semen de 30.865 y 700 embriones. Esta movilización de material genético posibilita cambios en las frecuencias génicas de los rodeos. Cuando animales portadores se reproducen entre sí, van a comenzar a aparecer enfermedades deletéreas con impacto en la producción y reproducción en ganado de leche o de carne. Una enfermedad genética, se asocia con alteraciones del genoma, ya sea a nivel de genoma nuclear o del genoma mitocondrial. Este tipo de alteraciones pueden ser hereditarias cuando están alterados los genomas de las células germinales (óvulos, espermatozoides) y hay transmisión del material genético de generación en generación (Llambí y Arruga., 2018). Hay que recordar que cuando se altera el genoma mitocondrial, la transmisión hereditaria será por vía materna de una generación a la próxima, debido a que las mitocondrias (orgánulos vitales para la respiración y energía de las células) solos son aportadas por el óvulo.
Cuando la patología es genética pero no hereditaria se verán afectadas, células somáticas de un individuo determinado (Ej. mutación en las células de algún tejido del organismo). Por lo tanto no siempre una patología genética se hereda o se trasmite a la descendencia.
ENFERMEDADES HEREDITARIAS MONOGÉNICAS
Los desórdenes genéticos pueden afectar un solo gen denominándose enfermedades de tipo monogénicas como Factor XI (FXID), deficiencia en la adhesión leucocitaria bovina (BLAD), citrulinemia (BC), braquiespina (BY), DUMPs y el complejo vertebral de malformación (CVM) que son características del ganado Holstein entre otras. Muchas de estas enfermedades en homocigosis (dos alelos mutados en el mismo individuo) se manifiestan con letalidad, debido a que los animales afectados no dejaran descendencia (Llambí., 2015). Por eso es importante diagnosticar a tiempo, posibles reproductores portadores de enfermedades monogénicas recesivas. Una estrategia propuesta es la de eliminar los alelos recesivos mutantes de la población mediante la eliminación de los reproductores portadores. Este enfoque se ha utilizado para eliminar portadores de defectos como BLAD y CVM (Sattler., 2002; Thallman y col., 2009). Como crítica a este tipo de estrategia es que se descartaría material genético de élite para otras características productivas de importancia. Otra estrategia seguida es conocer cuáles son los animales portadores de alelos recesivos no deseables para evitar el apareamiento entre ellos (uso de apareamiento dirigido).
Salimi y col., 2014 mediante simulaciónes estudian el cambio de frecuencias de portadores de alelos deletéreos y realizan estimaciones de pérdidas económicas a lo largo del tiempo (período de 25 años). Estos autores plantean un primer escenario donde no se permiten cruzamientos entre animales portadores, un segundo escenario donde no se define ninguna estrategia previa de cruzamientos y un tercer escenario donde se eliminan a los portadores de la población. En el primer escenario la frecuencia de portadores disminuye lentamente (0.67 a 0.56 en una simulación de 25 años), en el segundo escenario las frecuencias se mantienen constantes en ese mismo período de años (disminución no significativa) mientras que en el tercer escenario la frecuencia se reduce significativamente (0.68 a 0.14) pero consecuentemente hay una reducción significativa del progreso genético con respecto a los escenarios anteriores. Dichos autores proponen que el escenario tres, solo sería viable en términos económicos y solo se podría aplicar cuando el número identificado de portadores en las poblaciones es bajo. Por otro lado la lista de enfermedades hereditarias que se descubren va en aumento por lo que una estrategia de erradicación es poco factible, siendo aconsejable la estrategia del primer escenario.
En nuestro País la unión de esfuerzos entre investigadores del Área Genética de Facultad de Veterinaria, investigadores de la Unidad de Biotecnología del INIA-Las Brujas y del DILAVE – MGAP “Miguel C. Rubino” Laboratorio Regional Este- Treinta y Tres han generado avances en el diagnóstico de de enfermedades hereditarias en la especie bovina. Tomando como modelo de estudio, la enfermedad hereditaria BLAD, que produce mortalidad de terneros por inmunodepresión severa en las primeras semanas o meses de vida y es de complejo diagnóstico clínico, ya que no se observa un fenotipo anormal en los terneros afectados. En Uruguay las primeras comunicaciones sobre la detección de los primeros animales portadores de BLAD, utilizando la técnica molecular de la PCR-RFLP se realizaron en el año 2000 (Llambí y col., 2003). Los últimos datos en nuestro País muestran una baja prevalencia del 0.5% de portadores de BLAD en una muestra de 190 terneras provenientes de 30 establecimientos lecheros (Branda y col., 2016).
A nivel mundial en los últimos años otra patología genética que ha tenido un gran impacto económico negativo en lechería ha sido la Braquiespina (BY). Se caracteriza clínicamente por mortalidad embrionaria o continuación de la gestación con nacimiento de terneros muertos que presentan severa afectación esquelética y malformación de órganos internos. El gen implicado se denomina FANCI (gen relacionado con la anemia de Fanconi en humanos) y la mutación es una deleción de 3.3 Kb (Charlier y col., 2012).
En Uruguay, Alcántara y col., 2017, realizando un estudio de los catálogos de reproductores del año 2015 encontró que el 77% presentaban información sobre el status de esta enfermedad (BY= portador, TY= libre) identificando un 1.73% de toros portadores BY. Por lo que se puede afirmar que los alelos mutantes de braquiespina se encuentran circulando en nuestros rodeos.
A veces una enfermedad hereditaria puede presentar lo que se denomina “heterogeneidad alélica”; esto quiere decir que el gen tiene cierta inestabilidad mutacional con presencia de inserciones, deleciones y/o mutaciónes puntuales a lo largo del mismo (exónes o intrónes). En estos casos en distintas razas pueden aparecer fijadas distintos tipos de mutaciones del mismo gen con lo cual se dificulta el diagnóstico molecular (Llambí, 2015). Un ejemplo es la patología “pie de mula” o sindactilia hereditaria de los bovinos (defecto óseo donde hay fusión o ausencia de división de los dos dedos del pie). En Uruguay se identificó a nivel molecular la mutación A/G en el exón/intrón 37 del gen LRP4 en esta patología en el ganado Aberdeen Angus (Romero, 2017; Romero y col., 2015).
A nivel de diagnóstico molecular, en nuestro País, son varias las enfermedades hereditarias del ganado donde se han ido identificando la presencia de portadores: osteopetrosis hereditaria congénita, MSUD (enfermedad de la orina con olor a jarabe de arce), cardiomiopatía de pelo crespo, epidermólisis bullosa entre otras (Kelly y col., 2012; Dutra y col., 2012; Dutra, 2016.; Romero, 2017).
EVOLUCIÓN DE LA BASE OMIA
Una herramienta on line desarrollada por el Prof. Nicholas (Universidad de Sydney, Australia) y de gran utilidad para la genética aplicada a las Ciencias Veterinarias es la base OMIA (http:// omia.angis.org.au/home/). Desde 1970 se puso en evidencia el crecimiento continuo de publicaciones científicas relacionadas con mecanismos y enfermedades hereditarias; consecuentemente se desarrollaban las técnicas de diagnóstico molecular y los proyectos de secuenciación de genomas en especies domésticas. Esto último fue el disparador para que surgiera esta base como una manera de organizar electrónicamente la información que se venía generando.
De esta manera la información sobre trastornos y característica genéticas se hizo accesible, ordenada y actualizable a nivel global (Llambí y Arruga, 2018). En bovinos la primera enfermedad hereditaria asociada a una mutación puntual en el ADN se describió en el año 1987 y correspondió a un tipo hereditario de bocio donde estaba afectado el gen de la tiroglobulina (TG). En los últimos años la utilización de diferentes marcadores moleculares (microsatélites o STR, polimorfismos de nucleótido simple o SNPs), junto al desarrollo de las nuevas técnicas de secuenciación masiva (NGS, del inglés: Next Generation Sequencing), ha permitido el descubrimiento de nuevas patologías y características con base hereditaria.
El uso de chips de SNPs y análisis de asociación del genoma completo o GWAS (del inglés: Genome-wide association study) hace que se aceleren los procesos de identificación y diagnóstico de enfermedades genéticas (Gráfico 1). En el año 2008 mediante los primeros chips de SNPs (panel 25 K Affymetric SNP y panel 60K Illumina) se descubren las bases moleculares de las enfermedades hereditarias: distonía muscular congénita tipo 2, OMIA 001451-9913 y la Ictiosis congénita, OMIA 000547- 9913 en bovinos.
A fines del 2012, el desarrollo del proyecto 1000 genomas de toros donde se analizan por GWAS reproductores pertenecientes a distintas razas (http://www.1000bullgenomes.com/) viene siendo uno de los motores de mayor impulso para el conocimiento de nuevas enfermedades hereditarias de esta especie (Gráfico 2).
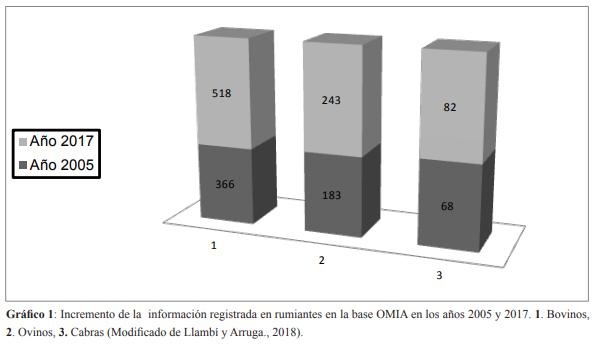
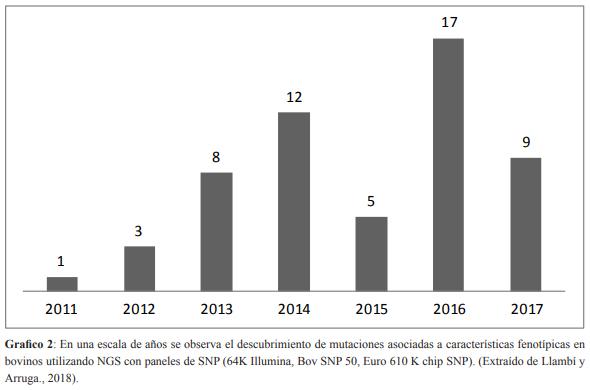
CONSIDERACIÓN FINAL
A pesar de los avances sobre el conocimiento de enfermedades hereditarias principalmente en la especie bovina; en Uruguay, todavía queda un largo camino por recorrer en cuanto a generar un “rastreo de alelos no deseables” (deleterious alleles tracking) sistematizado.
REFERENCIAS
1. Alcántara M, Artigas R, Llambí S. (2017). Relevamiento de toros portadores de la enfermedad hereditaria Braquiespina en la raza Holando de Uruguay. X Jornadas Técnicas Veterinarias. Montevideo, Uruguay.
2. Branda Sica A, Federici MT, Dutra F, Romero A, Briano C, Dalla Rizza M, Llambí S. (2016).Identificación de terneras Holando portadoras de BLAD y Citrulinemia en la región Este de Uruguay por PCR-RFLP y secuenciación. Veterinaria (Montevideo) Volumen 52 Nº 202 (2016) 23-27.
3. Charlier C, Agerholm J, Coppieters W, Karlskov-Mortensen P, Li W, Gerben de Jong, Fasquelle C, Karim L, Cirera S, Cambisano N, Ahariz N, Mullaart E, Georges M, Fredholm M. (2012). A Deletion in the Bovine FANCI Gene Compromises Fertility by Causing Fetal Death and Brachyspina. PLoS ONE 7(8): e43085. doi:10.1371/journal. pone.0043085
4. Dutra F, Baroni L, Techera M, Quinteros C. (2012). Osteopetrosis letal hereditaria (enfermedad de los huesos de mármol) en terneros Aberdeen Angus en Uruguay. Veterinaria (Montevideo). 48:21-27.
5. Dutra F, Romero A, Quinteros C, Kelly L. (2015). MSUD (Maple Syrup Urine Disease) en terneros Polled Hereford y cruzas Polled Hereford x Shorthorn en Uruguay.Veterinaria (Montevideo) 51:14 – 25
6. Kelly L, Dutra F, Llambí S, Rivero R, MoraesJ, Trenchi G, D’Agosto S, Peraza P, Ravagnolo O, Dalla Rizza, M. (2012). Diagnóstico molecular de enfermedades hereditarias bovinas en el Uruguay.Veterinaria (Montevideo) 48:3-11.
7. Llambí S, Guevara K, Rincón G, Zaffaroni R, de Torres E, Barrera J, Arruga MV, Rodríguez V, Postiglioni A. (2003). Frequencia da deficiencia na adesão leucocitaria em uma popula- ção de bovinos da raça holandesa, no Uruguai. Ars. Veterinaria. 19:52-56.
8. Llambí S. (2015). Avances en el diagnóstico molecular de enfermedades hereditarias de animales domésticos. Rev. Opción Veterinaria, Nº1, 10-15. http://www.opcionveterinaria.com.uy/ interactiva/2015/032015/#p=1.
9. Llambí, S, Arruga MV. (2018). Selecciones de genética veterinaria I. ISBN: 978-84-697-9330-5. Pag-1-140. Editorial Linza. Zaragoza-España.
10. Romero Velázquez A, Romero Benavente A, Montenegro M, Artigas RA, Briano C, Dutra F, Arruga M.V, Llambí S. (2015). Identificación de la mutación A/G en el exón/intrón 37 del gen LRP4 asociada a sindactilia en un ternero Aberdeen Angus en Uruguay (primer reporte). Proceeding XLIV Congreso Argentino de Genética, J of Basic and Applied Genetics (BAG) , Suppl XXVI,133.
11. Romero, A. (2017). Genotipado de las principales enfermedades hereditarias en bovinos de las razas hereford (MSUD) y Aberdeen Angus (osteopetrosis y sindactilia) en la región este de Uruguay. Tesis de Maestría en Salud Animal, Programa de Posgrado de Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay. 1-53.
12. Salimi F, Nejati A, Javaremi M, Aminafshar M, Honarvar M. (2014). Comparing different strategies in reducing the economic impact of recessive genetic disorders affecting reproductive efficiency in dairy cattle: a simulation study. Journal of Animal & Plant Sciences, 24(6): 2014: 1584-1591.
13. Sattler CG. (2002). Update on CVM research. Proc. 19th Tech. Conf. AI Reprod. Natl. Assoc. Anim. Breeders, Columbia, MO.19–22.
14. Thallman RM, Keele JW, Bennett GL. (2009). Proposed strategy for selection against recessive genetic defects through a combination of inbreeding and DNA markers. Proc. Beef Improvement Federation 41st Annual Research Symposium, Sacramento, California, USA.131-144.
Temas relacionados:
Autores:
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.




