Principales moléculas proteícas de la sangre animal
Publicado: 20 de octubre de 2015
Por: Ballesteros N. N. E; Luis Macedo Segura; José Pablo Pérez Gavilán Escalante P. Departamento de Biología Molecular y Biotecnología, Instituto de Investigaciones Biomédicas, UNAM, Ciudad Universitaria, México DF
PRINCIPALES MOLÉCULAS PROTEÍCAS DE LA SANGRE
Hemoglobina
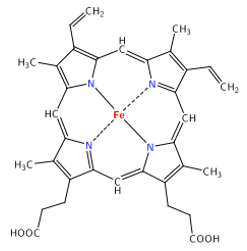
La hemoglobina de los mamíferos es tetramérica (formada por cuatro subunidades) y consiste de dos globinas α y dos globinas β, cada cadena contiene un grupo hemo1 (Figura 1). Cada cadena contiene 141 residuos en la globina a y 146 en la b1. El sistema de anillos heterocíclicos del hemo es un derivado de la porfirina que está constituido por cuatro anillos pirrol, unidos por puentes meteno1 (Figura 2). La secuencia de aminoácidos en las cadenas α y β determina el plegamiento de cada cadena y su interacción entre las subunidades y las propiedades de unión al oxígeno1.
Fig 1. Estructura de la molécula de hemoglobina - McKee T., McKee J., 20032
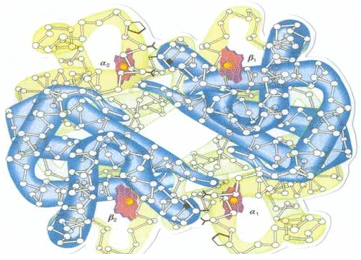
Fig 2. Estructura química del grupo hemo - http://www.molecularstation.com/molecular-biology-images/505-protein-pictures/48-heme-group.html3
Existen comúnmente cuatro tipos de globinas: alfa (α), beta (β), gamma (γ), y delta (δ) y de la combinación de estas cadenas se forman varios tipos de hemoglobinas, las hemoglobinas normales son: la hemoglobina A (α2β2) después del nacimiento, hemoglobina A2 (α2δ2) se encuentra después del nacimiento pero en pequeña cantidad y la hemoglobina F (α2γ2) predominante en el desarrollo fetal4.
Las aves y los mamíferos difieren en las propiedades de su sangre para unirse al oxigeno1. Los eritrocitos de las aves están nucleados y tienen un retículo endoplasmático rugoso desarrollado5; además en los eritrocitos de las aves hay altas concentraciones de inositol fosfato polifosfatado, derivado de la fosforilación oxidativa y en los mamíferos hay más concentración de difosfoglicerato; lo anterior causa modificaciones en la vía de glucolisis de los eritrocitos15. De acuerdo a lo anterior la hemoglobina de las aves tiende a tener mayor afinidad por el oxígeno en comparación con los mamiferos1.
Existen antígenos eritrocitarios que determinan los sistemas sanguíneos en cada especie. En los bovinos existen 70 grupos sanguíneos internacionalmente reconocidos, donde se encuentran 11 sistemas antigénicos (A, B, C, F, J, L, M, R, S, T y Z). El grupo B tiene 60 diferentes antígenos. El antígeno J es un lípido que se encuentra en los fluidos corporales y es absorbido por los eritrocitos6.
Las ovejas tienen 7 sistemas (A, B, C, D, M, R y X). Al igual que en los bovinos, el sistema B es altamente polimórfico. El sistema R es similar al J en los bovinos, en que es soluble. El grupo M-L está envuelto en el transporte activo del potasio en los eritrocitos6.
Las cabras tienen 5 sistemas (A, B, C, M y J), siendo muy similares a los encontrados en ovejas, el grupo J es soluble como en el caso de los bovinos6.
En gatos se han identificado 1 sistema (AB), en el que se encuentran tres grupos sanguíneos A, B y AB6.
En los perros existen 8 grupos sanguíneos (1.1, 1.2, 3, 4, 5, 6, 7, 8), conocidos como DEA (dog erythrocyte antigen) por sus siglas en ingles6.
En los equinos se han identificado 30 grupos sanguíneos, de estos solo 8 son sistemas genéticos. De estos 8, solo 7 son internacionalmente reconocidos (A, C, D, K, P, Q and U)6. En los cerdos existen 16 grupos sanguíneos (A, B,C, D, E, F, G, H, I, J, K, L, M, N, O y P). En las gallinas se han identificado 18 grupos sanguineos6.
Por causa de la demanda creciente de sangre para trasfusiones humanas, se está buscando introducir el gen de la hemoglobina humana para hacer cerdos transgénicos que pudiesen ser donadores de sangre a humanos 7,8,9.
La albúmina
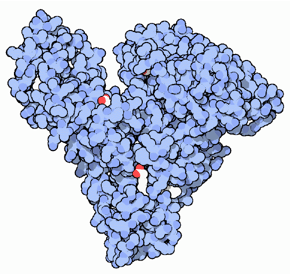
La albúmina (69 kDa) es la proteína principal del plasma de la sangre y constituye aproximadamente 60% de la proteína plasmática total. Consiste en una cadena polipeptídica de 585 aminoácidos y posee 17 enlaces disulfuro10 (Figura 3). Los enlaces disulfuro proporcionan estabilidad, mientras que las cadenas de péptidos que intervienen permiten una mayor flexibilidad. La configuración incluye 67% de hélices alfa y el 10% hojas beta12. Tiene una forma elipsoide, lo que indica que no provoca un aumento en la viscosidad del plasma, a diferencia de una molécula alargada como el fibrinógeno10.
La albúmina tiene como funciones principales el mantenimiento de la presión oncótica del plasma, atender las necesidades proteicas de los órganos y transporte de ácidos grasos y pigmentos biliares13.
Fig. 3. Estructura de la molécula de albúmina. http://www.pdb.org/pdb/101/motm.do?momID=3711
Globulinas
Las globulinas corresponden al 18% de las proteínas plasmáticas, se dividen en alfa, beta y gammaglobulinas, según su movilidad electroforética14.
En el grupo de las α1 globulinas se encuentran: la orosomucoide, glicoproteína acida, rica en glúcidos (40%), la α1-antitripsina, glicoproteína de peso molecular de 54,000 daltons, que contiene 12% de glúcidos y es un inhibidor de proteasas, y la α1-fetoproteina, esencial para el desarrollo del embrión, la cual contiene 4.3% de glúcidos y posee un peso molecular de 70,000 daltons13.
En el grupo de las α2-globulinas, se encuentran: las haptoglobulinas, la α2-macroglobulina (8% de glúcidos y PM de 850,000 daltons) y la ceruloplasmina, transportadora del 95% del cobre plasmatico13.
La fracción β-globulínica, contiene algunos anticuerpos, así como isoaglutininas, entre otras sustancias que se encuentran en esta fracción se pueden citar también la protrombina, la enzima fibrinolítica plasmina y varias proteínas conjugadas como la transferrina o siderofilina, que aseguran el transporte de hierro en el organismo13.
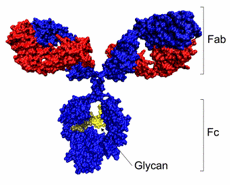
En el grupo de las γ -globulinas se encuentran las inmunoglobulinas (IgG, IgE, IgD, IgA e IgM) sintetizadas en los linfocitos B15. Las inmunoglobulinas tienen como estructura básica cuatro subunidades: dos cadenas ligeras (L) de aproximadamente 23 kDa y dos cadenas pesadas (H) de 53-75 kDa; estas subunidades se encuentran unidas por puentes disulfuro e interacciones no covalentes que forman una estructura en forma de Y15 (Figura 4). Al digerir las inmunoglobulinas con papaína se producen dos fragmentos (Fab) de 50 kDa, los fragmentos Fab donde tienen el sitio de unión antígeno anticuerpo y un fragmento Fc (50 kDa)15. Las cinco clases de inmunoglobulinas difieren en el tipo de cadenas pesadas que contienen y en algunos casos en la estructura de sus subunidades15. La inmunoglobulina M (IgM) está formada por 5 estructuras en forma de Y, unidas por una subunidad central J; es la primera inmunoglobulina que se secreta en presencia de un antígeno, es efectiva contra microorganismos. La inmunoglobulina G (IgG) es la más abundante, se encuentra distribuida en la sangre y en el líquido extravascular. La IgA se puede encontrar como monómeros, dímeros o trímeros, es secretada en las mucosas, principalmente en la mucosa del tracto digestivo. La inmunoglobulina E (IgE) es encontrada en pequeñas cantidades, protegen contra parásitos y está implicada en reacciones alérgicas15.
Se ha investigado la posible transferencia de inmunidad pasiva del suero sanguíneo, mostrando su efectividad en la protección inmunológica16-22.
Estructura de la molécula de albúmina. http://www.pdb.org/pdb/101/motm.do?momID=3711
Fig 4. Estructura de la inmunoglobulina G(IgG) - Collin M. et al. 200816
Fibrinógeno
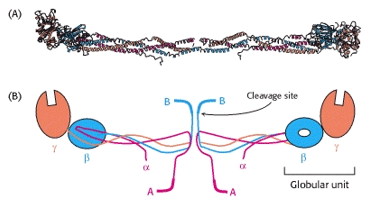
El fibrinógeno representa el 4% de las proteínas plasmáticas. Tiene un peso molecular de 340 kDa y está formado por seis cadenas: las cadenas están unidas por fibrinopéptidos A y B, cadena posee 3 subunidades, conocidas como Aα, Bβ y γ 23(Figura 5). El fibrinógeno es la sustancia que provoca la coagulación de la sangre, se le considera el precursor soluble de la fibrina, proteína soluble que constituye el coagulo13.
Fig. 5 .Estructura del fibrinógeno. A. Un diagrama donde se muestran las dos regiones α-hélice, conectadas a una región globular. B. Representación esquemática, mostrando la posición de los fibrinopéptidos A y B. - Nelson L. D. Y Cox M.M, 2005 23
REFERENCIAS
- WELLS M.G. R., Evolution of hemoglobin function: molecular adaptations to environment, Clin. and Exp. Pharm. and phys, 1999, 26: 591-595.
- McKEE T., McKEE J. Biochemistry, Three Edition, McGraw Hill Interamerican, United States of America, 2003.
- MOLECULAR STATION, Consulta electrónica, junio 2011 http://www.molecularstation.com/molecular-biology-images/505-proteinpictures/48-heme-group.html.
- KAUSHANSKY K., LICHTMAN M., BEUTLER E., KIPPS T., Williams Hematology, Eighth Edition, McGraw Hill Interamericana, USA, 2010.
- GALVES M. C., RAMIREZ B. G., OSORIO J., El laboratorio clínico en hematología de aves exóticas, Biosalud,2009, 8: volumen 8:178 – 188.
- DOUGLAS J., WEISS K., WARDROP J. Schalm’s veterinary hematology, 6th Edition, Willey-Blackwell, Ames, Iowa, 2010.
- SWANSON M.E., MARTIN M.J., O’DONNELL J.K., Production of functional human hemoglobin in transgenic swine. Biotechnol 1992,10:557.
- RAO M. J., SCHNEIDER K., CHAIT B. T., CHAO T. L., KELLER H., ANDERSON S., MANJULA B., KUMAR R., Recombinant Hemoglobin a Produced in Transgenic Swine: Structural Equivalence with Human Hemoglobin A, Art. cells, blood subs., and immob. biotech.,1994, 22(3):695-700.
- PRATHER R. S.; SHEN M.; DAI Y., Genetically Modified Pigs for Medicine and Agriculture, Agric. Biotech. and Gen. Eng. Rev., 2008, 25:245-266.
- MURRAY R., MAYES P., GRANNER D.K., RODWELL V., Harper Bioquímica ilustrada, 16th. Edición, Editorial Manual Moderno, México/DF, 2004.
- PROTEIN DATA BASE, RSCB. Búsqueda electrónica. Agosto del 2011. http://www.pdb.org/pdb/101/motm.do?momID=37
- FERRER, M.L., DUCHOWICZ, R., CARRASCO, B., GARCIA DE LA TORRE, G., ACUNA, U. Physical chemical data support heart-shaped structure for albumin in solution, Biophys. j. 2001. 80:2422-2430.
- MACEDO S.L. 2004. Posibilidades de las albuminas y globulinas del plasma animal en la formulación de hamburguesas. Tesis profesional, Facultad de Química, UNAM.
- CHEFTEL, J. C. Proteínas alimentarias. Editorial Acribia, Zaragoza/España. 1989. Pág. 221-232.
- VOET D., VOET J., PRATT G., CHARLOTE W., Fundamentos de Bioquímica, John Wiley and Sons Inc., USA, 1999.
- COLLIN M., OONAGH S., BJO’RCK L. IgG glycan hydrolysis by a bacterial enzyme as a therapy against autoimmune conditions, PNAS, 2008 105(11): 4265-4270.
- VAN DIJK. A., EVERTS H., NABUURS M. J., MARGRY R. J., BEYNEN A. C., Growth performance of weanling pigs fed spray-dried animal plasma: a review, Liv. Prod. Sci. 2001, 68(2-6): 263-274.
- VAN DIJK. A., ENTHOVEN P. M.,VAN DEN HOVEN S.,VAN LAARHOVEN M., NIEWOLD T. A., NABUURS M. J., BEYNEN A. C., The effect of dietary spray-dried porcine plasma on clinical response in weaned piglets challenged with a pathogenic Escherichia coli, Vet. Microbiology 2002, 84(3): 207-218.
- NIEWOLD T. A., VAN DIJK A., GEENEN P. L., ROODINK H., MARGRY R., VAN DER MEULEN J., Dietary specific antibodies in spray-dried immune plasma prevent enterotoxigenic Escherichia coli F4 (ETEC) post weaning diarrhoea in piglets, Vet. Microbiology 2007, 124(3-4): 362-369
- QUIGLEY III J. D., WOLFE T.M., Effects of Spray-Dried Animal Plasma in Calf Milk Replacer on Health and Growth of Dairy Calves, J. of Dairy Sci. 2003, 68(2): 586-592.
- PIERCE J. L., CROMWELL G.L., LINDEMANN M. D., RUSSELL L.E. and WEAVER E.M., Effects of spray-dried animal plasma and immunoglobulins on performance of early weaned pigs, J. Anim. Sci. 2005, 83(12) 2876-2885.
- PEACE R. M., CAMPBELL J., POLO J., CRENSHAW J., RUSSELL L. and MOESER A., Spray-Dried Porcine Plasma Influences Intestinal Barrier Function, Inflammation, and Diarrhea in Weaned Pigs, J. Nutr. 2011, 141(7) 1312-1317.
- NELSON L. D. Y COX M.M., Lehninger, Principios de Bioquímica, 4th Edición, Editorial McGraw Hill, México/DF, 2005.
Autores:


Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.







