Salmonella en la carne de pollo
Presencia y Resistencia a los Antimicrobianos de serovariedades de Salmonella enterica aisladas en una empresa avícola integrada del Ecuador
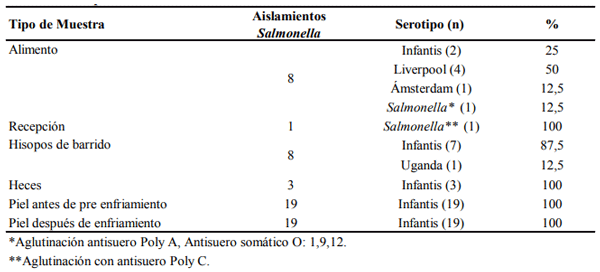
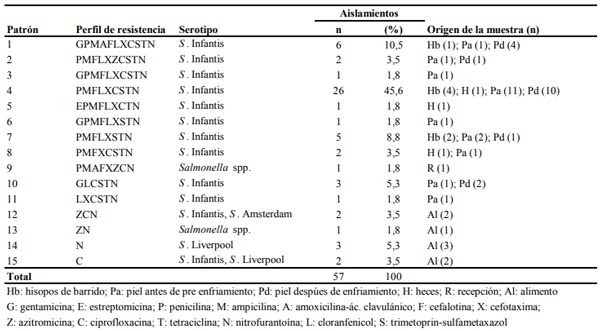
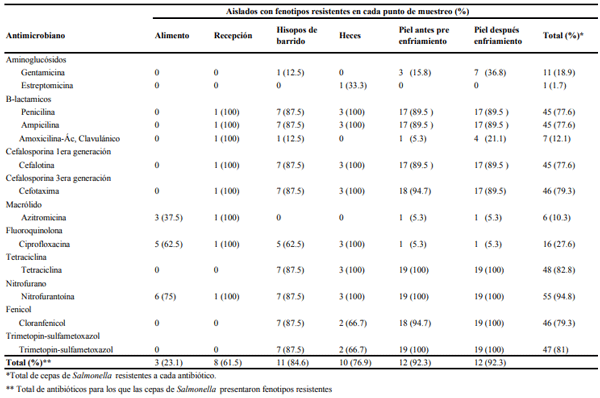
A nivel mundial Salmonella es la responsable de causar millones de casos de gastroenteritis humana y más de cien mil defunciones cada año. Una de las principales fuentes de contagio esta bacteria son los productos de origen aviar. La utilización generalizada de antimicrobianos en la industria avícola ha favorecido el surgimiento de cepas de Salmonella multirresistentes. Dichas cepas podrían transmitirse al ser humano a través del consumo de productos cárnicos contaminados. El objetivo de esta investigación fue identificar serotipos y patrones de resistencia antimicrobiana de cepas de Salmonella aisladas en una empresa avícola integrada en Ecuador. Al final del período de muestreo se recolectaron 289 muestras que fueron analizadas en base a la norma NTE INEN-ISO 6579 Anexo D. El 20.1% de las muestras fueron positivas a Salmonella, identificándose 4 diferentes serovariedades, siendo S. Infantis (74.1%) el serotipo más frecuente. La mayoría de cepas de Salmonella presentaron resistencia a nitrofurantoína (94.8 %), tetraciclina (82.8%), cloranfenicol (79.3%) y trimetopin-sulfametoxazol (81%). Los resultados de este estudio indican que Salmonella puede estar presente en los diferentes procesos de la industria avícola ecuatoriana, además la resistencia antibacteriana de cepas aisladas en carne de pollo puede representar un riesgo para la salud pública.
PALABRAS CLAVES: Ecuador, Industria Avícola, Resistencia a los antimicrobianos, Salmonella, Serotipo.
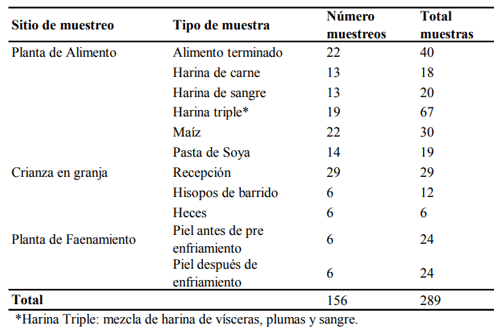
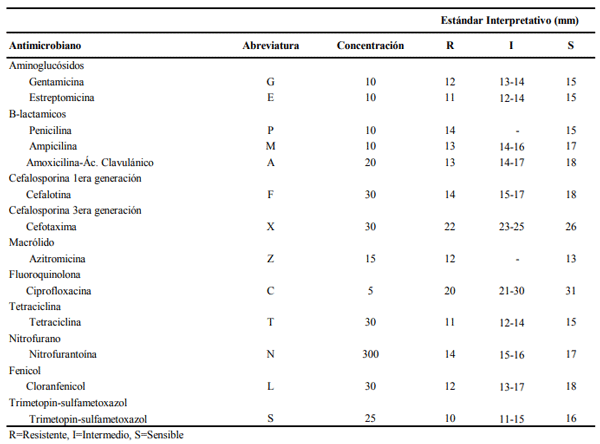
METODOLOGÍA

DISCUSIÓN
- Adesiyun A, Webb L, Musai L, Louison B, Joseph G, Stewart-Johnson A, Samlal S, Rodrigo S. 2014. Survey of Salmonella Contamination in Chicken Layer Farms in Three Caribbean Countries. Journal of Food Protection 77(9): 1471–1480.
- Akond M, Shirin M, Alam S, Hassan S, Rahman M, Hoq M. 2012. Frequency of drug resistant Salmonella spp. isolated from poultry samples in Bangladesh. Stamford Journal of Microbiology 2(1): 15–19.
- Al-Zenki S, Al-Nasser A, Al-Safar A, Alomirah H, Al-Haddad A, Hendriksen R, Aarestrup F. 2007. Prevalence and antibiotic resistance of Salmonella isolated from a poultry farm and processing plant environment in the State of Kuwait. Foodborne Pathogens and Disease 4(3): 367–73.
- Alali W, Gaydashov R, Petrova E, Panin A, Tugarinov O, Kulikovskii A, Mamleeva D, Walls I, Doyle M. 2010. Prevalence and Distribution of Salmonella in Organic and Conventional Broiler Poultry Farms. Foodborne Pathogens and Disease 7(11): 1363–1371.
- Andino A, Pendleton S, Zhang N, Chen W, Critzer F, Hanning I. 2014. Survival of Salmonella enterica in poultry feed is strain dependent. Poultry Science 93(2): 441–7.
- Antunes P, Mourão J, Campos J, Peixe L. 2016. Salmonellosis: the role of poultry meat. Clinical Microbiology and Infection 22(2): 110–121.
- Berghaus RD, Thayer SG, Law BF, Mild RM, Hofacre CL, Singer RS. 2013. Enumeration of Salmonella and Campylobacter spp. in Environmental Farm Samples and Processing Plant Carcass Rinses from Commercial Broiler Chicken Flocks. Applied and Environmental Microbiology 79(13): 4106–4114.
- Brizio AP y Prentice C. 2015. Chilled broiler carcasses: a study on the prevalence of Salmonella, Listeria and Campylobacter. International Food Research Journal 22(1): 55–58.
- Choi D, Chon JW, Kim HS, Kim DH, Lim JS, Yim JH, Seo KH. 2015. Incidence, Antimicrobial Resistance, and Molecular Characteristics of Nontyphoidal Salmonella Including Extended-Spectrum β-Lactamase Producers in Retail Chicken Meat. Journal of Food Protection 78(11): 1932–7.
- Clep R . 2010. Prevalence of mobile serovars of Salmonella spp. isolated from breeding hens, laying hens and broiler chickens in 2010. Scientific Works. C Series. Veterinary Medicine 58(4): 70–79.
- CLSI. 2015. Performance Standards for Antimicrobial Susceptibility Testing. Clinical and Laboratory Standards Institute, 950. 35(3): 44-50.
- CONAVE. 2013. Estadísticas avícolas. Página de Internet: http://www.conave.org/upload/ informacion/Estadisticas avicolas.pdf. Consultada: 18-diciembre-2015.
- Cox NA, Buhr RJ, Smith DP, Cason JA, Rigsby LL, Bourassa DV, Fedorka-Cray P, Cosby D. 2014. Sampling naturally contaminated broiler carcasses for Salmonella by three different methods. Journal of Food Protection 77(3): 493– 495.
- Cui M, Xie M, Qu Z, Zhao S, Wang J, Wang Y, He T, Wang H, Zuo Z, Wu C. 2016. Prevalence and antimicrobial resistance of Salmonella isolated from an integrated broiler chicken supply chain in Qingdao, China. Food Control 62: 270–276.
- Da Silva N, Hirotomi M, Junqueira V, Silveira N, Da Silva M y Gomes R. 2013. Microbiological Examination Methods of Food and Water: A Laboratory Manual. CRC Press/ Balkema. London, UK. 484 pp.
- Donado-Godoy P, Clavijo V, León M, Tafur MA, Gonzales S, Hume M, Alali W, Walls I, Lo Fo W, Danilo MA, Doyle MP. 2012. Prevalence of Salmonella on Retail Broiler Chicken Meat Carcasses in Colombia. Journal of Food Protection 75(6): 1134–1138.
- Donado-Godoy P, Byrne B, León M, Castellanos R, Vanegas C, Coral A, Arevalo A, Clavijo V, Vargas M, Romero J, Tafur M, Pérez E, Smith W. 2015. Prevalence, resistance patterns, and risk factors for antimicrobial resistance in bacteria from retail chicken meat in Colombia. Journal of Food Protection 78(4): 751–9.
- EFSA. 2008. Microbiological Risk Assessment in Feedingstuffs for Food-Producing Animals. EFSA Journal 720: 1–84.
- EFSA. 2010. Analysis of the Baseline Survey on the Prevalence of Campylobacter in Broiler Batches and of Campylobacter and Salmonella on Broiler Carcasses in the EU, 2008, Part A: Campylobacter and Salmonella Prevalence Estimates. EFSA Journal 8(03).
- EFSA. 2015. Trends and Sources of Zoonoses ,Zoonotic Agents and Food-Borne. EFSA Journal 13(1): 1–162.
- EFSA, ECDC. 2013. The European Union Summary Report on Antimicrobial Resistance in Zoonotic and Indicator Bacteria from Humans, Animals and Food in 2011. EFSA Journal 11(5).
- EFSA y ECDC. 2015a. EU Summary Report on Antimicrobial Resistance in Zoonotic and Indicator Bacteria from Humans, Animals and Food in 2013. European Food Safety Authority Journal 13(2).
- EFSA y ECDC. 2015b. The European Union Summary Report on Trends and Sources of Zoonoses, Zoonotic Agents and Food-Borne Outbreaks in 2013.” European Food Safety Authority Journal 13(1).
- Eurosurveillance editorial team. 2014. The European Union Summary Report on antimicrobial resistance in zoonotic and indicator bacteria from humans, animals and food 2012 published. Euro Surveillance : Bulletin Européen Sur Les Maladies Transmissibles=European Communicable Disease Bulletin 19(12): 20748.
- FAO/WHO. 2009. Salmonella and Campylobacter in chicken meat, meeting report. Microbiological Risk Assesmment Series 19. Italy. 56 pp.
- Fitch FM, Carmo-Rodrigues M, Oliveira VG, Gaspari MV, Dos Santos A, de Freitas JB y Pignatari AC. 2015. β-Lactam Resistance Genes: Characterization, Epidemiology, and First Detection of blaCTX-M-1 and blaCTX-M-14 in Salmonella spp. Isolated from Poultry in Brazil-Brazil Ministry of Agriculture’s Pathogen Reduction Program. Microbial Drug Resistance 22(2): 164–71.
- FDA. 2013. National Antimicrobial Resistance Monitoring System - Enteric Bacteria (NARMS): 2012 Executive Report. Rockville, MD: U.S. Department of Health and Human Services, Food and Drug Administration.
- Giombelli A y Abreu M. 2014. Prevalence of Salmonella and Campylobacter on Broiler Chickens from Farm to Slaughter and Efficiency of Methods To Remove Visible Fecal Contamination. Journal of Food Protection 77(11): 1851–1859.
- Giombelli A, Hammerschmitt D, Cerutti MF, Chiarini E, Landgraf M, Franco BD y Destro M. 2015. High pressure spray with water shows similar efficiency to trimming in controlling microorganisms on poultry carcasses. Poultry Science 94(10): 2589–95.
- Guastalli B, Batista D, Souza A, Guastalli E, Lopes P, Almeida A, Prette N, Barbosa F, Stipp D, Freitas O. 2016. Evaluation of Disinfectants Used in Pre-Chilling water Tanks of Poultry Processing Plants. Revista Brasileira de Ciência Avícola 18(2): 217–224.
- Gyles CL. 2008. Antimicrobial resistance in selected bacteria from poultry. Animal Health Research Reviews 9(2): 149–158.
- Herren RV. 2012. The Poultry Industry. In: The Science of Animal Agriculture: 76-95. New York.
- Heyndrickx M, Vandekerchove D, Herman L, Rollier I, Grijspeerdt K, De Zutter, L. 2002. Routes for Salmonella contamination of poultry meat: epidemiological study from hatchery to slaughterhouse. Epidemiology and Infection 129(2): 253–265.
- Humphrey T. 2004. Science and society: Salmonella, stress responses and food safety. Nature Reviews Microbiology 2(6): 504–509.
- Im MC, Jeong SJ, Kwon YK, Jeong OM, Kang MS, Lee YJ. 2015. Prevalence and characteristics of Salmonella spp. isolated from commercial layer farms in Korea. Poultry Science 94(7): 1691–8.
- Katoh R, Matsushita S, Shimojima Y, Ishitsuka R, Sadamasu K , Kai A. 2015. Serovars and Drug-Resistance of Salmonella Strains Isolated from Domestic Chicken Meat in Tokyo (1992-2012). The Journal of the Japanese Association for Infectious Diseases 89(1): 46–52.
- Kutay HC, Dümen E, Keser O, Bilgin AŞ, Ergin S y Kocabağli N. 2016. Prevalence and Antimicrobial Susceptibility of Salmonella in Rendered Animal Products Used in Poultry Feed in Turkey. Kafkas Universitesi Veteriner Fakultesi Dergisi 22(6): 909–916.
- Lamas A, Fernandez-No I, Miranda JM, Vázquez B, Cepeda A, Franco CM. 2016. Prevalence, molecular characterization and antimicrobial resistance of Salmonella serovars isolated from northwestern Spanish broiler flocks (2011–2015). Poultry Science 95(9): 2097-2105.
- Lee SK., Choi D, Kim HS, Kim DH, Seo KH. 2016. Prevalence, Seasonal Occurrence, and Antimicrobial Resistance of Salmonella spp. Isolates Recovered from Chicken Carcasses Sampled at Major Poultry Processing Plants of South Korea. Foodborne Pathogens and Disease 13(10): 544–550.
- Lillard HS. 1979. Levels of chlorine and chlorine dioxide of equivalent bactericidal effect in poultry processing water. Journal of Food Science 44(6): 1594–1597.
- Logue CM, Sherwood JS, Olah PA, Elijah LM, Dockter MR. 2003. The incidence of antimicrobial-resistant Salmonella spp. on freshly processed poultry from US Midwestern processing plants. Journal of Applied Microbiology 94(1): 16–24.
- Loretz M, Stephan R, Zweifel C. 2010. Antimicrobial activity of decontamination treatments for poultry carcasses: A literature survey. Food Control 21(6): 791–804.
- Mainali C, McFall M, King R, Irwin R. 2014. Evaluation of Antimicrobial Resistance Profiles of Salmonella Isolates from Broiler Chickens at Slaughter in Alberta, Canada. Journal of Food Protection 77(3): 485–492.
- Maka L, Maćkiw E, Ściezyńska H, Pawłowska K, Popowska M. 2014. Antimicrobial susceptibility of Salmonella strains isolated from retail meat products in Poland between 2008 and 2012. Food Control 36(1).
- Marin C, Balasch S, Vega S, Lainez M. 2011. Sources of Salmonella contamination during broiler production in Eastern Spain. Preventive Veterinary Medicine 98(1): 39–45.
- Mattiello SP, Drescher G, Barth VC, Ferreira CA, Oliveira SD. 2015. Characterization of antimicrobial resistance in Salmonella enterica strains isolated from Brazilian poultry production. Antonie van Leeuwenhoek 108(5): 1227–1238.
- Mdemua S, Maina J, Ephraim Z. 2016. Isolation of Salmonella in Commercial Chicken Feeds in Ilala District. American Scientific Research Journal for Engineering, Technology, and Sciences 19(1): 1–8.
- Medeiros M A, Oliveira D C, Rodrigues D, Freitas D R. 2011. Prevalence and antimicrobial resistance of Salmonella in chicken carcasses at retail in 15 Brazilian cities. Pan American Journal of Public Health 30(6): 555–60.
- Miranda J M, Mondragón A C, Martinez B, Guarddon M, Rodriguez J A. 2009. Prevalence and antimicrobial resistance patterns of Salmonella from different raw foods in Mexico. Journal of Food Protection 72(5): 966–971.
- Molina A, Granados-Chinchilla F, Jiménez M, Acuña-Calvo M, Alfaro M, Chavarría G. 2016. Vigilance for Salmonella in Feedstuffs Available in Costa Rica: Prevalence, Serotyping and Tetracycline Resistance of Isolates Obtained from 2009 to 2014. Foodborne Pathogens and Disease 13(3): 119–127.
- Moraes D, Andrade M, Duarte S, Bastos T, Arnhold E, Jayme V, Nunes I. 2016. Phenotypic and molecular detection of Salmonella sp. on growing, rearing and production phases in a commercial group of laying hens. Pesquisa Veterinária Brasileira 36(6): 503–508.
- Nagel GM, Bauermeister LJ, Bratcher CL, Singh M, McKee SR. 2013. Salmonella and Campylobacter reduction and quality characteristics of poultry carcasses treated with various antimicrobials in a post-chill immersion tank. International Journal of Food Microbiology 165(3): 281–286. OIE. 2012.
- OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 7th edition. Francia.
- OMS. 2014. Antimicrobial Resistance: Global Report on Surveillance. Página de Internet: http://www.who.int/drugresistance/documents/surveillancereport/en/. Consultada: 20-diciembre-2015
- Parveen S, Taabodi M, Schwarz J G, Oscar T P, Harter-Dennis J, White D G. 2007. Prevalence and antimicrobial resistance of Salmonella recovered from processed poultry. Journal of Food Protection 70(11): 2466–2472.
- Pellegrini D, Paim D, Lima G, Pissetti C, Kich J, Cardoso M. 2015. Distribution of Salmonella clonal groups in four Brazilian feed mills. Food Control 47: 672–678.
- Pérez C, Rivera S, Pirela de Vera A, Rincón H, Mavárez Y, Román R. 2004. Aislamiento de Salmonella en canales de aves y evaluación de la efectividad de diferentes medios de enriquecimiento y selectivos. Revista Científica 14(2): 177–185.
- Quesada A, Reginatto GA, Español AR, Colantonio LD, Burrone MS. 2016. Resistencia antimicrobiana de Salmonella spp aislada de alimentos de origen animal para consumo humano. Revista Peruana de Medicina Experimental Y Salud Publica 33(1): 32–44.
- Rahmani M, Peighambari SM, Svendsen CA, Cavaco LM, Agersø Y, Hendriksen R S. 2013. Molecular clonality and antimicrobial resistance in Salmonella enterica serovars Enteritidis and Infantis from broilers in three Northern regions of Iran. BMC Veterinary Research 9(1): 66.
- Rašeta M, Teodorović V, Bunčić O, Katić V, Branković Lazić I, Polaček V, Vidanović D. 2014. Antibiotic Resistance and Molecular Studies on Salmonella Enterica Subspecies Enterica Serovar Infantis Isolated in Human Cases and Broiler Carcasses. Acta Veterinaria-Beograd 64(2) 257–268.
- Rasschaert G, Houf K, De Zutter L. 2007. Impact of the Slaughter Line Contamination on the Presence of Salmonella on Broiler Carcasses. Journal of Applied Microbiology 103(2): 333–41.
- Rivera W, Barquero E, Zamora R. 2014. Salmonella Contamination Risk Points in Broiler Carcasses during Slaughter Line Processing. Journal of Food Protection 77(12): 2031–34.
- Rodriguez R, Fandiño C, Donado P, Guzmán L, Verjan N. 2015. Characterization of Salmonella from Commercial Egg-Laying Hen Farms in a Central Region of Colombia. Avian Diseases 59(1): 57–63.
- Sanad YM, Johnson K, Park SH, Han J, Deck J, Foley SL, Kenney B, Ricke S, Nayak R. 2015. Molecular Characterization of Salmonella enterica serovars isolated from a turkey production facility in the absence of selective antimicrobial pressure. Foodborne Pathogens and Disease 13(2):80–7.
- Sodagari HR, Mashak Z, Ghadimianazar A. 2015. Prevalence and antimicrobial resistance of Salmonella serotypes isolated from retail chicken meat and giblets in Iran. The Journal of Infection in Developing Countries 9(5): 463–469.
- Su LH., Chiu CH, Chu C, Ou JT. 2004. Antimicrobial Resistance in Nontyphoid Salmonella Serotypes: A Global Challenge. Clinical Infectious Diseases 39(4): 546–551.
- Tîrziu E, Lazăr R, Sala C, Nichita I, Morar A, Şereş M, Imre K. 2015. Salmonella in Raw Chicken Meat from the Romanian Seaside: Frequency of Isolation and Antibiotic Resistance. Journal of Food Protection 78(5): 1003–1006.
- Torres GJ, Piquer FJ, Algarra L, de Frutos C, Sobrino OJ. 2011. The prevalence of Salmonella enterica in Spanish feed mills and potential feed-related risk factors for contamination. Preventive Veterinary Medicine 98: 81–87.
- van Asselt ED, Thissen JT, van der Fels-Klerx HJ. 2009. Salmonella serotype distribution in the Dutch broiler supply chain. Poultry Science 88(12): 2695–2701.
- Vinueza C, Cevallos M, Ron L, Bertrand S, De Zutter L. 2016. Prevalence and Diversity of Salmonella Serotypes in Ecuadorian Broilers at Slaughter Age. PLoS ONE 11(7): e0159567.
- Von Rückert D, Pinto P, Santos BM, Moreira M, Rodrigues AC. 2009. Pontos críticos de controle de Salmonella spp. no abate de frangos. Arquivo Brasileiro de Medicina Veterinaria E Zootecnia 61(2): 326–330.
- Voss-Rech D, Vaz CS, Alves L, Coldebella A, Leão JA, Rodrigues DP, Back A. 2015. A temporal study of Salmonella enterica serotypes from broiler farms in Brazil. Poultry Science 94(3): 433–441.
- Voss-Rech D, Potter L, Vaz CS, Pereira D, Sangioni L, Vargas Á, Botton S. 2016. Antimicrobial Resistance in Nontyphoidal Salmonella Isolated from Human and Poultry-Related Samples in Brazil: 20-Year Meta-Analysis. Foodborne Pathogens and Disease 20.
- Wallis TS, Barrow PA. 2005. Salmonella Epidemiology and Pathogenesis in Food-Producing Animals. EcoSal Plus 1(2): 1–31.
- Wang H, Ye K, Wei X, Cao J, Xu X, Zhou G. 2013. Occurrence, antimicrobial resistance and biofilm formation of Salmonella isolates from a chicken slaughter plant in China. Food Control 33(2): 378–384.
- Wierup M. 2013. Salmonella in Feed. En: Salmonella in Domestics Animals, eds. Barrow P A y Methner U. London: © CAB International, 377–398.
- World Health Organization. 2013. WHO Model List of Essential Medicines - 18th List (April 2013). Página de Internet: http:// www.who.int/medicines/publications/essentialmedicines/en/. Consultada: 21-febrero-2016.
- World Health Organization. 2015. WHO estimates of the global burden of foodborne diseases: foodborne disease burden epidemiology reference group 2007-2015. Página de Internet: http://www.who.int/foodsafety/publications/foodborne_disease/fergreport/ en/. Consultada: 20-enero-2017.
- Yang S, Wu Z, Lin W, Xu L, Cheng L, Zhou L. 2016. Investigations into Salmonella contamination in feed production chain in Karst rural areas of China. Environmental Science and Pollution Research 24(2): 1372-1379.
- Zare Bidaki M, Tehrani Pour A, Dadpour S, Gholizadeh, H. 2013. Prevalence of Salmonella in poultry carcasses serotypes in Birjand industrial slaughterhouses. Journal of Birjand University of Medical Sciences 20(2): 191–197.








.jpg&w=3840&q=75)