Xilanasa: impacto en el crecimiento y salud intestinal de pollos de engorde
Publicado: 19 de octubre de 2021
Por: Tatiana Garcia Díaz; Ramalho Rodrigueiro; Eliane Aparecida da Silva; Bruno Marotta Lima. Nutrition Service CJ CheilJedang Brazil.
Introducción
Las aves modernas utilizadas para producción de pollo de engorde, se caracterizan por presentar una tasa de conversión alimenticia eficiente. Esto se debe, principalmente, al mejoramiento genético que se ha alcanzado a través de los años, permitiendo que los animales ganen peso rápidamente cuando reciben la alimentación adecuada, atendiendo los requerimientos nutricionales de las aves (Rostagno et al., 2011). Por esta razón, el conocimiento sobre la composición y el valor nutricional de los ingredientes utilizados en la formulación de las dietas, constituyen factores fundamentales para obtener mayores índices zootécnicos, y consecuentemente, mayores ganancias económicas.
Los principales ingredientes utilizados para formulación de dietas para aves de corral son los granos de cereales como maíz, y soja (Stefanello et al., 2016; Hu et al., 2019), los cuales, son incluidos en cantidades adecuadas en la dieta para satisfacer las necesidades energéticas y proteicas de los animales, llevándolos a la expresión de su máximo potencial genético. Sin embargo, el elevado costo del maíz y la soja en el mercado actual, causado principalmente por la alta demanda del mercado y fenómenos climáticos, ha llevado a los productores de aves a incluir en la dieta de los animales ingredientes alternativos, como sorgo, trigo, cebada y/o DDGS (coproductos de destilería), buscando reducir costos, una vez que los rubros de alimentación, pueden llegar a representar hasta 80% del total de los costos de producción (Alqaisi et al. 2011).
El uso de estos alimentos alternativos en la dieta de las aves es limitado, debido a que contienen alto contenido de fibra y polisacáridos no amiláceos (PNA’s), los cuales no son digeridos por las aves, debido a que las enzimas producidas por los animales monogástricos no son eficientes para desdoblar estos componentes, por lo que permanecen sin descomposición en el tracto digestivo, provocando reducción en la eficiencia alimentaria, el rendimiento y la salud intestinal de las aves (Moftakharzadeh et al., 2019; Hoeck et a.,l 2021).
Actualmente, el uso de enzimas exógenas como la Xilanasa, se han convertido en un gran aliado para productores y nutricionistas, pues esta degrada las cadenas largas de los PNA’s, hidrolizando los enlaces de las moléculas de xilano (Bedford, 2000; Petry et al., 2021; Hoeck et al., 2021), ayudando a reducir los efectos anti-nutricionales de los PNA’s, presente no solo en alimentos alternativos, sino también en soja y maíz. La reducción de la viscosidad intestinal es uno de los principales efectos observados con el uso de la Xilanasa, pues mejora de la digestibilidad de los nutrientes y el rendimiento del crecimiento de los pollos de engorde (Choct et al., 2004; Gao et al., 2008; Vandeplas et al., 2010; Valdivia et al., 2019).
Los productos de la hidrólisis del arabinoxilano por acción de la enzima Xilanasa produce subunidades de oligosacáridos de cadena corta, como los xilo-oligosacáridos, que actúan como prebióticos para las bacterias beneficiosas en el intestino y están asociados con mejoras en el rendimiento de las aves, modulando las poblaciones microbianas en el sistema digestivo, mejorando la salud intestinal y aumento de la producción de ácidos grasos de cadena corta (AGCC) en el ciego, y fortaleciendo el sistema inmune (Yang et al., 2008; Masey-O′Neill et al., 2014).
El objetivo de este trabajo fue revisar los efectos la inclusión de la enzima Xilanasa sobre el crecimiento y salud intestinal de aves de corral.
Polisacáridos no amiláceos (PNA’s)
Los PNA’s son carbohidratos complejos, distintos de los almidones, que se encuentran en los alimentos. En los granos de cereales los PNA’s predominantes son arabinoxilanos, seguidos pelos los β-glucanos. El arabinoxilano es una hemicelulosa formado por cadenas lineales de xilosa unidas por enlaces β-(1-4), con diversas ramificaciones de unidades de β-L-arabinofuranosa, encontrándose en mayor proporción en granos de cereales como el trigo, centeno y triticale, ya los β-glucanos son los PNA´s más abundantes en la cebada y avena, y están formados por cadenas lineales de glucosas unidas por enlaces β-(1-4) o β-(1-3) (Collins et al., 2005).
Aunque el maíz y la harina de soja son altamente digeribles en pollos de engorde, estos ingredientes contienen cantidades considerables de PNA’s. El maíz contiene aproximadamente 8% de los PNA’s en la materia seca, con predominancia en arabinoxilanos y en la soya, los PNA’s llegan a ser 22% de la materia seca (Tabla 1; Rostagno et al., 2017).
Los arabinoxilanos se clasifican de acuerdo a su solubilidad en agua, en solubles o insolubles. Los arabinoxilanos solubles, forman soluciones viscosas debido a su capacidad para absorber hasta diez veces su peso en agua (Choct, 1997), esta característica aumenta la viscosidad de la digesta en el trato digestivo de aves dificultando la motilidad intestinal, reduciendo la tasa de pasaje y la acción de las enzimas endógenas. Se ha demostrado que los PNA’s de la dieta aumentan la secreción de mucinas intestinales, glicoproteínas de alto peso molecular secretadas por las células caliciformes en el colon y el intestino delgado (Tanabe et al., 2006; Raza et al., 2019), disminuyendo la digestión y absorción de nutrientes a través de su efecto fisicoquímico en el tracto intestinal.
Tabla 1. Contenido de polisacárido no amiláceo en los alimentos (% de materia natural)
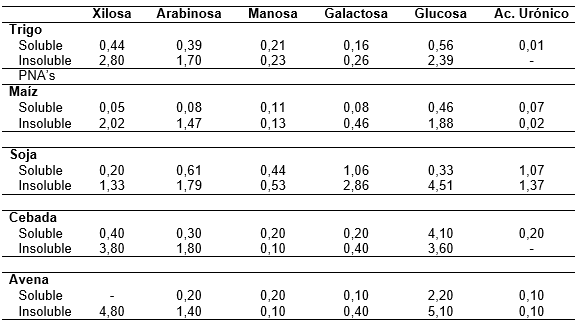
Adaptado de Rostagno et al., 2017.
Van der Klis y Voorst, (1993) también han descrito que la viscosidad de la dieta puede afectar la fisiología y morfología del tracto digestivo, así como microbiota del intestino de pollos de engorde, pues el exceso de nutrientes como proteínas y almidón, no digeridos en el intestino y las condiciones anaeróbicas, favorecen el crecimiento excesivo de bacterias patógenas. Como consecuencia, los nutrientes de la dieta no se digieren adecuadamente, reduciendo su absorción, comprometiendo la salud intestinal y el desempeño de los animales (Choct & Annison, 1992; Choct et al., 1995; Choct et al. 1999).
Los efectos anti-nutricionales causados por los arabinoxilanos también están relacionados con su capacidad de encapsular o atrapar nutrientes como el almidón, proteínas, aminoácidos, calcio, fosforo y zinc, en las células del endospermo, lo que se conoce como “efecto jaula", pues actúa como una barrera física que limita la degradación de estos nutrientes, reduciendo el valor de energía metabolizable aparente (EMA) del alimento (Slominski et al., 1993; Singh & Kim, 2021).
Xilanasa y el desempeño de pollos de engorde
Los efectos benéficos sobre el desempeño de pollos de engorde con la inclusión de la enzima Xilanasa en dietas que contienen granos de cereales, como trigo, cebada y centeno, por ejemplo, han sido ampliamente descritos en la literatura. Chiu-Fung et al. (2013) observaron mejora de 9,85 y 10,09% de la tasa de conversión alimenticia y la ganancia de peso de las aves, respectivamente, en aves de 15 a 42 días suplementadas con la enzima Xilanasa con actividad de 30.000 U/g. Sin embargo, Chiu-Fung et al. (2013) y Zhang et al. (2014) no observaron efectos sobre el consumo de alimento, atribuyendo la mejora en la conversión alimentar a la mayor digestibilidad de los nutrientes observada en las aves suplementadas con la Xilanasa, como afirmado en otros autores (Esmaeilipour et al., 2012; Wang et al., 2021).
En estudio comparativo realizado en una granja en West Java, Indonesia de en pollos de engorde utilizando niveles de la enzima Xilanasa (1.500; 2.250; 3.600 y 6.000 U/g) y control negativo (dieta basal, sin suplementación enzimática), fue observada reducción en la tasa de conversión alimenticia de 5,5; 5,5; 3,4 y 7% con los niveles de la enzima utilizados respectivamente (Grafico 1). El mismo estudio, mostró que el índice de eficiencia productiva de los pollos de engorde obtenido a través de la relación: (peso corporal final x tasa de supervivencia) ÷ (período de alimentación X tasa de conversión alimenticia) x 100, mejoró entorno de 11,5; 7,4; 6,5 y 10,3% con la suplementación enzimática (1.500; 2.250; 3.600 y 6.000 U/g) (Grafico 2).
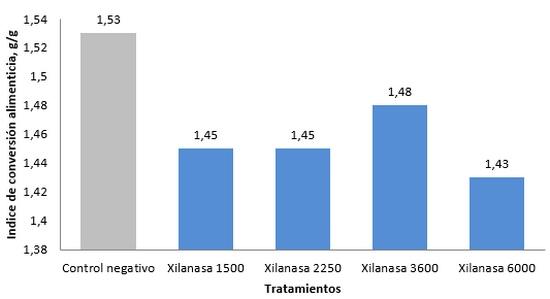
Grafico 1. Índice de conversión alimenticia de pollos de engorde suplementados con la Enzima Xilanasa. Informaciones obtenidas por CJ Cheiljedang.
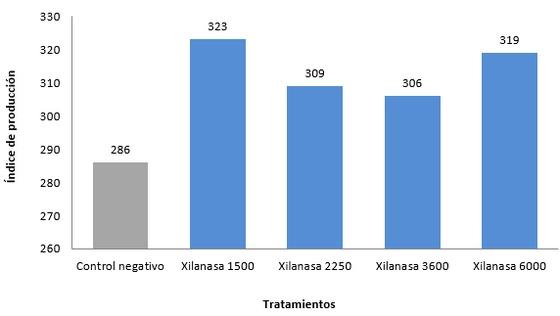
Grafico 2. Índice de producción de pollos de engorde suplementados con la Enzima Xilanasa. Informaciones obtenidas por CJ Cheiljedang.
Un aumento de 9; 11 y 7% en los coeficientes de digestibilidad de la proteína bruta, extracto de éter y EMA, respectivamente con la suplementación con diferentes unidades de la enzima Xilanasa en la dieta de pollos de engorde fueron descritos por Chiu-Fung et al. (2013) y descritos en la tabla 2.
Tabla 2. Efecto de los niveles de Xilanasa sobre los coeficientes de digestibilidad de nutrientes.
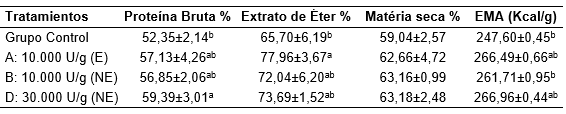
EMA: energía metabolizable aparente (kJ/g)
Adaptado de Chiu-fung et al. (2013).
E: Enzima encapsulada
NE: Enzima no encapsulada
De la misma forma, Zhang et al. (2014) también observaron mayor digestibilidad, principalmente en de la proteína y el almidón a través de la suplementación de la Xilanasa en la dieta de pollos de engorde. Por otro lado, Cowieson y Bedford (2009) relatan que la suplementación con la Xilanasa puede aumentar la digestibilidad ileal aparente de los aminoácidos en 16 y 30%, en dietas a base de trigo y centeno. En dietas a base de maíz y soja, el uso de la Xilanasa también ha demostrado tener beneficios potenciales mejorando la calidad nutricional de la dieta, mejorando la digestibilidad de nutrientes y promoviendo el rendimiento más uniforme de los pollos de engorde (Wyatt & Bedford, 1998; Cowieson & Bedford, 2010; Ward, 2021).
El mecanismo de acción de la Xilanasa se basa en la hidrolisis de los arabinoxilanos, principal componente de los PNA’s presentes en los granos de cereales, responsables por afectar negativamente el rendimiento de los pollos de engorde, debido a sus efectos anti-nutricionales que limitan el aprovechamiento de los nutrientes (Hoeck et al., 2021). La hidrolisis de los arabinoxilanos (solubles e insolubles) por acción de la enzima Xilanasa conduce a la reducción de la viscosidad y la mejora del llamado “efecto jaula”, permitiendo la liberación de nutrientes, dejándolos disponibles para ser digeridos por el animal (Bedford, 2000; Hoeck et al., 2021).
A partir de la hidrolisis de los arabinoxilanos en el intestino delgado ocurre la liberación de xilo-oligosacáridos ramificados (Collins et al., 2005), los cuales actúan como prebióticos, estimulando selectivamente el crecimiento de bacterias gram-positivas beneficiosas como Bifidobacterium y Lactobacillus, mejorando la salud intestinal de las aves (Masey-O′Neill et al., 2014).
Los efectos de la Xilanasa sobre la digestión y el rendimiento de los nutrientes también podrían atribuirse a las propiedades bioquímicas ideales de la Xilanasa, la cual expresa su máxima actividad en un rango de pH de 5 ~ 7 y temperatura entorno de 40 - 43°C. En las aves de corral, el sitio principal de digestión y absorción del alimento es el intestino delgado, donde se proporcionan las características ideales para la actividad de la Xilanasa, y adicionalmente, ocurre la absorción de nutrientes por parte del animal (Ravindran, 2013). Como consecuencia la disminución de los sustratos no digeridos en el intestino delgado, puede contribuir en la reducción de microorganismos fermentativos y microorganismos potencialmente patógenos en el íleo (Raza et al., 2019; Wang et al., 2021).
Xilanasa y salud intestinal en pollos de engorde
El concepto de salud intestinal es complejo y depende de la interacción de varios factores como la dieta, la morfología intestinal y la microbiota, los cuales permiten mantener el funcionamiento adecuado y el equilibrio del trato gastrointestinal (Raza et al., 2019). Un intestino sano es esencial para optimizar la digestibilidad, garantizar un buen desempeño zootécnico de las aves y minimizar la excreción de nutrientes al medio ambiente.
La morfología intestinal es uno de los indicadores más importantes para evaluar la función de digestión y absorción del intestino delgado (Gomide Junior et al., 2004), por ser el principal lugar de absorción de nutrientes. Parámetros como, la altura de las vellosidades intestinales, profundidad de las criptas y la espesura de la mucosa son modificados fácilmente en respuesta a la dieta ofrecida a los animales y condiciones patológicas de los animales, alterando la superficie de absorción, el estado de salud intestinal.
La utilización de ingredientes como el trigo y la cebada, que poseen altas concentraciones de PNA’s, para la formulación de dietas para pollos de engorde, puede tener impacto negativo en la salud intestinal de los animales, llegando a afectar las características morfológicas intestinales de los animales, así como el balance de la microbiota intestinal. Yaghobfar y Kalantar (2017) afirmaron que los PNA’s en la dieta de aves conducen a menor altura de las vellosidades intestinales, asociado a un menor potencial de absorción de nutrientes en el intestino (Saki et al., 2011). Posiblemente, esta reducción en el tamaño de las vellosidades intestinales se debe al aumento de la viscosidad de la digesta por la presencia de los PNA’s. El ambiente viscoso puede inhibir el contacto efectivo entre las vellosidades y los nutrientes, debilitando la estructura y funcionalidad del intestino (Spector, 1976).
La viscosidad de la dieta también puede reducir la movilidad intestinal y disminuir la tensión de oxígeno, estimulando así la colonización de ciertas bacterias patogénicas a nivel intestinal (Hübener et al., 2002; Bedford, 2018). Adicionalmente, la reducción en el recuento de bacterias acido-lácticas y bifidobactérias en el intestino de las aves, también ha sido descrito como un efecto negativo de la presencia de los PNA’s en la dieta de las aves. Estas bacterias están relacionadas con efectos probiótico, capaces de modular el sistema inmunológico innato del animal huésped (Christensen et al., 2002).
Chiu-fung et al. (2013) observaron que la suplementación con Xilanasa en la dieta de pollos de engorde es capaz de aumentar la altura de las vellosidades intestinales, aumentando la superficie de absorción de nutrientes a nivel intestinal (Tabla 3). Este aumento sobre las vellosidades intestinales fue más evidente con el uso de la enzima Xilanasa no encapsulada de 30.000 U/g. De la misma forma, Hoeck et al. (2021) observaron que la adición de la Enzima Xilanasa a la dieta de pollos de engorde fue capaz de aumentar la altura de las vellosidades duodenales entorno de 18% para diferentes dosis de Xilanasa (30.000, 45.000 y 90.000 U/kg de alimento). La altura de las vellosidades del íleon también aumentó entorno de 22% al utilizar 90.000 U de Xilanasa por kg de alimento. Estos efectos sobre la morfología intestinal parecen estar relacionados con la degradación de los arabinoxilanos por acción de la Enzima Xilanasa y la solubiliazación de los PNA’s promoviendo la reducción de la viscosidad de la dieta, aliviando los estos efectos negativos a nivel intestinal en pollos de engorde (Lee et al., 2020).
Tabla 3. Enzima Xilanasa sobre la morfología duodenal en pollos de engorde.
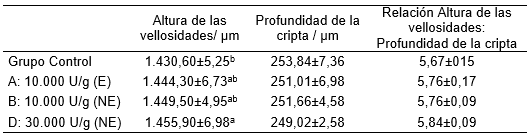
Adaptado de Chiu-fung et al., (2013)
E: Enzima encapsulada.
NE: Enzima no encapsulada.
La hidrólisis de arabinoxilanos también libera xilooligosacáridos, los cuales se fermentan a nivel intestinal estimulando selectivamente el crecimiento de bacterias gram-positivas benéficas, como Bifidobacterium y Lactobacillus, favoreciendo el aumento la fermentabilidad de la fibra dietética a nivel cecal (Masey-O′Neill et al., 2014; Wang et al., 2021). El aumento en la producción de AGCC (acetato, propionato y butirato) en el ciego genera impacto positivo en salud intestinal en pollos de engorde, no solo por el aporte energético al animal, sino porque desempeñan un papel clave en el desarrollo de la microbiota en el ciego, principalmente, sobre la población de lactobacilos (Van der Wielen et al., 2000).
Debido a sus efectos probióticos de Lactobacillus a nivel intestinal, el mayor desarrollo de estas bacterias ha sido relacionado con la exclusión competitiva de las bacterias patógenas como Salmonella y Campylobacter, microorganismos potencialmente patógenos para las aves de corral (Roberts et al., 2015; Wealleans et al., 2017; Gao et al., 2017; Raza et al., 2019), además de mayor altura de las vellosidades de mucosa en el íleon de los pollos de engorde (Wang et al., 2021) y en gallinas ponedoras (Dai et al., 2020).
Conclusión
Las dietas de aves de corral con alto contenido de PNA’s aumentan la viscosidad intestinal, dificultan la digestibilidad de los nutrientes y tienen efectos nocivos sobre la salud y el rendimiento de las aves. De esta forma, la utilización de enzimas exógenas como la Xilanasa ayudan en la digestión de amplia gama de fibras dietéticas, incluyendo los arabinoxilanos, contribuyendo en la reducción de la viscosidad intestinal y liberación de nutrientes, haciéndolos disponibles para el animal, mejorando parámetros de desempeño e influyendo positivamente sobre la salud intestinal.
Referencias
- Alqaisi, O.; Ndambi, O.A.; Hemme, T. Global view on feed cost and feed efficiency on dairy farms. All About Feed. 2:4. 2011.
- Bedford, M.R. Exogenous enzymes in monogastric nutrition-their current value and future benefits. Anim Feed Sci Technol.;86:1–13, 2000.
- Bedford, M.R.; Schulze, H. Exogenous enzymes for pigs and poultry. Nutr. Res. Rev. 11, 91–114, 1998.
- Choct, M. Feed Non-Starch Polysaccharides: Chemical Structures and Nutritional Significance. Feed Milling International, 6:13-26, 1997.
- Choct, M.; Annison, G. Anti-Nutritive Effect of Wheat Pentosans in Broiler Chickens: Roles of Viscosity and Gut Microflora. British Poultry Science, 33: 821-834. 1992.
- Choct, M.; Hughes, R. J.; Wang, J.; Bedford, M. R.; Morgan, A. J.; Annison, G. Feed enzymes eliminate the anti-nutritive effect of non-starch polysaccharides and modify the fermentation in broilers. Proc. 7th Austr. Poult. Sci. Symp., p. 121-125, 1995.
- Choct, M.; Kocher, A.; Water, D.L.E.; Pettersson, D.; Ross, G. A comparison of three xylanases on the nutritive value of two wheats for broiler chickens. Br J Nutr, 92:53–61, 2004.
- Choct, M.; Hughes, R.J.; Bedford, M.R. Effects of a xylanase on individual bird variation, starch digestion throughout the intestine, and ileal and caecal volatile fatty acid production in chickens fed wheat. Br Poult Sci. 40:419–422, 1999.
- Choct, M.; Kocher, A.; Waters, D.L.E.; Pettersson, D.; Ross, G. A comparison of three xylanases on the nutritive value of two wheats for broiler chickens. Br J Nutr. 92:53–61. 2004.
- Chiu-fung, L.; Xue, M.C.; Chung, W.; Man, C.; Hang, C.; Wah, L. K. Effect of different levels of xylanase on the growth performance and development of the immune and digestive organs in chicken. Chin. J. Clin. Nutr, 11:018.1006-267x, 2013.
- Christensen, H.R.; Frokiaer, H.; Pestka, J.J. Lactobacilli differentially modulate expression of cytokines and maturation surface markers in murine dendritic cells. J Immunol, 168: 171–178, 2002.
- Collins, T.; Gerday, C.; Feller, G. Xylanases, xylanase families and extremophilic xylanases. FEMS Microbiol. Rev. 29: 3–23, 2005.
- Cowieson, A.J.; Bedford, M.R. The effect of phytase and carbohydrase on ileal amino acid digestibility in monogastric diets: complementary mode of action? World’s Poult. Sci. J., 65:609-624., 2009.
- Cowieson, A.J.; Bedford, M.R.; Ravindran, V. Interactions between xylanase and glucanase in maize-soy-based diets for broilers. Br Poult Sci, 51:246–57, 2010.
- Dai, D.; Wu, S.; Zhang, H.; Qi, G.; Wang, J. Dynamic alterations in early intestinal development, microbiota and metabolome induced by in ovo feeding of L-arginine in a layer chick model. J. Anim. Sci. Biotechnol, 11:19. 2020.
- Esmaeilipour, O.; Moravej, H.; Shivazad, M.; Rezaian, M.; Aminzadeh, S.; Van Krimpen, M.M. Effects of diet acidification and xylanase supplementation on performance, nutrient digestibility, duodenal histology and gut microflora of broilers fed wheat based diet. Br Poult Sci, 53:235–24, 2012.
- Gao, F.; Jiang, Y.; Zhou, G.H.; Han, Z.K. The effects of xylanase supplementation on performance, characteristics of the gastrointestinal tract, blood parameters and gut microflora in broilers fed on wheat-based diets. Anim Feed Sci Technol, 142:173–184, 2008.
- Gao, P.; Ma, C.; Sun, Z.; Wang, L.; Huang, S.; Su, X.; XU., J.; Zhang, L. Feed-additive probiotics accelerate yet antibiotics delay intestinal microbiota maturation in broiler chicken. Microbiome, 5:91, 2017.
- Gomide Junior, M.H.; Sterzo, E. V.; Macari, M.; Boleli, I.C. Use of scanning electron microscopy for the evaluation of intestinal epithelium integrity. R. Bras. Zootec. 33:6, 2004.
- Hoeck, V.V.; Wu, D.; Somers, I.; Wealleans, A.; Vasanthakumara, B.L.; Sanchez, A.L.G.; Morisset, D. Xylanase impact beyond performance: A prebiotic approach in broiler chickens. J Appl Poult Res, 30:4, 2021.
- Hu, H; Dai, S.; Wen, A, Bai, X. Efficient Expression of Xylanase by Codon Optimization and Its Effects on the Growth Performance and Carcass Characteristics of Broiler. Animal, 9:65, 2019.
- Hübener, K., Vahjen, W., and Simon, O. Bacterial responses to different dietary cereal types and xylanase supplementation in the intestine of broiler chicken. Arch. Anim. Nutr, 56: 167–187, 2002.
- Lee, S.H.; Hosseindoust, A.; Laxman Ingale, S.; Rathi, P. C.; Yoon, S. Y.; Choi, J.W. Thermostable xylanase derived from Trichoderma citrinoviride increases growth performance and non-starch polysaccharide degradation in broiler chickens. Br. Poult. Sci. 6: 57–62, 2020.
- Lji, P. A.; Saki, A.; Tivey, D.R. Body and intestinal growth of broiler chicks on a commercial starter diet. 1. Intestinal weight and mucosal development. Br. Poult. Sci. 42: 505–513. 2001.
- Masey-O Neill, H.V.; Singh, M.; Cowieson, A.J. Effects of exogenous xylanase on performance, nutrient digestibility, volatile fatty acid production and digestive tract thermal profiles of broilers fed on wheat-or maize-based diet. Br. Poult. Sci., 55:351-359, 2014.
- Moftakharzadeh, S.A.; Janmohammadi, H.; Taghizadeh, A. Kianfar R, Olyayee, M. Effect of enzyme addition on energy utilization and performance of broiler chickens fed wheat-based diet with different metabolizable energy levels. Acta Scientiarum. Animal Sciences, 41: e44585, 2019.
- Mohammed, A.A.; Habib, A.B.; Eltrefi, A.M.; Shulukh, E.S.A.; Abubaker, A.A. Effect of different levels of multi-enzymes (Natuzyme Plus®) on growth performance, carcass traits and meat quality of broiler chicken. Asian J. Anim. Vet. Adv. 13: 61–66. 2017.
- Olgun, O.; Altay, Y.; Yildiz, A.O. Effects of carbohydrase enzyme supplementation on performance, eggshell quality, and bone parameters of laying hens fed on maize-and wheat-based diets. Br. Poult. Sci. 59: 211–217, 2018.
- Petry, A,L.; Patience, J.F.; Koester, L.R.; Huntley, N.F.; Bedford, M.R.; Schmitz-Esser, Stephan. Xylanase modulates the microbiota of ileal mucosa and digesta of pigs fed corn-based arabinoxylans likely through both a stimbiotic and prebiotic mechanism. PLOS ONE, 16: e0246144, 2021.
- Ravindran. V. Feed enzymes: the science, practice, and metabolic realities. J. Appl. Poult. Res., 22: 628-636, 2013.
- Raza, A.; Bashir, S.; Tabassum, R. An update on carbohydrases: growth performance and intestinal health of poultry. Heliyon 5:e1437. 2019.
- Roberts, T.; Wilson, J.; Guthrie, A.; Cookson, K; Vancraenest, K.; Schaeffer, J.; Moody, R.; Clark, S. New issues and science in broiler chicken intestinal health: Emerging technology and alternative interventions. J. Appl. Poult. Es, 24: 257-266, 2015.
- Rostagno, H.S.; Albino, L.F.T.; Donzele, J.L.; Gomes, P.C.; Oliveira, R.F.; Lopes, D. C.; Ferreira, A.S.; Barreto, S.L.; Euclides, R.F. Tabelas brasileiras para aves e suínos: composição de alimentos e exigências nutricionais. 3.ed. Viçosa, MG: Universidade Federal de Viçosa, 2011. 254p.
- Rostagno, H.S.; Albino, L.F.T.; Hannas, M.I.; Donzele, J.L.; Sakomura, N.K.; Peazzo, F.G. Saraiva, A.; Texeira, M.L.; Rodrigues, P.B.; Oliveira, R.F.; Barreto, S.L.T.; Brito, C.O. Tabelas brasileiras para aves e suínos. 4.ed. Viçosa, MG: Universidade Federal de Viçosa, 2017. 488p.
- Saki, A.A.; Hematti Matin, H.R.; Zamani, P., Tabatabai, M.M.; Vatanchian, M. Various ratios of pectin to cellulose affect intestinal morphology, DNA quantitation, and performance of broiler chickens. Journal of Livestock Science, 139:237-244, 2011.
- Stefanello, C.; Vieira, S.L.; Rios, H.V.; Simões, C.T.; Sorbara O.B. Energy and nutrient utilization of broilers fed soybean meal from two different Brazilian production areas with an exogenous protease. Animal Feed Science and Technology, 221:267-273, 2016.
- Singh, A.K.; Kim, W.K. Effects of dietary fiber on nutrients utilization and gut health of poultry: a review of challenges and opportunities. Animals, 11:181, 2021.
- Slominski, B.A.; Guenter, W.; L.D. Campbell. New approach to water-soluble carbohydrate evaluation of plant cell wall degrading enzymes. J. Agric. Food Chem. 41:2304–2308, 1993.
- Sklan, D. Development of the digestive tract of poultry. Worlds Poult Sci J ., 57: 415-428, 2001.
- Spector, M.D. Small intestinal mass of the rat is partially determined by indirect effects of intraluminal nutrition, 52:3-5, 1976.
- Tanabe, H.; Ito, H.; Sugiyama, K.; Kiriyama, S.; Morita, T. Dietary indigestible components exert different regional effects on luminal mucin secretion through their bulk-forming property and fermentability. Biosci. Biotechnol. Biochem, 70: 1188-1194, 2006.
- Van Der Wielen, P.W.J.J.; Biesterveld, S.; Notermans, S.; Hofstra, H.; Urlings, F. van Knapen, B.A.P.; Role of volatile fatty acids in development of the cecal microflora in broiler chickens during growth. Appl. Environ. Microbiol. 2536- 2540, 2000.
- Van Der Klis, J.D.; Voorst, A. V. The Effect of Carboxy Methyl Cellulose (A Soluble Polysaccharide) on the Rate of Marker Excretion from the Gastrointestinal Tract of Broilers. Spelderhol Centre for Poultry Research and Information Services, Agricultural. Research Department (DLO-NL), 7360 AA, 1993.
- Vandeplas, S.; Dauphin, R.D.; Thonart, P.; Théwis, A.; Beckers, Y. Effect of the bacterial or fungal origin of exogenous xylanases supplemented to a wheat-based diet on performance of broiler chickens and nutrient digestibility of the diet. Can J Anim Sci 90:221–228, 2010.
- Valdivia, L.A.; Matos, M.M.; Rodriguez, Z.; Perez, Y.; Rubio, Y.; Vega, J. Enzymatic additives and their use on animal rearing. Cuba. J. Agric. Sci., 53:4, 2019.
- Wang, J.; Sujie Liu, S.; Ma, J. Piao, X. Changes in Growth Performance and Ileal Microbiota Composition by Xylanase Supplementation in Broilers Fed Wheat-Based Diets. Front. Microbiol, 15, 2021.
- Wealleans, A.L.; Walsh, M.C.; Romero, L.F.; Ravindran, V. Comparative effects of two multi-enzyme combinations and a Bacillus probiotic on growth performance, digestibility of energy and nutrients, disappearance of non-starch polysaccharides, and gut microflora in broiler chickens. Poult. Sci., 96:4287-4297, 2017.
- Wyatt, C.L.; Bedford, M.R. Uso de enzimas nutricionais para maximizar a utilização de nutrientes pelo frango de corte em dietas à base de milho: recentes progressos no desenvolvimento e aplicação prática. In: SEMINÁRIO TÉCNICO FINNFEEDS, 1998, Curitiba. Anais... Curitiba: Finnfeeds, 1998. p.2-12.
- Ward, N.E. Debranching enzymes in corn/soybean meal–based poultry feeds: a review. Poult. Sci. pp. 1-11, 2021.
- Yang, K.; Pinker, R.T.; Ma, Y.; Koike, T.; Wonsick, M.M.; Cox, S.J.; Zhang, Y.C.; Stackhouse, P. Evaluation of satellite estimates of downward shortwave radiation over the Tibetan Plateau. J. Geophys. Res., 113: D17204, 2008.
- Yaghobfar, A.I.; Kalantar, M.I.I. Effect of Non–Starch Polysaccharide (NSP) of Wheat and Barley Supplemented with Exogenous Enzyme Blend on Growth Performance, Gut Microbial, Pancreatic Enzyme Activities, Expression of Glucose Transporter (SGLT1) and Mucin Producer (MUC2) Genes of Broiler Chickens. Revista Brasileira de Ciência Avícola, 19: 629-638, 2017.
- Zhang, L.; Xu, J.; Lei, L.; Jiang, Y.; Gao, F.; Zhou, G.H. Effects of xylanase supplementation on growth performance, nutrient digestibility and non-starch polysaccharide degradation in different sections of the gastrointestinal tract of broilers fed wheat-based diets. Asian Australas. J. Anim. Sci. 27:855–861, 2014.
Temas relacionados:
Autores:
CJ Bio
CJ Bio
Fenchem Inc.
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.







.jpg&w=3840&q=75)