Bronquitis infecciosa en gallinas ponedoras
Caracterización molecular del virus de bronquitis infecciosa aviar en granjas de gallinas ponedoras de la provincia de Tungurahua, Ecuador
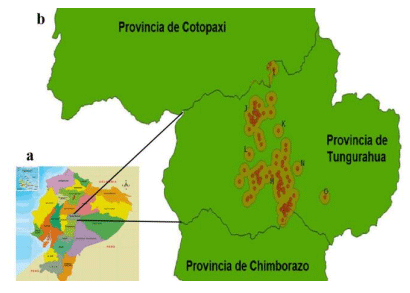
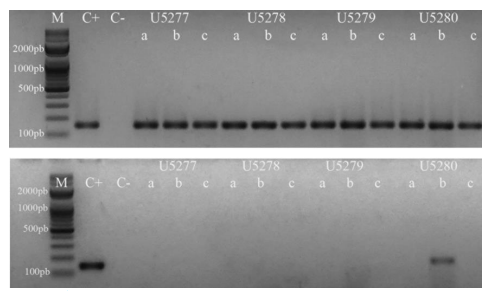
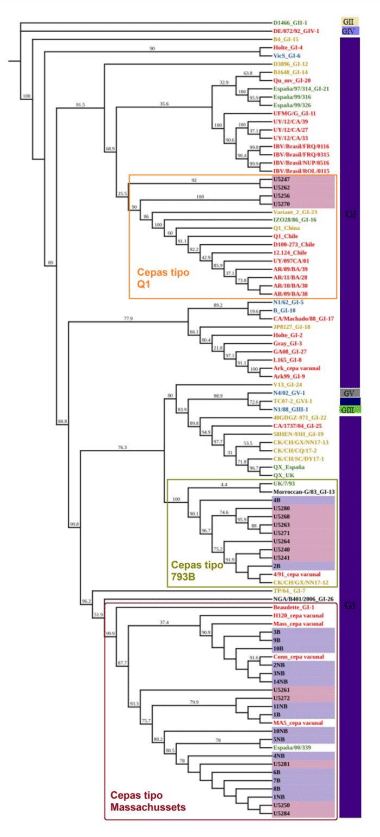
La bronquitis infecciosa aviar genera importantes pérdidas económicas y, si bien la vacunación disminuye dichas mermas, el surgimiento continuo de nuevas cepas virales complica el control de la infección. El objetivo de esta investigación fue caracterizar, mediante técnicas moleculares, las cepas del virus de la bronquitis infecciosa aviar circulantes en explotaciones de gallinas ponedoras de la provincia de Tungurahua, Ecuador. Se trabajó con muestras de hisopados y de órganos de 47 granjas y las secuencias obtenidas fueron comparadas con las correspondientes a 17 vacunas a virus vivo empleadas en la zona. Se encontraron 16 granjas positivas al amplificar la región 5’UTR y un segmento de S1. La construcción de un árbol filogenético mostró que cinco de las secuencias se ubicaron en el mismo clado de las cepas de tipo Massachusetts, linaje GI-1; siete se encontraron en el clado del linaje GI-13 o cepas tipo 793B y cuatro secuencias se agruparon en un clado de cepas tipo Q1, linaje G1-16. Si bien se requieren estudios moleculares más completos en los que se amplifique la totalidad del gen S a fin de obtener datos más concluyentes, se logró determinar que existen tres tipos de cepas circulando en la provincia de Tungurahua, dos posiblemente vacunales y otra de origen desconocido.
Palabras clave: Virus de bronquitis infecciosa aviar, gallinas ponedoras, aislamientos, filogenia, vacunas.
Materiales y métodos
Técnicas moleculares

PCR para un segmento del gen codificante de la proteína S1 del IBV
Análisis filogenético
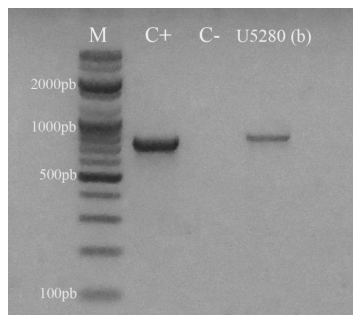
Resultados

Discusión y conclusiones
Agradecimientos
Declaración de conflicto de intereses: Todos los autores declaran que no existe conflicto de intereses, incluyendo las relaciones financieras, personales o de otro tipo que pudieran influir en el trabajo.
- Abro S. 2013. Molecular Characterization and Detection of Infectious Bronchitis Virus. Doctoral Thesis, Faculty of Veterinary Medicine and Animal Science, Swedish University of Agricultural Sciences. http://pub.epsilon.slu.se/9299/1/abro_s_121210.pdf
- Acevedo-Beiras A. 2010. Bronquitis infecciosa aviar: diagnóstico y control. REDVET (Revista Electrónica de Veterinaria).11(3):1-23. https://redalyc.org/pdf/636/63613123019.pdf
- Acevedo-Beiras A. 2017. Virus de la bronquitis infecciosa: un desafío para la avicultura. Revista de Salud Animal. 39(3):1-12. http://scielo.sld.cu/pdf/rsa/v39n3/rsa07317.pdf
- Agencia Ecuatoriana de Aseguramiento de la Calidad del Agro (AGROCALIDAD). 2013. Programa Nacional Sanitario Avícola. Dirección de Sanidad Animal: Programas Específicos. [En línea] Disponible en: https://oie.int/fileadmin/Home/eng/Animal_Health_in_the_World/docs/pdf/Sel f-declarations/Annexes/ANEXO_3.pdf [Consultado 03-02-2019].
- Agencia Ecuatoriana de Aseguramiento de la Calidad del Agro (AGROCALIDAD). 2021. Listado de cepas vacunales registradas ante la Agencia. [En línea] Disponible en: https://bing.com/ck/a?!&&p=40f9f82db4f7f61cc32c7209a24ac7d87d1847334c792 b2e0c96cb5ac6c5a12cJmltdHM9MTY1NTEyMjQzNiZpZ3VpZD0xMmRlN2UzNS0 0MjZhLTQ1MTctOGUzZS1kZDBiZDBlMmE0ZjUmaW5zaWQ9NTEyOQ&ptn=3&fc lid=4c018656-eb12-11ec-b00d80843e13383e&u=a1aHR0cHM6Ly93d3cuYWdyb2NhbGlkYWQuZ29iLmVjL3dwL WNvbnRlbnQvdXBsb2Fkcy8yMDIxLzA3L0xpc3RhZG9fQ2VwYXNfUmVnaXN0cm FkYXNfQWdyb2NhbGlkYWQueGxzeA&ntb=1[Consultado 12-04-2022].
- Aillón M. 2012. Propuesta e implementación de un proyecto comunitario que se dedicará a la crianza, producción y comercialización avícola en la parroquia de Ascázubi. Tesis para la obtención del título de Ingeniera en Contabilidad y Auditoría. Carrera de Contabilidad y Auditoría, Universidad Central del Ecuador. http://dspace.uce.edu.ec/bistream/2500/1473/1/t-uce-003-272.pdf
- Alexander D, Senne D. Newcastle Disease, Other Avian Paramyxoviruses, and Pneumovirus Infections. En: Saif, YM., Fadly, AM., Glisson, JR., McDougald, LR., Nolan LK. 2008. Diseases of poultry. 12th. ed. Iowa, State University Press. pp. 75- 116.
- Bermudez A. 2008. Introduction. En: Saif YM, Fadly AM., Glisson JR, McDougald LR, Nolan LK. 2008. Diseases of poultry. 12th. ed. Iowa, State University Press. pp. 3- 46.
- Callison SA, Hilt DA, Boynton TO, Sample BF, Robison R, Swayne DE, Jackwood MW. 2006. Development and evaluation of a real-time Taqman RT-PCR assay for the detection of infectious bronchitis virus from infected chickens. Journal of Virological Methods. 138(1-2):60-65. https://doi.org/0.1016/j.jviromet.2006.0 7.018
- Cavanagh D, Gelb J. Infectious Bronchitis. En: Saif YM, Fadly AM, Glisson JR, McDougald LR, Nolan LK. 2008. Diseases of poultry. 12th. ed. Iowa, State University Press. pp. 117-135.
- Corporación Nacional de Avicultores del Ecuador (CONAVE). 2020a. Cada año en Ecuador aumenta consumo de pollo y huevos. Maíz y Soya. [En línea] Disponible en: http://maizysoya.com/lector.php?id=20200548&tabla=articulos. [Consultado 05-06-2021].
- Corporación Nacional de Avicultores del Ecuador (CONAVE). 2020b. Importancia de la producción avícola en el contexto nacional. Maíz y Soya. [En línea] Disponible en: http://maizysoya.com/lector.php?id=20200585. [Consultado 05-06-2021].
- de Wit JJ, Cook JK, van der Heijden H. 2011. Infectious bronchitis virus variants: A review of the history, current situation, and control measures. Avian Pathology. 40(3):223-35. https://doi.org/10.1080/03079457.2011.566260
- de Wit JJ, Dijkman R, Guerrero P, Calvo J, Gonzalez A, Hidalgo H. 2017. Variability in biological behaviour, pathogenicity, protectotype and induction of virus neutralizing antibodies by different vaccination programmes to infectious bronchitis virus genotype Q1 strains from Chile. Avian Pathology. 46(6):666-75. https://doi.org/10.1080/03079457.2017.1346782
- Dolz R, Pujols J, Ordoñez G, Porta R, Majo N. 2008. Molecular epidemiology and evolution of avian infectious bronchitis virus in Spain over a fourteen-year period. Virology. 374(1):50-9. https://doi.org/10.1016/j.virol.2007.12.020
- Eldemery F, Li Y, Yu Q, Van Santen VL, Toro H. 2017. Infectious bronchitis virus does not protect against ark-type challenge. Avian Diseases. 61(3):397-401. https://doi.org/10.1637/11632-032017-ResNoteR
- Farrell D. 2013. Función de las aves de corral en la nutrición humana. [En línea] Disponible en: http://fao.org/3/a-al714s.pdf. [Consultado 12-03-2019].
- Farsang A, Ros C, Renström LHM, Baule C, Soós T, Belák S. 2002. Molecular epizootiology of infectious bronchitis virus in Sweden indicating the involvement of a vaccine strain. Avian Pathology. 31(3):229-36. https://doi.org/10.1080/030 79450220136530
- Feng K, Wang F, Xue Y, Zhou Q, Chen F, Bi Y, Xie Q. 2017. Epidemiology and characterization of avian infectious bronchitis virus strains circulating in southern China during the period from 2013-2015. Scientific Reports. 7(1):1-11. https:// doi.org/10.1038/s41598-017-06987-2
- García W. 2016. Detección de bronquitis infecciosa aviar mediante diagnóstico molecular en aves de traspatio. Tesis para obtener el título de Médico Veterinario y Zootecnista, Facultad de Medicina Veterinaria y Zootecnia, Universidad Central del Ecuador. http://www.dspace.uce.edu.ec/handle/25000/11984
- Hernandez S, Villegas P, Prieto F, Unda JC, Stedman N, Ritchie B, Carroll R, HernandezDivers SJ. 2006. A survey of selected avian pathogens of backyard poultry in northwestern Ecuador. Journal of Avian Medicine and Surgery. 20(3):147-58. https://doi.org/10.1647/2005-015R.1
- Hoang DT, Chernomor O, von Haeseler A, Quang Minh B, Sy Vinh L. 2017. UFBoot2: Improving the ultrafast bootstrap approximation. Molecular Biology Evolution. 35(2):518-22. https://doi.org/10.1093/molbev/msx281
- Instituto Nacional de Estadística y Censos (INEC). 2015. Aves planteles avícolas_nac2015. Encuesta de Superficie y Producción Agropecuaria Continua (ESPAC) 2015. [En línea]. Disponible en: https://anda.inec.gob.ec/anda/index.php/catalog/750/download/14283 [Consultado 02-03-2018].
- International Committee on Taxonomy of Viruses (ICTV). Changes to virus taxonomy and the Statutes ratified by the International Committee on Taxonomy of Viruses (2020). Archives of Virology. 2020 ;165(11):2737-48. PMID:32816125.
- Jackwood M. 2012. Review of infectious bronchitis virus around the world. Avian Diseases Digest. 56(4):634-41. https://doi.org/10.1637/10360-1022712-digest. 1
- Kalyaanamoorthy S, Minh BQ, Wong TKF, von Haeseler A, Jermiin LS. 2017. ModelFinder: Fast model selection for accurate phylogenetic estimates. Nature Methods. 14(6):587-9. https://doi.org/10.1038/nmeth.4285
- Liu S, Zhang X, Wang Y, Li C, Han Z, Shao Y, Li H, Kong X. 2009a. Molecular characterization and pathogenicity of infectious bronchitis coronaviruses: Complicated evolution and epidemiology in China caused by cocirculation of multiple types of infectious bronchitis coronaviruses. Intervirology. 52(4):223-34. https://doi.org/10.1159/000227134
- Liu S, Zhang X, Wang Y, Li C, Liu Q, Han Z, Zhang Q, Kong X, Tong G. 2009b. Evaluation of the protection conferred by commercial vaccines and attenuated heterologous isolates in China against the CK/CH/LDL/97I strain of infectious bronchitis coronavirus. Veterinary Journal. 179(1):130-6. https://doi.org/10.1016/j.tvjl.2007.08.018
- Marandino A. 2013. Diagnóstico y caracterización genética del virus de la bronquitis infecciosa aviar en la industria avícola regional. Tesis de Maestría PEDECIBA Biología. Sub área genética, Universidad de la República del Uruguay. https://www.colibri.udelar.edu.uy/jspui/bitstream/20.500.12008/4029/1/uy24- 16716.pdf
- Marandino A, Pereda A, Tomas G, Hernandez M, Iraola G, Craig MI, Hernandez D, Banda A, Villegas P, Panzera Y, Perez R. 2015. Phylodynamic analysis of avian infectious bronchitis virus in South America. Journal of General Virology. 96(6):1340-6. https://doi.org/10.1099/vir.0.000077
- Ministerio de Agricultura y Ganadería (MAG). 2021. Ecuador celebra el día nacional del huevo. [En línea] Disponible en: http://agricultura.gob.ec/ecuador-celebra-el-dia-nacional-del-huevo/
- Montassier HJ. 2010. Molecular epidemiology and evolution of avian infectious bronchitis virus. Revista Brasileira de Ciencia Avícola. 12(2):87-96. https://doi.org/10.1590/S1516-635X2010000200003
- Nguyen LT, Schmidt HA, von Haeseler A, Minh BQ. 2015. IQ-TREE: A fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies. Molecular Biology and Evolution. 32(1):268-74. https://doi.org/10.1093/molbev/msu300
- Organización Mundial de Sanidad Animal (OIE). 2018. Avian infectious bronchitis. [En línea] Disponible en: https://oie.int/fileadmin/Home/eng/Health_standards/tahm/2.03.02_AIB.pdf [Consultado 28-06-2020].
- Picault J, Drouin P, Lamandé J, Allée C, Toux J, le Coq H, Guittet M, Bennejean G. 1995. L’epizootie recente de bronchite infectieuse aviaire en France. Proceedings of the 1eres Journée de la Recherche Avicole. 177-9. https://journees-de-larecherche.org/JRA/Contenu/Archives/1_JRA/53epizootieJRA1.pdf
- Quinteros J A, Lee SW, Markham PF, Noormohammadi AH, Hartley CA, Legione AR, Coppo MJC, Vaz PK, Browning GF. 2016. Full genome analysis of Australian infectious bronchitis viruses suggests frequent recombination events between vaccine strains and multiple phylogenetically distant avian coronaviruses of unknown origin. Veterinary Microbiology. 197:27-38. https://doi.org/10.1016/j.vetmic.2016.11.003
- Rafique S, Siddique N, Abbas MA, Shah AA, Sharif A, Naeem K. 2018. Isolation and molecular characterization of infectious bronchitis virus (IBV) variants circulating in commercial poultry in Pakistan. Pakistan Veterinary Journal. 38(4):365-70. https://doi.org/10.29261/pakvetj/2018.071
- Shang J, Zheng Y, Yang Y, Liu C, Geng Q, Luo C, Zhang W, Li F. 2018. Cryo-EM structure of infectious bronchitis coronavirus spike protein reveals structural and functional evolution of coronavirus spike proteins. PLoS Pathogens. 14(4):1-19. https://doi.org/10.1371/journal.ppat.1007009
- Soos C, Padilla L, Iglesias A, Gottdenker N, Bedon M, Rios A, Parker P. 2008. Comparison of pathogens in broiler and backyard chickens on the Galápagos Islands: Implications for transmission to wildlife. The Auk. 125(2):445-55. https://doi.org/10.1525/auk.2008.06235
- Valastro V, Holmes EC, Britton P, Fusaro A, Jackwood MW, Cattoli G, Monne I. 2016. S1 gene-based phylogeny of infectious bronchitis virus: An attempt to harmonize virus classification. Infection, Genetics and Evolution. 39:349-64. https://doi.or g/10.1016/j.meegid.2016.02.015.
- Yu L, Jiang Y, Low S, Wang Z, Nam J, Liu W, Kwang J. 2001. Characterization of three infectious bronchitis virus isolates from China associated with proventriculus in vaccinated chickens. Avian Diseases. 45(2):416-24. https://doi.org/10.2307/1592981.









