Epidemiología molecular del Virus de la influenza aviar A H5NX
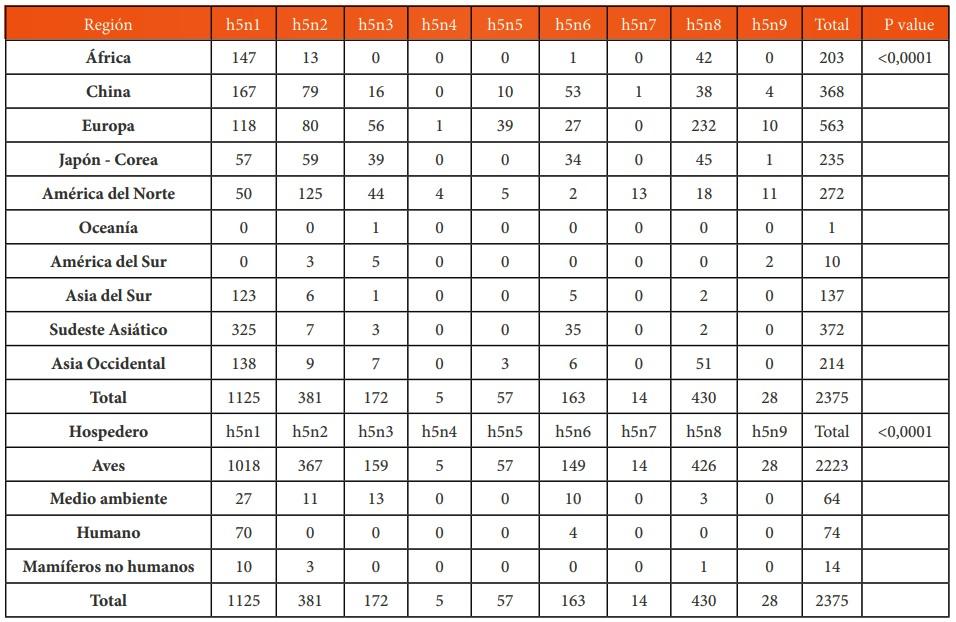
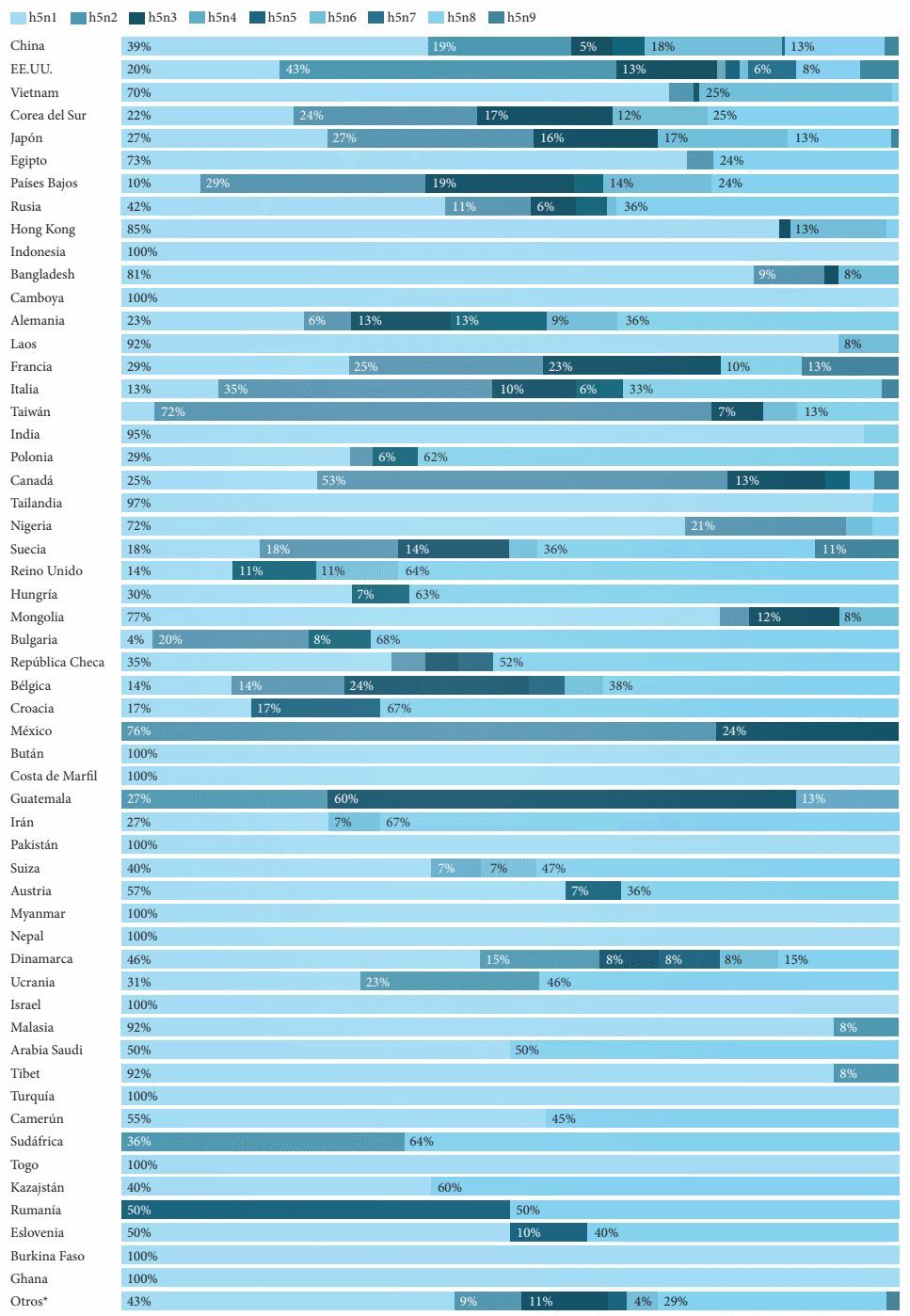
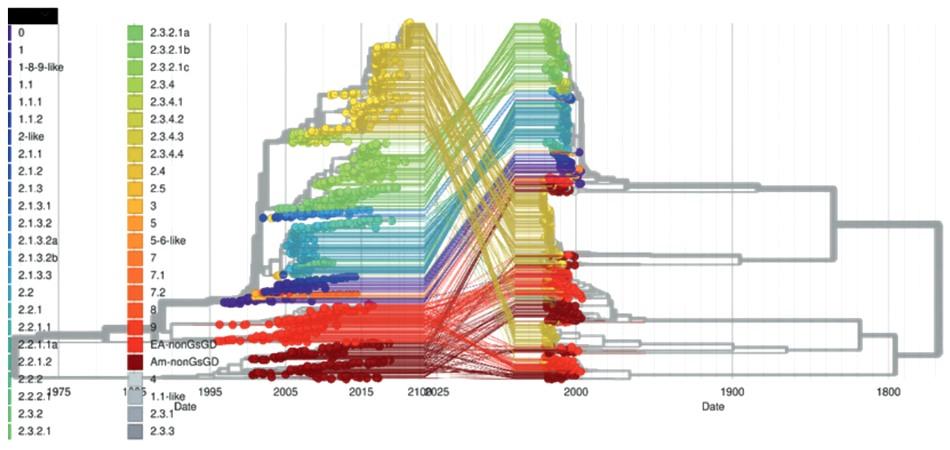
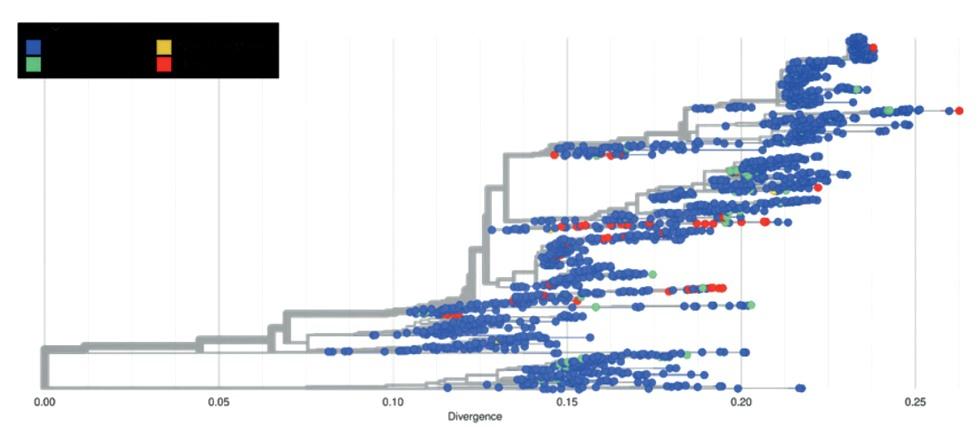
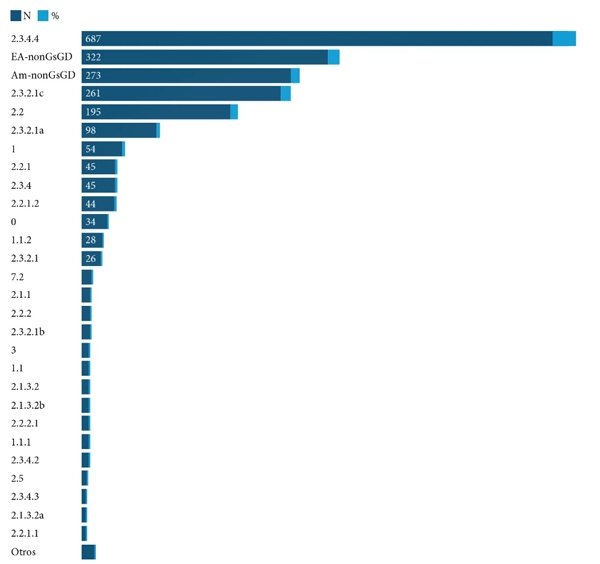
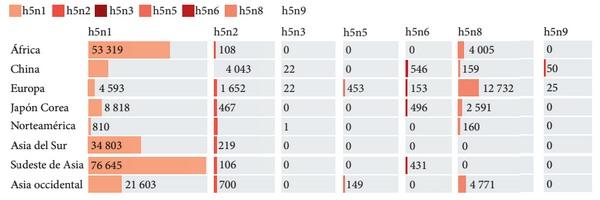
Introducción: El virus de la influenza aviar altamente patógena (H5N1) representa una amenaza para la salud animal y la salud pública, y se requiere una detección rápida específica para controlar rápidamente la enfermedad. Objetivo: Describir la epidemiología molecular del Virus de la influenza aviar A H5NX con la herramienta Nextstrain. Métodos: El presente es un estudio retrospectivo de corte transversal. Se analizaron las bases de datos públicas procedentes de Global Influenza Surveillance and Response System (GISRS) y GISAID Initiative (https:// http://www.gisaid.org/). Se seleccionaron los datos de influenza aviar altamente patógena A(H5N1) de la herramienta de visualización Nextstrain (https://nextstrain.org/flu/avian/h5n1/ha?lang=es). Esta es la versión de Nextstrain para los subtipos de influenza aviar A / H5NX. Resultados: Se analizaron 4378 secuencias de AH5NX, de los cuales se encontraron los subtipos más prevalentes en las siguientes regiones: África (h5n1), China (h5n1), Europa (h5n8), Japón – Corea (h5n1), América del Norte (h5n2), Oceanía (h5n2), Sudamérica (h5n3), Asia del Sur (h5n1), Sudeste de Asia (h5n1), Asia Occidental (h5n1). La mayor prevalencia en todos los hospederos (Aviar, Medio ambiente, Humano, Mamíferos no humanos) fue h5n1. Los clados más representativos fueron: 2.3.4.4 (17 %); 2.3.2.1c (14 %); 2,2 (13 %); EA-nonGsGD (9 %) y Am-nonGsGD (8 %). Conclusión: Existe una alta prevalencia de a/h5nx en el mundo, con posibilidad de infectar otras regiones.

- Moncla LH, Bedford T, Dussart P, Horm SV, Rith S, Buchy P, et al. Quantifying within-host diversity of H5N1 influenza viruses in humans and poultry in Cambodia. PLOS Pathog [Internet]. 2020 [citado el 9 de agosto de 2021];16(1):e1008191. Disponible en: https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1008191
- Gronsang D, Bui AN, Trinh DQ, Bui VN, Nguyen K V., Can MX, et al. Characterization of cross-clade monoclonal antibodies against H5N1 highly pathogenic avian influenza virus and their application to the antigenic analysis of diverse H5 subtype viruses. Arch Virol [Internet]. el 1 de agosto de 2017 [citado el 9 de agosto de 2021];162(8):2257–69. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28405766/
- Lewis NS, Banyard AC, Whittard E, Karibayev T, Kafagi T Al, Chvala I, et al. Emergence and spread of novel H5N8, H5N5 and H5N1 clade 2.3.4.4 highly pathogenic avian influenza in 2020. https://doi.org/101080/2222175120211872355 [Internet]. 2021 [citado el 9 de agosto de 2021];10(1):148–51. Disponible en: https://www.tandfonline.com/doi/abs/10.1080/22221751.2021.1872355
- Iwami S, Takeuchi Y, Liu X. Avian flu pandemic: Can we prevent it? J Theor Biol. el 7 de marzo de 2009;257(1):181–90.
- Webster R, Hulse D. Controlling avian flu at the source [Internet]. Vol. 435, Nature. Nature Publishing Group; 2005 [citado el 18 de septiembre de 2021]. p. 415–6. Disponible en: https://www.nature.com/articles/435415a
- Padmawati S, Nichter M. Community response to avian flu in Central Java, Indonesia. Anthropol Med [Internet]. abril de 2008 [citado el 18 de septiembre de 2021];15(1):31–51. Disponible en: https://www.tandfonline.com/doi/abs/10.1080/13648470801919032
- Halpin J. Avian flu from an occupational health perspective. Arch Environ Occup Heal [Internet]. 2005 [citado el 18 de septiembre de 2021];60(2):59–69. Disponible en: https://www.tandfonline.com/doi/abs/10.3200/AEOH.60.2.59-69
- Dent JE, Kao RR, Kiss IZ, Hyder K, Arnold M. Contact structures in the poultry industry in Great Britain: Exploring transmission routes for a potential avian influenza virus epidemic. BMC Vet Res 2008 41 [Internet]. el 23 de julio de 2008 [citado el 18 de septiembre de 2021];4(1):1–14. Disponible en: https://bmcvetres.biomedcentral.com/articles/10.1186/1746-6148-4-27
- Djunaidi H, Djunaidi ACM. The Economic Impacts of Avian Influenza on World Poultry Trade and the U.S. Poultry Industry: A Spatial Equilibrium Analysis. J Agric Appl Econ [Internet]. agosto de 2007 [citado el 18 de septiembre de 2021];39(2):313–23. Disponible en: https://www.cambridge.org/core/journals/journal-of-agricultural-and-applied-economics/article/abs/economic-impacts-of-avian-influenza-on-world-poultry-trade-and-the-us-poultry-industry-a-spatial-equilibrium-analysis/F011448252F6503D12673150FA000347
- Iglesias-Osores S, Tullume-Vergara PO, Acosta-Quiroz J, Saavedra-Camacho JL, Rafael-Heredia A. Genomic epidemiology of SARS-CoV-2 virus with a bioinformatics platform. Univ Médica Pinareña [Internet]. el 16 de julio de 2020 [citado el 31 de julio de 2020];0(0):e555. Disponible en: http://revgaleno.sld.cu/index.php/ump/article/view/555
- Iglesias-Osores S, Alcántara-Mimbela M, Arce-Gil Z, Córdova-Rojas LM, López-López E, Rafael-Heredia A. Nextstrain: una herramienta que analiza la epidemiología molecular del SARS-CoV-2. Rev Cuba Inf en Ciencias la Salud. 2021;32(2):1–22.
- Vega-fernández J, Iglesias-osores S, Tullume-vergara P. Use of a bioinformatic tool for the molecular epidemiology of SARS-CoV-2. Univ Médica Pinareña [Internet]. el 28 de mayo de 2020 [citado el 14 de julio de 2020];16(3):3–5. Disponible en: http://revgaleno.sld.cu/index.php/ump/article/view/530
- Kilpatrick AM, Chmura AA, Gibbons DW, Fleischer RC, Marra PP, Daszak P. Predicting the global spread of H5N1 avian influenza. Proc Natl Acad Sci [Internet]. el 19 de diciembre de 2006 [citado el 18 de septiembre de 2021];103(51):19368–73. Disponible en: https://www.pnas.org/content/103/51/19368
- ABDELWHAB EM, HAFEZ HM. An overview of the epidemic of highly pathogenic H5N1 avian influenza virus in Egypt: epidemiology and control challenges. Epidemiol Infect [Internet]. mayo de 2011 [citado el 18 de septiembre de 2021];139(5):647–57. Disponible en: https://www.cambridge.org/core/journals/epidemiology-and-infection/article/an-overview-of-the-epidemic-of-highly-pathogenic-h5n1-avian-influenza-virus-in-egypt-epidemiology-and-control-challenges/0C27CD26C2B866ACC4A1301C3F06474C
- Liu J, Xiao H, Lei F, Zhu Q, Qin K, Zhang X -w., et al. Highly Pathogenic H5N1 Influenza Virus Infection in Migratory Birds. Science (80- ) [Internet]. el 19 de agosto de 2005 [citado el 15 de agosto de 2021];309(5738):1206–1206. Disponible en: https://science.sciencemag.org/content/309/5738/1206
- Guan Y, Poon LLM, Cheung CY, Ellis TM, Lim W, Lipatov AS, et al. H5N1 influenza: A protean pandemic threat. Proc Natl Acad Sci [Internet]. el 25 de mayo de 2004 [citado el 15 de agosto de 2021];101(21):8156–61. Disponible en: https://www.pnas.org/content/101/21/8156
- Chen H, Smith GJD, Zhang SY, Qin K, Wang J, Li KS, et al. H5N1 virus outbreak in migratory waterfowl. Nat 2005 4367048 [Internet]. el 6 de julio de 2005 [citado el 15 de agosto de 2021];436(7048):191–2. Disponible en: https://www.nature.com/articles/nature03974
- Role for migratory wild birds in the global spread of avian influenza H5N8. Science [Internet]. el 14 de octubre de 2016 [citado el 18 de septiembre de 2021];354(6309):213–7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27738169/
- DH L, MK T, K W, HS I, CS S, DE S. Intercontinental Spread of Asian-Origin H5N8 to North America through Beringia by Migratory Birds. J Virol [Internet]. el 15 de junio de 2015 [citado el 18 de septiembre de 2021];89(12):6521–4. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25855748/
- J L, M G, D L, B L, K J, L Z, et al. Phylogenetic and biological characterization of three K1203 (H5N8)-like avian influenza A virus reassortants in China in 2014. Arch Virol [Internet]. el 1 de febrero de 2016 [citado el 18 de septiembre de 2021];161(2):289–302. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26526148/
- H S, J P, J H, L L, G X, GF G, et al. Characterization of clade 2.3.4.4 highly pathogenic H5 avian influenza viruses in ducks and chickens. Vet Microbiol [Internet]. el 15 de enero de 2016 [citado el 18 de septiembre de 2021];182:116–22. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26711037/
- Maines TR, Lu XH, Erb SM, Edwards L, Guarner J, Greer PW, et al. Avian Influenza (H5N1) Viruses Isolated from Humans in Asia in 2004 Exhibit Increased Virulence in Mammals. J Virol. el 15 de septiembre de 2005;79(18):11788–800.


Estados Unidos de América