Caracterización genética de cepas de campo del virus de la afeccion de la bolsa de fabricio detectadas en granjas de pollo de engorda en el Estado de Nuevo León
Para conocer las características moleculares del virus de la Infección de la bolsa de Fabricio (VIBF) en el estado de Nuevo León, México, se muestrearon 30 granjas de pollo de engorda durante mayo y junio de 2008. Se colectaron muestras de tejido bursal para la detección del VIBF mediante RT-PCR y posteriormente se secuenció la región hipervariable del gene VP 2. Adicionalmente se realizaron estudios de histopatología de la bolsa de Fabricio y ELISA para el VIBF.
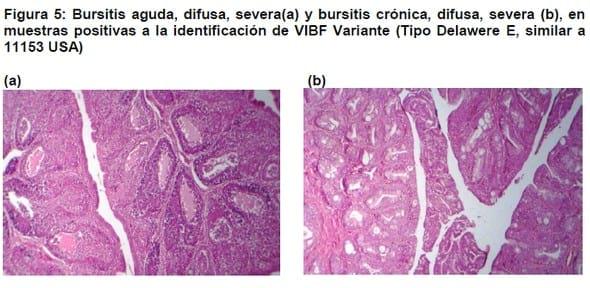
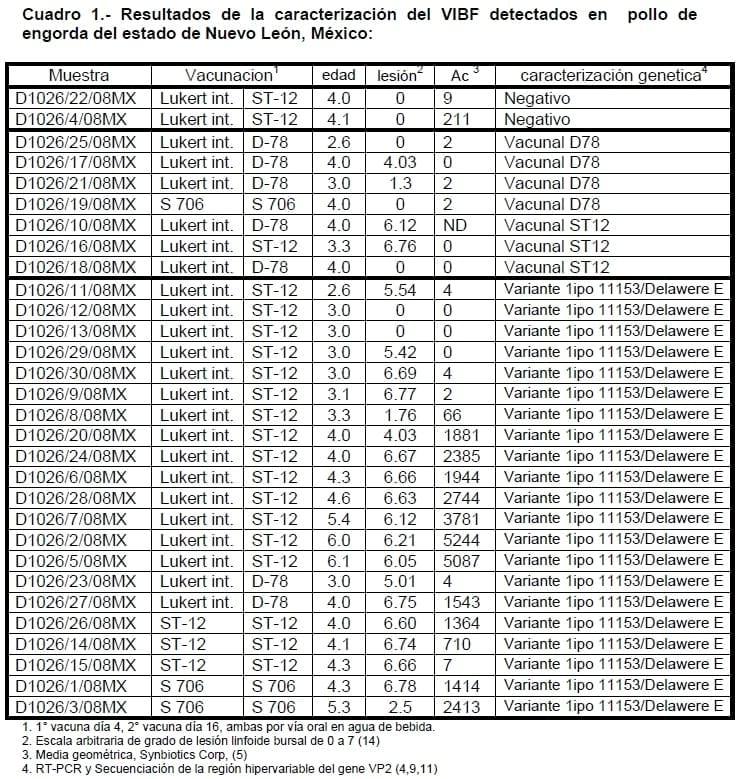
Los resultados de RT-PCR fueron positivos a la presencia del VIBF en 28 granjas. El análisis de las secuencias de nucleótidos determinó que los virus presentes en 21 granjas mostraron características genéticas parecidas a la variante Delaware E; estas variantes fueron genéticamente similares al virus 11153 USA, del tipo Delawere E, en la clasificación de Jackwood estarían incluidas en el Grupo Molecular 6. El estudio histopatológico mostró que en trece de estas granjas se observaron lesiones bursales severas, en cuatro se presentaron lesiones moderadas, en dos se observaron lesiones leves y en dos no se detectaron lesiones bursales. En estas granjas se detecto seroconversión al VIBF a partir de las 4 semanas de edad.
En siete granjas se detectaron virus estándar similares a cepas vacunales. En cuatro se detectaron virus similares a la cepa D-78; dos granjas sin lesiones bursales, una con lesiones leves y una con lesiones moderadas: En tres granjas se detectaron virus similares a la cepa ST-12; una granja sin lesiones busales y dos con lesiones severas. No se detectó seroconversión al VIBF en ninguna de estas 7 granjas. En dos granjas las muestras fueron negativas a la detección del VIBF, las muestras no presentaron lesiones bursales ni se detectó seroconversión al VIBF.
La presencia de cepas variantes de VIBF se detecto en aves con calendarios de vacunación diferentes con cepas vacunales estándar intermedias.
PALABRAS CLAVE: Infección de la bolsa de Fabricio, variantes, caracterización genética, diagnóstico.
Variantes (6). La detección e identificación de las cepas del VIBF es importante para ajustar los calendarios de vacunación a los subtipos de virus presentes en el medio ambiente de las aves (7). La secuenciación genética del gene de la proteína VP-2 es método mas confiable para la identificación y diferenciación de las cepas del VIBF (7,8,16). Variantes del VIBF aisladas en Estados Unidos y Latinoamérica muestran cambios ("drifts") antigénicos que afectan la neutralización de los epitopes de la proteína de la cápside VP2. En estudios realizados en Georgia EUA, se detecto que el 80% de las cepas de Estados Unidos fueron variante tipo Delaware E y el 8% similar a Variante E; en Colombia y Ecuador se detectaron cepas similares a la variante Delaware E, en Perú y Venezuela se detectaron tipos Delaware y GLS mientras que en Brasil y Rep. Dominicana se detectaron cepas clásicas de alta virulencia, de las muestras procedentes de México 6 correspondieron a cepas estándar y 3 no fueron tipificables con el sistema utilizado (2). En otro estudio realizado en la Universidad de Ohio, a partir de muestras procedentes de México, se encontraron cepas Variantes cercanas al grupo Delaware E, cepas clásicas virulentas y cepas variantes cercanas a cepas clásicas (3).
En un estudio previo realizado por Valladares, J.C. y Banda, A en el año 2003 (resultados no publicados), a partir de 25 grupos de muestras de tejido bursal de pollo de engorda, se detectaron 15 virus de la Infección de la bolsa de Fabricio (VIBF) utilizando la técnica de la transcripción reversa y la reacción en cadena de la polimerasa (RT-PCR) para amplificar productos de 248 pares de bases, abarcando la región hipervariable del gen VP2, así como el análisis del polimorfismo en la longitud de fragmentos de restricción (RFLP) de los productos obtenidos por RT-PCR utilizando las endonucleasas de restricción Dra I, Sac I, Taq I, Sty I, Bst NI, y Ssp I. En este estudio, se identificaron nueve virus que presentaron un patrón idéntico al de la cepa variante Delaware E, tres virus similares a la cepa vacunal ST-12, dos virus similares a la cepa vacunal PBG y un virus que mostró un patrón de RFLP único que no correspondía a ninguna cepa conocida. Sin embargo, los productos obtenidos no fueron secuenciados para obtener una clasificación mas precisa de los VIBF detectados en el estado de Nuevo León, México
en 15 granjas la edad fue alrededor de las 4 semanas y en 4 granjas alrededor de las 6 semanas de edad. De cada granja se muestrearon 10 aves seleccionadas al azar. Las aves fueron enviadas al laboratorio, donde fueron sangradas y sacrificadas para la toma de muestras, colectando muestras de tejido bursal para biología molecular (10 porciones de BF juntas, conservadas en congelación) y para histopatología (10 porciones individuales de BF, conservadas en formol al 10%), así como muestras de suero para ELISA de IBF.
Identificación del VIBF y caracterización molecular: La identificación y caracterización molecular del VIBF se realizó en el Laboratorio de Ceva-Phylaxia Co Ltd, de acuerdo a la metodología publicada previamente (4,9,10). Se utilizó la técnica de transcripción reversa y reacción en cadena de la polimerasa para amplificar un segmento de 408 pares de bases (pb) de longitud, del pb 721 al pb 1128; de la secuencia de nucleótidos de la región hipervariable del gen VP-2 del VIBF. El fragmento ampliado fue secuenciado y se elaboró un árbol filogenético de las secuencias detectadas utilizando las secuencias de referencia disponibles en el banco de secuencias NCBI (National Center for Biothecnology Information).
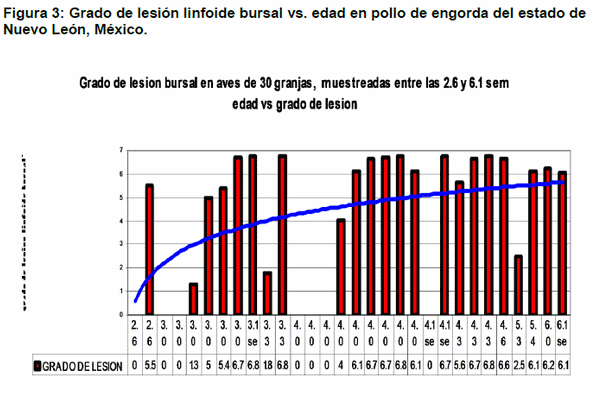
Histopatología: Se realizó el estudio histopatológico de las lesiones bursales, calificándolas en una escala arbitraria de lesión de 0 a 7, de acuerdo a su distribución y a su grado de severidad; donde valores de 0 se consideraron sin lesiones, valores entre 0.1 y 2.5 como lesiones leves, valores mayores de 2.6 y menores de 6 como lesiones moderadas y valores entre 6 y 7 se consideraron lesiones severas. El nivel del daño bursal se obtuvo por el promedio de lesión de las 10 bolsas obtenidas de cada granja (14).
Serología: se realizó la detección de anticuerpos séricos contra el VIBF, mediante una prueba de ELISA convencional (5).
Identificación del VIBF y caracterización molecular: Los resultados de RT-PCR fueron positivos a la presencia del VIBF en 28 granjas, en dos granjas no se detectó el VIBF.
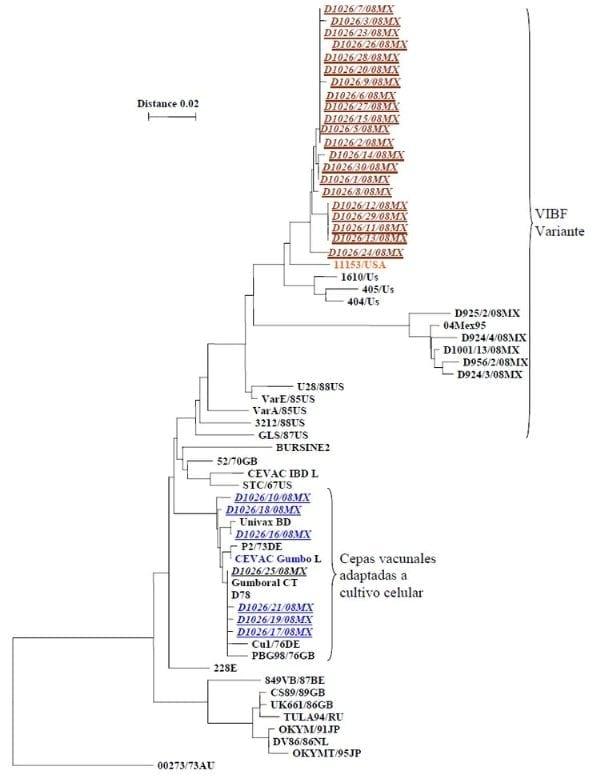
De los 28 virus detectados, 21 virus mostraron características genéticas de virus Variantes y 7 de virus Estándar. Los virus Variantes detectados tuvieron características genéticas del Tipo Delawere E; estas Variantes fueron similares genéticamente al virus 11153 USA (1). El análisis de la secuenciación genética detectó al aminoacido T (treonina) en la posición 222, lo cual es compatible con una cepa variante; el aminoacido L (leucina) en la posición 253 y al aminoácido Q (glutamina) en la posición 284, lo que indica que los virus detectados no corresponden ni a cepas vacunales ni a cepas clásicas virulentas. La presencia de este tipo de secuencias indica que los virus detectados pueden clasificarse en el Grupo Molecular 6 de la clasificación descrita poir Jackwood en 2007 (3). De los virus Estándar detectados, cuatro presentaron características genéticas similares a la cepa D-78 y los otros tres presentaron características genéticas similares a la cepa ST-12.
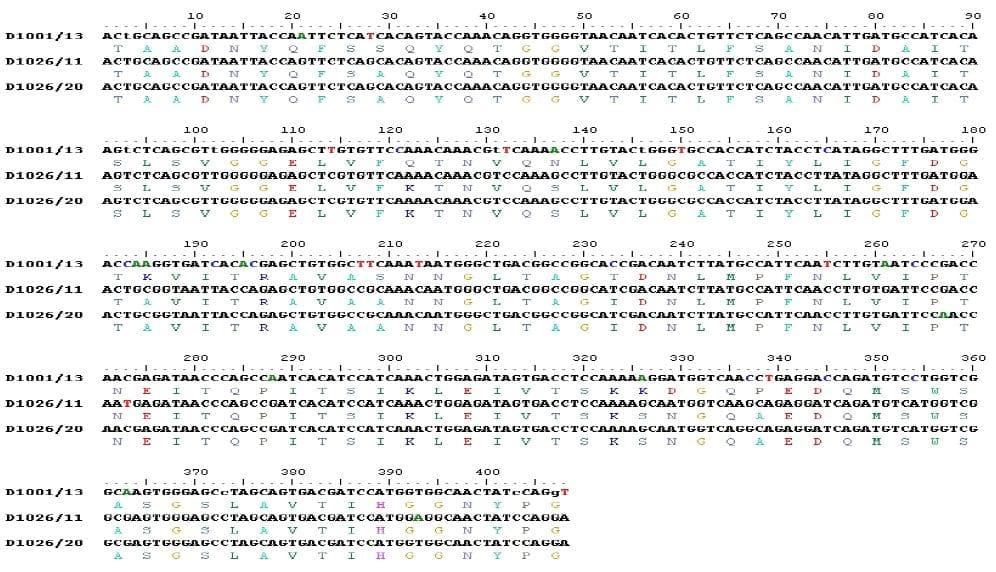
El árbol filogenético de los virus detectados se observa en la Figura 1 y la secuenciación genética de dos de los virus detectados se observa en la Figura 2.
Histopatología: En las muestras de 7 granjas no de observaron lesiones bursales, en 3 granjas se observaron lesiones leves, en 5 granjas lesiones moderadas y en 15 granjas lesiones severas. La severidad de la lesión se incrementó con la edad de las aves muestreadas (Figuras 3 y 5).
Serología: En 18 granjas el titulo de anticuerpos fue muy bajo o nulo; en 11 granjas el título de anticuerpos fue moderado. La seroconversión se detectó únicamente en aves a partir de las 4 semanas de edad y sólo en granjas con presencia de virus Variantes.
Estos resultados son similares a los reportados previamente, en los que se menciona que el 88% de los VIBF detectados en Estados Unidos son de tipo Variante Delaware E, variante que también ha sido detectada en Colombia, Ecuador, Perú y Venezuela (2). Estudios realizados en la Universidad de Georgia, EUA, durante 2005 y 2006, se reporto que algunas cepas mexicanas de VIBF están filogenéticamente agrupadas muy cerca de las cepas Variantes A y E, indicando que, aunque no son similares a las Variantes A ó E, si corresponden a cepas variantes y son diferentes de las cepas Clásicas (15); mientras que estudios realizados en la Universidad de Ohio se encontraron cepas Variantes cercanas al grupo Delaware E, cepas Clásicas virulentas y cepas Variantes cercanas a cepas Clásicas, clasificadas en el Grupo Molecular 6 (3).
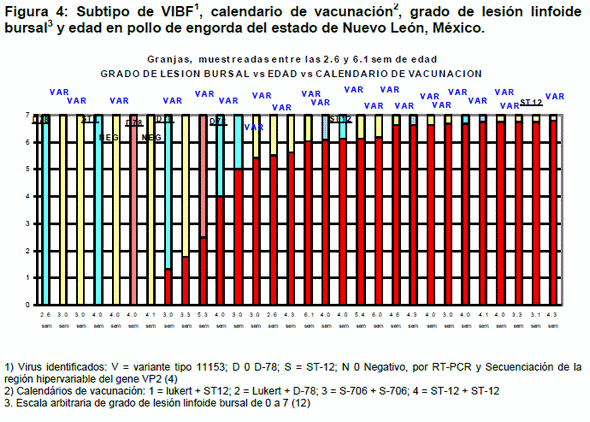
En cuatro granjas se detectaron virus con características genéticas similares a la cepa D-78; las muestras de dos granjas no presentaron lesiones bursales, una granja presentaron lesiones leves y una granja lesiones moderadas.: En tres granjas se detectaron virus con características genéticas similares a la cepa ST-12, en una de estas granjas no se observaron lesiones mientras que las otras dos granjas se observaron lesiones bursales severas. La edad de las aves de estas granjas fue entre 2.6 y 4 semanas y no se detectó seroconversión al VIBF en ninguna de ellas. La presencia de estos virus similares a virus vacunales coincide con las cepas vacunales utilizadas en las parvadas muestreadas en cuatro granjas, en tres granjas los virus detectados fueron diferentes a los virus vacunales utilizados en las aves muestreadas.
En dos granjas las muestras fueron negativas a la detección del VIBF mediante RT-PCR, en aves de 4.0 y 4.1 sem de edad, las muestras de estas granjas no presentaron lesiones bursales y no se detectó seroconversión al VIBF.
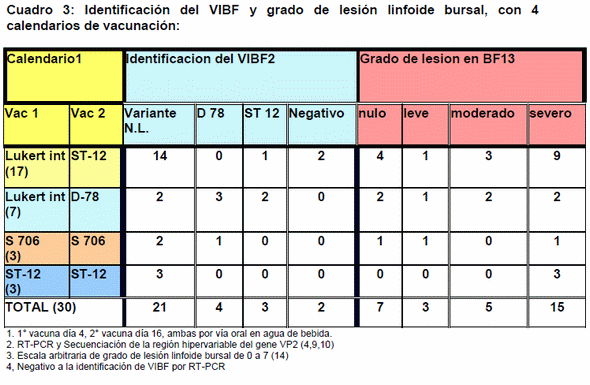
Con relación a los calendarios de vacunación utilizados, en las granjas con vacunas Lukert + ST 12, de 17 muestras, se detectaron 14 virus variantes, un ST 12 y dos negativas a VIBF; en granjas con vacunas Lukert + D 78 de 7 muestras, se detectaron 2 virus variantes, 3 virus tipo D 78 y 2 virus tipo ST 12; en las granjas con vacunas S 706 + S 706, de 3 muestras, se detectaron 2 virus variantes y un virus tipo D 78; en las granjas vacunadas con ST 12 + ST 12, de 3 muestras, se detectaron 3 virus variantes. Aparentemente los virus VIBF Variantes pueden estar presentes en parvadas vacunadas con cualquiera de los calendarios de vacunación utilizados en las granjas estudiadas (Cuadro 2).
2) - Banda, A., P. Villegas, A and J. El-Attrache, Molecular Characterization of Infectious Bursal Disease Virus from Commercial Poultry in the United States and Latin America Avian Diseases 47:87-95, 2003
3)-Cookson, K, Tamayo, M. and Jackwood, D.: Phylogenetic analysis of very virulent, classic and variant infectious bursal disease virus from central and south America, 56° Western Disease Conference, 115-117, Las Vegas, USA, 2007
4) Domanska, K., Mato, T., Rivallan, G., Smietanka, K., Minta, Z., de Boisseson, C., Toquin, D., Lomniczi, B., Palya, V. Eterradossi, N.: Antigenic and genetic diversity of early European isolates of Infectious bursal disease virus prior to the emergence of the very virulent viruses: early European epidemiology of Infectious bursal disease virus revisited?. Arch. Virol. 149: 465-480, 2004.
5) Instructivo de uso Synbiotics Corporation, Gaithersburg Maryland, USA.
6) Ismail, N. M., Y. M. Saif, W. L. Wigle, G. B. Havenstein, and C. Jackson: Infectious bursal disease virus variant from commercial leghorn pullets. Avian Diseases. 34:141-145, 1990.
7).- Jackwood, D.: Recent trends in the molecular diagnosis of infectious bursal disease viruses. Anim. Health Res. Rev.: 5(2):313-316, 2004.
8) - Letzel, T., Coulibaly, F., Rey, F., Delmas, B., Jagt, E., van Loon, A. and Mundt. E.: Molecular and Structural Bases for the antigenicity of VP2 of infectious bursal disease virus, Journal of Virology, (81)32: 12827-12835, 2007.
9) Lin, Z., Kato, A., Otaki, Y., Nakamura, T., Saamaz, E. & Ueda, S.:Sequence comparison s of a highly virulent infectious bursal disease virus prevalent in Japan. Avian Diseases, 37, 315-323. 1993.
10) Liu, H., Giambrone, J.J. & Dormitoroi, T. (1994). Detection of genetic variations in serotype I isolates of infectious bursal disease virus using polymerase chain reaction and restriction endonucleas e analysis. Journal of Virological Methods, 48, 281- 291.
11) Lukert P and Saif, M: Infectious bursal disease, in Diseases of Poultry, Chapter 3. Eleventh edition, 2003, editor in Chief Y.M. Saif, Iowa State Press.
12) Rosenberger, J. K., S. S. Cloud, and A. Metz: Use of infectious bursal disease virus variant vaccines in broilers and broiler breeders, Proceedings of the 36th Western Poultry Disease Conference. University of California, Davis, CA. 106-109, 1987
13) Schnitzler, D, Bernstein, F., Miller, H. and Becht, H.: The genetic basis for the antigenicity of the VP2 protein of the infectious bursal disease virus. Journal of General Virology (74), 1563 1571, 1993.
14) Valladares, J.C.: Manual de Procedimientos Técnicos de Laboratorio, Laboratorio de Control de Calidad y Patología Aviar, PAPSA, México, 2007.
15) Villegas, P. y A. Banda: Enfermedad infecciosa de la bolsa: Diferencias entre las cepas del virus, diagnóstico y prevención. Memorias del XI Seminario Internacional de Patología y Producción Aviar The University of Georgia- AMEVEA Athens, GA, 2006
16) Wu, C., Rubinelli, P. and Lin, T.: Molecular detection and differentiation of infectious bursal disease virus. Avian Diseases 51(2): 515-526, 2007.

(virus de Nuevo León en cursiva y subrayados):
Virus de Nuevo Leon:
D1026/11
D1026/20