Introducción
Las fluoroquinolonas son agentes sintéticos con notable desarrollo en avicultura, particularmente en los integrantes de segunda generación (1,2). Ejercen actividad bactericida de tipo concentración dependiente, mediante el bloqueo de las enzimas ADN girasa y topoisomerasa IV, que intervienen en el plegamiento de la doble hélice de ADN, fundamentales para la estructura tridimensional del material genético (3-5).
Estos antimicrobianos desarrollan actividad excelente sobre enterobacterias y Pseudomona aeruginosa, moderada sobre Estafilococos spp., buena frente Clamidias spp. y Micoplasmas spp. (2,5,6); y poseen propiedades farmacocinéticas que permiten la aplicación en el agua de bebida (7,8), absorción oral variable (9) y concentraciones tisulares importantes respecto al plasma, re-sultado del carácter anfótero, reducida afinidad por las proteínas plasmáticas (3-5) y bajo perfil toxicológico en aves (2) y en otras especies domésticas (10,11).
La danofloxacina es una fluoroquinolona utilizada solo en animales domésticos, que desarrolla acciones frente a gramnegativos, ciertos grampositivos y Micoplasmasspp. (12,13). En las aves, se utiliza para el tratamiento de enfermedades causadas por E. coli (2,14), Pasteurella haemolytica y multocida, H. somnus y Micoplasmas spp.
Los estudios farmacocinéticos indican que en pollos hay absorción tras la administración oral (15-18), la cual se logra en tiempo corto de acuerdo con los tiempos medios de absorción (t½abs) informados de 0,89 (16) a 1,2 h (15). Luego de la aplicación de 5 mg/kg, la curva de disposición plasmática generó áreas bajo la curva (ABC) de 3,05 (16), 3,5 (15), 5,1 (17) y 7,7 ± 1,3 μg/ ml (19). La Cmáx obtenida se ubicó entre 0,47 y 0,5 μg/ ml (15,16,18,19), provisto a las 2,4 h (Tmáx) (18,19); la vida media de eliminación (t½β) fue de 6,9 a 8,7 h (16) y 13,05 h (19), mientras el tiempo medio de residencia (TMR) alcanzó las 8,6 h (15), el Vd a 2,11 L/kg (18); el clearence (Cl) fue de 20,5 (17) a 23,5 ml/h/kg a (15), yen pavos el valor alcanzó 9,77 ml/h/kg (20).
La danofloxacina desaparece primero en plasma y luego en tejidos (18). Se encuentran altas concentraciones en hígado a las 6 h de administración, las cuales descien-den a las 48 h de la última dosis recibida (17). Se observa un cociente tejido/plasma de 10,7 (15) a 20,6 ± 2,1 (19), mientras en el músculo se ve la relación entre 2,5 (15) y 4,1 ± 0,36 (19). En riñón y músculo, el descenso es paralelo al observado en el hígado, aunque 2 a 10 veces menos significativos. Esta sustancia es poco metabolizada (17). El mayor residuo encontrado en estos tejidos fue el principal metabolito, N-demetil, hallado en el hígado, pero inexistente en la piel y en el tejido adiposo (17).
En el músculo y el hígado, la Cmáx fue de 2,3 ± 0,38 y 12,6 ± 1,2 μg/g, respectivamente, conseguidos a las 6 y 3,1 ± 1,6 h, respectivamente. La vida media de eliminación fue de 9,7 ± 1,4 h en el músculo y las 8,7 ± 0,44 h en el hígado (19).
En pavos, la administración oral de 6 mg/kg generó una Cmáx plasmática de 1,1 ± 0,95 μg/ml, obtenida a las 2,1 ± 2,5 h. El ABC fue de 7,7 ± 1,7 μg-h/ml y la biodisponibilidad hallada fue del 78,7 ± 17,3 %. En esta especie demostró moderada permanencia en el organismo, según reflejan el t½β y el TMR de 9,7 ± 2,9 y 15,1 ± 4,3 h, respectivamente (20).
La aplicación de fluoroquinolonas en animales de producción se reflejó en la incidencia creciente de cepas resistentes de Campylobacter spp., asociada con la administración desmedida e inadecuada y por la presencia de residuos (21-23). La situación determinó restricciones para el empleo, la determinación de límites máximos de residuos (LMR) en tejidos comestibles y la implementación de periodos de retiro (24).
En pollos, el laboratorio fabricante propone la aplicación oral en el agua de bebida de danofloxacina mediante polvos solubles en dosis de 5-10 mg/kg/d de 3 a 5 d (15,17). Como alternativa confiable, se realizó un estudio poblacional, en reemplazo de los diseños tradicionales que utilizan pocos animales, con el objetivo de establecer concentraciones plasmáticas y en tejidos comestibles, luego de la administración oral única, para estimar parámetros cinéticos que permitan valorar su utilidad terapéutica y, con datos de depleción tisular, para establecer un periodo de resguardo a la faena.
Material y métodos
Como sujetos experimentales se utilizaron 42 pollos parrilleros mixtos (n = 42), línea Ross, clínicamente sanos; vacunados contra marek, newcastle, gumboro y bronquitis infecciosa; seleccionados al azar de una población de 750 pollos de 55 d de edad al inicio de la experiencia; con un peso promedio de 3,076 ± 0,15 kg; pertenecientes a un establecimiento avícola comercial próximo a la ciudad de Río Cuarto. Las aves, sujetas a idénticas condiciones de manejo y alimentación, fueron alojadas en condiciones de ambiente adecuadas para la edad de los animales: ventilación forzada, plan de luz de 18 h totales, temperatura ambiente acondicionada entre 19 y 21 ºC y humedad ambiente promedio 65 % con agua de bebida ad libitum y alimento balanceado para aves libre de promotores de crecimiento y coccidiostáticos.
Luego de una semana de ambientación, se conformaron al azar 14 lotes de 3 individuos cada uno. Cada lote fue identificado, y previo ayuno de 12 h y de 3 h postaplicación, cada animal recibió una dosis única de 5 mg/kg de danofloxacina aplicada directamente en forma de bolo en la cavidad bucal. Después cada lote se sacrificó por exanguinación, previo aturdimiento mecánico, procedimiento similar al utilizado en establecimientos autorizados para la faena de aves, y aprobado por el Comité de Ética de la Investigación de la Universidad Nacional de Río Cuarto (Expediente 33/11), en los siguientes tiempos postaplicación: 0,25; 0,5; 0,75; 1; 2; 4; 6; 8; 12; 24; 48; 72; 96 y 120 h; de esto se obtuvieron 5 ml de sangre en tubos heparinizados centrifugados de inmediato durante 10 min a 2500 r. p. m., 3 g de hígado y 3 g de músculo. El plasma resultante y las muestras de tejido se identificaron y conservaron en viales por separado hasta su análisis a –20 °C.
La validación del método se concretó mediante ensayos de linealidad, recuperabilidad, límite de detección, límite de cuantificación, reproducibilidad y repetibilidad. Estos ensayos, y la determinación de la concentración del analito en las muestras problema, se efectuaron sobre el índice de área, resultante de la división de las áreas de las señales cromatográficas de danofloxacina y el estándar interno de marbofloxacina.
El ensayo de linealidad consistió en determinar el grado de ajuste de los valores de índice de área y sus res-pectivos estándares de calibración, a una línea recta mediante una regresión lineal entre ambas variables. La recuperabilidad se determinó eluyendo por triplicado tres estándares de calibración y tres de recuperabilidad, en concentraciones diferentes de danofloxacina, y se calculó el porcentaje de recuperabilidad (% R) para cada concentración.
El ensayo de límite de detección (LD) se realizó con la fórmula que considera la superficie de área en el cro-matograma, originada tras la elusión de las concentraciones más pequeñas de danofloxacina, mediante las cuales se estableció una curva de calibración y se obtuvo el valor de b.
LD = (promedio SD × 3,3) / b
El límite de cuantificación (LC) se calculó con la misma fórmula y valores, solo que se multiplica el promedio de áreas obtenidos por 10:
LC = (promedio SD × 10) / b
El ensayo de repetibilidad consistió en la elusión de los estándares de calibración por sextuplicado. Se conside-ró aceptable cuando el coeficiente de variación (CV) entre elusiones, en cuanto el índice de áreas de los cro-matogramas, fue ≤ 1,5 %. El ensayo de reproducibilidad consistió en eludir los estándares de calibración en ensa-yos efectuados en 6 d diferentes. Se consideró aceptable cuando el CV de los índices de áreas de los cromatogramas fue ≤ 3 %.
En el plasma el ensayo preparativo consistió en la ex-tracción líquido-líquido del analito utilizando 200 μl de plasma, 200 μl de agua deionizada, 800 μl de metanol y 30 μl de una solución de marbofloxacina de 10 μg/mL como estándar interno. El conjunto fue sometido a agitación por vórtice durante 30 s, y luego de 25 min de reposo a temperatura ambiente (25 °C), fue centrifugado a 13500 r. p. m. a 4 °C durante 25 min (25). El sobrenadante fue filtrado con filtro de nylon de 0,22 μ, y 50 μl de este se emplearon como volumen de inyección de la muestra para su separación y cuantificación por cromatografía líquida de alta performance (HPLC).
En tejidos, el ensayo preparativo consistió en la extracción líquido-líquido del analito, empleando 150 mg de tejido, y se le adicionaron 100 μl de una solución de 20 μg/ml de marbofloxacina, como estándar interno, y 0,75 ml de la solución de homogenización conformada por agua deionizada, metanol, ácido perclórico al 70 % y ácido fosfórico 500:500:10:1 v/v/v/v.
El conjunto fue homogeneizado mecánicamente duran-te 1 min. Luego se agregaron 0,75 ml de la solución de homogeneización. El contenido fue sometido a 1 min de vórtice, 25 min de reposo a temperatura ambiente, esta-cionado durante 12 h en heladera a 4 ºC, y luego centrifugado durante 30 min a 13.500 r. p. m. a 4 °C (25). El sobrenadante fue filtrado con filtros de nylon de 0,22 μ, y 50 μl fueron utilizados como volumen de inyección de la muestra para su separación y cuantificación por HPLC. Estas se realizaron a temperatura ambiente por HPLC, mediante una elusión isocrática en fase reversa, con flu-jo de 0,8 ml/min, utilizando columna octadecilsilano C-18, 5 μ, 25 cm, Hewlett Packard, precolumna Pheno-menex, jeringa de inyección Hamilton de 100 μl y lectu-ra en detector de fluorescencia establecido a 295 nm de excitación y 490 nm de emisión (25).
La elusión generó picos en el cromatograma correspon-dientes al estándar interno y al analito en estudio; aquí se tomaron las áreas de los picos, calculando el cocien-te, para la confección de la curva de calibración y establecer las concentraciones plasmáticas y tisulares de danofloxacina por regresión lineal simple (26). De los tres pollos sacrificados por tiempo, se consiguió un valor promedio para el cálculo de la concentración final de la curva en el plasma o tejido en función del tiempo.
El programa farmacocinético no compartimental PK Solution 2.0 (27) se aplicó para el análisis cinético individual en el plasma y en cada tejido estudiado, incorporando los promedios de concentraciones de danofloxacina establecidas en cada tiempo, la dosis utilizada y el peso promedio de las aves incluidas en la experiencia. El programa estimó valores de parámetros cinéticos robustos propios de cada tejido. El periodo de retiro se estimó con el programa WT 1.4 de la EMEA (28), según los LMR establecidos en músculo e hígado de pollo de 200 y 400 µg/kg, respectivamente, y se in-cluyeron los valores residuales obtenidos en la determinación de cada tejido.
Resultados
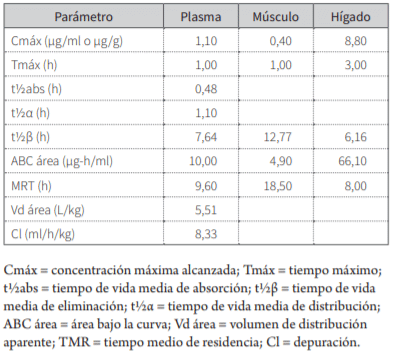
Las concentraciones plasmáticas y tisulares obtenidas en función del tiempo se representan en la tabla 1. En la tabla 2 se muestran los resultados en los distintos pa-rámetros farmacocinéticos, derivados del análisis de los promedios de concentraciones de cada tejido en diferentes tiempos desde los 15 min hasta las 24 h siguien-tes a la aplicación de danofloxacina, con el programa farmacocinético no compartimental PK Solution 2.0 (27). El análisis de las concentraciones residuales versus el tiempo con el programa WT 1.4 de la EMEA (28)permitió estimar un periodo de resguardo a la faena de 1,4 y 3,34 d, para músculo e hígado, respectivamente, que en condiciones prácticas se extenderían a 2 d para el músculo y 4 para el hígado.
Tabla 1. Concentraciones plasmáticas de danofloxacina (±DE) versus el tiempo (horas) en plasma y tejidos (μg/ml o μg/g)
Tabla 2. Parámetros farmacocinéticos obtenidos en plasma y tejidos con 5 mg/kg de danofloxacina por vía oral en pollos
Discusión
No se observaron reacciones adversas de ninguna na-turaleza en las aves tratadas, en concordancia con el perfil de seguridad que exhiben las fluoroquinolonas cuando se utilizan según las condiciones recomendadas (2,5,10,11). El método implementado permitió cuantificar el antimicrobiano en plasma y tejidos hasta las 72 h postaplicación. Los resultados obtenidos revelan que la administración oral de 5 mg/kg de danofloxacina a pollos parrilleros adultos en condiciones de ayuno previo a 12 h, con el propósito de evitar la interacción del an-timicrobiano con los iones divalentes de origen alimentario (2,11,13), experimenta pronta absorción, ya que se determina en el plasma a los 15 min postaplicación y consigue el Cmáx de 1,1 μg/ml a 1 h, más pronto que lo encontrado en el hombre y en caninos por el conjunto de fluoroquinolonas (10,11). El Cmáx obtenido excede otros ensayos realizados con danofloxacina por vía oral en pollos parrilleros (15,16,18,19), posiblemente por las condiciones de ayuno de este ensayo (2,11,13).
El t½β obtenido de 7,6 h es similar al hallado en pollos de 7,31 h (16) e inferior a las 13,05 ± 1,68 h en pollos (19) y 9,74 ± 2,93 h en pavos (20). El TMR encontrado en esta experiencia de 9,6 h, respecto a experiencias realizadas en pollos, es inferior al obtenido con danofloxacina en pollos de 8,69 h (15) y 15,17± 4,37 h en pavos (20). Estos valores concuerdan con los antecedentes de moderada permanencia plasmática de fluoroquinolonas en pollos (29), similar a lo que sucede con danofloxacina en mamíferos domésticos (30,31).
La curva de disposición plasmática generó un ABC de 10 µg-h/ml, mayores a los valores registrados en esta especie utilizando idéntica dosis de danofloxacina (15-17,19) y en pavos, tras la aplicación de 6 mg/kg (20). La rápida declinación plasmática verificada desde las 12 h no resulta solo de los procesos de eliminación, sino también de la distribución a los tejidos, lo cual es similar a lo observado en experiencias realizadas en pollos (15). Sin embargo, la depuración hallada, comparada con otros agentes del grupo en pollos es menor a la obser-vada con danofloxacina de 20,5 (17) y 23,52 ml-min/ kg (15).
Acorde con sus características físico-químicas, como liposolubilidad (11,14,18) y reducida afinidad por pro-teínas plasmáticas (4,24), los antecedentes de las fluoroquinolonas indican elevada distribución tisular (31-33), que se reflejan en el valor de Vd de 5,1 L/kg encontrado en este estudio. Sin embargo, excede a los registrados de 1,42 ± 0,15 L/kg en caprinos (34), 2,21 L/kg en po-llos (18), 2,76 ± 0,18 L/kg en ovinos (31) y 4,3 L/kg en bovinos (30)
La comparación de las ABC en este estudio arroja cocientes tejido/plasma de 0,48 y 6,61 en músculo e hígado, respectivamente, valores menos significativos a los encontrados por otros autores en pollos con este antimicrobiano (15,17,19).
Similar a lo registrado en pollos parrilleros (17), las concentraciones hepáticas decrecen en forma paralela a las plasmáticas. En esta experiencia se hallaron 0,4 ± 0,19 µg/g a las 24 h y el valor mínimo de 0,035 ± 0,011 µg/g se determinó a las 72 h postaplicación. El Cmáx conseguido en este tejido, de 8,8 µg/g, excede altamente al plasmático de 1,1 µg/ml, pero es menor al informado de 12,68 ± 1,21 µg/g, utilizando una dosis similar (19).
En el hígado el Tmáx se logra a las 3 h. Los valores de t½β y TMR, de 6,16 y 8 h, encontrados respectivamen-te, señalan la permanencia de danofloxacina en este tejido, pero son menos trascendentes respecto a los registrados en otro ensayo realizado en pollos con danofloxacina (19).
En el músculo, las concentraciones determinadas descienden significativamente desde las 12 h de 0,125 ± 0,014 µg/g hasta 0,019 ± 0,002 µg/g a las 72 h. En este tejido, el Cmáx de 0,4 µg/g se consigue a la hora posaplicación, y es menor al 1,1 µg/g establecido en el plasma y en otros ensayos realizados en pollos, que indican 2,31 ± 0,38 µg/g (19). La danofloxacina exhibe mayor permanencia en músculo respecto al plasma y al hígado, según surge de la comparación de los valores de t½β ha-llados de 12,77; 7,64 y 6,16 h.
Las concentraciones tisulares inferiores pueden ser consecuencia del modo de aplicación: en este análisis se realizan en forma de bolo; en otros, el fármaco es su-ministrado en el agua de bebida. Esta aplicación genera concentraciones continuas, similar a la vía intravenosa continua, a la modalidad del ensayo, a la metodología analítica, etc. No obstante, se observan marcadas variaciones en la información disponible respecto a la disposición tisular de danofloxacina y otras quinolonas en animales domésticos.
A pesar de las diferencias expresadas en el ABC plasmático versus los tisulares, particularmente el hígado, el periodo de resguardo a la faena de danofloxacina en pollos parrilleros, estimado según los datos surgidos del aná-lisis farmacocinético en los tejidos comestibles (35,36), se estableció en 1,4 y 3,34 d, para músculo e hígado, respectivamente.
La sustitución del diseño farmacocinético tradicional, que considera la toma de muestras seriadas en pocos animales —usualmente seis individuos— (13), por el modelo poblacional implementado en este estudio, resulta ventajosa por cuanto implica la colecta de muestras temporales de plasma o tejidos de diferentes individuos. Esto permite atenuar las variaciones atribuidas a la edad, sexo, tamaño corporal, o provocadas por causas patológicas o nutricionales, etc., advertidas en los estudios cinéticos convencionales (31,33,37).
Conclusiones
El perfil cinético exhibido por danofloxacina en pollos concuerda con sus propiedades físico-químicas. Las curvas de disposición generadas en plasma y en los tejidos estudiados, luego de la aplicación vía oral, importantes hasta las 12-24 h, permiten considerar la apli-cación de una sola dosis diaria.
El diseño poblacional implementado es adecuado para realizar estudios farmacocinéticos, de disposición tisular, y para establecer el periodo de resguardo. El método de extracción aplicado y la técnica de HPLC implementada resultaron confiables, accesibles y sensibles para cuantificar concentraciones de danofloxacina en el plasma o tejidos de pollos, útil para estudios cinéticos o para establecer concentraciones residuales.
La administración de danofloxacina en pollos en las dosis de 5 mg/kg, durante periodos breves y respetando el periodo de retiro, establecidos en función de las concentraciones residuales, es de 1,4 y 3,34 d, para músculo e hígado, respectivamente. En la práctica, la mayor residualidad hepática determina un periodo de resguardo de 4 d en pollos en engorde, compatibles con la brevedad de los ciclos productivos de pollos parrilleros.
Los resultados obtenidos respaldan el empleo de danofloxacina por vía oral en pollos. No obstante, la administración debe ser prudente, en las dosis indicadas, durante periodos breves y respetando el periodo de resguardo, establecido en función de las concentraciones residuales de 1,4 y 3,34 d, para músculo e hígado, respectivamente, compatibles con la brevedad de los ciclos productivos de pollos parrilleros.
Articulo publicado en Rev. Med. Vet. ISSN 0122-9354 ISSNe 2389-8526: Bogotá (Colombia) N° 35: 103-111, julio-diciembre del 2017: Errecalde Erlicher CA, Prieto Paoletti GF, Bourel Gudiño B, Luders Post CF, Tonini GarcíaMP, Rodríguez Triana L. Disposición de danoflaxacina en plasma y en tejidos comestibles de pollos parrilleros. Rev Med Vet. 2017;(35):103-11. doi: http://dx.doi.org/10.19052/mv.4393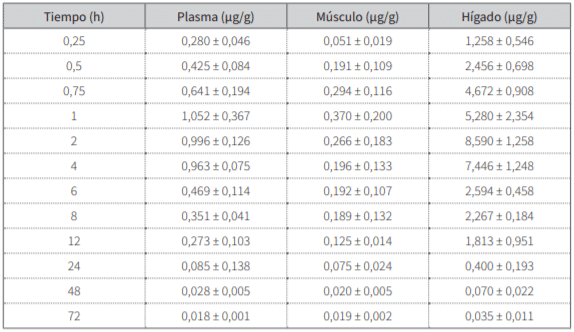







.jpg&w=3840&q=75)