Utilización de streptomyces sp. Rl8 como agente probiótico en pollos de la raza Leghorn
Durante sus primeras semanas de vida los pollos de las instalaciones avícolas están sometidos a situaciones de estrés que ocasionan desbalances en la microbiota intestinal, que hacen a su vez que sean susceptibles a la incidencia de microorganismos patógenos. El uso de antibióticos de amplio espectro para contrarrestar los efectos de dichos patógenos ha originado problemas de resistencia bacteriana y de inocuidad alimentaria. Se ha propuesto la utilización de probióticos como un medio para la reducción de patógenos intestinales y aumento de indicadores bioproductivos. En el presente trabajo se evaluó la actividad probiótica de Streptomyces sp. cepa RL8 en indicadores fisiológicos y productivos en pollos de la raza Leghorn. Se demostró que no hubo diferencias significativas entre el grupo tratado y el grupo control en cuanto a los parámetros productivos y de salud. Sin embargo, se encontraron diferencias significativas entre ambos grupos para algunos componentes hematológicos e inmunológicos. Por tanto, la cepa de Streptomyces sp. RL8 puede ser una alternativa para mejorar el estado de salud de los pollos, a través de la estimulación de parámetros hematológicos y modulación del sistema inmune de las aves.
Palabras clave: gallinas – microbiota intestinal – probióticos – Streptomyces
Animales y dieta basal
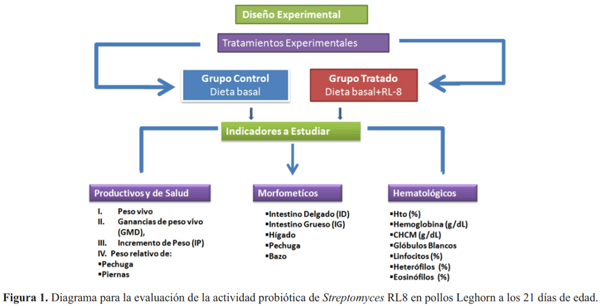
Para la experimentación se emplearon 60 animales, 30 hembras y 30 machos, de la raza Leghorn de un día de edad, con peso vivo promedio de 38,72 g, que se distribuyeron a razón de 30 aves por tratamiento (Figura 1). Los animales recibieron ad libitum el agua y el alimento a base de maíz y soya enriquecido con el suplemento probiótico a una carga de 108 ufc·g-1.
Se utilizó la cepa de Streptomyces RL8, la cual se creció en Caldo Triptona Soya e incubó a 28 ºC con agitación; seguido de inoculación en un subproducto de la producción agrícola como sustrato sólido e incubación a 28 ºC. El mismo se conservó a 25 ºC hasta su utilización.
Se establecieron dos grupos de animales los cuales fueron alimentados hasta los 21 días de edad. El cultivo microbiano en sustrato sólido se mezcló, diariamente, de forma manual con la dieta basal. Los grupos experimentales fueron:
Grupo RL8 (II): con adición de sustrato sólido conteniendo Streptomyces RL8 a 108 ufc·g-1 de pienso.
Los animales se alojaron en jaulas metálicas a una densidad de 25 aves m2 hasta los 18 días de edad, posteriormente se redistribuyen según el 2 tratamiento a 12-13 aves m2 según (García, 2011). El sistema de vacunación de los animales consistió en una dosis de Marek y Gumboro el primer día de edad.
Los muestreos se ejecutaron a los 21 días de edad de los animales, los cuales se pesaron y sacrificaron por desangramiento de la vena yugular descrito por Lissette (2015). Se tomó una muestra de 1 mL de sangre por cada animal en tubos conteniendo heparina sódica. Se determinó el efecto de la cepa de Streptomyces RL8 sobre los parámetros de crecimiento en función de los siguientes indicadores: Peso vivo, Ganancia de peso vivo (GMD), Incremento de Peso (IP), Peso relativo de: Pechuga y Piernas. Para analizar los parámetros morfométricos se pesaron, Intestino Delgado (ID), Intestino Grueso (IG), los Ciegos vacíos, Hígado y Pechuga. Se determinó el peso del bazo como órgano inmune en una balanza técnica Sartorius BL 1 500 según - (Asghar et al., 2015). El peso relativo de estos órganos se expresó en g·kg -1 de peso vivo del animal descrito por (Herrera et al., 2007; García, 2011).
A las muestras de sangre de cada animal se le determinó la hemoglobina (Hb) (g·dl - 1), hematocrito (Ht) (%) y Concentración de Hemoglobina Corpuscular Media (CHCM) (g·dl -1), linfocitos (%), glóbulos blancos (GB), heterófilos (%) y eosinófilos (%) (Asghar et al., 2015). Para la determinación de hemoglobina se utilizó el método de la cianometahemoglobina (Crosby et al., 1954), tomando 0,2 mL de sangre diluida con 5 mL del reactivo de Drabkin seguido de lectura a 540 nm después de 10 min, usando agua destilada como blanco.
Se utilizó el software STATISTICA 8.0.360 para Windows. Para los datos paramétricos se realizó un ANOVA. Para datos que no presentan una distribución normal se realizó la prueba a posteriori de Duncan para p< 0,05.
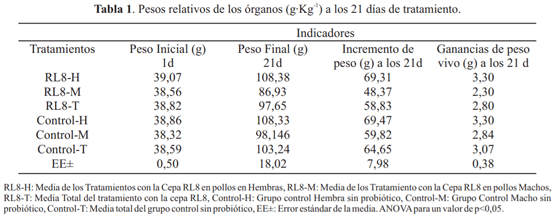
La tabla 1 muestra el comportamiento de los indicadores productivos de los animales durante la evaluación del microorganismo candidato a probiótico. Estadísticamente no hubo diferencias significativas entre el grupo tratado con la cepa de Streptomyces RL8 y el control. Los valores obtenidos en este experimento fueron muy inferiores a los que obtuvo (García, 2016; Rahimi & Khaksefidi, 2006b) al tratar pollos de ceba tratados con Lactobacillus spp. Todo parece indicar que el probiótico utilizado no ejerce efecto sobre el peso de los pollos evaluados.
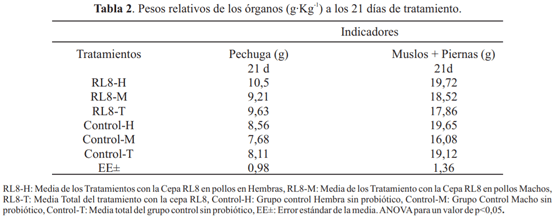
La tabla 3 muestra los resultados de los indicadores morfométricos de las aves a los 21 días de edad. No se encontraron diferencias significativas para el peso relativo del hígado, intestino delgado, intestino grueso y ciego; quizás debido a que los aditivos microbianos evaluados no ejercieron acción en estos órganos, efecto similar al observado por Milián (2009), Rondón (2009), Gunal et al. (2006) y García (2011), al evaluar pollos de engorde con cepas de Lactobacillus pentosus (ex Fred 1921) Zanoni et al. 1987 LB 31, Wickerhamomyces anomalus (E.C. Hansen) Kurtzman, Robnett & Basehoar-Powers 2008 LV6, Bacillus subtilis (Ehrenberg, 1835) Cohn, 1872 y Lactobacillus salivarius Rogosa et al. 1953, respectivamente (García, 2011).
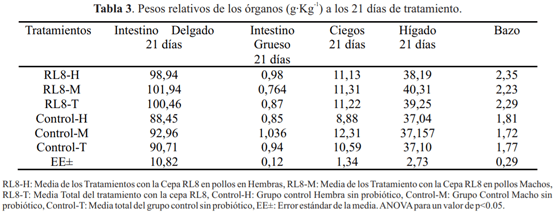
La tabla 4 muestra los resultados del análisis hematológico. Aunque los valores de hemoglobina (Hb) y hematocrito (Hto) se mantuvieron dentro de los rangos normales de crianza (23-55 % y 7,0-18,6 g·dL-1 , respectivamente (Anon, 2013)) en ambos g r u p o s, e st e ú l t i m o p a r á m e t r o f u e significativamente superior en el grupo tratado con Streptomyces RL8. Sin embargo, estos valores de hemoglobina y hematocrito fueron inferiores a los que obtuvo (Fernández et al., 2014) en pollos de ceba, pero coinciden con los obtenidos por García (2011) al evaluar L. pentosus LB-31, W. anomalus LV-6 y su mezcla en pollos de engorde; y con Gutiérrez & Corredor-Matus (2017) quienes eva lua ron pollos de c eba tr a t ados con Saccharomyces cerevisiae Meyen ex E.C. Hansen 1883, Lactobacillus acidophilus (Moro 1900) Hansen & Mocquot 1970, B. subtilis y una mezcla de los tres.

- Anon, 1993. Removal of blood from laboratory mammals and birds. First report of the BVA/FRAME/RSPCA/UFAW joint working group on refinement. Laboratory Animals, 27: 1-22.
- Asghar, A.; Shawrang, P. & Shakorzadeh, S. 2015. Immune response of Salmonella challenged broiler chickens fed diets containing Gallipro, a Bacillus subtilis probiotic. Probiotics and Antimicrobial Proteins, 7: 24–30.
- Avilez-Colon, B.L.; Rugeles-Pinto, C. C.; JabibRuiz, L. & Herrera-Benavides, Y.M. 2015. Parámetros hematológicos en pollos de engorde criados en una granja de producción cerrada en el trópico bajo. Revista Medica Veterinaria, 29: 33-39.
- Awad, W.; Ghareeb, K. & J., B. 2010. Effect of addition of a probiotic micro-organism to broiler diet on intestinal mucosal architecture and electrophysiological parameters. Animal Physiology and Animal Nutrition, 94: 486-494.
- Barnes, H.J.; Vaillancourt, J. P. & Gross, W. B. 2003. th Colibacillosis diseases of poultry. 11 Ed, Section II, Chapter 18.
- Berdy, J. 2005. Bioactive microbial metabolites. Journal of Antibiotics (Tokyo), 58: 1-26.
- Cardoso, L.; Da Silva, C. & Rangel, P. 2014. Efeitos do uso de probióticos na resposta imunológica e nos parâmetros sanguíneos das aves. Revista Eletrônica Nutritime, 11: 3450-3464.
- Collins, M. D. & Gibson, G. R. 1999. Probiotics, prebiotics, and synbiotics: approaches for modulating the microbial ecology of the gut. The American Journal of Clinical Nutrition, 69: 1042-1057.
- Crosby, W.H.; Munn, J.I. & Furth, F.W. 1954. Standardizing a method for clinical hemoglobinometry. U.S. Armed Forces Med, 5: 693-703.
- Duncan, B. 1955. Multiple range and multiple F test. Biometrics, 11: 1-42.
- Fernández, H.T.; Morales, M.; Amela, M.I.; Salerno, C.; Rodríguez Ganduglia, H.; Arenaz, F. & Zamponi, A.M. 2014. Efectos de la adición de probiótico (Bacillus subtilis) y omega 3 (Salvia hispanica L.) sobre los parámetros sanguíneos en pollos parrilleros Revista de Agronomía del Noroeste de Argentina, 34: 113-116.
- García, M. 2016. Obtención de actinomicetos marinos con acción probiótica en ostiones y camarones. Tesis en opción al grado c i entífi co de Doc tor en Ci enc i a s Veterinarias. Centro de Bioactivos Químicos. Universidad Central "Marta Abreu" de Las Villas. Santa Clara, Cuba, 150 pp.
- García, Y. 2011. Obtención de microorganismos con actividad probiótica a partir de excretas de pollos de ceba fermentadas. Tesis en opción al grado científico de Doctor en Ciencias Veterinarias. Departamento de Fisiología y Bioquímica. Instituto de Ciencia Animal, La Habana. 184 pp.
- Gunal, M.; Yayli, G. & Kaya, O. 2006. The effects of antibiotic growth prometer, probiotic or o rg a n i c a c i d s u p p l eme n t a ti o n o n performance, intestinal microflora and tissue of broilers. Internacional Journal Poultry Science, 5: 149-155.
- Gutiérrez, l. & Corredor-Matus, J.R. 2017. Parámetros sanguíneos y respuesta inmune en pollos de engorde alimentados con probióticos. Veterinaria y Zootecnía, 11: 81- 92.
- Hassan-Khan, S.; Nasir-Mukhtar, M.A.; Rehman, A. & Fareed, G. 2011. Effects of supplementation of multi-enzyme and multi-species probiotic on production performance, egg quality, cholesterol level and immune system in laying hens. Journal of Applied Animal Research, 39: 386-398.
- Haile, Y. & Chanie, M. 2014. Comparative aspects of the clinical hematology of birds: A Review. British Journal of Poultry Sciences, 3: 88-95.
- Herrera, I.; Ramón, I. & Muñiz, O. 2007. Eficiencia Técnica y Económica en la Producción Avícola de Pollos de Engorda. Facultad de estudios superiores Cuatitlán. Departamento de Ciencias Sociales. Departamento de Ciencias Pecuarias Producción. (citado el 14 de marzo del 2017).
- La Ragione, R.M.; Coles, K.E.; Jorgensen, F.; Humphrey, T.J. & Woodward, M.J. 2001. Virulence in the chick model and stress tolerance of Salmonella enterica serovar Orion var. 15+. International Journal of Medical Microbiology, 290: 707–718.
- Lanoot, B. 2005. Improved taxonomy of the genus Streptomyces. PhD thesis, Faculty of Sciences, Ghent University, Ghent, Belgium. 42 pp.
- Lara-Mantilla, C. & Burgos-Portacio, A. 2012. Potencial probiótico de cepas nativas para uso como aditivos en la alimentación a v í c o l a . Re v ist a Co l omb i a n a d e Biotecnología, 14: 31-40.
- Lino-Navarro, M., León Quispe, J. & Huamán Iturrizaga, M. 2016. Evaluación de la capacidad antagonista de un antimicrobiano producido por Streptomyce sp. CEPA13A-2 frente a microorganismos resistentes a BLactámicos de origen hospitalario. Revista Peruana de Investigación Materno Perinatal, 5: 28-34.
- Lissette, S. 2005. Problemas del pollo de engorde antes y después del beneficio-pollo en canal. Revista Electrónica de Veterinaria R E D V E T , 6 : http://www.veterinaria.org/revistas/redvet/ n060605/060517.pdf
- Marietto-Gonçalves, G.A.; Curotto, S.M.R.; Baptista, A.A.S.; Donato, T.C.; Takazira, R.K.; Sequeira, J.L. & Andreatti Filho, R.L. 2014. Effects of Lactobacillus Probiotic, P22 Bacteriophage and Salmonella typhimurium on the Heterophilic burst activity of broiler chickens. Brazilian Journal of Poultry Science, 16: 257-264.
- Mahajan, G. B. & Balachandran, L. 2011. Antibacterial agents from actinomycetes-a review. Front Biosci. (Elite ed.) 4: 240-253.
- Milián, G. 2009. Obtención de cultivos de Bacillus spp. y sus endosporas. Evaluación de sus actividad probiótica en pollos (Gallus gallus domesticus). Instituto de Ciencia Animal. 134 pp.
- Miroslava, M.; Viola, S.; Klaudia, B.; Andrea, L. & Sona, G. 2004. Effect of probiotic Activity of Enterococcus faecium EE3 strain against Salmonella infection in Japanese quails. Bulletin of the Veterinary Institute in Pulawy, 48: 387-390.
- Pérez, M.; Laurencio, M.; Rondón, A.J.; Milian, G.; Bocourt, R. & Arteaga, F. 2011. Actividad antimicrobiana de una mezcla probiótica de exclusión competitiva y su estabilidad en el tiempo. Salud Animal, 33: 147-153.
- Procópio, R. E.; da Silva, I. R.; Martins, M. K.; de Azevedo, J. L. & de Araújo, J. M. 2012. Antibiotics produced by Streptomyces. Braz. Journal Infections Diseases, 16: 466- 471.
- Rahimi, S. & Khaksefidi, A. 2006. A comparison between the effects of a probiotic (Bioplus 2B) and an antibiotic (virginiamicin) on the performance of broiler under heast stress condition. Iran Journal of Veterinary Research, 7: 23-28.
- Rondón, A. J. 2009. Obtención de biopreparados a partir de lactobacilos autóctonos del tracto digestivo de pollos y evaluación de su efecto probiótico en estos animales. La Habana. Instituto de Ciencia Animal. 131 pp.
- Rondón, A.J.; Samaniego, L.M.; Bocourt, R.; Rodríguez, S.; Milián, G.; Ranilla, M.J.; Laurencio, M. & Pérez, M. 2008. A isl a m i e n t o , i d e n t i f i c a c i ó n y caracterización parcial de las propiedades probióticas de cepas de Lactobacillus sp. procedentes del tracto gastrointestinal de pollos de ceba. Ciencia y Tecnológia Alimentaria, 6: 56-63.
- Tannock, G.W. 1999. A fresh look at the intestinal microflora.In: Probiotics. A Critical Review. G. W. Tannock. Horizon Scientific Press. England, 161 pp.
- Ullah, I.; Arshad, M.; Chuadhry, M.J.I.; Noureen, U.; Jadoon, W. A. & Jadoon, M.A. 2012. Actinomycetes screening for bioactive potential isolated from the moist forest soils of Pakistan. Records: Zoological Survey of Pakistan, 21: 10-13.
- Veizaj-Delia, E.; Piu, T.; Lekaj, P. & Tafaj, M. 2010. Using combined probiotic improve growth performance of weaned piglets on farm conditions. Livestock Science, 134: 249-25.
- Vleck, C.M.; Vertalino, N. & Vleck, D. 2000. Stress, cortico-sterone, and heterophil to lymphocyte ratios in free-living ade penguins. The Condor, 102: 392–400.






