INTRODUCCIÓN
La enteritis necrótica (EN) se ha estimado que causa alrededor de 6 mil millones de dólares americanos en pérdidas anuales para la industria avícola a nivel global (Wade y Keyburn, 2015). Por consiguiente, varios estudios se han realizado con el objetivo de desarrollar tratamientos alternativos, desde la prohibición de los antibióticos promotores de crecimiento (APC) en varias regiones del mundo.
La inducción experimental de daños intestinales para causar EN en pollos de engorda ha sido a menudo acompañada con la infección con Eimeria, previo a la inoculación con Clostridium perfringens (Wu et al., 2010). Adicionalmente, el consumo de dietas altas en proteína no sólo causa un incremento de nitrógeno en la digesta y excretas, sino también en el substrato para el crecimiento C. perfringens (Lan et al., 2005; Timbermont et al., 2011). Entonces, reducir la proteína cruda (PC) de la dieta puede contribuir a la reducción los niveles de C. perfringens, aunque beneficiando a las bacterias utilizadoras de carbohidratos e.g. el almidón que escapa de la digestión sirve como sustrato para la fermentación (M'Sadeq et al., 2015).
Ya que el Bacillus amyloliquefaciens CECT 5940 produce amilasa para la degradación de almidón, su suplementación puede favorecer la proliferación de bacterias ácido-lácticas (Diaz, 2007). Además, esta bacteria puede cruzarse con otras familias de bacterias que son capaces de usar lactato para producir butirato como Ruminococcaceae y Lachnospiraceae (Onrust et al., 2015). El butirato es conocido por tener un efecto positivo sobre el metabolismo de la energía y salud del intestino (Topping and Clifton, 2001). De manera que la reducción de PC en combinación con el uso de B. amyloliquefaciens CECT 5940 puede tener un efecto sinérgico en el control de C. perfringens evitando los mayores problemas asociados a la EN en pollos de engorda.
MATERIALES Y MÉTODOS
El estudio fue realizado por el Dr. Shubiao Wu en la New England University en Australia. Se utilizaron 480 pollos de engorda Ross 308 de un día de edad con 42.0 ± 0.1 g de peso inicial, los cuales fueron distribuidos aleatoriamente en cuatro tratamientos experimentales con ocho réplicas de 15 pollos cada una. Se formularon dos dietas basales. La dieta con contenido “normal” de PC (NPC) estuvo compuesta de trigo, sorgo y pasta de soya, formulada para cubrir las recomendaciones de aminoácidos de Evonik (AMINOChick® 2.0) para las fases de inicio (día 1 a 10), crecimiento (día 11-24) y finalización (día 25 a 35), las cuales aportaron 23% de PC, 21.49% de PC y 19% de PC, respectivamente. La dieta basal con contenido “reducido” de PC (RPC) contenía 2% menos PC comparado con la dieta NPC en cada fase, lo cual fue posible con la suplementación DL-metionina, L-lisina HCl, L-treonina, L-valina, L-isoleucina, y L-arginina. Los tratamientos consistieron en: 1) dieta NPC sin probiótico; 2) dieta NPC con 0.5 kg/kg de Ecobiol® 500 (1 × 109 UFC/g de B. amyloliquefaciens CECT 5940); RPC sin probiótico; y 4) dieta RPC con 0.5 kg/kg de Ecobiol® 500. Todos los pollos fueron sometidos al mismo desafío, el cual consistió en la inoculación con un 1 mL de Eimeria (E. máxima, E. acervulina, con 5000 oocistos esporulados cada una y E. brunetti con 2500 oocistos esporulados) al día 9 y 1 mL de C. perfringens (1×108 UFC) a los días 14 y 15 (Fact & Figures Poultry n°15179). El alimento y agua fueron ofrecidos a libre acceso durante el periodo experimental. La forma física de la dieta fue pellets.
Peso corporal vivo (PCV) y consumo de alimento fueron registrados en el día 35, para el cálculo de la ganancia diaria promedio de peso (GDP) y el índice de conversión alimenticia (ICA). Diariamente se registró la causa de muerte, fecha y peso de los pollos muertos. En el día 16, cuatro pollos por corral fueron seleccionados al azar y pesados. Estos pollos fueron noqueados por shock eléctrico, y se tomaron muestras de sangre, el suero fue separado para análisis de ácido úrico.
Muestras de 1 mL del contenido cecal mezclado fue usados para análisis por extracción de DNA de acuerdo con Kheravii et al. (2017). El resto del contenido cecal fue usado para análisis de contenido de ácidos grasos volátiles (AGVs) siguiendo el método descrito por Jensen et al. (1995). Muestras de la digesta ileal colectadas en el día 35 fueron liofilizadas a -50°C y molidas finamente. La dieta y muestras de la digesta ileal liofilizadas fueron analizadas para determinar su contenido total de aminoácidos (AA) en el laboratorio de Evonik en Singapur. La digestibilidad ileal aparente (DIA) de los AA fue calculada de la siguiente formula; DIA = (100-(100×Id×AAdc/Idc×AAd) donde: Id=contenido del marcador (TiO2) en la materia seca (MS) de la dieta, AAdc=contenido de AA en la MS de la digesta, Idc=contenido de TiO2 en la MS de la digesta, AAd=contenido de AA en la MS de la dieta. En el día 35, aproximadamente 1 kg de cama de cada corral fue colectado aleatoriamente para evaluar la humedad de la cama por secado de las muestras en estufa a 105°C por 24 horas. En el día 35, cuatro pollos por corral fueron seleccionados aleatoriamente y sacrificados. Entonces, se cortaron las pechugas muslos y grasa abdominal. Las lesiones de las almohadillas de las patas fueron evaluadas con una escala de 0 a 4, de acuerdo con el grado de severidad de la lesiones (Welfare Quality, 2009). Los datos fueron analizados con el paquete estadístico SPSS versión 22. La medias de los tratamiento fueron comparados empleando la prueba de Tukey. La significancia estadística fue declarada con un valor de P<0.05.
RESULTADOS Y DISCUSIÓN
Desempeño productivo y digestibilidad ileal aparente después de un periodo de 35 días
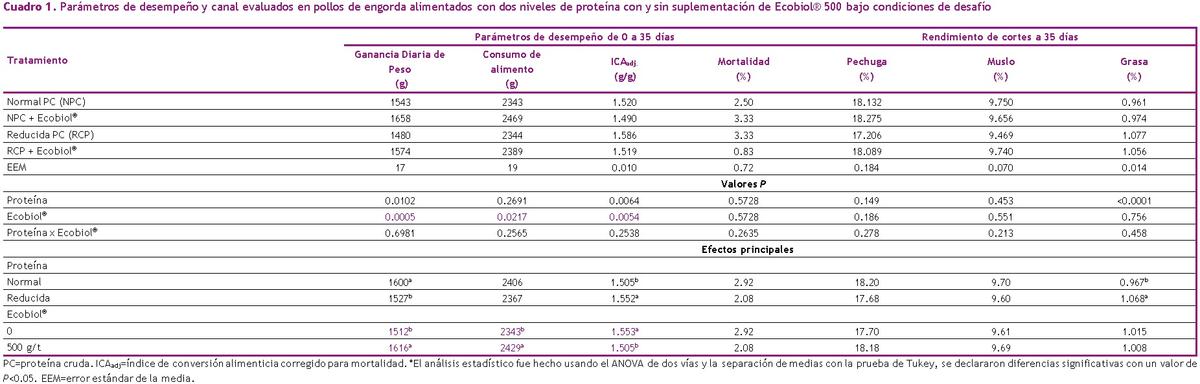
Los resultados de los parámetros de desempeño y rendimiento de cortes son presentados en el Cuadro 1. No se observaron interacciones entre la PC de la dieta y Ecobiol® (P>0.05) para desempeño o rendimiento de los cortes. La reducción de PC en condiciones de desafío resultó en bajo PCV y alto ICA (P<0.05), pero no hubo diferencia en consumo de alimento (P>0.05). La reducción de PC resultó en mayor contenido de grasa abdominal (P<0.05). Por otro lado, la suplementación de Ecobiol® resulto en mayor PCV y consumo de alimento, aunque redujo el ICA (P<0.05), independientemente del nivel de PC en la dieta. No se observaron cambios significativos en el rendimiento de cortes con la inclusión de Ecobiol®. No se observaron cambios en la mortalidad por la inclusión de Ecobiol® o nivel de PC en la dieta.
En nuestro estudio no fue posible mantener el desempeño productivo de los pollos cuando se redujo la PC en la dieta bajo condiciones de desafío. Usualmente un bajo PCV es atribuible al bajo consumo de alimento, pero en este caso con desafíos a la salud intestinal, el crecimiento puede ser afectado, debido a un incremento en los requerimientos de AA los cuales son usados para procesos metabólicos (Sandberg et al., 2007) o derivados a para nutrir el sistema inmunológico innato (Klasing, 2007). La suplementación de Ecobiol® mejoró el crecimiento, lo cual es consistente con estudios previos conducidos también bajo condiciones de desafío (De Oliveira et al., 2019). Además, el desempeño en dietas RPC con la suplementación de Ecobiol® fue similar a los resultados observados en los pollos con la dieta NPC sin Ecobiol®.
Excluyendo la grasa abdominal, no hay cambio significativo en las características de la canal con el nivel de PC en la dieta o suplementación con Ecobiol®. Generalmente, un incremento en la relación almidón:proteína está asociada con mayor deposición de grasa (Crystal et al., 2020), porque los pollos alimentados con dieta bajas en PC consumen relativamente más energía que proteína y depositan este exceso de energía en forma de grasa (Gous et al., 1990) de esta manera se explican los resultados obtenidos.
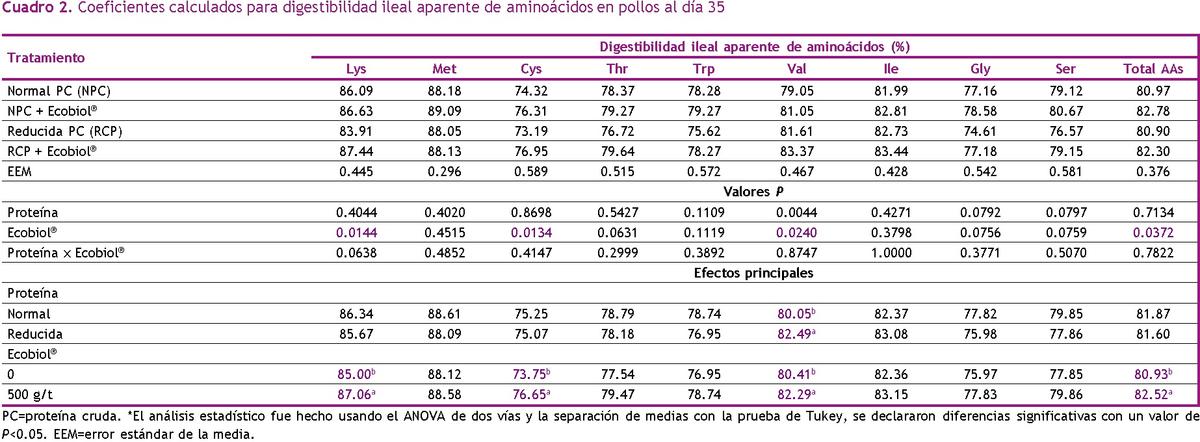
La DIA calculada de los AA se muestran en el Cuadro 2. No se observaron interacciones entre el nivel PC y Ecobiol® (P>0.05) para DIA. La suplementación con Ecobio® incremento significativamente los coeficientes de digestibilidad de todos los AA, especialmente en lisina, cistina y valina (P<0.05) independientemente del nivel de proteína. Excepto por el incremento en la DIA de valina (P<0.05), la reducción de PC no afecto otros coeficientes de DIA (P > 0.05).
Previamente ya ha sido observado que pollos desafiados con la vacuna en contra de la coccidia han incrementado la pérdida endógena de AA, lo cual parcialmente explica el descenso de los valores de DIA y DIS (Adedokun et al., 2016). Aunque estas pérdidas no fueron medidas en este estudio, hay una gran posibilidad que Ecobiol® haya contribuido a reducir las pérdidas endógenas de AA y, por consiguiente, se tuvieron valores altos de DIA (especialmente para Lisina, Cistina y Valina). El incremento de alrededor de 2% de digestibilidad, principalmente de lisina, explica potencialmente los resultados que obtuvimos en los cuales la suplementación de Ecobiol® en dietas RPC resulto en desempeño similar de pollos alimentados con a dietas NPC sin Ecobiol®.
Parámetros de salud, ácidos grasos de cadena corta y cuantificación microbiana al día 16
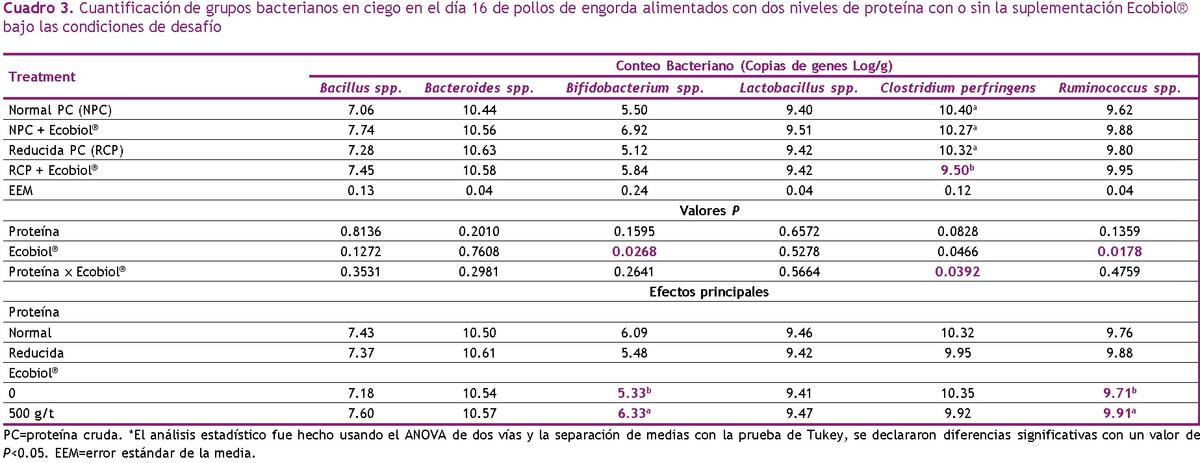
Los resultados del análisis del dPCR se presentan en el Cuadro 3. Hubo una interacción entre nivel de PC y la suplementación de Ecobiol® para conteo de C. perfringens, donde el valor más bajo se observó en el grupo alimentado con la combinación de ambos (P<0.05). Independientemente del nivel de PC, los pollos alimentados con Ecobiol® tuvieron mayor conteo cecal de Bifidobacterium y Ruminococcus spp. La reducción solo de PC no afectó la población cecal de bacterias (P>0.05).
Los resultados de cuantificación de AGVs se muestran en el Cuadro 4. No se observaron interacciones entre el nivel de PC y la suplementación de Ecobiol® (P>0.05) sobre el contenido de AGVs. Los pollos alimentados con dietas que contenían Ecobiol® mostraron mayor contenido cecal de acetato, lactato y butirato, mientras que el isobutirato e isovalerato fueron reducidos (P<0.05) independientemente del nivel de PC. La reducción de proteína causó un incremento en el contenido cecal de acetato, propionato y butirato, aunque el lactato fue disminuido (P<0.05).
El Bacillus amyloliquefaciens CECT 5940 tiene la capacidad de producir amilasas que podrían mejorar la digestión del almidón en la dieta y favorecer la proliferación de bacterias ácido-lácticas (Diaz, 2007). Esto podría explicar parcialmente la mayor concentración de ácido láctico con la suplementación con Ecobiol®, pero no con la reducción de proteína únicamente (Cuadro 4). Tanto el lactato como el acetato producidos por miembros de Bifidobacterium spp. pueden cruzarse con otras familias de bacterias como Ruminococcaceae y Lachnospiraceae que son capaces de usar lactato para producir butirato (Onrust et al., 2015; Moens et al., 2017). Dado que la suplementación con Ecobiol® aumentó tanto Bifidobacterium como Ruminococcacus spp. (Cuadro 3) podemos asumir un beneficio cooperativo de este mecanismo de alimentación cruzada y, por lo tanto, resulta en una alta producción cecal de acetato y butirato (Cuadro 4). Además, el butirato juega un papel importante en el control de C. perfringens (Timbermont et al., 2010) y esto explica la reducción observada en nuestro estudio con la combinación de PC reducida y la inclusión de Ecobiol® (Cuadro 3).
El lactato se puede convertir en propionato a través de reacciones enzimáticas, que son moduladas por algunos miembros de Lachnospiraceae (Flint et al., 2015), que no cuantificamos pero que potencialmente podrían explicar la mayor producción de propionato con el grupo alimentado con PC reducida. Se sabe que el butirato y el acetato tienen un efecto positivo sobre el metabolismo energético y la salud intestinal (Topping y Clifton, 2001) y tanto la suplementación de Ecobiol® como la reducción de PC mejoraron la producción de estos dos AGVs. Los ácidos isovalérico e isobutírico son productos de la fermentación bacteriana de leucina y valina, respectivamente (Allison 1978). Estos dos AGVs aumentan en presencia de Eimeria y C. perfringens juntos (Stanley et al.2014) y la reducción de estos dos AGVs con la suplementación con Ecobiol® puede indicar que B. amyloliquefaciens CECT 5940 es capaz de mejorar los efectos negativos de la desafío.
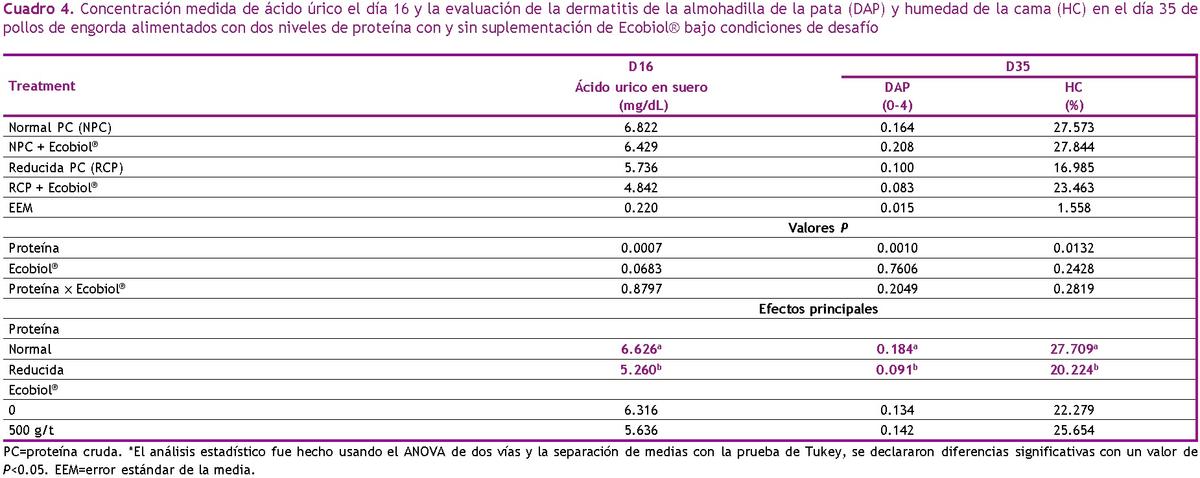
Los resultados del ácido úrico (AU) sérico medido el día 16 y la evaluación de la dermatitis de la almohadilla de la pata (DAP) y la humedad de la cama (HC) el día 35 se presentan en el Cuadro 5. No hubo interacción significativa entre el nivel de PC y Ecobiol® para UA en día 16 o DAP y HC el día 35 (P>0.05). Además, no se observaron cambios significativos con la suplementación de Ecobiol® en UA, HC o DAP (P>0.05). Por otro lado, observamos una reducción del AU en el día 16 con la reducción de PC, así como reducciones de HC y, en consecuencia, reducción de DAP (P<0.05).
Nuestro estudio anterior mostró que Ecobiol® puede mejorar las puntuaciones de calidad de la cama y DAP (De Oliveira et al., 2019), pero no fue el caso en nuestro estudio actual. Por otro lado, los beneficios de la reducción de la PC se mencionan a menudo en la literatura. Un contenido reducido de PC en las dietas para pollos de engorda puede reducir la ingesta de agua porque hay una menor necesidad de excretar el exceso de nitrógeno (Bailey, 1999); en consecuencia, existe un riesgo reducido de cama húmeda y un riesgo reducido de lesiones en las patas (Martland, 1985). Además, las experiencias de campo muestran que los niveles bajos de PC en las dietas de pollos de engorda pueden reducir el riesgo de problemas de digestión y enteritis necrótica (van Harn et al., 2019).
Tanto la reducción de PC como la suplementación con Ecobiol® tienen sus propios beneficios para mejorar la salud y el bienestar intestinal, y muchos de ellos se confirmaron en el estudio actual. La falta de interacciones entre Ecobiol® y la reducción de PC significa que ambas respuestas son independientes, excepto en el caso de la reducción de C. perfringens en el ciego. En conclusión, la reducción de proteínas contribuye a mejorar la calidad de la cama y disminuir la dermatitis de la almohadilla plantar, pero proporcionar Ecobiol® en combinación con proteína reducida podría ser una solución segura para evitar pérdidas de rendimiento con infecciones patógenas inesperadas.
CONCLUSIONES
Independientemente del nivel de proteína, la alimentación con B. amyloliquefaciens CECT 5940 (Ecobiol®) promovió el rendimiento (ICA y peso corporal), mejoró la digestibilidad ileal aparente (Lisina, Cistina y Valina), aumentó la población cecal de Bifidobacterium y Ruminococcus spp., y aumentó la producción cecal de acetato, lactato y butirato mientras disminuye el isobutirato y el isovalerato.
Independientemente de la suplementación con Ecobiol®, la reducción de proteínas redujo el ácido úrico plasmático, la humedad de la cama, la dermatitis de la planta de la pata y el aumento de la producción cecal de acetato, butirato y propionato. Un efecto sinérgico de la reducción de proteínas y la suplementación con Ecobiol® resultó en una disminución de C. perfringens en el ciego.



.jpg&w=3840&q=75)