Mycoplasmosis Aviar. El poder de un enemigo oculto.
Publicado: 22 de agosto de 2022
Por: Luis Miguel Gómez-Osorio, PhD. Country Manager Huvepharma nv. Colombia
Mensajes claves:
1. Mycoplasma gallisepticum y Mycoplasma synoviae son los principales responsables de las enfermedades respiratorias en aves con pérdidas económicas enormes para la industria avícola.
2. Es un microorganismo bastante inteligente, ya que hábilmente evade la respuesta inmune y se esconde para sobrevivir dentro de células no fagocíticas en momentos estresantes para la bacteria como las semanas de choques antimicoplásmicos.
3. Su control debe ser integral (bioseguridad, vigilancia y erradicación de lotes infectados) o estar basado en estrategias tanto de corto plazo (reducción de microorganismos en tracto respiratorio con terapia antibiótica o con vacunación) y de largo plazo (control de lotes positivos considerando su erradicación)
4. Debería existir una política de prevención, control y erradicación de la enfermedad por parte de las entidades gubernamentales y subsidios para erradicación de lotes positivos.
5. El programa preventivo de los 7 pasos es una guía fundamental para lograr su control.
2. Es un microorganismo bastante inteligente, ya que hábilmente evade la respuesta inmune y se esconde para sobrevivir dentro de células no fagocíticas en momentos estresantes para la bacteria como las semanas de choques antimicoplásmicos.
3. Su control debe ser integral (bioseguridad, vigilancia y erradicación de lotes infectados) o estar basado en estrategias tanto de corto plazo (reducción de microorganismos en tracto respiratorio con terapia antibiótica o con vacunación) y de largo plazo (control de lotes positivos considerando su erradicación)
4. Debería existir una política de prevención, control y erradicación de la enfermedad por parte de las entidades gubernamentales y subsidios para erradicación de lotes positivos.
5. El programa preventivo de los 7 pasos es una guía fundamental para lograr su control.
Introducción:
Uno de los principales problemas que afecta la industria avícola es la presencia de enfermedades infecciosas que afectan las aves las cuales no las dejan llegar a su óptimo técnico y productivo. Dentro de este grupo de enfermedades, la infección por Mycoplasma spp. juega un papel clave debido a las inmensas pérdidas en la industria avícola por la disminución en la producción de huevo, tasa de crecimiento y aumento en las tasas de decomiso en planta de sacrificio (Kleven, 2008). Se ha estimado que dichas pérdidas pueden oscilar entre un 10 a 20% en producción de huevo y entre un 3-10% en pollo de engorde en lotes con Mycoplasmosis (Bradbury and Morrow, 2008).
Microorganismo
Aunque se han reportado más de 120 especies de Mycoplasma, tan solo 20 de ellas son de importancia en aves. Las más patógenas en pollo de engorde son Mycoplasma gallisepticum (MG) y Mycoplasma synoviae (MS) y en pavos son M. meleagridis (MM) y M. iowae (MI) (Umar et al, 2017). Mycoplasmas son miembros de la clase Mollicutes (división Tenericutes). Son bacterias libres y auto replicantes, las cuales son conocidas por tener el genoma más pequeño de las bacterias (580-1350 kb) con un porcentaje de Guaninas (G) + Citosinas (C) del 23 al 40%. La pared celular está ausente y su membrana celular tiene esteroles los cuales la diferencian de otros microorganismos (Shoaib, 2019). Para MG y MS se han descrito factores de virulencia los cuales participan en la adhesión a la membrana del hospedero mediante proteínas especializadas (molécula de cito-adhesión GapA, mientras que otra molécula, la CrmA, facilita la unión), evasión de la respuesta inmune, auto-injuria tisular del hospedero, manifestaciones autoinmunes, producción de toxinas, componentes tóxicos de membrana y alteraciones del metabolismo celular del hospedero (Umar et al, 2017).
Patogenia y respuesta inmune
La infección por MG y MM causa la enfermedad respiratoria crónica (CRD) en pollos y causa sinusitis infecciosa en pavos por MM y MI. Lo signos incluyen estertores respiratorios, tos secreción nasal y en pavos, sinusitis. La infección por MS se conoce frecuentemente como sinovitis infecciosa, tanto aguda como crónica en pollos, la cual involucra la membrana sinovial de las articulaciones y tendones. Sin embargo, durante los últimos años, MS se ha asociado cada vez menos con sinovitis, pero más con aerosacculitis en pollos y algunas veces en pavos (Khalifa et al, 2013).
La patogénesis de Mycoplasmas en las aves se resume en la Figura 1.
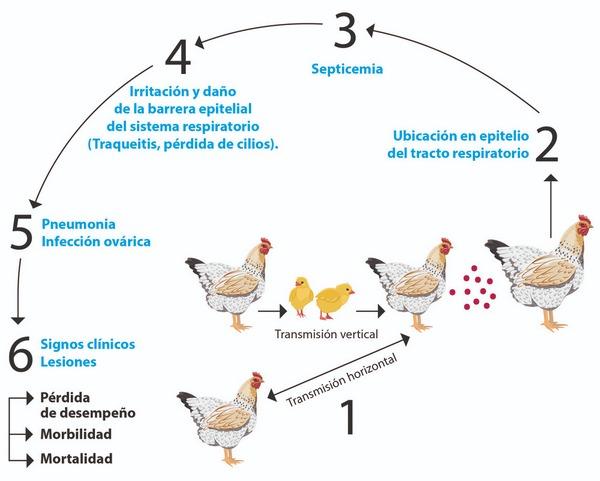
Figura 1. Transmisión de Mycoplasma gallisepticum
La interacción de Mycoplasmas con el sistema inmune es compleja ya que algunas especies se resisten a los mecanismos de eliminación. Algunas especies son capaces de inhibir la fagocitosis y la producción de citoquinas proinflamatorias como la interleukina (IL) IL-1 y el factor de necrosis tumoral (TNF). MG por ejemplo es capaz de cambiar varias veces el antígeno que se está presentando al sistema inmune. Una vez Mycoplasma se une a las células del sistema inmune del hospedero, se desencadena una liberación de moco por parte de las células caliciformes. La patogenicidad de MG se puede complicar por su habilidad de penetrar y sobrevivir dentro de células no fagocíticas lo cual le permite su diseminación. Las infecciones por Mycoplasma spp. se asocian con un daño celular y tisular generado por el sistema inmune (Indiková et al, 2013). La Figura 2 muestra la interacción de la bacteria con el hospedero, respuesta inmune y efectos en otros órganos diferentes el sistema respiratorio.
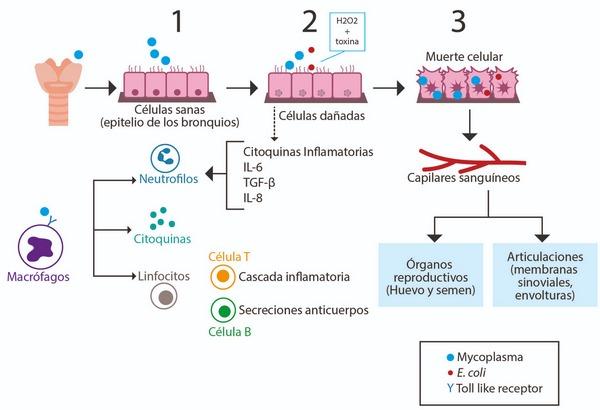
Figura 2. Interacción de Mycoplasma con el hospedero, respuesta inmune y diseminación hacia otros órganos. 1. Mycoplasma ingresa por vía aérea ocasionando ciliostasis y colonización. 2. Mycoplasma destruye los cilios, reduciendo la cantidad de moco, inhibiendo síntesis de proteínas y de DNA. 3. Diseminación sistémica por Mycoplasma y E.colicausando una respuesta inmune inflamatoria y enfermedad, pérdidas en producción y salud
Diagnóstico
El laboratorio es fundamental en el diagnóstico y por ende en el control de la Mycoplasmosis. Solo los signos clínicos y lesiones patológicas no son suficientes y confiables para apoyar un correcto desenlace. Un diagnóstico temprano y rápido es importante para prevenir la diseminación de la infección y limitar las pérdidas económicas de la industria avícola.
Existen tres métodos para el diagnóstico de MG y MS que son: aislamiento e identificación del microorganismo, detección de su material genético (DNA) e identificación de anticuerpos (prueba serológica) (OIE, 2008). Las pruebas serológicas disponibles son la prueba rápida en placa (SPA), inhibición de la hemaglutinación y la ELISA. Dichas pruebas son bastante usadas en el diagnóstico, sin embargo estos métodos son bastante demandantes de tiempo, laboriosos y de baja sensibilidad. Además, pueden tener reacciones inespecíficas y problemas de reacciones cruzadas con los reactivos lo cual hace bastante difícil la interpretación de los resultados. Los métodos serológicos son útiles para el monitoreo de los lotes y es un soporte en el diagnóstico cuando se sospecha de la infección (Ley, 2008). La ELISA se ha usado para detectar anticuerpos contra MG en tracto respiratorio y muestras de yema de huevo. SPA se pueden hacer en yema de huevo y se clasifican en positivos, sospechosos y negativos cuando los títulos son iguales o más altos que 1:10, 1:5 y más bajos que 1:5 respectivamente. Sin embargo, el aislamiento y la identificación del microorganismo es el “gold standard” para el diagnóstico por infecciones de mycoplasma a pesar de la dificultad que esto conlleva (Umar et al, 2016).
Prevención
Aunque todos los mycoplasmas que son patogénicos en avicultura se transmiten verticalmente, realizar el reemplazo de lotes libres de mycoplasma es esencial. Para esto deberían existir políticas gubernamentales de prevención, control y de apoyo o subsidios para el avicultor. El primer paso es adquirir huevos fértiles y aves libres de MG y MS los cuales se someten al tratamiento de huevos fértiles a temperaturas de 46°C por 12-14 horas o con terapia antibiótica ya sea in-ovo o por sumergimiento de los huevos en soluciones que contienen antibióticos (Kleven, 2008; Umar et al, 2016). Un programa efectivo de bioseguridad es fundamental para mantener adecuadamente los lotes libres de la infección por mycoplasma. Sin embargo, existen zonas densas avícolas que están contaminadas y que incrementan el riesgo de exposición especialmente cuando hay vacíos en los programas de bioseguridad. Un sistema de monitoreo constante se vuelve esencial a la hora prevenir las infecciones y en caso de un brote de un lote, se vuelve supremamente crítico prevenir la contaminación de otros lotes.
La prevención se podría resumir en los siguientes 7 puntos estratégicos de control: 1. Romper el ciclo de la transmisión venérea en reproductores parentales (evaluaciones serológicas con cultivos de semen y vagina antes de la monta. 2. Programa de bioseguridad estratégico, es decir, granjas de una sola edad, programas todo dentro todo fuera, separación y control de tráfico, control de limpieza y desinfección. 3. Erradicación de lotes positivos a Mycoplasma mediante la rutina de evaluación serológica. 4. Quimioterapia de lotes infectados (programas antimicoplásmicos con estrategias de rotación y monitoreo). 5. Métodos de higiene en las prácticas de inseminación. 6. Destrucción de Mycoplasma dentro de los huevos con terapia (antimicoplásmicos). 7. Programas de vacunación (vacunas vivas y muertas)
Medicación
Mycoplasma es un microorganismo carente de pared celular, es por esto que son resistentes a los b-lactámicos como penicilinas y cefalosporinas. Sin embargo, ellos tienden a ser sensibles a macrólidos, tetracicilinas, fluoroquinolonas, pleuromutilinas, entre otros. No obstante, se ha reportado resistencia a varios de ellos (Gerchman et al, 2011; Gharaibeh and Al-Rashdan 2011). El tratamiento con antibióticos de reproductoras infectadas por mycoplasma disminuye la tasa de transmisión de las manifestaciones clínicas y el riesgo de transmisión transovárica a niveles menores del 0.1% (Gerchman et al, 2011; Kleven, 2008). La medicación antibiótica (por sumergir o inyectar los huevos) se ha empleado para reducir la transmisión por huevos y para mejorar la incubabilidad y la salud de la progenie cuando las gallinas están infectadas con MG (Nadeem et al, 2014). La Valnemulina (un derivado semisintético de las pleuromutilinas que actúa inhibiendo la iniciación de la síntesis proteica a nivel del ribosoma bacteriano) ha demostrado ser seguro y eficaz (Xiao et al, 2015). Tiamulinas, Tilosinas y Tetracicilinas, son las más usadas para prevenir la transmisión o como tratamiento profiláctico o metafiláctico en la CRD. Algunos productos como enrofloxacina o tilmicosina no están permitidos en todos los países.
Un programa antimicoplásmico típico en lotes de reproductoras positivas a MG o MS, podría ser la medicación continua por 5 a 7 días en el alimento o en el agua de bebida cada mes (Hong et al, 2015). Lo cual ocasionaría una reducción de las poblaciones de MG en el tracto respiratorio, potencialmente reduciendo el riesgo de transmisión a lotes cercanos (Mavromati et al, 2011). Aunque la medicación antibiótica es una herramienta efectiva para la reducción en la transmisión por el huevo, signos clínicos y lesiones, esta no eliminará completamente la infección de un lote y sí su uso es muy prolongado, generará resistencia con el tiempo. Si bien el uso de antibióticos son consideradas estrategias afectivas y útiles para disminuir pérdidas económicas por MG y MS, dicha solución nunca debería ser concebida como una solución a largo plazo (experiencia práctica del autor).
Vacunación
La vacunación puede ser una forma viable en granjas multi-edades donde no es posible sostener el status de aves libres de MG o MS. Entre las opciones se encuentran las cepas virulentas aisladas de campo como las bacterinas inactivadas en solución oleosa y vacunas vivas atenuadas (Kleven, 2008).
La mayor ventaja de las bacterinas oleosas es la protección contra pérdidas económicas que se generarían sin la introducción de una cepa viva. Entre las desventajas se encuentra sus altos costos, manipulación individual de aves y la falta relativa de protección contra la colonización por cepas de campo de MG. Un punto importante es que los anticuerpos circulantes no se detectan posterior a la vacunación y por eso una respuesta serológica palta odría ser un excelente indicador de colonización por una cepa de campo.
Cuando se usan vacunas vivas, se vuelve fundamental poderlas distinguir de las cepas salvajes. Además, se debe verificar si la vacuna fue capaz de colonizar exitosamente la mucosa respiratoria del ave y ejercer una respuesta inmune protectora frente a cepas salvajes. La secuenciación del gen vlhA se viene usando frecuentemente para diferenciar cepas vacunales tipo MSH de cepas de campo (Bayatzadeh et al, 2014). Desafortunadamente, ciertos perfiles de secuenciación de dicho gen no son exclusivos de cepas vacunales y algunas cepas de campo también comparten dichos perfiles. Recientemente se han propuesto otros genes como obg con el estudio de variantes alélicas con dos polimorfismos de nucleótido simple (SNPs del inglés single nucleotide polymorphisms) o la técnica de PCR con MAMA (del inglés melt-curved and agarose gel based mismatch amplification mutation assays) (Kreizinger et al, 2015) para distinguir cepas vacunales de cepas de campo.
Referencias:
- Bayatzadeh MA, Pourbakhsh SA, Ashtari A, Abtin AR, Abdoshah M. 2014. Molecular typing of Iranian field isolates Mycoplasma synoviae and their differentiation from the live commercial vaccine strain MS-H using vlhA gene. British Poultry Science 55: 148-156.
- Bradbury JM, Morrow C. 2008. Avian mycoplasmas. Poultry Diseases, p. 220–234
- Gerchman I, Levisohn S, Mikula I, Manso-Silvan L, Lysnyansky I. 2011. Characterisation of in vivo-acquired resistance to macrolides of Mycoplasma gallisepticum strains isolatedfrom poultry. Veterinary Research 42: 90.
- Gharaibeh S, Al-Rashdan M. 2011. Change in antimicrobial susceptibility of Mycoplasma gallisepticum field isolates. Veterinary Microbiology 150: 379-383.
- Hong YH, Kwon JS, Lee HJ, Song CS, Lee SW. 2015. Eradication of Mycoplasma synoviae from a multi-age broiler breeder farm using antibiotics therapy. Poultry Science 94: 2364-2368
- Indiková I, Much P, Stipkovits L, Siebert-Guille K, Szostak MP, Rosengarten R, Citti C. 2013. Role of the GapA and CrmA cytadhesins of Mycoplasma gallisepticum in promoting virulence and host colonisation. Infections and Immunity 81: 1618-1624.
- Khalifa KA, Abdelrahim ES, Badwi M, Mohamed AM. 2013. Isolation and molecular characterisation of Mycoplasma gallisepticum and Mycoplasma synoviae in chickens in Sudan. Journal of Veterinary Medicine: Article ID 208026, doi:10.1155/2013/208026
- Kleven SH. 2008. Control of Avian Mycoplasma Infections in Commercial Poultry. Avian Diseases 52:367-374
- Kreizinger Z, Sulyok KM, Pasztor A, Erdelyi K, Felde O, Povazsan J, Korosi L, Gyuranecz M. 2015. Rapid, simple and cost-effective molecular method to differentiate the temperature sensitive (ts+) MS-H vaccine strain and wild-type Mycoplasma synoviae isolates. PLoS One 10: e0133554
- Ley DH. 2008. Mycoplasma gallisepticum infection, in: Saif YM, Fadly AMJ, Glisson R, Mc Dougald LR, Nolan LK, Swayne DE, (Eds) Diseases of poultry, 12th ed., pp. 807-845 (Blackwell Publishing, Ames, IA)
- Lockaby SB, Hoerr. 1999.Virulence of Mycoplasma synoviae in Poultry: A Review. Worlds Poultry Science Journal Vol. 55
- Mavromati J, Mavromati E, Gjeta Z. 2011. The Effect of a macrolid antibiotic on the control of mycoplasmas and production efficiency in broilers. Biotechnology in Animal Husbandry 27: 721-731.
- Nadeem M, Yousaf A, Iqbal Z, Awais MM, Pervez BA. 2014. Prevalence, diagnosis and treatment of mycoplasmosis in game birds. World's Poultry Science Journal 70: 69-80.
- OIE. 2008. Avian mycoplasmosis (Mycoplasma gallisepticum, Mycoplasma synoviae) In: Manual of diagnostic tests and vaccines for terrestrial animals, 2008, pp. 525-541
- Shoaib M. Mycoplasmosis in Poultry. 2019. A Perpetual Problem. Journal of Microbiology and Biotechnology Food Science 6:1271-1275.
- Umar S, Munir MT, Rehman Z, Subhan S, Azam T, Shah MAA 2017. Mycoplasmosis in poultry: update on diagnosis and preventive measures. World's Poultry Science Journal, 73(1), 1-12. http://dx.doi.org/10.1017/S0043933916000830.
- Xiao X, Sun J, Yang T, Fang X, Wu D, Xiong YQ, Cheng J, Chen Y, Shi W, Liu YH. 2015. In vivo pharmacokinetic/pharmacodynamic profiles of valnemulin in an experimental intratracheal Mycoplasma gallisepticuminfection model. Antimicrob Agents Chemother 59: 3754-3760.
Publicación del Dr. Luis Miguel Gómez-Osorio en su perfil de la red profesional LinkenIn (Junio, 2022) y reproducido en engormix por gentileza del autor
Temas relacionados:
Referentes que Recomendaron :
Karina GaviñaRecomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Usuarios destacados en Avicultura

Lorena Ramos
Cargill
Nutricionista Senior en Cargill Protein, América Latina
Estados Unidos de América
Estados Unidos de América




