INTRODUCCION
Las cepas patógenas para aves se clasifican dentro del grupo APEC (Avian Pathogenic Escherichia coli)1-7, las cuales pueden actuar como agente causal, o bien, como patógeno secundario en enfermedades inmunodepresoras o del tracto respiratorio. También se ha demostrado que, tanto las cepas comensales, como las patógenas pueden colonizar, así como persistir eficientemente en el tracto intestinal y que la translocación extraintestinal ocurre en la presencia de factores estresantes8. Los serogrupos que se reportan más comúnmente son: O1, O2, O35, O36, O78 y O84 5, 9,10, 28.
La Colibacilosis aviar es una enfermedad de importancia económica para la industria avícola, ya que se manifiesta como una infección localizada o generalizada. Es causada por Escherichia coli, cuya patogenia depende de la virulencia de la cepa, estado del hospedero y factores ambientales. Las patologías más comunes asociadas a esta enfermedad son perihepatitis, aerosaculitis y pericarditis; aunque también pueden ser encontrados otros síndromes tales como peritonitis por huevo, salpingitis, orquitis, coligranuloma, onfalitis, celulitis coliforme, síndrome de la cabeza hinchada, osteomielitis/artritis, panoftalmitis, onfalitis e infección del saco vitelino11. La manifestación más severa de la colibacilosis aviar es la septicemia (colisepticemia) que ocurre frecuentemente en parvadas afectadas junto con otras infecciones respiratorias; se cree que E. coli puede actuar como patógeno oportunista después de la acción de Mycoplasma gallisepticum o de virus como el de la bronquitis infecciosa o Laringotraqueítis12,13; sin embargo, la celulitis y otras lesiones causadas por E. coli han sido reproducidas experimentalmente en pollos sin la participación de otro agente14,15. Aunque la patogénesis de la colibacilosis es poca entendida, el desarrollo de una bacteremia parece ser esencial 8,16.
La exposición de las aves a microorganismos estimula la producción de anticuerpos específicos, los cuales a su vez, reaccionan con los microorganismos y aceleran su destrucción mediante tres mecanismos: la neutralización, en la cual los anticuerpos se unen y neutralizan patógenos específicos haciéndolos incapaces de unirse a los receptores de superficie de la célula blanco y con esto previene la colonización. La opsonizaciónse presenta enbacterias patógenas que pueden replicarse extracelularmente, las cuales son más rápidamente internalizadas y destruidas por fagocitos si están cubiertas por anticuerpos. Por último, en la activación del complemento los anticuerpos se unen a los receptores de superficie de los patógenos, y pueden activar al complemento y producir nuevas proteínas de éste hasta formar poros en la membrana celular bacteriana denominado complejo de ataque a membrana (MAC), o bien, estas proteínas pueden unirse a receptores de fagocitos para facilitar la destrucción del patógeno17. Por estas razones, las inmunoglobulinas juegan un papel importante en la inmunidad contra E. coli, por que éste, generalmente, no es un patógeno intracelular.
En las aves existen tres tipos de inmunoglobulinas: IgM, IgY e IgA. La primera se encuentra en la superficie de la mayoría de las células B y es el primer anticuerpo producido después del contacto primario con el antígeno; a medida que la respuesta inmune progresa, las células productoras de IgM detienen la producción de IgM y comienza la producción de IgY o IgA, lo que se conoce como variación de clase. La IgM e IgY se encuentran principalmente en el suero o el plasma de la sangre, mientras que la IgA se encuentra en mayor cantidad en secreciones y está implicada en la inmunidad mucosal17.
Por otro lado, los anticuerpos maternos usualmente son secuestrados de la circulación materna durante el desarrollo del ovocito y subsecuente transporte a la yema del huevo a través de la membrana del saco vitelino dentro de la circulación embrionaria18-20. Los anticuerpos transferidos predominantemente son de la clase de inmunoglobulinas Y (IgY), mientras la transferencia de IgA e IgM usualmente ocurre en bajos niveles19-22. El pico de anticuerpos maternos en pollos jóvenes se presenta a los 3 ó 4 días de nacidos, y después decrecen gradualmente a niveles no detectables entre la segunda y tercera semana de edad19, 20.
Debido a la importancia que tienen las cepas de Escherichia coli, y de que no existen comercialmente pruebas para determinar la respuesta inmune humoral contra serogrupos APEC, el objetivo de este trabajo fue diseñar y estandarizar un ensayo de ELISA contra los serogrupos más frecuentemente aislados en Mexíco28.
MATERIAL Y MÉTODOS
Cepas Bacterianas. Fueron seleccionados tres serogrupos de Escherichia coli a partir de aves con colibacilosis en México, debido a que fueron los que se aislaron con mayor frecuencia, además de que se determinó que eran cepas virulentas mediante la utilización de diversas técnicas (Ramírez et al 34) , Los serogrupos O2, O78 y O84 fueron los que se aislaron con mayor frecuencia en un estudio previo a partir de granjas de reproductoras, incubadora y pollo de engorda28, las cepas se encuentran liofilizadas, en el cepario del laboratorio de bacteriología del Departamento de Producción Animal: Aves, de la Facultad de Medicina Veterinaria y Zootecnia de la UNAM.
Purificación del LPS de E. coli. Para evaluar los títulos de anticuerpos en suero de los pollos en las diferentes edades, se estandarizó el ensayo de ELISA. Para ello, fue necesario llevar a cabo la purificación del LPS de cada uno de los serogrupos mencionados, el cual fue empleado como antígeno. El método que se utilizópara la purificación del LPS fue descrito por Wesphal, et al 29. Brevemente, los cultivos de E. coli se sembraron en 5 placas de TSA (Oxoid) por cada cepa (O2, O78 y O84) y se incubaron a 37°C por 18h. Después de la incubación, el crecimiento del cultivo bacteriano se cosechó en un tubo con 10ml de agua destilada. La suspensión bacteriana se calentó entre 75-80 °C durante 10 a 15 min. Una vez que la suspensión bacteriana alcanzó esta temperatura, se adicionó 10 ml de fenol destilado (Sigma) precalentado entre 75 a 80°C y se mezcló con agitación vigorosa durante 15 min. Posteriormente, la suspensión se enfrió en hielo a 10°C y centrifugó a 4500 rpm por 15 min. La fase superior (acuosa) se almacenó en hielo y se hizo una segunda extracción con la fase inferior (fenólica) como se describió anteriormente. Para ello, se adicionó10 ml de agua destilada y 10 ml de fenol, y la fase acuosa formada se mezcló con la de la primera extracción, las cuales se colocaron en una membrana de diálisis de 6000 a 8000 kD de tamaño de poro y fueron dializadas durante 18 a 24h en agua destilada con agitación. A cada membrana se le adicionó un volumen de entre 20 y 25 ml. Posteriormente, el LPS se liofilizó durante 18 a 24 h. Después de esto, se trató con 20 µg/ml de RNAsa (Sigma) y 20 µg/ml de DNAsa (Sigma) y se incubó a 37°C con agitación durante 3 h, después se adicionó proteinasa K (Sigma) a una concentración de 200 µg/ml y se incubó de nuevo a 60° C por 3h. El LPS se centrifugó a 35000 rpm durante 3h, y la pastilla que se formó se resuspendió en agua destilada estéril, y finalmente se liofilizó y almacenó en refrigeración hasta su empleo.
Electroforesis de los LPS O2, O78 y O84. Para confirmar la purificación de LPS se realizó una electroforesis en SDS-PAGE descrito por Laemmli30, con 6 y 15 % de poliacrilamida en el gel concentrador y gel separador respectivamente. Las muestras de LPS extraído por el método de Wesphal et al 29 se hidrataron con agua destilada estéril a una relación 1:1 p/v, se utilizó por cada pozo del gel concentrador 15 μl de LPS y se le adicionaron 3μl de buffer de Laemmli 5X, los cuales antes fueron tratados por 5 minutos a 100 ºC. Posteriormente, se realizó la electroforesis a 80mA en el gel concentrador y a 70mA en el gel separador hasta que la línea formada por el azul de bromofenol corrió 13 cm en el gel (3h aproximadamente). Para poder visualizar la migración del LPS y la separación de sus componentes el gel se tiñó con nitrato de plata usando el método descrito por Tsai et al 31, para lo cual se fijó el LPS en el gel con una solución con 40 % etanol, 5 % ácido acético (200ml) en un recipiente limpio durante toda la noche. Posteriormente, se retiró la solución y se adicionó una solución con 0.7% de ácido periódico en 40 % de etanol y 5 % de ácido acético para oxidar el LPS por 5 min. Inmediatamente, se retiró la solución anterior y hicieron 3 lavados de 15 min cada uno con abundante agua destilada. Una vez que transcurrió el tiempo de lavado, se eliminó el agua y se agregaron 150 ml de la solución de nitrato de plata recién preparada (2ml de NH4OH concentrado en 28ml de NaOH 1N), y se agitó vigorosamente por 10 min. A continuación, se adicionaron 5ml al 20% de nitrato de plata (SIGMA) a la primera mezcla hasta que se formó un precipitado color café, posteriormente se diluyó con 115ml de la primera mezcla hasta que el precipitado fue disuelto y la solución viró a un color cristalino. Después se realizaron 3 lavados como se mencionó anteriormente y se remplazó el agua por 200 ml de solución reveladora (50mg de ácido cítrico y 0.5 ml de formaldehído al 37%, 1000 ml de agua destilada), en la cual permaneció hasta que el LPS en el gel fue teñido. Por último, el gel se lavó con abúndate agua destilada y almacenó con agua destilada.
Western Blot con antisueros de conejo específicos. Para confirmar que el LPS extraído correspondía a cada uno de los diferentes serogrupos (O2, O78, O84). Para ello, se utilizó la técnica electroforesis en SDS-PAGE descrita por Laemmli30. El Western-blotting se desarrolló por el método descrito por Towbin et al32, para lo cual se transfirió el LPS del gel a una membrana de nitrocelulosa con un tamaño de poro de 0.45 µm (Bio-Rad) y se enfrentaron contra antisueros de referencia específicos utilizado obtenidos de conejo contra cada LPS. La transferencia se realizó a 200mA por 4 horas. Posteriormente, la membrana de nitrocelulosa se cortó en tiras correspondientes a cada carril del LPS transferido y los espacios libres se bloquearon con leche descremada al 5% en PBS 1x y se incubaron toda la noche con agitación. Después se lavaron tres veces con PBS- tween 0.1% durante 5 min, la membrana se incubó por 2h a temperatura ambiente con el antisuero de conejo específico diluido 1:50 en leche descremada al 5% con PBS. Después de lavar tres veces con PBS- tween 0.1%, (5 min) se incubó con el anticuerpo secundario, que consistió en anticuerpo de cabra anti IgG de conejo conjugado con fosfatasa alcalina diluido 1:1000 en leche descremada al 5% con PBS. (ZYMED, laboratories invitrogen immunodetection). Las hojas de nitrocelulosa se lavaron tres veces con PBS- tween 0.1%, durante 5 min, una vez con TB para eliminar sales y subsiguientemente con buffer de fosfatasa. Posteriormente se le adicionó el sustrato a las muestras por 15 minutos, 1 tableta por 10 ml de agua destilada (SIGMA fastTM BCIP/NBT) una vez que reaccionó la enzima y el sustrato, se detuvo la reacción mediante un lavado con abundante agua destilada.
Preparación de las placas de ELISA. Una vez que se obtuvo el antígeno de las tres cepas se prepararon las placas para llevar a cabo la técnica de ELISA descrita por Chart et al 33(57) con algunas modificaciones. En breve, la microplaca se recubrió con 1µg del LPS O2, O78 u O84 en 100µl de amortiguador de carbonatos (0.16 g NaCO3, 0.29 g NaCHO3, 100ml de H2O destilada, pH 9.6) y se incubaron por 2h a 37°C; posteriormente, a 4°C durante toda la noche. A continuación, la placa se lavó 3 veces con 100µl de PBS-Tween (PBS, Tween 20 0.5% v/v) por pozo, los espacios donde el LPS no se adsorbió fueron bloqueados adicionando 200µl de albumina sérica bovina al 1% (w/v) en PBS por cada pozo durante 2hrs a 37°C, después de lo cual la placa se lavó 3 veces con PBS-Tween (200µl por pozo). Los sueros de prueba se utilizaron a una dilución 1:50, colocando 100µl por pozo, dejándolos incubar por 2 h a 37ºC. Después se hicieron 3 lavados con PBS-Tween. Para generar la reacción, 100µl de IgG de conejo anti IgY de aves marcado con fosfatasa alcalina (Invitrogen) en una concentración 1:1000 fueron adicionados en cada pozo y se incubó por 2hrs a 37°C, posteriormente la placa se lavó como se describe arriba. Para visualizar la reacción se adicionaron 200μl de p-nitrofenil fosfato (1 mg/ml; Sigma) en buffer de dietanolamina (pH 9.8; Sigma) y la placa se incubó a temperatura ambiente por 30 min. La reacción se detuvo adicionando 30µl de NaOH 3M. Los valores fueron medidos en un lector de microplacas de ELISA (Bio-Tek) a 405 nm. La técnica se hizo por duplicado. El punto de corte se estableció con el promedio de absorbancia de sueros negativos más tres desviaciones estándar.
Detección de anticuerpos en aves SPF. Para determinar la presencia de anticuerpos en aves mediante el empleo de la técnica de ELISA para los tres serotipos, se alojaron 34 pollitos libres de patógenos específicos (SPF) de un día de edad, las cuales fueron mantenidas en las unidades de aislamiento del Departamento de Producción Animal: Aves de la FMVZ, de la UNAM, las cuales fueron alojadas en corrales y se les proporcionó agua y alimento ad libitum. Semanalmente, a partir del primero día de edad, se obtuvieron muestras de sangre y fueron colocadas en microtubos para la obtención de suero. Una vez que el suero se desprendió del coagulo de sangre se colectó y se transfirió a otro microtubo. Todas las muestras de suero fueron conservados en congelación hasta que se emplearon para evaluar la respuesta inmune de las aves mediante el uso de las técnicas de ELISA que se diseñaron en el presente trabajo para los serotipos O2, O78 y O84.
Inmunotransferencia con suero de pollos. Para evaluar los perfiles antigénicos reconocidos por los anticuerpos IgY anti-LPS O2, O78 y O84 de E. coli, los extractos de LPS fueron separados porSDS-PAGE y posteriormente se llevó a cabo la inmunotransferencia usando el mismo procedimiento descrito anteriormente32. Con algunas modificaciones, para ello se utilizaron los sueros de pollos en una dilución 1:50 de las semanas 1 y 2, previamente analizados por ELISA. Esta vez el anticuerpo secundario fue un anticuerpo de conejo anti IgY de pollo (Invitrogen) conjugado con fosfatasa alcalina en una dilución 1:1000.
RESULTADOS
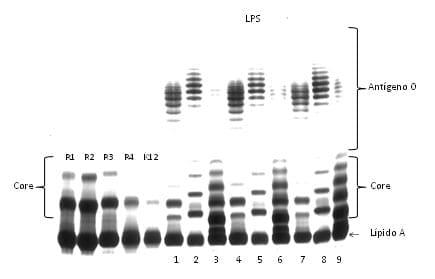
Purificación del LPS de E. coli. Los resultados obtenidos mostraron que del LPS O2 se obtuvieron 8.81mg; de O78: 6.23mg; y de O84: 7.25mg. Al analizar los perfiles electroforéticos de los LPS se observaron las diferencias que deben presentar en las cadenas laterales del antigeno O, en este tambien se pudieron identificar el core externo e interno y el lípido A (Figura 1).
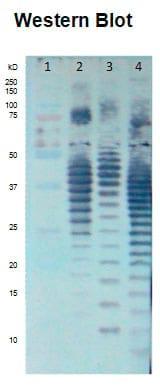
Para confirmar la identidad de cada LPS se utilizó un ensayo de western-blot (Inmunotransferencia),el resultado obtenido fue satisfactorio ya que se comprobó que cada LPS transferido a la membrana de nitrocelulosa correspondía al serogrupo específico (Figura 2), y que no se presentaban reacciones contra los otros LPS, lo anterior se analizó al utilizar de manera cruzada los diferentes sueros de conejo y no observar reactividad contra las cadenas laterales del antígeno O, aunque si hubo reactividad contra el core y el lípido A (Datos no mostrados).
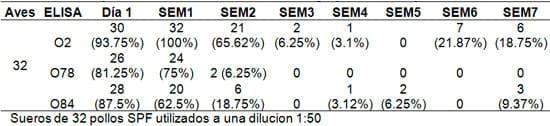
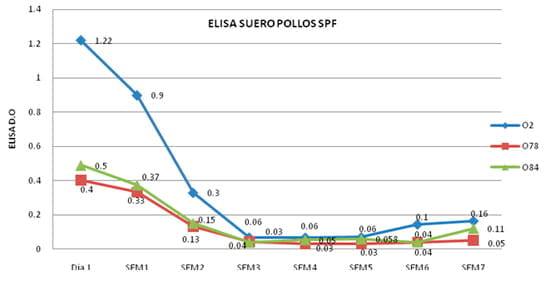
En los ensayos de ELISAcon los sueros de 32 pollos SPF, se pudo observar que el 94% obtuvieron respuestas positivas contra O2, el 81% contra O78 y el 88% contra O84 (Cuadro 1). Sin embargo, para el análisis de resultados se determinó la media de la absorbancia en las lecturas de todos los sueros y se pudo observar que la respuesta sérica reconocía, aunque, con diferente intensidad a los tres LPS. También se pudo observar que la respuesta de anticuerpos contra el serogrupo O2, se mantiene positiva hasta la segunda semana y media de edad (18 días). Posteriormente, esta respuesta decrece hasta un nivel negativo a partir de la tercer semana y se mantiene hasta la séptima semana. En cuanto a la respuesta de anticuerpos contra los serogrupos O78 y O84, esta se mantienen positiva durante la primer semana y media de edad (11 días); posteriormente, esta respuesta decrece hasta alcanzar títulos negativos a partir de la semana 2 y se mantienen negativos durante las 5 semanas restantes (Figura 3).
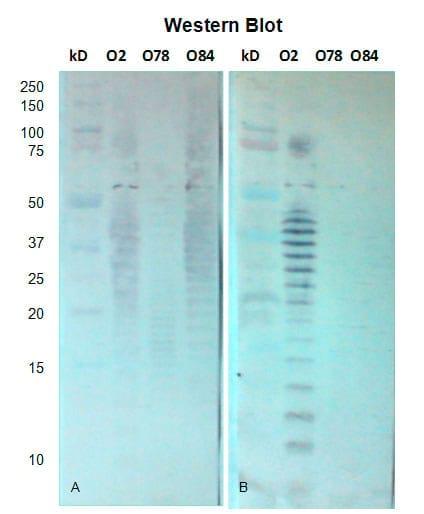
Especificidad antigénica de anticuerpos anti-LPS. En la inmunotransferencia con los sueros de pollos SPF, se pudo observarque los anticuerpos reaccionaron con los diferentes componentes del LPS en un rango de entre 10 y 107 kDa. Las reacciones fueron en mayor proporción contra las cadenas laterales del antígeno somático del LPS en un rango de entre 10 y 50 kDa. En la Figura 4A se puede observar la reacción del suero de pollos de un día de edad y en 4B la de un suero de una semana de edad.
DISCUSION
En el presente estudió se diseñaron y estandarizaron tres pruebas de ELISA contra con los serogrupos O2, O78 y O84, ya que han sido los que se aíslan con mayor frecuencia en el trabajo de Rosario et al (2005) y Ramírez et al (2007). Adicionalmente, porque en un ensayo de letalidad embrionaria realizado en un estudio paralelo34, las cepas mostraron un porcentaje de letalidad que los clasificó como virulentas, siendo el ensayo de letalidad embrionaria una prueba para discriminar entre una cepa comensal y cepas APEC35. Por otro lado, los serogrupos O2 y O78 han sido reportados por otros autores como los más comunes36,37 y como serogrupos asociados con cepas virulentas 5,9,10. Se evaluaron los sueros de pollos SPF de un día de edad, y se observaron respuestas positivas contra los LPS O2, O78 y O84 durante la primer y segunda semana de edad. Estos resultados sugieren que las madres transfieren inmunidad materna a su progenie, lo cual coincide con lo dicho por Brambel38. Estas respuestas pueden estar relacionados a que E. coli es un habitante natural de la biota intestinal de la aves, además de este contacto directo, podría haber existido una infección previa de las reproductoras, que al sobrevivir y crear inmunidad, pueden transferir los anticuerpos maternos a la progenie, en este caso, los pollos estudiados. En un estudio realizado por Yoshiharu et al39 demostraron que la protección transferida de progenitoras vacunadas a su progenie dura hasta los 21 días después de la eclosión, en nuestros resultados las respuestas de anticuerpos maternos se mantienen positivas contra los serogrupos O78 y O84 hasta los 11 días edad y contra O2 hasta los 18 días de edad, a pesar de que las madres, por ser libres de patógenos específicos, no son vacunadas. El western blot revela que los anticuerpos en suero de pollos reaccionan con los diferentes componentes del LPS de E. coli, principalmente con las cadenas laterales del antígeno somático, siendo este el antígeno de superficie de mayor proporción en las bacterias de E. coli. Esto demuestra la especificidad de los anticuerpos maternos contra los serogrupos APEC estudiados. Sin embargo, como la respuesta de anticuerpos podría ser indicativa de una respuesta inmune adquirida, en el presente trabajo se emplearon anticuerpos anti-LPS como un índice de respuesta inmune humoral. Aunque no se evaluó la correlación entre títulos de anticuerpos y protección, los anticuerpos pueden jugar un papel importante en la protección contra la colibacilosis aviar por que E. coli generalmente no es un patógeno intracelular40, y se sabe que los anticuerpos pueden impedir la colonización neutralizando al antígeno, o bien pueden ayudar a la destrucción de la bacteria mediante fagocitosis post-opsonización o activando por vía clásica al sistema del complemento.
Estos resultados demuestran que las pruebas de ELISA diseñadas en el presente trabajo son una herramienta de gran utilidad para el diagnóstico, ya que es capaz de detectar la presencia de anticuerpos en las aves. Adicionalmente, proporcionan datos para investigaciones posteriores sobre el papel que juegan los anticuerpos maternos en la protección de pollitos contra la colibacilosis aviar.
REFERENCIAS
- Dho-Moulin M, Fairbrother JM. Avian pathogenic Escherichia coli (APEC). Vet Res 1999; 30: 299-316.
- Ramiréz GB. Serotipificación y detección de genes de virulencia en cepas de Escherichia coli aisladas de diferentes muestras obtenidas en una empresa avícola integrada. (tesis de licenciatura) México, D.F. FMVZ. UNAM, 2007.
- Chansiripornchaia N, Ramasootab P, Sasipreeyajana J, Svensonc SB. Differentiation of avian pathogenic Escherichia coli (APEC) strains by randomamplified polymorfhic DNA (RAPD) analysis. Vet Microbiol 2001; 80:75-83.
- Delicado ER, Guimaraes de Brito B, Gaziri LCJ, Vidotto MC. Virulence-associated genes in Escherichia coli isolates from poultry with colibacillosis. Vet Microbiol 2003; 94: 97-103.
- Blanco JE, Blanco M, Mora A, Jansen WH, García V, Vázquez ML, Blanco J. Serotypes of Escherichia coli isolated from septicaemic chickens in Galicia (Northwest Spain). Vet Microbiol 1998; 61: 229-235.
- Dias da Silveira W, Ferreira A, Brocchi M, de Hollanda LM, Pestana de Castro A F, Tatsumi YA, Lancellotti M. Biological characteristics and pathogenicity of avian Escherichia coli strains. Vet Microbiol 2002-1; 85: 47-53.
- Gibbs PS, Wooley RE. Comparison of the intravenous chicken challenge method with the embryo lethality assay for studies in avian collibacillosis. Avian Dis 2003;47:672-680.
- Leitner, G. & Heller, E.D. 1992. Colonization of Escherichia coli in young turkeys and chickens. Avian Dis., 36, 211_220.
- Dias da Silveira W, Ferreira A, Lancellotti M, Barbosa IGCD, Leite DS, de Castro AFP, Brocchi M. Clonal relationships among avian Escherichia coli isolates determined by enterobacterial repetitive intergenic consensus (ERIC)–PCR. Vet Microbiol 2002-2; 89: 323–328.
- Nolan LK, Vaillancourt JP, Barnes HJ. Colibacilosis. 2009; 18:691-715.
- Barnes, H. J. 2000. Pathological manifestation of colibacillosis in poultry. Proc 21st World´s poultry congress, Montréal, Canada, aug 20-24
- Gross WB. Colibacillosis. In: Diseases of poultry. Calnek BW, Barnes HJ, Beard CW (eds.) Iowa State University Press. Ames Iowa. 1991; 138-144.
- Majó N, Gilbert X, Vilafranca M, O Loan CJ, Costa LI, Pagés AG, Costa L, Pagés A, Ramis A. Turkey rhinotruqueitis virus and escherichia coli experimental infection in chickens: hitopatological, immunocytochemical and microbiological study. Microbiol Vet. 1997; 57:29-40.
- GomiS SM, Watts T, Riddell C, Potter AA, Allan BJ. Experimental reproduction of Escherichia coli cellulitis and septicemia in broiler chickens. Avian Dis 1997; 41:234–240.
- Peighambari SM, Julian RJ, Vaillancourt JP, Gyles CL. Escherichia coli cellulitis: experimental infections in broiler chickens. Avian Dis 1995; 39:125–134.
- Cheville NF, Arp LH. Comparative pathologic findings of Escherichia coli infection in birds. J. Am. Vet. Med. Assoc. 1978;173:584–587.
- Linden CD, Roth TF. IgG receptors on feotal chick yolk sac. J. Cell Sci. 1978; 33:317–328.
- Kramer TT, Cho HC. Transfer of immunoglobulins and antibodies in the hen’s egg. Immunology 1970; 19:157–167.
- Rose ME, Orlans E, Buttress N. Immunglobulin classes in the hen’s egg: their secretion in yolk and white. Eur. J. Immunol. 1974; 4:521–523.
- Hassan JO, Curtiss III R. Effect of vaccination of hens with an avirulent strain of Salmonella typhimurium on immunity of progeny challenged with wild-type Salmonella strains. Infect. Immun. 1996; 64:938–944.
- Hornok S, Bitay Z, Szell Z, Varga I. Assessment of maternal immunity to Cryptosporidium baileyi in chickens. Vet. Parasitol. 1998; 79:203–212.
- Methner U, Steinbach G. Efficacy of maternal Salmonella antibodies and experimental oral infection of chicks with Salmonella enteritidis. Berl. Muench. Tieraerztl. Wochenschr. 1997; 110:373–377.
- Shawky SA, Saif YM, McCormick J. Transfer of maternal anti-rotavirus IgG to the mucosal surfaces and bile of turkey poults. Avian Dis 1994; 38:409–417.
- Smith NC, Wallach M, Miller CM, Morgenstern R, Braun R, Eckert J. Maternal transmission of immunity to Eimeria maxima: enzyme-linked immunosorbent assay analysis of protective antibodies induced by infection. Infect. Immun. 1994.62:1348–1357.
- 28. Rosario CC, Puente JL, Verdugo-Rodríguez A, Anderson RC, Eslava CC. Phenotypic characterization of ipaH+Escherichia coli strains associated with yolk sac infection. Avian Dis 2005; 49: 409-417.
- Westphal O, Jann K. Bacterial lipopolysaccharide: extraction with phenol-water and further applications of the procedure. Methods Carbohydr. Chem. 1965; 5:83–91.
- Laemmli UK. 1970. Cleavage of structural protein during the assembly of the head of bacteriophage T4. Nature 227:680-685.
- Tsai, C. M., and C. E. Frasch. 1982. A sensitive silver stain for detecting lipopolysaccharide in polyacrylamide gels. Anal. Biochem. 119:115-119.
- Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets. Procedure and some applications. Proc. Natl. Acad. Sci. USA 1979; 76:4350-4354.
- Chart H, Scotland SM, Smith HR, Rowe B. Antibodies to Escherichia coli O157 in patients with haemorrhagic colitis and haemolytic uraemic syndrome. J Clin Pathol 1989; 42:973–976.
- Ramirez GB. Asociación entre letalidad embrionaria y presencia de genes de virulencia en cepas de Escherichia coli aisladas de aves. (tesis maestria ). México, D.F. FMVZ. UNAM, 2009
- Heller ED, Drabkin N. Some characteristics of pathogenic E. coli strains. Br Vet, 1977; 133:572-578.
- Sojka WJ. Escherichia coli in domestic animals and poultry. Commonwealth Agricultural Bareau, Farnham Royal, England. 1965; 1-231
- Brambel FWR. The transmission of passive immunity from mother to young. Frontiers Biol. 1970;18: 1-19.
- Yoshiharu O, Jensen AE, Cheville NF. Immunity of chicks against colibacilosis by vaccination of parent breeders. Bull. Univ. Osaka 1987; 40:38-44.
- Yaguchi K, Ohgitani T, Noro T, Kaneshige T, Shimizu Y. Vaccination of chickens with liposomal inactivated avian pathogenic Escherichia coli (APEC) Vaccine by eye drop or coarse spray administration. Avian Dis. 2009; 53:245-249.
- Heller ED, Leitner G, Drabkin N, Melamed D. Passive immunization of chicks against Escherichia coli. Avian Pathol. 1990; 19:345-354.
- Tizard, IR. Inmunología veterinaria 6ta ed. México: Interamericana McGraw-Hill 2002; cap.22 pag. 285-286.
- Buxton A.On the transference of bacterial antibodies from hen to the chick. J. Gen. Microbiol. 1952; 7:268–286.
- Kowalczyk K, Daiss J, Halpern J, and Roth TF. Quantitation of maternal-fetal IgG transport in the chicken. Immunology 1985; 54:755–762.
- Gibbs PS, Maurer JJ, Nolan LK, Wooley RE. Prediction of chicken embryo lethality with the avian Escherichia coli traits complement resistance, colicin V production, and presence of the increased serum survival gene cluster (iss). Avian Dis 2003-2; 47: 370-379.
Cuadro 1. Sueros positivos en ELISA contra los serogrupos O2, O78 y O84.
Figura 1. Electroforesis en SDS-PAGE teñido con nitrato de plata. Líneas 1, 4 y 7 (10, 13 y 15 µg de LPS O2, respectivamente).
Líneas 2, 5 y 8 (10, 13 y 15 µg de LPS O78, respectivamente). Líneas 3, 6 y 9 (10, 13 y 15 µg de LPS O84, respectivamente), R1, R2, R3, R4 y K12 son cores de referencia (Laboratorio de Salud Pública, Facultad de Medicina-UNAM
Figura 2. Transferencia de LPS (O2, O78 y O84) a 200mA por 4 h. Sueros hiperinmunes de conejo específicos. Línea 1, marcador de peso molecular, línea 2 (O2), línea 3 (O78), línea 4 (O84). Dilución 1:50. Incubación a temperatura ambiente por 1 h y 30 min.
Figura 3. Promedio de las lecturas de absorbancia de los sueros de 32 pollos SPF en una dilución 1:50, enfrentados contra los LPS O2, O78 y O84 en un ensayo de ELISA.
Figura 3. Transferencia de LPS (O2, O78, O84) a 200mA por 4 h. Inmunoblot con suero de pollos en una dilución 1:50. Incubación, temperatura ambiente por 1 h y 30 min. A. Sueros de 1 semana de edad y B. Suero de la semana 2 de edad.
Trabajo presentado en el XXXV Convención Anual ANECA (Oaxaca), en Abril de 2010.









.jpg&w=3840&q=75)