INTRODUCCIÓN
En la producción avícola actual, la separación física entre la planta incubadora y las granjas puede ocasionar que los pollos recién nacidos pasen un período variable de tiempo sin agua ni alimento y, generalmente, transcurren entre 36 y 48 h después del nacimiento para que las aves tengan acceso al alimento, reduciéndose en este período el peso de las aves (1). Un retraso en el consumo de alimento puede reducir la tasa de crecimiento y provocar pérdidas de peso (2).
Por el contrario, el acceso inmediato al alimento y al agua después de la eclosión puede promover el desarrollo del tracto digestivo, aumentar el peso corporal (3,4) y disminuir la mortalidad en los primeros 3 días de edad (5).
Con la alimentación temprana se suministran nutrientes necesarios para los pollos recién nacidos durante las primeras 48 a 72 h. Se ha reportado que esta práctica puede reducir la deshidratación y promover la rápida reabsorción del saco vitelino (6), el desarrollo del hígado, páncreas e intestino (7), incrementar el desarrollo del ave inmediatamente después de la eclosión, mejorar la resistencia contra la exposición a las bajas temperaturas en pollos jóvenes (8) y promover un mayor desarrollo del sistema inmunitario (9).
Al estudiar el efecto de la alimentación, inmediatamente después de la eclosión sobre la activación del programa genético que regula la lipogénesis hepática, se encontró que durante la primera semana post eclosión fue significativa la regulación de los genes clave lipogénicos incluyendo los de las enzimas ATP citrato liasa, enzima málica, ácido graso sintasa, acetil-CoA carboxilasa, alfa estearil-CoA desaturasa-1, entre otros (10). La restricción de alimentos durante las primeras 48 h post-eclosión provocó una disminución significativa de la ganancia de peso, de la glucosa en plasma y de la regulación de los genes lipogénicos, que se revierte al iniciarse la alimentación (10). No existen reportes previos acerca de cómo puede afectarse la actividad de enzimas digestivas, principalmente las que forman parte integral del borde en cepillo intestinal, tales como las disacaridasas, fosfatasas y fitasa.
Es de interés práctico el estudio de los requerimientos nutricionales y los efectos de alimentar las aves a temprana edad, o en el intervalo de tiempo que transcurre desde la eclosión hasta su llegada a la granja, sobre el desarrollo del tracto gastrointestinal, ya que puede repercutir en el desarrollo corporal, por lo cual se realizó la presente investigación con el objetivo evaluar el efecto de suministrar dos suplementos diferentes a temprana edad sobre la actividad de enzimas digestivas duodenales y pancreáticas en pollos de engorde.
MATERIALES Y MÉTODOS
Incubación y eclosión de los huevos fértiles. Un total de 300 huevos fértiles, provenientes de gallinas reproductoras de la línea Hubbard de 33 semanas de edad, adquiridos de la Granja Vipraca, C.A. ubicada en el estado Yaracuy, fueron incubados a 37.8°C en una incubadora-nacedora, marca Chick master, con volteo automático del Centro de Bioquímica Nutricional de la Facultad de Ciencias Veterinarias (FCV) de la Universidad Central de Venezuela (UCV) ubicada a 67°36’36’’ longitud este, 10°16’20’’ latitud norte y 443 m.s.n.m, con una temperatura media de 25.1°C y una pluviosidad promedio anual de 1063 mm.
En la eclosión, los pollos fueron extraídos de la nacedora, asignados a jaulas metálicas de batería para su alojamiento en el bioterio de la Cátedra de Bioquímica de la FCV-UCV, mantenidos en adecuadas condiciones de hidratación, ventilación y densidad, y sometidos de inmediato a los tratamientos experimentales (100 aves/tratamiento). Los alimentos y el agua fueron suministrados ad libitum desde la eclosión hasta las 72 horas de edad.
Manejo de las aves y alimentación. EL alimento balanceado hidratado fue formulado de acuerdo con las recomendaciones internacionales (11). En las tablas 1, 2 y 3 se presenta la composición y el análisis bromatológico (12) de los alimentos y suplementos suministrados. Todas las aves recibieron agua a voluntad. Para realizar las respectivas mediciones, al nacer y a las 48 y 72 h de nacidos, fueron sacrificados, por dislocación cervical, 30 pollos/tratamiento/intervalo, para extraer, a temperaturas entre 0 y 4ºC, los segmentos duodenales y el páncreas a partir de los cuales se prepararon los homogenizados para las determinaciones de las actividades de las enzimas intestinales maltasa, sacarasa, fosfatasa alcalina y fitasa. En las muestras de homogenizado duodenal se determinó la actividad de las enzimas pancreáticas a-amilasa, tripsina y la actividad de la lipasa se determinó en muestras de homogenizado pancreático.

Diseño experimental y tratamientos. Las aves fueron asignadas, en un diseño completamente al azar, a los siguientes tratamientos:
T0: Ayuno desde la eclosión hasta 48 h
T1: Alimento balanceado hidratado (ABH) desde la eclosión hasta las 48 h de vida.
T3: Suplemento hidratante comercial (SHC) desde la eclosión hasta las 48 h de vida.
Análisis bromatológico de los alimentos. Los análisis bromatológicos fueron realizados en un laboratorio comercial, e incluyeron la determinación de proteína cruda, extracto etéreo y fibra cruda, según los métodos estandarizados (12).
Preparación del homogeneizado intestinal. Los segmentos duodenales fueron extraídos a temperaturas entre 0 y 4ºC, cortados longitudinalmente, colocados sobre una placa de vidrio y raspados suavemente con una lámina portaobjeto para obtener la mucosa que fue homogeneizada a máxima velocidad durante 1 min en solución tampón con 2 mM de HEPES a pH 7.1 y almacenada en alícuotas a –20ºC hasta el momento del análisis, en un lapso no mayor a 15 días.
Preparación del homogenizado pancreático. Todo el procedimiento se realizó entre 0 y 4°C. Los páncreas fueron homogeneizados, a máxima velocidad, por 3 min en 4 g/ml de solución salina fisiológica, filtrados a través de un liencillo estéril y el extracto almacenado en alícuotas a -20°C hasta que fueron requeridos para las determinaciones enzimáticas, en un lapso de tiempo no mayor a 15 días.
Actividades enzimáticas. Los análisis enzimáticos se realizaron en el Laboratorio de Enzimología y Toxicología adscrito a la Cátedra de Bioquímica, FCV-UCV. Se analizaron réplicas de homogenizado compuestas, en todos los casos, por un pool proveniente de 3 pollos para un total de 10 determinaciones/tratamiento en cada intervalo de tiempo.
Maltasa (EC 3.2.1.20) y Sacarasa (EC 3.2.1.48). La actividad específica de las disacaridasas maltasa y sacarasa fue determinada utilizando como sustrato una solución de maltosa o sacarosa 56 mM en maleato de sodio 100 mM a pH 6.0 y disuelto en NaOH al 15% (p/v) (13). La mezcla de reacción fue incubada, a 41ºC, durante 15 y 30 min para maltasa y sacarasa respectivamente, luego de lo cual se detuvo colocando los tubos en agua en ebullición por 20 seg. La cantidad de glucosa liberada en la reacción fue cuantificada utilizando un kit Bioscience GOD-PAP 900®. La absorbancia se cuantificó en un espectrofotómetro (Perkin Elmer, Lambda 11, California, USA) a una longitud de onda de 510 nm. La actividad específica se expresó como nmoles de glucosa liberada/min/mg de proteína (13).
Fosfatasa alcalina (EC 3.1.3.1). La actividad de esta enzima fue determinada utilizando Kits LABTEST®. La fosfatasa alcalina presente en la muestra hidroliza al sustrato timolftaleína monofosfato, liberando timolftaleína y fosfato inorgánico. Se incubaron 50 µl de sustrato, 500 µl de tampón suministrado por el fabricante y 50 µl de la muestra durante 10 min a 41ºC. La reacción de detuvo con una solución conteniendo carbonato de sodio 150 mM e hidróxido de sodio 100 mM. La absorbancia fue medida en el espectrofotómetro a una longitud de onda de 590 nm y comparada contra la de un patrón de concentración conocida. La actividad se expresó en (Unidades/L)/min/mg de proteína (13).
Fitasa (EC 3.1.3.8). Se determinó a 41ºC incubando 40 µl del homogenado duodenal con 200 µl de la sal sódica de inositol hexafosfórico 1 mM y 200 µl del tampón conteniendo 25 mM de MgCl2 y 50 mM de MES a pH 6.0. La reacción se detuvo agregando 3600 µl de una solución con 0.28% (p/v) de molibdato de amonio, SDS al 1.1% (p/v) y ácido ascórbico al 1.1% (p/v). La concentración de fosfato liberado fue determinada en el espectrofotómetro a una longitud de onda de 820 nm. Los valores de absorbancia se compararon con los de una curva estándar elaborada a partir de una solución 0.5 mM de KH2PO4 y fue expresada como nmoles de PO4 hidrolizados/minuto/mg de proteína (13,14).
α-Amilasa (EC 3.2.1.1). El homogenado (50 μl) se incubó durante 15 min a 41°C en una mezcla de reacción conteniendo 100 μl de Tris-HCl 160 mM a pH 7.5 y 200 μl de almidón al 0.15% en ácido sórbico saturado. La reacción se detuvo agregando 100 μL de HCl al 0.5N luego de lo cual se añadió 2 ml de agua destilada y 100 ml de solución de yodo 0.01 N. La cantidad de almidón degradado por la amilasa se determinó por espectrofotometría midiendo la disminución de la coloración azul del complejo iónico almidón-yoduro a una longitud de onda de 620 nm (15). Los valores se compararon con los una curva estándar elaborada a partir de una solución de almidón al 0.15% (p/v). La actividad se expresó como μg de almidón degradado/min/ mg de proteína (15).
Tripsina (EC 3.4.21.4). El homogenizado de páncreas fue incubado durante 15 min a 41°C con 200 μl del sustrato caseína al 1% (p/v) en fosfato de sodio 0.1 M a pH 7.4. La reacción se detuvo con la adición de 1 ml de ácido tricloroacético al 5% (p/v) y la mezcla filtrada en papel Whatman 42. Se hicieron reaccionar 250 μl del filtrado con 1250 μl de Na2CO3 0.2 M y 250 μl del reactivo de Folin-Ciocalteu diluido 1:5 en agua destilada (16). Después de una incubación durante 20 min a 41°C se midió la absorbancia a una longitud de onda de 625 nm. La actividad se expresó como Unidades de Actividad Proteolítica (UAP) definidas como la cantidad (mEq) del aminoácido tirosina liberado como producto de la proteólisis del sustrato en las condiciones del ensayo (15).
Lipasa (EC 3.1.1.3). La actividad de esta enzima se determinó en homogenizado de páncreas, determinando el volumen de NaOH 0.05 M requerido para neutralizar los ácidos grasos liberados durante 3 h de incubación, con agitación moderada, a 37°C con 3 ml de aceite de oliva utilizado como sustrato. La actividad se expresó como µl de NaOH/mg de proteína (16).
Análisis de proteína. El contenido de proteína se determinó haciendo reaccionar las muestras con una solución filtrada en papel Whatman 40 conteniendo azul comassie brillante-G250 al 1% en etanol, diluida 1:2 en ácido ortofosfórico al 8.9% (13) utilizando el tampón correspondiente como blanco y Albúmina Sérica Bovina (BSA) como estándar.
Análisis estadístico. Los resultados fueron expresados como el promedio ± la desviación estándar, y analizados estadísticamente a través del Análisis de Kruskal-Wallis y la prueba de rangos promedios a un nivel de significancia p≤0.05 (17).
RESULTADOS
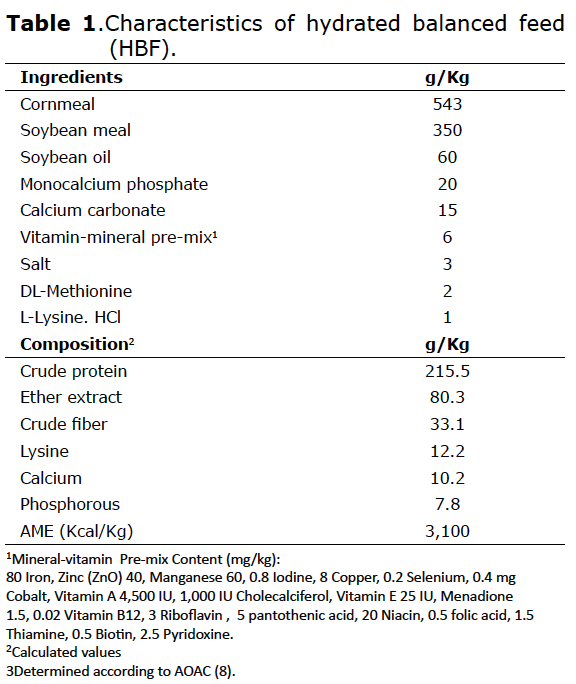
Maltasa (EC 3.2.1.20). Inmediatamente después de la eclosión, la actividad específica de la enzima maltasa, determinada en homogenizado de segmentos duodenales, fue de 39 ± 1 nmoles de glucosa/min/mg de proteína. Tanto a las 48 como a las 72 h de nacidos, la actividad fue mayor (p≤0.05) en los animales que recibieron SHC desde el nacimiento hasta las 48 h post-eclosión (T2) en comparación con el control, que se mantuvo en ayuno durante 48 h (Figura 1). Las aves que recibieron ABH presentaron mayor actividad de esta enzima a las 48 h de nacidos (p≤0.05).
Sacarasa (EC 3.2.1.48). En el momento de la eclosión, la actividad específica de la enzima sacarasa, determinada en homogenizado de segmentos duodenales, fue de 1.2 ± 0.1 nmoles de glucosa/min/mg de proteína, cerca de 32 veces más baja que la actividad de la maltasa después de la eclosión. En las primeras 48 h después de la eclosión no se encontraron diferencias significativas entre los tratamientos. No obstante, a las 72 h se presentaron diferencias significativas a favor de T1 y T2 (Figura 1). Por tanto, el suministro de ABH y SHC en las primeras 48 h de vida mejoró la actividad de la sacarasa a las 72 h de edad de las aves (p≤0.05), provocando un incremento de la actividad de cerca de 3 veces en comparación con el control.
Fosfatasa Alcalina (EC 3.1.3.1). Inmediatamente después de la eclosión, la actividad específica de la enzima fosfatasa alcalina, determinada en homogenado de segmentos duodenales, fue de 53 ± 12 (U/L)/min/mg de proteína. A las 48 h de vida, los animales que consumieron el SHC (T2) presentaron una actividad 1.2 veces más alta, con diferencias significativas (p<0.05) en comparación con el grupo control (T0) (Figura 1). No obstante, en las aves mantenidas en ayuno durante 48 h después de la eclosión (T0) se presentó una actividad significativamente mayor (p≤0.05) en el tercer día de edad, 24 h después de recibir el alimento.
Fitasa (EC 3.1.3.8). Inmediatamente después de la eclosión, la actividad específica de la enzima fitasa, determinada en homogenado de segmentos duodenales, fue de 5.1 ± 0.2 nmoles de PO4/min/ mg de proteína. La tendencia, al igual que en el caso de la fosfatasa alcalina, es a aumentar en las primeras 72 h post-eclosión. El suministro de alimentación temprana, tanto del ABH como del SHC promovió una mayor actividad fitásica en las primeras 72 h de nacidos (p≤0.05), con incrementos de hasta 3.2 veces en comparación con el control (Figura 1).
En términos generales, en los animales del grupo control que se mantuvieron en ayuno durante 48 h, se evidenció, como efecto de suministrar alimentación después del período de ayuno, un aumento en la actividad de las enzimas integrales del borde en cepillo intestinal, en este caso en el segmento duodenal, maltasa, sacarasa, fosfatasa alcalina y fitasa, a las 72 h después de la eclosión. Asimismo, en las aves que recibieron algún tipo de alimento o suplemento (ABH o SHC) durante las primeras 48 h de edad, se observó una marcada tendencia al incremento de la actividad de estas enzimas digestivas.
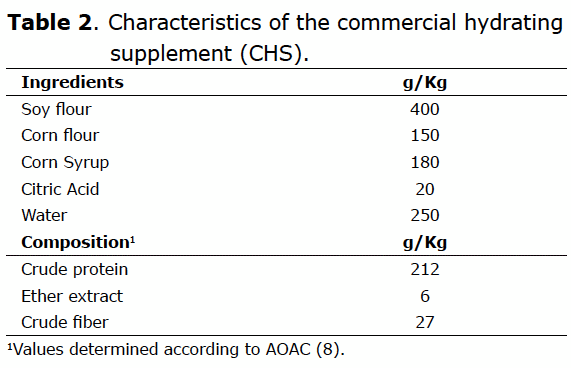
α-Amilasa (EC 3.2.1.1). Inmediatamente después de la eclosión, la actividad específica de la enzima α-amilasa, determinada en homogenizado de páncreas, fue de 94 ± 7 μg de almidón degradado/ min/mg de proteína. La tendencia fue a presentarse un valor mayor en las 48 h y a disminuir a las 72 h.
A las 48 h de edad los pollos de todos los tratamientos presentaron una actividad de esta enzima significativamente menor (p≤0.05) en comparación con los animales del grupo control, siendo mayor la actividad en T0 muy cercana al 300% con respecto al tratamiento inmediatamente inferior [T2], (Figura 2).
Tripsina (EC 3.4.21.4). Inmediatamente después de la eclosión, la actividad específica de la enzima tripsina, determinada en homogenizado de páncreas, fue de 0.3 ± 0.06 UAP/min/mg de proteína y mostró una tendencia, en los animales del grupo control, al incremento en las primeras 72 h de vida.
El suministro de ABH o SHC no aumentó la actividad de esta enzima (Figura 2). En las primeras 48 h de edad, la actividad fue semejante tanto en los animales en ayuno como en aquellos que recibieron algún tipo de alimento o suplemento. A partir de las 48 h de edad, se observa un marcado incremento en la actividad de la tripsina únicamente en los animales que se habían mantenido en condiciones de ayuno (T0) y una disminución significativa (p≤0.05) en la actividad en los grupos que recibieron ABH y SHC (T1 y T2).
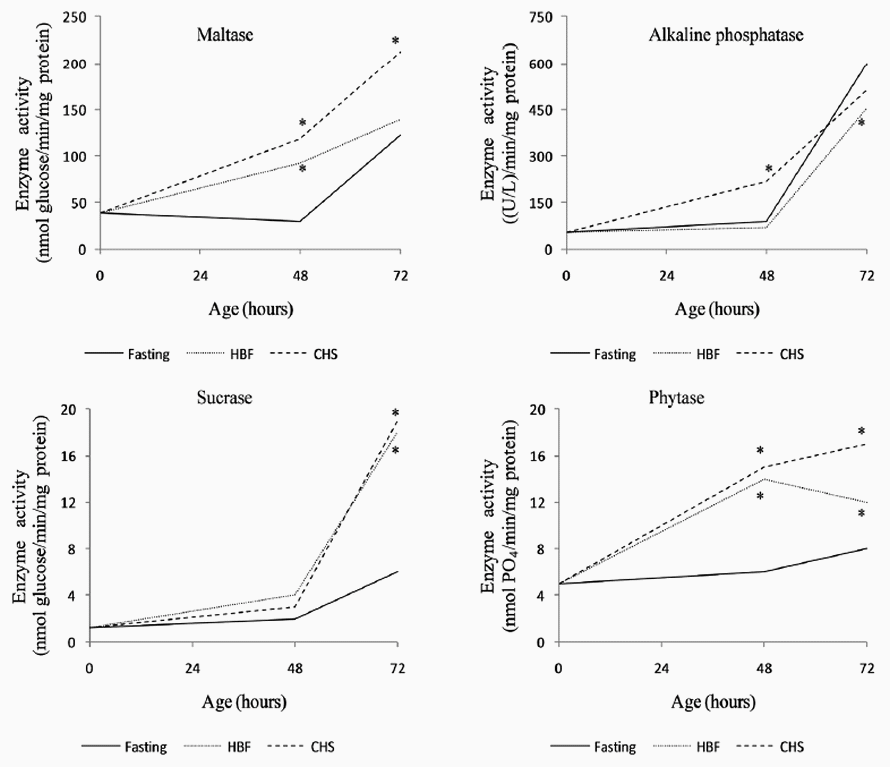
 Click aquí para ampliar la imagen Figura 1. Actividad específica de las enzimas digestivas duodenales en pollos de engorde en ayunas o alimentación temprana. Ayuno desde la eclosión hasta las 48 hrs. HBF = alimento balanceado hidratado suministrado desde la eclosión hasta las 48 hrs. CHS = suplemento hidratante comercial suministrado desde la eclosión hasta las 48 h * (p <0.05).
Click aquí para ampliar la imagen Figura 1. Actividad específica de las enzimas digestivas duodenales en pollos de engorde en ayunas o alimentación temprana. Ayuno desde la eclosión hasta las 48 hrs. HBF = alimento balanceado hidratado suministrado desde la eclosión hasta las 48 hrs. CHS = suplemento hidratante comercial suministrado desde la eclosión hasta las 48 h * (p <0.05).
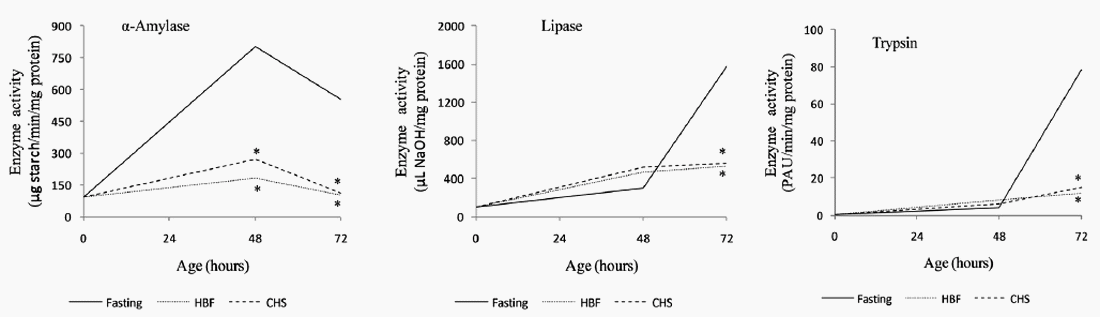
 Click aquí para ampliar la imagen Figura 2. Actividad específica de las enzimas digestivas pancreáticas en pollos de engorde en ayunas o alimentación temprana. Ayuno desde la eclosión hasta las 48 hrs. HBF = alimento balanceado hidratado suministrado desde la eclosión hasta las 48 hrs. CHS = suplemento hidratante comercial suministrado desde la eclosión hasta las 48 horas. * (p ≤ 0,05).
Click aquí para ampliar la imagen Figura 2. Actividad específica de las enzimas digestivas pancreáticas en pollos de engorde en ayunas o alimentación temprana. Ayuno desde la eclosión hasta las 48 hrs. HBF = alimento balanceado hidratado suministrado desde la eclosión hasta las 48 hrs. CHS = suplemento hidratante comercial suministrado desde la eclosión hasta las 48 horas. * (p ≤ 0,05).Lipasa (EC 3.1.1.3). Inmediatamente después de la eclosión, la actividad específica de la enzima lipasa, determinada en homogenizado de páncreas, fue de 106 ± 17 µl de NaOH/ mg de proteína. La tendencia general fue a incrementarse en las primeras 72 h.
Al segundo día de edad, todos los tratamientos presentaron una tendencia al incremento en la actividad de esta enzima, con relación a la actividad al nacimiento, aún en las aves que estuvieron bajo ayuno total (T0). A las 72 h, se observó un incremento acelerado en la actividad de esta enzima en el grupo de animales que estuvo bajo ayuno durante 48 h (Figura 2).
DISCUSIÓN
Tanto el suministro de ABH como el SHC suministrados desde el nacimiento hasta las 48 h post-eclosión provocaron un aumento en la actividad de la enzima maltasa. Este efecto pudiese repercutir favorablemente en una mejor actividad digestiva y mayor absorción de glucosa proveniente de la dieta, lo que al mismo tiempo permitiría mejorar el metabolismo energético del ave. La actividad específica de la maltasa presentó una tendencia marcada al incremento con la edad, en concordancia con lo reportado por otros autores (13).
La actividad de la sacarasa fue casi 32 veces más baja que la actividad de la maltasa después de la eclosión. En pollos de mayor edad se ha reportado que la actividad de la sacarasa suele ser alrededor de 13 a 16% menor que la de la maltasa (13). El suministro de ABH y SHC en las primeras 48 h de vida aumentó la actividad de la sacarasa a las 72 h (p≤0.05). Al igual que la maltasa, la actividad específica de la sacarasa se incrementó con la edad de los animales en el lapso de tiempo que duró el estudio y aumentó después del período de restricción de alimentos; de manera similar a lo reportado por Pinheiro et al (18). Se ha reportado que la actividad de las enzimas digestivas puede ser afectada por las características de la dieta y la disponibilidad del sustrato (19), entre otros factores. La actividad de las enzimas maltasa, sacarasa, fosfatasa alcalina y fitasa, todas proteínas catalíticas integrales del borde en cepillo intestinal, determinadas en el segmento duodenal, aumentó en las primeras 72 h de edad de las aves en los grupos que recibieron algún tipo de alimento o suplemento desde inmediatamente después de la eclosión.
Al evaluar el efecto de la restricción de alimento entre 7 y 14 días de edad, en pollos de engorde, se reportó un aumento en la actividad de las enzimas maltasa y sacarasa inmediatamente después del período de restricción (18). Esto podría aplicarse para explicar en parte el efecto del suministro de alimento a las 48 h de edad, en las aves del grupo control, al incrementar la actividad de las enzimas duodenales.
En cuanto a las enzimas pancreáticas, algunos autores han reportado que la actividad específica de las enzimas digestivas aumenta con la edad, alcanzando valores máximos en el páncreas al 8vo día para amilasa y lipasa y al 11vo día para tripsina. En el contenido intestinal la actividad máxima se observó al 4to día para lipasa, al 11vo día tripsina y al 17vo día en amilasa (9). Durante las primeras 48 h de edad, la actividad de la tripsina fue semejante en todos los grupos, incluyendo a los animales en ayuno, indicando una actividad poco dependiente de la presencia del sustrato, en concordancia por lo reportado por otros autores (20) al observar que la actividad de la tripsina no fue afectada después de evaluar dos niveles diferentes de energía en la dieta en pollos de engorde durante la primera semana de vida. Los resultados obtenidos en el presente estudio podrían estar relacionados con estudios previos en los cuales se ha demostrado que al iniciar la alimentación de los pollos 36 h después de la eclosión se produjo disminución significativa del peso vivo en los primeros tres días de edad (11), así como retardo del crecimiento y menor producción de carne (6), lo que puede ser consecuencia de una menor actividad de las enzimas digestivas del borde en cepillo intestinal.
En conclusión el suministro de ABH o SHC durante las primeras 48 h de vida de los pollos aumentó la actividad específica de las enzimas duodenales del borde en cepillo intestinal maltasa, sacarasa y fitasa y disminuyó la actividad de las enzimas pancreáticas α-amilasa, tripsina y lipasa en los primeros 3 días de edad.
Agradecimientos
Al Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela por el financiamiento de la presente investigación, a través del Proyecto de Grupo Nº PG-11-7118- 2008/1.









