Trichoderma harzianum como agente de control biológico
Publicado: 16 de febrero de 2016
Por: Ing. Agr. Graciela Romero; Ing. Agr. Virginia Olivera Costa e Ing. Agr. Déborah Rodriguez. Facultad de Agronomía, Universidad de la República. Uruguay
1. Introducción.
A partir de la creación de la segunda ley forestal No. 15939, creada el 28 de diciembre de 1987, se impulsó el sector, dada la fuerte promoción de plantaciones con condiciones claramente definidas en lo que respecta a tipos de suelo, especies, densidades, retiros, sanidad y prevención de incendios.
Durante los últimos 20 años se ha multiplicado por 30 la superficie plantada, aproximadamente 950 mil hectáreas en 2010. A esto se le agregan las 750 mil hectáreas de bosque nativo existentes en nuestro país, por lo que la superficie forestada es de 1.700 mil hectáreas, aproximadamente.
Las actividades que lo conforman son: agraria (silvícola) que comprende la producción de material reproductivo y plantines en viveros, la implantación, tratamientos silvícolas intermedios de los bosques y la cosecha; actividad industrial y la actividad de transporte y logística. El sector incluye al menos cuatro cadenas industriales de base forestal: la cadena celulósico-papelera, la de productos de madera elaborada (madera rolliza tratada, madera aserrada, tableros, carpintería de obra, muebles, molduras, etc.), la industria química (resinas, aceites esenciales, bioplásticos, etc.), y la energética.
El gran desafío a nivel nacional de las cadenas forestales, radica en construir un modelo de desarrollo sustentable propio, permitiendo conciliar la conservación de la biodiversidad, el uso sostenible de sus componentes, y la participación justa y equitativa en los beneficios derivados de la utilización de los recursos naturales, (Aguirre y Garret, citado por Olivera Costa y Rodriguez, 2014).
Entre los factores que determinan el incremento de productividad, está el uso de plantines de buena calidad considerando buena conformación y sanidad, los cuales se producen en viveros forestales, entendiéndose como aquel “sitio donde nacen y se crían las plantas forestales, permaneciendo el tiempo necesario para lograr la altura y el vigor indispensables para llevarlas al sitio definitivo de la forestación", (Irisity, citado por Olivera Costa y Rodríguez, 2014).
Para lograr este propósito una buena estrategia es el manejo integrado de enfermedades (MI), este introduce una nueva visión respecto a las poblaciones de patógenos, insectos o malas hierbas, considerándolas componentes del agroecosistema; lo que permite reducir el uso de pesticidas, minimizando los efectos sobre el ambiente, la salud humana, (Pérez, citado por Olivera Costa y Rodríguez, 2014), y sobre todo la microbiota edáfica natural del suelo la cual resulta afectada por el uso excesivo de compuestos químicos que se refleja en el descenso de las poblaciones naturales, tanto en vivero como en plantación.
Dentro del MI, el control biológico es una herramienta, basada en la introducción artificial de agentes de biocontrol en el patosistema, (Mondino y Vero, citado por Olivera Costa y Rodríguez, 2014), o la reintroducción como es el caso de Trichoderma harzianum, habitante natural del suelo.
En este contexto las especies de Trichoderma han sido investigadas como agentes de control biológico por más de 70 años, pero solo recientemente se han comercializado; esto es resultado del cambio en la actitud de la sociedad hacia el uso de compuestos químicos en los cultivos, (Chávez, citado por Olivera Costa y Rodríguez, 2014.
El género Trichoderma posee buenas cualidades para el control de enfermedades en plantas causadas por patógenos fúngicos del suelo. Las especies de Trichoderma actúan como hiperparásitos competitivos, que producen metabolitos antifúngicos y enzimas hidrolíticas a los que se les atribuyen los cambios estructurales s nivel celular, tales como vacuolización, granulación, desintegración del citoplasma y lisis celular, encontrados en los organismo con los que interactúa, (Ezziyyani et al., citados por Chávez,2006).
Esta investigación apunta a la aplicación del hongo Trichoderma harzianum, como controlador biológico el cual se caracteriza por ser un biocontrolador y biopromotor del crecimiento vegetal, nativo en suelos de nuestro país y en varias regiones templadas. (Añon, 2004).
2. Manejo integrado.
Durante los últimos años se ha incrementado la conciencia acerca de la necesidad de preservar los recursos naturales y el medio ambiente tanto para las generaciones actuales como para las futuras. En este contexto hoy en día los objetivos de la producción agrícola son brindar a los consumidores productos de calidad e inocuidad asegurada, producidos mediante métodos conservacionistas de los recursos naturales, respetuosos del medio ambiente. (Mondino y Vero, citado por Olivera Costa y Rodríguez, 2014).
Para dar respuestas a las exigencias actuales de la sociedad, agricultores y técnicos deben implementar complejos sistemas de manejo integrado de las enfermedades, en los que se trata de minimizar el uso de fungicidas recurriendo a técnicas y productos de bajo impacto ambiental, respetando la salud de trabajadores y consumidores, (Olivera Costa y Rodríguez, 2014).
En agricultura se entiende como manejo integrado de plagas (MIP) o control integrado de plagas a una estrategia que usa una gran variedad de métodos complementarios: físicos, mecánicos, químicos, biológicos, genéticos, legales y culturales para el control de plagas. Estos métodos se aplican en tres etapas: prevención, observación y aplicación. Es un método ecológico que aspira a reducir o eliminar el uso de plaguicidas y de minimizar el impacto al medio ambiente.
El control biológico de las enfermedades de plantas aparece como una herramienta indispensable al momento de diseñar y poner en práctica sistemas de manejo integrado. Este surge de la observación, estudio y conocimiento de la naturaleza misma, (Olivera Costa y Rodríguez, 2014).
2.1. Control biológico.
Baker y Cook (1974) definen el control biológico como la reducción de la densidad del inoculo o de las actividades de un patógeno que produce una enfermedad, por uno o más organismos, en forma natural o a través de la manipulación del medio ambiente, hospedero, o antagonista, o por la introducción de una población de uno o más antagonistas, (Cabrera y Tejera, 2002).
Según Rey et al. (2000) las especies del género Trichoderma son las más utilizadas para el control de enfermedades de plantas causadas por hongos debido a que no afectan las plantas superiores, son fáciles de aislar, cultivar y rápido crecimiento en diversos sustratos, , (Kurioka, Martirena y Mulvany, 2013). Según Harman et al., citados por Mondino y Vero (2006) Trichoderma harzianum, es un efectivo promotor del crecimiento en raíces de maíz y pepino. Se afirma que controla fitopatógenos de parte aérea mediante la colonización radicular, ya que induce la resistencia sistémica contra ataques en otras partes de la planta. Otros estudios han demostrado que inocular las raíces con determinadas cepas de Trichoderma lleva a un aumento localizado en la planta de las enzimas vinculadas a la resistencia a patógenos, (Kurioka et al., 2013).
2.2. Trichoderma harzianum.
2.2.1. Ecología del microorganismo.
La primera delimitación genética de Trichoderma spp., la realizó Hartz en 1871, quien enfatizó la importancia y las características microscópicas en la delimitación del género, especialmente por la presencia de fiálides (Romero, citado por Olivera Costa y Rodríguez, 2014) desde entonces ha sido ampliamente estudiado dada su importancia como agente de biocontrol.
Trichoderma harzianum es un hongo aerobio obligado y al ser saprófito del suelo usa un amplio rango de compuestos como fuentes únicas de carbono y nitrógeno, (Añon, 2004).
Trichoderma es una especie que crece en casi todas las regiones climáticas y en una gran variedad de suelos, como ser, praderas, suelos agrícolas, forestales, salinos y desérticos. Existe una correlación entre la distribución de las especies y las condiciones ambientales, como por ejemplo Trichoderma hamamatum y Trichoderma pseudokoningii se encuentran bajo condiciones de excesiva humedad, Trichoderma viride y Trichoderma polysporun habitan en regiones de temperaturas frías, Trichoderma harzianum es característico de temperaturas cálidas y/o templadas, (Danielson y Davey citados por Cabrera y Tejera, 2002).
Su desarrollo se ve favorecido por la presencia de altas densidades de raíces las cuales son colonizadas rápidamente por estos microorganismos, (Chávez, citado por Olivera Costa y Rodríguez, 2014). De las especies de Trichoderma que frecuentemente se utilizan para el biocontrol, son las especies harzianum y viride, de las cuales la primera ha sido la más estudiada. Trichoderma es un fungicida de amplio espectro de acción. Es eficaz contra diversos organismos y géneros de patógenos; tanto en el suelo contra pudriciones de raíces como Armillaria, Ryzoctonia, Phytium, Phyotophtora, Fusarium, enfermedades que se presentan en numerosas especies tanto anuales como perennes, o bien, contra géneros productores de enfermedades de órganos aéreos como Botrytis o Stereum, (Olivera Costa y Rodríguez, 2014).
Cuadro 1. Clasificación taxonómica.
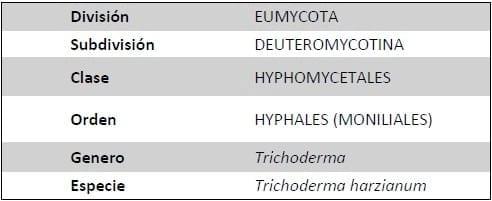
Fuente Agrios, 1995.
2.2.2. Características macroscópicas.
Trichoderma spp es un organismo que presenta colonias (Figura 1) con un rápido crecimiento y ramificación alcanzando las mismas de 7-9 cm de diámetro luego de tres días, en un principio las colonias presentan un color blanquecino y en unos pocos días adquieren una coloración verde intensa (Olivera Costa y Rodriguez,2014).
Figura 1. Cultivos de T. harzianum cepa L1 aislada por Lage y cía.
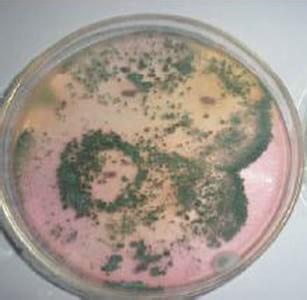
Fuente Negrone, León,Villalba,(2008).
2.2.3. Características microscópicas.
Las cepas pertenecientes a este género se caracterizan por tener una fase asexual, produciendo así esporas asexuales, en forma mitótica y clonal, no presentando una etapa sexual, al menos las cepas que se utilizan con fines de control biológico, (Olivera Costa y Rodríguez, 2014).
El micelio es septado e hialino, del cual se originan los conidióforos, el tamaño de los mismos es de 62,5-69 x 3-4,7 μm, son de color verde (Romero, citado por Olivera Costa y Rodríguez, 2014) de aspecto aterciopelados irregulares, cortos y muy bifurcados. Las ramas principales del conidióforo producen ramas laterales que pueden presentarse en forma verticilada o no; a su vez estas ramas pueden bifurcarse nuevamente. Todas las ramas primarias y secundarias se levantan aproximadamente sobre 90° con respecto al eje principal. En caso que la bifurcación se presente en forma verticilada, el conidióforo toma un aspecto piramidal.
En la mayoría de los casos, el conidióforo termina en una o más fiálides con formas cilíndricas o casi subglobosas, que le dan el aspecto de una botella (Donati, 2011).
Las fiálides son largas y delgadas, solitarias a lo largo del eje, asimétricas, con un tamaño de 6,3-15,6 x 2,7-3,4 μm., con verticilos terminales de hasta 4 conidios de un tamaño aproximado de 3,8-4 x 3,1-3,7 μm, con forma citriforme y subglobosos ( Romero, citado por Olivera Costa y Rodriguez,2014).
Sobre las partes terminales de éstas se forman las esporas (conidios) unicelulares y esféricas, de tonalidades verdes (a veces puedes ser hialinas), con paredes lisas o ásperas, que se disponen en forma de racimos globosos (con disposición de gloióspora) que se separan con facilidad (Donati, 2011).
Este hongo además forma estructuras de resistencia denominadas clamidosporas intercalares o terminales en cortas ramificaciones, las cuales son unicelulares pero pueden fusionarse entre dos o más, de forma subglobosa o elipsoidal o periforme, de coloración subhialinas a amarillentas de 4 a 12 μm de diámetro, con una pared de 1 μm de espesor, (Bissett citado por Cabrera y Tejera, 2002).
Figura 2. A) Hifas y conidióforos de Trichoderma harzianum (1cm = 20 μm). B) Esquema de conidióforo de Trichoderma harzianum.
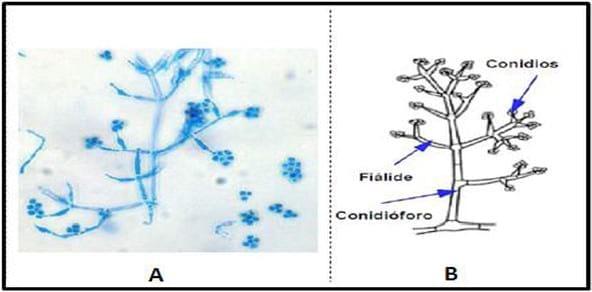
Fuente Donati, (2011).
2.2.4. Factores que afectan el crecimiento y desarrollo.
2.2.4.1. Temperatura.
Dentro del amplio rango de temperaturas a las cuales las especies de Trichoderma se han adaptado, se puede considerar que la mayoría de estas presentan como óptimo de temperatura el intervalo entre los 25 a 30º C (Danielson y Davey et al., citados por Donati ,2011).
Especies como Trichoderma citrinoviride y Trichoderma saturnisporum, parecen tener el óptimo de temperatura más alto (entre 38 y 44º C); Trichoderma viridae y Trichoderma polysporum con el rango óptimo de temperatura más fresco (entre los 20 a 25º C); y en términos medios, especies como Trichoderma harzianum con un rango de temperatura cálido que oscila entre los 22 a 33º C, con una temperatura óptima de 27º C (Danielson y Davey, citados por Donati, 2011).
2.2.4.2. Humedad.
La mayoría de las especies de Trichoderma pasa de un estado latente a uno activo, a medida que aumenta el contenido de humedad del suelo, desarrollándose óptimamente hasta un 60% de la capacidad de campo del mismo (Donati, 2011).
2.2.4.3 Ph.
Las diferentes cepas tienen la habilidad de crecer en un amplio rango de pH que va de 2 a 6, presentando un crecimiento optimo entre 4 y 6,5, y solo unas pocas especies parecen tolerar un pH menor a 3, según Kubicek y Harman citados por Donati (2011).
Según otros autores, Danielson y Davey, citados por Cabrera y Tejera (2002) Trichoderma harzianum, presenta un rango óptimo de crecimiento a pH de 3,7 a 4,7.
2.2.4.4. Oxigeno.
Dos componentes del aire son esenciales para los hongos: el oxígeno y el dióxido de carbono. Trichoderma es un hongo netamente aerobio obligado, si bien se encuentran algunas especies de Trichoderma, como anaerobios facultativos, las cuales tienen la habilidad para crecer en hábitats como suelos profundos donde el oxígeno es relativamente insuficiente (Chávez citado por Oliver Costa y Rodriguez,2014).
En el caso de incorporar a un sustrato Trichoderma como agente de biocontrol en la producción de plantines en vivero, es fundamental considerar las características del sustrato en lo referente a una buena aireación, no solo para el hongo, sino también para el sistema radicular del plantín. Utilizando sustratos con baja proporción de la fase sólida (del orden del 15% del peso seco), o sea buena macroporosidad, se asegura un buen intercambio gaseoso en el sistema sustrato-atmósfera tanto del O2 como del CO2 producido (Donati, 2011).
2.2.5. Trichoderma como controlador biológico.
Trichoderma muestra diversas ventajas como agente de control biológico, debido a su rápido crecimiento y desarrollo; también produce una gran cantidad de enzimas capaces de degradar a otros organismos, cuya secreción se induce con la presencia de hongos fitopatógenos, Olivera Costa y Rodríguez, 2014.
Cruzat y Ionannidis (2008) destacan las siguientes ventajas de Trichoderma harzianum:
- Es un agente natural, no agresivo con plantas o suelos.
- Aumenta la capacidad de crecimiento de la planta y le confiere mayor resistencia a condiciones de estrés (mayor desarrollo radicular).
- Carece de toxicidad sobre las partes comestibles de los cultivos, asimismo aminora el daño al medio ambiente por la ausencia de químicos persistentes en el suelo.
- Se aplica fácilmente mediante formulación líquida o sólida, pulverizándolo sobre el terreno o sobre la planta; no requiere de equipamiento especial para su aplicación.
- Compatible con otros fungicidas, como el azufre.
- Bajo costo, comparado con productos alternativos (extractos vegetales).
- Compatible con inoculantes de leguminosas; es posible aplicarlo a semillas que han sufrido un tratamiento fungicida químico.
- Disminuye y, en algunos casos, elimina la necesidad de tratar con fungicidas químicos, con lo cual se reducen los costos y el uso de fertilizantes, pues las plantas tienen más raíces y las utilizan mejor.
- Por ser un habitante natural del suelo, su registro comercial suele ser más fácil que el de un producto químico.
- Es considerado un producto no tóxico ni alergénico, no presenta toxicidad en mamíferos y es inocuo para abejas y abejorros.
- El control biológico por microorganismos presenta ventajas como: especificidad, permanencia en el tiempo e inocuidad para el ser humano y el medio ambiente, ya que se realiza con organismos presentes naturalmente en los ecosistemas del país.
- A diferencia del control biológico con insectos depredadores o parásitos, las formulaciones con microorganismos controladores son de más fácil aplicación.
Cuadro 2. Algunos hongos fitopatógenos controlados por Trichoderma spp.
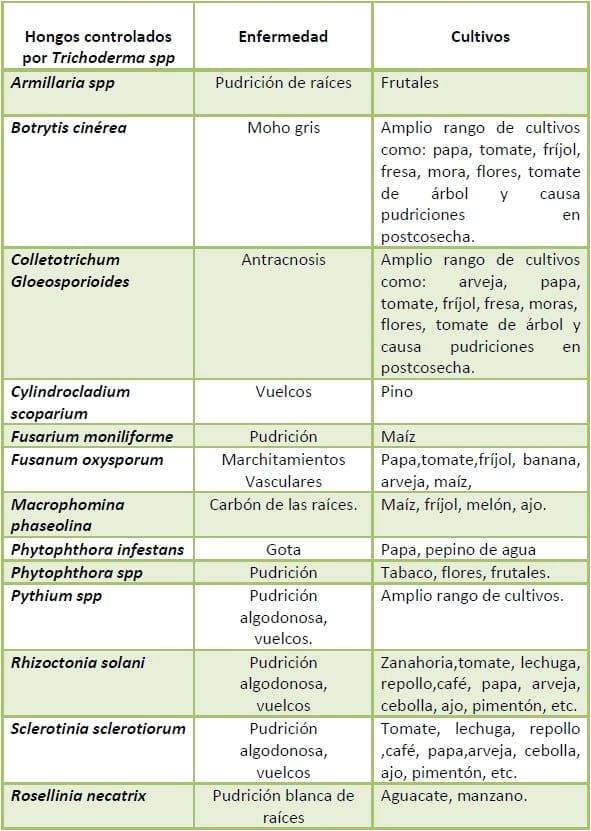
Fuente: Adaptado de Herrera-Estrella y Carsolino, 1998 y Chet and Invar., 1994, citados por Añon, 2004.
2.2.6. Control biológico con Trichoderma en diferentes ambientes.
El control con Trichoderma puede realizarse en los diferentes ambientes donde se produce el ataque de los patógenos. La selección del método de aplicación se hace teniendo en cuenta los patógenos que se pretenden controlar y el sitio de la planta donde se produce el ataque, (Olivera Costa y Rodríguez, 2014).
El control se aplica a las semillas; al suelo; en la superficie aérea, a las flores, frutos y hojas y a los productos cosechados, en éstos últimos es muy difícil lograr un control efectivo y hasta el presente es donde menor desarrollo se ha alcanzado (Pérez, citado por Oliver Costa y Rodriguez,2014).
2.2.6.1. Control biológico en las semillas.
El tratamiento de semillas tiene dos objetivos. El primero es la protección; se define como la habilidad del tratamiento para proteger las semillas contra los agentes patógenos que ésta conlleva o de los que habitan en el suelo, para este propósito necesita ser efectivo en un período corto de tiempo que puede ir de 7 a 14 días.
El segundo es la protección en el tiempo de las partes subterráneas de la planta; algunas cepas de Trichoderma tienen habilidad para competir en la rizósfera y son capaces de colonizar la raíz y el espacio adyacente a ésta a partir de la semilla tratada (Pérez, citado por Olivera Costa y Rodríguez, 2014), siendo este uno de los métodos más utilizados por las ventajas que ofrece.
En primer lugar facilita el establecimiento de Trichoderma en la rizósfera de la planta, se pueden tratar de una vez, cantidades grandes de semillas con mucha eficiencia y la cantidad de Trichoderma que se necesita es relativamente pequeña si se compara con la que se adiciona al sustrato para la siembra en semilleros o para la aplicación directa al campo, lo que resulta mucho más económico.
El tratamiento puede realizarse por diferentes métodos: aplicación del producto en forma de polvo seco, usando un ingrediente inerte, como por ejemplo el grafito, para aumentar la adherencia a las semillas; aplicación del biopreparado en forma de pasta en mezcla con un ingrediente que forme una película adherente y la cobertura por peletización (Pérez, citado por Olivera Costa y Rodríguez, 2014).
Un elemento a considerar cuando se tratan semillas es la velocidad con que el patógeno y el antagonista colonizan ésta. Muchas especies de Trichoderma tienen una velocidad de germinación lenta respecto de algunos patógenos muy agresivos, por ejemplo P. ultimun es capaz de germinar después de dos horas en contacto con los exudados de las raíces, lo cual disminuye el tiempo de colonización de la semilla (Pérez, citado por Olivera Costa y Rodríguez, 2014).
Taylor et al., citados por Pérez (2004) recomiendan en esos casos la doble peletización de la semilla, primero se aplica el antagonista y después un nutriente, cuando la semilla se pone en contacto con la humedad del suelo el nutriente adicionado se disuelve y Trichoderma puede germinar rápidamente y colonizar antes que el patógeno sea estimulado por las secreciones de las raíces. Se sugiere tener esto en consideración en el momento de diseñar formulaciones para la protección de las semillas, Olivera Costa y Rodríguez, 2014.
2.2.6.2. Control biológico en el suelo.
El mayor énfasis en las investigaciones con Trichoderma se ha puesto en el control de los patógenos que tienen el suelo como hábitat. Una de las razones fundamentales de esa tendencia es que el ambiente del suelo es mucho más favorable para el establecimiento de un antagonista que otros, como por ejemplo la filósfera. De hecho el control biológico con Trichoderma ha sido más exitoso en la rizósfera que en otros ambientes (Pérez, citado por Olivera Costa y Rodríguez, 2014).
El control biológico en el suelo y en las semillas está muy relacionado. Una gran parte de las aplicaciones de Trichoderma para el control de patógenos que habitan el suelo se realiza a través del tratamiento de semillas tal como se describió anteriormente. Uno de los objetivos de aplicar Trichoderma a las semillas es establecer el agente localmente en la rizósfera (Harman y Nelson, citados por Pérez, 2004). Otros métodos para introducir biopreparados de Trichoderma en el suelo son la aplicación directa al surco o a voleo, en el momento de la siembra, en estos casos generalmente como gránulos, o incorporado junto con enmiendas orgánicas (Pérez, citado por Olivera Costa y Rodríguez, 2014).
Gran parte del éxito que se obtiene con el uso de biopreparados en base a Trichoderma dependen del método de aplicación, por esa razón a la mezcla con enmiendas orgánicas se ha prestado tanta atención. La introducción de diferentes enmiendas orgánicas al suelo previo a la siembra y a la aplicación de Trichoderma condiciona un ambiente favorable para la multiplicación y colonización de éste. Se ha comprobado que la efectividad es aún mayor si Trichoderma se incorpora como parte de un compost (Pérez, citado por Olivera Costa y Rodríguez, 2014).
Diferentes razas de T. harzianum han resultado muy efectivas en el control de Fusarium, Pythium, Phytophthora y Rhizoctonia en maíz, algodón, soya, papa, tomate, tabaco, remolacha, frijoles, maní y frutales (Pérez, citado por Olivera Costa y Rodríguez, 2014).
2.2.6.3. Control en la superficie aérea (flores, frutos y follaje).
Aunque el control biológico de las enfermedades fungosas en la superficie aérea de las plantas puede ser posible aplicando principios semejantes a los que se aplican para el control de las enfermedades de las raíces éste difiere del último en aspectos esenciales, en primer lugar ha sido menos estudiado -entre otras causas- debido a su efectividad moderada, que con frecuencia es menor del 50 %, a un espectro de acción estrecho y velocidad de acción lenta (Pérez, citado por Olivera Costa y Rodríguez, 2014); y por otra parte, a la disponibilidad de fungicidas relativamente efectivos contra la mayoría de los patógenos fungosos foliares (Pérez, citado por Olivera Costa y Rodríguez, 2014).
La efectividad moderada puede deberse a que el ambiente en la filósfera es un hábitat más hostil para los microorganismos que el suelo. La escasa disponibilidad de nutrientes, las temperaturas extremas, el polvo y la intensidad de la radiación solar son condiciones que dificultan el establecimiento de los antagonistas (Pérez, citado por Olivera Costa y Rodríguez, 2014), sólo aquellos muy agresivos pueden establecerse por sí mismos antes de la llegada de los patógenos y por tanto ser capaces de frenar el desarrollo de la enfermedad; entre los antagonistas con esas características se encuentran especies pertenecientes al género Trichoderma (Pérez, citado por Olivera Costa y Rodríguez, 2014).
Las formulaciones diseñadas para aplicaciones en la filósfera generalmente contienen aditivos (nutrientes y adherentes) para facilitar la colonización por Trichoderma. Se ha de tener en cuenta que esos aditivos no estimulen al patógeno bajo las condiciones de escasez de nutrientes que existe en ese lugar.
Hasta hace poco tiempo las investigaciones realizadas sobre control biológico de las enfermedades foliares estaban centradas en el control de patógenos bacterianos. El hecho de que en los últimos años se haya incrementado el número de casos de fungo-resistencia, por ejemplo, a los benzimidazoles y dicarboximidas (Pérez, citado por Olivera Costa y Rodríguez, 2014), la preocupación por los efectos negativos de los fungicidas sobre el agro-ecosistema y el elevado costo de obtención de nuevos productos plantea la necesidad de desarrollar estrategias de control alternativas y por tanto se ha incentivado el interés en el control biológico de las enfermedades foliares causadas por hongos. Inicialmente las investigaciones se concentraron en el uso de Trichoderma spp. y Gliocladium spp., para el control de Botrytis cinerea, en uva y fresa (Wilson y Backman, citados por Pérez, 2004). B. cinerea es uno de los patógenos más nocivos para una amplia variedad de cultivos, T. harzianum ha sido usado exitosamente en el control de éste en numerosos países (Pérez, citado por Olivera Costa y Rodríguez, 2014).
2.2.7. Mecanismos de acción directos de Trichoderma spp. como agente de biocontrol.
Las especies del genero Trichoderma son los antagonistas más utilizados para el control de enfermedades producidas por hongos debido a su ubicuidad, facilidad de aislamiento y cultivo, rápido crecimiento en varios sustratos, ataca una amplia variedad de hongos fitopátogenos responsables de la mayoría de enfermedades en cultivos, pero sobretodo porque no ataca plantas superiores, (De la Cruz et al., citados por Chávez, 2006).
Estas especies presentan diferentes modos o mecanismos de acción que le permiten el control de los fitopatógenos. Entre estos mecanismos se encuentran:
- Competencia por el sustrato
- Micoparasitismo
- Antibiosis
- Desactivación de enzimas del patógeno
- Resistencia inducida
- Tolerancia a situaciones de estrés por favorecer el desarrollo radicular y aéreo de la planta.
2.2.7.1. Competencia.
La competencia constituye un mecanismo de antagonismo muy importante.
Se define como el comportamiento desigual de dos o más organismos ante un mismo requerimiento (sustrato, nutrientes), siempre y cuando la utilización de este por uno de los organismos reduzca la cantidad o espacio disponible para los demás. La competencia ocurre, siempre y cuando, haya escasez de algún factor esencial para el desarrollo de los microorganismos involucrados.
Este tipo de antagonismo se ve favorecido por las características del agente de control biológico como plasticidad ecológica, velocidad de crecimiento y desarrollo, y por otro lado por factores externos como tipo de suelo, pH, temperatura, humedad, entre otros. Sin duda, este tipo de mecanismo de acción se ve favorecido por las características intrínsecas del género Trichoderma; algunas de las cuales ya se han mencionado directa o indirectamente: alta velocidad de crecimiento y desarrollo, abundante esporulación, gran capacidad de sobrevivir en condiciones muy extremas (tipo de suelo, pH, temperatura, humedad, presencia de compuestos tóxicos como herbicidas y fungicidas, etc.). Todas estas características referidas al género Trichoderma, lo convierten en un excelente competidor por los diversos factores esenciales de crecimiento para los microorganismos, además de ser un eficiente agente de control biológico (Benítez et al., Infante, citados por Donati, 2011).
2.2.7.2. Micoparasitismo.
Mondino y Vero (2006) definen como micoparasitismo a la capacidad de un organismo de degradar y asimilar hongos, (Olivera Costa y Rodríguez, 2014).
El organismo micoparasito debe ser capaz de colonizar un hongo vivo, degradar sus paredes celulares, asimilar y nutrirse a partir del contenido celular del mismo, (Olivera Costa y Rodríguez, 2014). Este mecanismo es una de las estrategias utilizadas por hongos biocontroladores como los pertenecientes a los géneros Trichoderma y Gliocladium.
El micoparasitismo es un proceso complejo el cual se divide en cuatro etapas: crecimiento quimiotrófico, reconocimiento, adhesión y enrollamiento, y actividad lítica, (Figura 3). El desarrollo de cada una de las etapas depende de los microorganismos involucrados, de la acción biotrófica o necrotrófica del antagonista y de las condiciones ambientales (Infante, citado por Olivera Costa y Rodríguez, 2014).
Crecimiento quimiotrófico: El quimiotropismo positivo es el crecimiento del antagonista en dirección hacia el patógeno, bajo el estímulo de algún compuesto químico. Durante la etapa de localización, Trichoderma puede detectar al hospedante a distancia y sus hifas crecer en dirección al patógeno como respuesta a un estímulo químico.
- Reconocimiento: El reconocimiento entre el hospedero y el micoparásito se realiza a través de interacciones del tipo lecitinas-carbohidratos, entre las paredes de ambos organismos. Las lectinas son proteínas enlazadas a azúcares o glicoproteínas, las cuales aglutinan células y están involucradas en las interacciones entre los componentes de la superficie de las células y su ambiente extracelular (Infante et al., citados por Olivera Costa y Rodríguez, 2014). El reconocimiento entre cepas de Trichoderma y especies de hongos fitopatógenos son efectivas sólo contra patógenos específicos, por lo que el reconocimiento molecular es el evento esencial que precede al proceso antagonista.
- Adhesión y enrollamiento: Una vez que la respuesta de reconocimiento es positiva, el micoparásito se une al hospedero. En el género Trichoderma las hifas del micoparásito se adhieren a las del hospedante mediante la formación de estructuras parecidas a ganchos y apresorios y se enrollan alrededor de estas (Figura 4).
- Actividad lítica: En la última etapa del proceso de micoparasitismo, ocurre la producción de enzimas líticas extracelulares, fundamentalmente quitinasas, glucanasas y proteasas, capaces de degradar las paredes celulares del hongo hospedero, que posibilitan la penetración de las hifas del antagonista. Las especies del género Trichoderma excretan enzimas (celulasas, glucanasas, lipasas, proteasas y quitinasas) que participan en la lisis de la pared celular de las hifas del hospedante, facilitando la inserción de estructuras especializadas y de sus propias hifas, que absorben nutrientes del interior del hongo fitopatógeno. Finalmente el proceso termina con la pérdida del contenido citoplasmático de la célula del hospedante, el cual se presenta con síntomas de disgregación, lo que disminuye la actividad patogénica del mismo.
Figura 3. Mecanismo de acción antagónica de Trichoderma.
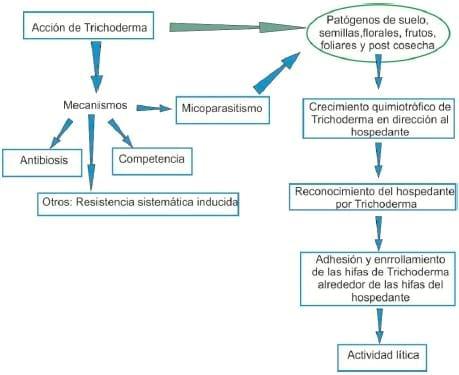
Fuente: Pérez, 2004.
El micoparasitismo no está restringido solamente a la destrucción de hifas; sino que también se puede dar sobre las estructuras de resistencia de diferentes hongos. Es común encontrar poblaciones naturales de Trichoderma colonizando esclerotos de Sclerotinia sclerotiorum (Mondino y Vero, citados por Olivera Costa y Rodríguez, 2014).
Figura 4. Fotomicrografías de interacciones entre Trichoderma harzianum (T.h.) y Phytophthora capsici (P.c).
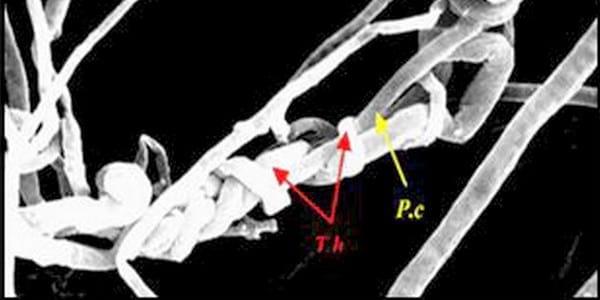
Fuente: Ezziyyani M , et al., 2004.
En esta imagen se puede apreciar el enrollamiento masivo de las hifas de Trichoderma harzianum (T.h) alrededor de las de P.c. Aspecto del micoparasitismo ejercido por el antagonista, T.h. sobre el patógeno P.c. Vistas en microscopia electrónica de barrido, (Olivera Costa y Rodríguez, 2014).
2.2.7.3. Antibiosis.
Esta ocurre cuando hay producción de metabolitos tóxicos o antibióticos de un organismo con acción directa sobre otro. Muchos microorganismos tienen la capacidad de producir antibióticos en cultivos puros, lo cual es la más fuerte evidencia de la posible acción de este tipo de compuestos como mecanismo de ataque de Trichoderma harzianum bajo condiciones de campo. No obstante, para este hongo en particular, la producción de metabolitos está fuertemente ligada a la producción de enzimas propias del proceso de micoparasitismo, (Añon, 2004).
Dennis y Webster, citados por Infante et al., (2009) fueron los pioneros en esta temática, con la realización de los trabajos más completos acerca de la función de los antibióticos producidos por hongos del género Trichoderma sobre patógenos de las plantas. Ellos relacionaron la actividad antibiótica de Trichoderma spp. con compuestos no volátiles, entre los que se encontraban uno identificado como trichodermin y otros metabolitos peptídicos, (Olivera Costa y Rodríguez, 2014).
En investigaciones posteriores Webster y Lomas, citados por Díaz (2010) determinaron que Trichoderma spp. produce dos antibióticos más: gliotoxina y viridina, (Olivera Costa y Rodríguez, 2014).
Más tarde Oliver y Germain, citados por Infante et al., (2009) informaron que T. harzianum Rifai produce numerosos antibióticos como son: trichodermina, suzukacilina, alameticina, dermadina, trichotecenos y trichorzianina, (Olivera Costa y Rodríguez, 2014).
Posteriormente, Dennis y Webster, citados por Pérez, (2004) detectaron que la actividad antibiótica de algunos aislamientos se debía también a la producción de compuestos volátiles, y notaron que los aislamientos más activos poseían un fuerte olor a coco, posiblemente relacionado con la actividad antagonista, (Olivera Costa y Rodríguez, 2014).
Los antibióticos volátiles tienen un efecto esencialmente fungistático, debilitando al patógeno y lo hacen más sensible a los antibióticos no volátiles, lo que se conoce como un "hiperparasitismo" de origen enzimático, (Olivera Costa y Rodríguez, 2014).
Stefanova et al., (1999) informaron la presencia de metabolitos no volátiles con actividad antifúngica en cuatro aislamientos de Trichoderma y concluyeron que los mismos reducen el crecimiento micelial de Phytophthora nicotianae Breda de Haan y R. solani en medios de cultivo envenenado con filtrados líquidos donde se habían cultivado las cepas antagónicas. Plantean además, que al parecer estos causan a nivel celular: vacuolización, granulación, coagulación, desintegración y lisis, (Olivera Costa y Rodríguez, 2014).
2.2.8. Mecanismos de acción indirectos de Trichoderma spp. como agente de biocontrol.
2.2.8.1. Efecto promotor del crecimiento en plantas.
El género Trichoderma aparte de controlar enfermedades producidas por diferentes patógenos, tiene la capacidad de promover el crecimiento de las plantas inoculadas con el mismo, (Negrone,León,Villalba, 2008).
Trichoderma harzianum presenta acción solubilizadora de nutrientes y minerales del suelo, lo que conlleva a un aumento en el crecimiento de las plantas, además de la disminución de la actividad de organismos perjudiciales de la microflora de la raíz, lo cual es un efecto indirecto que brinda protección a las mismas (tanto en la parte radical como en la parte aérea) contra la infección por patógenos. Esto lleva a un aumento en el crecimiento de la raíz, obtención de plantas con sistemas radicales más ramificados, raíces más fuertes y robustas, lo cual puede incrementar el rendimiento del cultivo debido a que proporciona al sistema radical un mayor alcance y absorción de nutrientes y agua (Tortolero y Pavone, citados por Olivera Costa y Rodríguez, 2014).
Especies del género Trichoderma presentan una relación simbiótica con las raíces de plantas que determinan un aumento considerable en el crecimiento de las mismas, Kurioka et al., (2013), y por lo tanto mayor tolerancia a situaciones de estrés.
Posibles mecanismos que explican la promoción de crecimiento según Inbar citado por Kurioka et al., (2013), son control de patógenos de menor importancia, producción de hormonas, producción de vitaminas, conversión de materiales no utilizables en utilizables (solubilización de minerales), aumento en la absorción de minerales y aumento en la traslocación de minerales.
Hoy por hoy existen muchos trabajos realizados con varias especies de interés tanto agrícola como hortícolas, fruticultura y forestal, que demuestran el efecto biopromotor sobre del crecimiento de estos cultivos al agregarle diferentes cepas de Trichoderma (Donati, 2011).
Añon et al., (2004), en una evaluación con plantines de Pinus taeda, y diferentes dosis de fertilización y la inclusión o no de Trichoderma harzianum cepa L1, concluyeron que los plantines inoculados con Trichoderma harzianum presentaron una altura mayor del 24%, con respecto a los no inoculados. Además, los plantines a los que se les incluyo Trichoderma harzianum exhiben un diámetro de cuello un 15% mayor, con respecto a los sin inocular; un 49% más en materia fresca y un 38 % más en materia seca, en referencia a los sin inocular.
En la evaluación del crecimiento de plántulas de Pinus radiata en vivero con y sin agregado de Trichoderma harzianum al sustrato, se observó que indujo un aumento en el desarrollo radicular, de la planta permitiendo una mayor absorción de nutrientes disponibles. Los resultados indican que la presencia conjunta de compost y T. harzianum se visualizó en un incremento en altura y biomasa de las plantas, así como del desarrollo del sistema radical. Por su parte, la presencia de compost estimula un incremento poblacional del hongo T harzianum, indicando que la inoculación de los sustratos utilizados para producción de plántulas de P. radiata con T harzianum generaría un incremento significativo en el vigor de las plántulas producidas (Donoso et al., citado por Kurioka et al., 2013)
Una investigación realizada en aguacate por Bolaños et al., citados por Olivera Costa y Rodríguez (2014), observaron que plantas inoculadas con Trichoderma presentaron valores de peso fresco aéreo y peso fresco radicular mayores que los valores arrojados por las plantas inoculadas con otras especies de hongos formadores de micorrizas arbusculares y de antagonistas, también se obtuvieron mayores valores de peso seco aéreo y peso seco raíces lo que indica que esta combinación de hongos formadores de micorrizas arbusculares y Trichoderma favorece el desarrollo vegetativo de las plántulas.
La realidad es que no se conoce con exactitud los procesos por el cual Trichoderma estimula el crecimiento vegetal, pero se ha identificado algunas cepas que producen fitohormonas (auxinas, citoquininas y etileno) con poder inductor. Dentro del grupo de las citoquininas se ha identificado a la zeatina, y en las giberelinas a GA3 y grupos relacionados a esta última (Arora et al., Benítez et al., citados por Donati, 2011).
Según Valencia et al., Cubillos et al., citados por Rossi (2010) las sustancias producidas por T. harzianum, actúan como catalizadoras de los tejidos meristemáticos primarios en las partes jóvenes de la planta, lo que provoca una aceleración en la reproducción celular, esto hace que la planta se desarrolle más rápido en comparación con plantas que no han sido tratadas con este agente. En investigaciones realizadas indican T. harzianum biopromotor del crecimiento, Cubillos et al., citado por Rossi (2010), donde mostraron a Trichoderma como estimulador in vitro en semillas de maracuyá, aumentando la velocidad de germinación y el porcentaje de germinación de las mismas. La estimulación del metabolismo de las semillas mediante el tratamiento con Trichoderma presenta la ventaja de que los plantines tienden a presentar mayor uniformidad en sus dimensiones y por lo tanto en la calidad final del material (Carneiro, Cóppola et al., citados por Rossi, 2010). Cubillos citado por Rossi (2010), observo incrementos significativos tanto en longitud como en grosor del tallo de las plantas producidas, así como en la longitud de la raíz, mayor producción de hojas verdaderas y aumento del peso seco total. El crecimiento en la biomasa radical no solamente beneficia al vegetal, también aumenta la disponibilidad propia de nutrientes para el biopromotor, ya que se acrecientan los exudados de raíz (Rossi, 2010).
Ezziyyani et al., citados por Rossi (2010), vieron que las semillas de pimiento tratadas con T.harzianum aumentaron el porcentaje de germinación y el peso seco de las plantas.
Con la utilización de marcadores moleculares en ensayos los autores sugieren que Trichoderma estimula le expresión de genes que regulan la producción de auxinas, hormonas importantes en la producción de raíces laterales (Rossi, 2010).
Como se dijo en el párrafo anterior la Trichoderma produce factores de crecimiento como auxinas, citoquininas, etileno y ác. acético entre otros, que se dirigen a las raíces y por lo tanto se verán sus efectos en el crecimiento vegetal. Sin embargo en algunos casos este efecto es cuestionado, ya que algunos genotipos vegetales no reaccionan de la manera esperada ante el incremento local de estas hormonas en la rizósfera (Rossi, 2010).
Como se sabe las citoquininas están involucradas en la regulación de procesos fisiológicos y de desarrollo de los vegetales, entre los que se incluyen la estimulación de la división celular, la morfogénesis de tallos y raíces, la senescencia de la hoja, la movilización de nutrientes, la dominancia apical, la formación y actividad de los meristemos del ápice caulinar, el desarrollo floral, la ruptura de la dormición de la yema, la germinación de la semilla, entre otros (Rossi, 2010).
La inoculación del sustrato con Trichoderma harzianum tuvo efecto promotor en el crecimiento, que se evidencia en todos los parámetros de calidad de plantin de Pinus taeda evaluados. Para los parámetros evaluados se observó que la dosis de fertilizante utilizada para la producción de plantines en conjunto con la inoculación de T. Harzianum produjo plantines de mayor calidad que cuando no se inoculo. También se observó que hubo una respuesta significativa para algún parámetro cuando se aplicó el doble de dosis utilizada para la producción de plantines en conjunto con la inoculación de T.harzianum (Añon, 2004).
Donati (2011), en la investigación realizada pudo comprobar que el producto comercial Trichoderma harzianum (Trichosoil®) presento un efecto promotor del crecimiento sobre plantines de Pinus taeda, producidos en un vivero forestal. Este efecto se constató a nivel de las variables estudiadas, diámetro a la altura del cuello y altura de la parte aérea. Además se observó un incremento de la biomasa producida, reflejada en el aumento de los pesos frescos y secos de los plantines. El incremento mencionado anteriormente, se basa en las diferencias observadas en la parte aérea de los plantines, pero no se encontraron diferencias para el sistema radicular.
Los resultados obtenidos por Rossi (2010), indican que la aplicación de Trichoderma harzianum en sustrato presento un efecto promotor en el crecimiento de plantines de Eucalyptus dunnii evidenciado en todos los parámetros evaluados. Se puede mencionar que entre estos parámetros los niveles superiores alcanzados por las variables diámetro y altura, mencionadas por ser los índices más utilizados en viveros, de 31.6 % y 11.3 % respectivamente. Con la aplicación de Trichoderma harzianum permitió comenzar las etapas de clasificación de plantines tres semanas antes de lo estipulado, además se bajó las dosis de nitrógeno aplicadas para estos mismos plantines.
Boffano y Mosqueira (2012), observaron en su investigación donde se evaluaron cinco hibridos de E. grandis para el parámetro morfológico, diámetro de cuello, los híbridos mostraron diferencias significativas solo en la fase rustificación. Donde el híbrido GC172 fue el mejor, en relación a los híbridos GC513, GT529 y GU8, y a la vez estos últimos fueron superiores al híbrido GC514. Y se obtuvo los mejores valores, para altura de plantín, como para diámetro de cuello, fue el híbrido GC172, de esta manera queda en evidencia su superioridad del mismo en la fase de vivero.
En una investigación realizada recientemente por Olivera Costa y Rodríguez (2014), para la producción de plantines sanos y vigorosos, donde se evaluaron dos tamaños de plantines de híbridos de E. grandis tratados con Trichoderma harzianum más quitosano observaron que presentaron mayor crecimiento para los tres hibridos evaluados en ambos tamaños donde el genotipo GC514 tamaño intermedio y una aplicación presento un crecimiento en altura promedio de 0.13 m superior con respecto al testigo y dos aplicaciones, en lo que se refiere al diámetro el crecimiento promedio fue de 0.42 cm y 0.37 cm, superior al testigo y dos aplicaciones respectivamente. Para el genotipo GT529 tamaño grande y una aplicación, el crecimiento en altura promedio fue de 0.24 m superior al testigo y 0.16 m superior a los individuos que recibieron la segunda aplicación extra. El crecimiento en diámetro fue de 0.25 cm y 0.26 cm superior al testigo y dos aplicaciones respectivamente. Y el genotipo GU8 tamaño grande y dos aplicaciones, el crecimiento en altura que presentaron los individuos en promedio fue de 0.23 m con respecto al testigo y una aplicación. El crecimiento en diámetro fue de 0.42 cm con respecto al testigo y una aplicación.
2.2.8.2. Solubilización de nutrientes minerales.
Los nutrientes en el suelo se encuentran en diferentes formas químicas, donde muchas veces estos no se encuentran disponibles para las plantas. Ciertos microorganismos pueden transformar las formas no solubles, o sea no disponibles en disponibles para las plantas. Esto podría explicar el efecto de los microorganismos en la promoción del crecimiento vegetal debido al resultado de la biofertilización (Altomare et al. 1999, Benítez et al., citado por Donati, 2010).
Trichoderma spp. es un microorganismo con capacidad de solubilizar nutrientes y minerales del suelo no disponibles para las plantas . La forma en que lo hace es mediante tres mecanismos: acidificación del medio mediante la liberación de ácidos orgánicos que secuestran cationes y acidifican el medio alrededor de las raíces, producción de metabolitos quelantes (sideróforos) que quelatizan Fe, Fe3+ y Cu2+ y actividad redox (Tortolero y Pavone, citados por Olivera Costa y Rodríguez, 2014).
Debido a los mecanismos mencionados anteriormente es que, los fosfatos (principalmente de calcio), Fe2 O3, MnO2, Cu y Zn quedarían disponibles para las plantas (asimilables), lo que provoca incrementos en la altura y biomasa de las mismas (Tortolero y Pavone, citados Olivera Costa y Rodríguez, 2014).
El fósforo en la solución del suelo (el disponible para las plantas), se encuentra en muy bajas concentraciones debido a que esta de forma no disponible formando complejos fosfatados insolubles como P-Al, P-Fe y P-Ca, los que no pueden ser asimilados por las plantas. Pero el fosfato de calcio insoluble puede ser disuelto y estar de forma asimilable debido a los microorganismos de la rizósfera, que a través de un mecanismo que se supone que se da por la liberación de ácidos orgánicos por parte de los microorganismos (Cunningham y Kuiack, Altomare et al., citados por Donati, 2010). Tortolero y Pavone, citados por Olivera Costa y Rodríguez (2014), mencionan que una vez que el fosforo es solubilizado es almacenado en la biomasa de Trichoderma para ser liberado próximo a las raíces luego de la lisis o degradación del micelio por la edad.
Tortolero y Pavone, citados por Olivera Costa y Rodriguez (2014), observaron que al tratar sustrato con Trichoderma spp. se da una liberación de nutrientes minerales y de materia orgánica al mismo ya que, aumenta la actividad saprofítica de estos en el suelo, también mejora la absorción de elementos como arsénico, cobalto, cadmio, níquel, aluminio y algunos micronutrientes tales como magnesio, manganeso, boro, zinc y sodio.
Para el manganeso Trichoderma tiene la capacidad de solubilizarlo sin tener en cuenta el pH del medio ni la disponibilidad del mismo, este micronutriente es importante dentro de la planta ya que cumple diferentes funciones fisiológicas de las como la fotosíntesis, metabolismo del nitrógeno, síntesis de compuestos aromáticos como precursores de aminoácidos y hormonas, de fenoles y lignina, por lo tanto tiene un rol importante en el crecimiento y resistencia a enfermedades (Altamore et al., citados por Kurioka et al., 2013).
2.2.8.3. Inducción de resistencia.
Según Agrios (2004), la resistencia se define la capacidad de un organismo para excluir o superar, por completo o en algún grado, el efecto de un agente patógeno o factor perjudicial de otro tipo.
Las plantas presentan dos tipo de mecanismos de defensa uno de ellos es denominado constitutivo que son los que actúan de forma pasiva, ya que la resistencia la otorga mediante deposición de cera y cutícula sobre células de la epidermis, modificación de la estructura de las paredes celulares por la acumulación de lignina, callosa, suberina, gomas, cutina, glicosidos fenólicos, fenoles, quinonas, esteroides, glicoalcaloides, terpenoides y tioninas, paredes celulares más gruesas, tamaño, localización y forma de estomas, y presencia de tricomas, lo mencionado anteriormente correspondería a los mecanismos físicos los bioquímicos son fitoanticipinas, lectinas, proteínas inhibidoras de poligalacturonasas, quitinasas y glucanasas. Pero en cambio la inducción de mecanismos de resistencia a enfermedades, se activa por la mediación de sistemas de reconocimiento específicos por los cuales la planta reconoce el ataque de un patógeno (Hutcheson, Madriz, citado por Rossi 2010). La planta posee la capacidad de resistir una enfermedad o adquirirla en la interacción con el patógeno, esta puede ser de dos tipos: compatible cuando ocurre enfermedad, e incompatible cuando la planta resiste. En esta última la planta puede percibir la presencia del patógeno mediante dos mecanismos diferentes (Rossi, 2010). Uno de los mecanismos se basa en la teoría gen por gen, la cual propone la interacción física entre un producto codificado por un gen de resistencia (R) de la planta con el producto de un gen de avirulencia (avr) del patógeno, de esta forma activándose los mecanismos de resistencia en la planta que impiden la aparición de la enfermedad. Es altamente específica y complementaria a nivel de la planta y el patógeno, causando generalmente una reacción de tipo hipersensible, con muerte celular generalizada que detiene el desarrollo de la infección (Rossi, 2010). Y el otro mecanismo está determinado por el reconocimiento de compuesto o inductores químicos, que son secretados por el patógeno o por la planta en la interacción con el mismo, los que son reconocidos por receptores de membrana de las células vegetales, generando la activación de mecanismos de defensa. No es específico a nivel de especies o subespecies entre genes específicos y complementarios (Saucedo y Gavilanes, citado por Rossi, 2010).
La defensa inducida en el vegetal como consecuencia del reconocimiento entre genes vegetales y patógenos, o por reconocimiento de inductores son los siguientes: muerte celular por reacción hipersensible, acumulación de metabolitos secundarios con actividad antimicrobiana, acumulación de enzimas hidrolíticas, y deposición de sustancias reforzadoras de la pared celular vegetal entre otros; que pueden actuar en conjunto para detener el avance del patógeno (Collinge et al., citados por Madriz, Rossi 2010).
La defensa inducida puede dividirse en resistencia sistémica adquirida y resistencia sistémica inducida, diferenciándose ambas por el tipo de inductor, el tipo de respuesta y el tipo de señal que coordina la respuesta de resistencia a distancia (Rossi, 2010).
2.2.8.4. Resistencia sistémica adquirida.
La visión actual de la resistencia sistémica adquirida es que varias moléculas- no necesariamente dañinas a lo patógenos son capaces de inducir respuestas de defensa en las plantas (Sticher et al., Pérez, Olivera Costa y Rodríguez, 2014). Esto ha sido comprobado en Trichoderma harzianum Rifai; donde las enzimas producidas por esa especie han sido identificadas como inductoras de la resistencia sistémica adquirida contra Botrytis cinérea Pers.:Fr. en fresas (Martínez et al., Pérez, Olivera Costa y Rodríguez, 2014).
En la resistencia sistémica adquirida, la respuesta del vegetal puede ser activada por la interacción con patógenos que causen una lesión, por respuestas de hipersensibilidad o por metabolitos liberados por el propio patógeno. Está asociada a una alta producción de genes PR (Hammerschmidt, Madriz, citado por Rossi, 2010) que codifican para proteínas-PR relacionadas con la patogénesis. Los genes codifican la síntesis de proteínas PR como por ejemplo enzimas quitinasas y β -1.3-glucanasas. Estas se acumulan en las plantas después y durante la infección. Se caracterizan por un bajo peso molecular, resistencia a la proteasa, y estar localizada extracelularmente. Tienen la función, particularmente las enzimas mencionadas, de hidrolizar la pared celular fúngica ya que esta contiene β -1.3- glucano y quitina, inhibiendo por consiguiente el desarrollo de estos organismos (Rossi, 2010).
La resistencia sistémica adquirida (SAR) se puede activar por: la infección de patógenos que ocasionen una lesión necrótica localizada, por repuesta de hipersensibilidad, ácido salicílico, ácido 2,6-dicloroisonicotinico, acibenzolar-S-metil (Walters y Heil, citado por Donati, 2011), sales de fosfatos o sílice (Mondino y Vero, citado por Donati, 2011).
Se sabe que el comienzo de SAR está asociado con niveles elevados de ácido salicílico a nivel local y sistémico y con la expresión de un conjunto específico de genes que codifican proteínas relacionadas a la patogénesis (PR). La activación de la expresión de genes PR y SAR depende de la transducción de la señal de ácido salicílico y ésta, a su vez, es dependiente del regulador transcripcional NPR1 (Walters y Heil, Van Wees et al., citado por Donati, 2011).
La inducción por SAR genera una señalización caracterizada por la expresión de genes PR de forma local como sistémica, dando protección a diferentes órganos de la planta; generalmente es contra un amplio espectro de patógenos, incluyendo hongos, bacterias y virus, con un efecto de larga duración (Donati, 2011).
2.2.8.5. Resistencia sistémica inducida.
La resistencia inducida se basa en que las plantas contienen información genética para la resistencia contra las enfermedades. Hay agentes de biocontrol como es el caso de Trichoderma harzianum que puede provocar que se activen mecanismos antes que se dé la infección por un patógeno, estimulándose una respuesta de resistencia por períodos extendidos en tejidos y órganos, que se hará efectiva cuando el vegetal este en presencia del patógeno (Rossi, 2010).
Tanto la resistencia adquirida como la inducida pueden iniciarse como respuesta a una herida local, actuando en forma sistémica en la planta, brindando protección no solo el sitio donde ocurrió la inducción, sino también lugares alejados del mismo (Woo et al., citado por Rossi, 2010).
En investigaciones, artículos realizadas por Harman et al., citados por Mondino y Vero (2006), indicaron que T. harzianum es activo contra hongos presentes en la parte aérea mediante la colonización radicular, induce la resistencia sistémica contra ataques en otras zonas de la planta (Rossi, 2010).
Ezziyyani et al., citados por Rossi (2010), observaron que el tratamiento con T. harzianum en las raíces de pimiento produce una reacción sistémica a nivel de hojas a pesar de que las mismas no han sido afectadas por el antagonista ni por el patógeno.
Madriz citado por Rossi (2010), explica los mecanismos moleculares de reconocimiento basados en la generación de una cascada de reacciones de defensa. Las que son activadas por la interacción y reconocimiento de receptores trans-membrana codificados por genes R de la planta, con ligandos codificados por genes avr del patógeno como quitinasas o glucanasas. Estas reacciones de defensa se pueden activar por la acción de inductores (elicitores en inglés). Estos compuestos se unen a receptores de membrana de la célula vegetal y pueden estimular en la planta una respuesta similar a la que provocaría el patógeno, induciendo de esta manera mecanismos de resistencia en el vegetal en ausencia de aquel.
Los inductores mencionados anteriormente pueden ser ácidos grasos, glicoproteínas, proteínas, péptidos, oligosacáridos, lípidos, lipoproteínas, etc. Se pueden encontrar elicitores exógeno de origen patógeno y elicitores de origen endógeno debido a la liberación de fragmentos de la pared celular del hospedero debido a la interacción primaria con el patógeno (Riveros et al., citados por Rossi, 2010).
Dentro de los elicitores exógeno de origen patógeno se encuentra la Trichoderma (Madriz, citado por Rossi, 2010). En investigaciones de Trichoderma en sistemas rizosféricos se observó que este agente biológico es capaz de producir tres tipos diferentes de inductores, siendo estos péptidos o enzimas, proteínas avr, y fragmentos de pared celular como oligosacáridos de bajo peso molecular (Woo et al., citados por Rossi, 2010). El reconocimiento de los compuestos antes mencionados termina en una rápida activación de genes de defensa (Rossi, 2010).
Figura 5. Modelo para la vía de señalización de resistencia sistémica inducida (ISR) en Arabidopsis, relación entre los factores de transcripción NPR1, MYB72 y ELI3, las hormonas ácido jasmónico (JA) y etileno (ET) y la potenciación sistémica de la defensa.
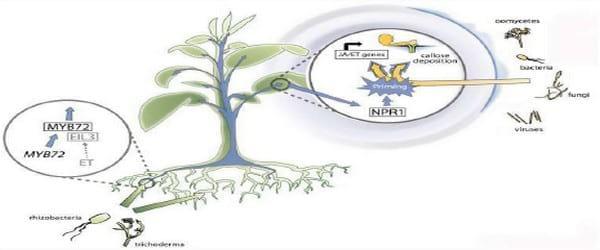
Fuente modificado de Wan Wees et al., citados por Donati, 2011.
Los mismos estudios en Arabidopsis confirmaron que ISR está bajo el regulador transcripcional NPR1 (al igual que SAR), y este responde a las diferentes vías de defensa dependientes de las hormonas mencionadas (Pieterse et al., Walters y Heil, Wan Wees et al., citados por Donati, 2011). En Análisis realizados indican que genes de defensa en Arabidopsis, mostraron que el factor de transcripción MYB72 es necesario en los primeros pasos en la señalización de ISR. Además se supone que MYB72 actuaría en forma conjunta con otro componente de señalización, el factor de transcripción ELI3. En Arabidopsis, la ISR mediada por rizobacterias se asocia a menudo con la potenciación sistémica de la defensa (Priming), mediante la expresión de genes de respuesta de JA / ET y el depósito elevado de calosa en el lugar de entrada de patógenos (Van Wees et al., citado por Dontai, 2011).
MAP quinasas.
Las MAP quinasas actúan como puntos de señalización del estrés, tanto de origen biótico como el originado por patógenos y elicitores derivados del mismo, y de origen abiótico como bajas temperaturas, oxidación, etc, pueden inducir en las plantas respuestas de defensa a través de rutas de MAP quinasas (Mishra et al., Ortiz, citado por Rossi, 2010).
MAP quinasas (MAPK en inglés) son una de las categorías de proteínas más importantes. Estas moléculas de señalización se encuentran tanto en el núcleo como en el citoplasma de las células, participando de distintas rutas de transducción (Mishra et al., Ortiz, citados por Rossi, 2010). Estas están asociadas a una gran cantidad de señales asociadas a la defensa, entre las que se encuentran las fitohormonas como el etileno, ácido salicílico y especies reactivas de oxígeno (Nakagami et al., Ortiz, citados por Rossi, 2010).
Un ejemplo de señalización en resistencia inducida investigado por Brodersen et al.,Ortiz, citados por Rossi (2010), indica que la MAP quinasa AtMPK4 presenta como principal función la represión de la resistencia sistémica adquirida, así como la inducción de genes de defensa (EDS1 y PAD4) por el ácido jasmónico/etileno. En resistencia inducida las respuestas dependen hormonalmente del etileno y el ácido jasmónico (Abeles, Pieterse, Sticher, Shoresh et al., citados por Rossi, 2010). Estas dos hormonas son necesarias para inducir la expresión de ciertos genes de defensa, genes que no son inducidos por el ácido salicílico (Penninckx et al., Moreno, citados por Rossi, 2010).
Los elicitores que han sido mencionados anteriormente liberados por Trichoderma estimulan receptores para el etileno y el ácido jasmónico presentes en la planta a nivel de raíz. Estos se volatilizarían siendo captados por tallos, hojas y demás órganos de la planta, y de esta forma activando la transcripción de genes para el desarrollo de una defensa sistémica (Rossi, 2010).
Como condición para que estas dos hormonas actúen es que los niveles de concentración de ácido salicílico sea bajo. Lo que quiere decir que las vías de señalización del ácido jasmónico, el etileno y el ácido salicílico no actúan de forma aislada a través de cascadas lineales de inducción, sino que están interconectadas. Se sabe que la inducción de resistencia sistémica adquirida vinculada al ácido salicílico, tiene un efecto negativo en las vías del ácido jasmónico y el etileno (Moreno, citado por Rossi, 2010).
Quien presenta la capacidad de regular diferencialmente las respuestas de defensa inducidas tanto por el ácido salicílico como por la combinación del ácido jasmónico y etileno según las diferentes señales, es el gen denominado NPR1. Éste crea una proteína reguladora que se encuentra en el citoplasma de la célula (Rossi, 2010).
En investigaciones realizadas por Shoresh et al. (2004) donde inocularon plantas con Trichoderma se observó que usando inhibidores de estas dos hormonas disminuía el efecto protector de este agente. Estos resultados indican que la participación hormonal del ácido jasmónico y el etileno en la resistencia inducida la cual es mediada por Trichoderma (citado por Rossi, 2010).
2.2.8.6. Peroxídasas en la respuesta de defensa.
Las peroxídasas son enzimas que oxidan sustratos (orgánico tanto como inorgánicos) a expensas del peróxido de hidrógeno, pertenecientes al grupo de las reductasas (Olivera Costa y Rodríguez, 2014).
Presentes en muchos tipos de células y promueven la oxidación con la transferencia de iones de hidrógeno a peróxido de hidrógeno formando moléculas de agua.
Donante + H2O2 ↔ Donante oxidado + H2O
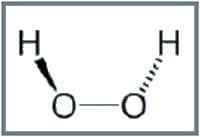
Los peróxidos se forman en pequeñas dosis en procesos de oxidación natural, pero para evitar la acumulación hacia concentraciones que provoquen daños, se utiliza una enzima (peroxidasa) que cataliza el peróxido de hidrógeno y lo transforma en agua y oxígeno elemental (Kurioka et al., 2013).
Las peroxidasas cumplen una función que no está directamente relacionada con la inducción de la resistencia en la planta, pero que contribuyen a la respuesta de defensa en la misma (Olivera Costa y Rodríguez, 2014).
Estas actúan como proteínas relacionadas a la defensa (proteínas PR), participando en la respuesta hipersensitiva de SAR, donde esta reacción es utilizada por la planta como una estrategia de defensa, en la que las células vecinas a la infección entran a la muerte celular programada para eliminar la fuente más inmediata de energía y nutrientes para el microorganismo invasor (Camarena, citado por Donati, 2011).
Las peroxidasas fortalecen la pared realizando uniones cruzadas de glicoproteínas ricas en hidroxiprolina (Bradley et al., citados por Kurioka et al., 2013) y estas poseen enzimas que son capaces de hidrolizar polímeros presentes en paredes celulares de hongos. También lignifican las paredes celulares de la planta y de esta forma limita la entrada de patógenos (Olivera Costa y Rodríguez, 2014).
Cuando una célula vegetal detecta la presencia de un patógeno se activa una reacción de defensa inducida, es más severa a nivel local, en el tejido donde está en contacto con el patógeno, y más débil de forma sistémica, en el resto de los tejidos de la planta, los que no están afectados por el patógeno. Esto permite potenciar las barreras de defensa, tanto químicas como estructurales en el tejido atacado (Olivera Costa y Rodríguez, 2014).
A la reacción de la planta que se da localmente se le llama respuesta de hipersensibilidad (HR) y puede llevar a necrosis del tejido infectado. La necrosis se produce por acumulación de compuestos químicos, entre los cuales se encuentran la producción de especies reactivas de oxígeno (ERO) y las fitoalexinas (Olivera Costa y Rodríguez, 2014).
Kurioka et al., (2013), en la evaluación realizada pueden concluir que Trichoderma estaría afectando la síntesis proteica de peroxidasa, enzima que está involucrada en mecanismos de defensa de la planta. Implicada en la producción como en la detoxificación de los EROs, donde éstas activan la muerte celular programada, la biosíntesis de fitoalexinas, activación de cascadas MAPK, actividad antimicrobiana, movilización de Ca2+ y transporte de iones, fortalecimiento de la pared celular como en la activación de genes de defensa, resistencia sistémica inducida como se mencionó en este trabajo anteriormente.
La inclusión de Trichoderma harzianum en el sustrato induce cambios en la expresión de un conjunto de genes relacionados a la defensa de la planta (genes PR) que probablemente aumentan los niveles de defensa de la misma. Los cambios constatados fueron a nivel de la expresión de los genes que codifican enzimas con actividad de peroxidación (Donati, 2011).
Rossi (2010), pudo constatar en los análisis isoenzimáticos de peroxidasas que Trichoderma harzianum, a nivel endógeno, indujo resistencia a enfermedades en el vegetal. Debido a que altero la expresión de las isoenzimas mencionadas, donde promueve la formación de un tipo diferente de enzima dentro de la familia de las peroxidasas. Esto lleva no solo a un incremento de moléculas defensivas sino también a formas diferentes de las mismas en la planta.
2.2.8.7. Formación de las especies reactivas de oxígeno.
Las ERO generadas durante la patogénesis son producidas de manera característica fuera de la membrana plasmática de las células vegetales (apoplasto) (Doke y Ohashi, Levine et al., Benezer et al., citados por Olivera Costa y Rodríguez, 2014). Se han propuesto dos mecanismos enzimáticos como los responsables en la producción de los EROs. El primer mecanismo involucra a la enzima NADPH oxidasa localizada en la membrana plasmática, la cual se considera como la principal fuente de ERO en respuesta a varios patógenos (Torres et al., Benezer et al., citados por Olivera Costa y Rodríguez, 2014). Y el segundo formado por las peroxidasas de la pared celular, las cuales pueden contribuir a la producción apoplástica de ERO en algunas interacciones planta patógeno (Bolwell et al., Benezer et al., citados por Olivera Costa y Rodríguez, 2014).
Según Díaz et al., citados por Olivera Costa y Rodríguez (2014), las funciones que cumplen los ERO en la respuesta contra patógenos son por lo menos tres, estas crean el ambiente apropiado que promueve el proceso de lignificación y la formación de puentes cruzados en la pared celular (lo que las torna más resistentes al ataque de enzimas fúngicas), poseen también una acción tóxica directa sobre el patógeno frenando su crecimiento, y por ultimo sirven como moléculas señales para inducir la expresión de algunos genes relacionados a la defensa. Las ERO participan en la activación de proteínas cinasas activadas por mitógeno (MAPK; Mitogen Activated Protein Kinases), en el cambio en los niveles de Ca2+, y en la modificación del estado redóx celular (Rentel y Knight, Benezer et al., citados por Olivera Costa y Rodríguez, 2014). El estado redóx en las plantas regula a NPR1, que es un activador de las respuestas de defensa que dependen del ácido salicílico. Este se acumula en el citosol como un oligómero inactivo mantenido así por enlaces disulfuro, después de la estimulación su reducción libera unidades monoméricas que migran hacia el núcleo e interactúan con el factor de trascripción reducido TGA1, el que activa la expresión de genes de defensa dependientes de ácido salicílico (Mou et al., Benezer et al., citados por Olivera Costa y Rodríguez, 2014). En células de Arabidopsis tratadas con H2O2 se observaron cambios en el perfil de expresión de 175 genes (de 11000 analizados). Estos genes codifican para enzimas antioxidantes, proteínas asociadas con la defensa o con funciones de señalización tales como cinasas o factores de transcripción (Desikan et al., Benezer et al., citados por Olivera Costa y Rodríguez, 2014). Se ha propuesto que las ERO, en combinación con el ácido salicílico, puedan ser moléculas reguladoras del establecimiento de las defensas sistémicas en contra de patógenos (Bolwell et al., Benezer et al., citados por Olivera Costa y Rodríguez, 2014). Por lo tanto la producción de ERO en plantas es esencial para la defensa en contra de la infección por patógenos.
a) Peróxido de hidrogeno.
Cuando se activan las defensas de las plantas la producción de peróxido de hidrógeno quien genera la muerte celular se da en dos fases. Lo que ocurre primero es una acumulación inicial rápida de peróxido llamada fase I y lo que se llama fase II es la producción más de peróxido, esto se ha observado para interacciones de incompatibilidad con el patógeno, o sea que causan infección. Para el caso de interacciones compatibles se observó que solo se da la primer fase (Rossi, 2010). El peróxido de hidrógeno además de ser considerado toxico a nivel celular, presenta como función transmitir las señales exteriores derivadas de estímulos de origen ambiental y biótico al interior de la célula debido a que puede difundir a través de la membrana, en cambio otras ROS no (García et al., citado por Rossi, 2010). Interviene en la modulación de varios genes relacionados con la resistencia en el vegetal, y además puede oxidar metales como el Fe a través de la reacción de Feldon produciendo radicales hidroxilos (García et al., citado por Rossi, 2010).
b) Radical hidroxilo.
El radical hidroxilo es el derivado reactivo del oxígeno más tóxico que se produce en el vegetal. La función del mismo es degradar ácidos grasos no saturados de la membrana que son de gran importancia biológica por ser parte importante de la membrana celular, por lo que se puede decir que es una molécula utilizada contra la infección causada por fitopatógenos (García et al., citado por Rossi, 2010).
c) Radical anión superóxido.
El radical anión superóxido puede reaccionar con los lípidos de la membrana plasmática, generando daños irreversibles a esta estructura. Puede actuar como oxidante o reductor, y puede transformarse en peróxido de hidrógeno (García et al., citado por Rossi, 2010). Estas sustancias pueden ser una vía de señalización para iniciar la respuesta en la planta (Soto et al., citado por Rossi, 2010).
d) Homeostasis redox.
La función de homeostasis redox la realiza el ácido salicílico que inhibe tanto la transcripción como la actividad de la catalasa al unirse directamente a esta enzima según lo pudo ver Horvath et al., Palma, citados por Rossi (2010), en experimentos in vitro sobre Arabidopsis thaliana. Por tanto este ácido también es importante para regular el balance entre producción de ROS y sistemas antioxidantes (Palma, citado por Rossi, 2010).
Figura 6. Expresión de la resistencia sistémica adquirida.
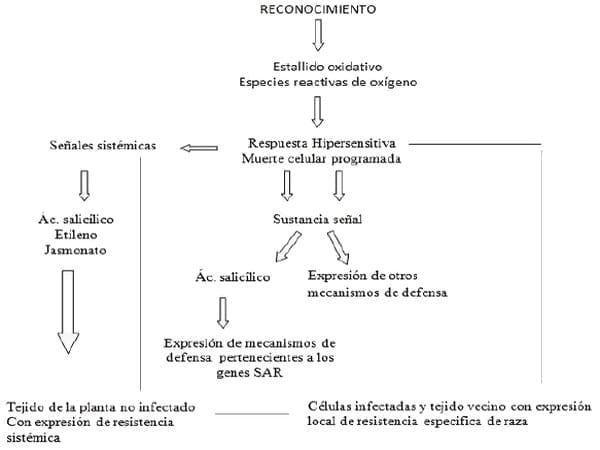
Fuente Camarena y Torre,2007 citados por Kurioka et al., 2013.
2.2.9. Trichosoil®.
Este es un producto comercial, obtenido a partir del programa de investigación y desarrollo de productos biológicos de Lage y Cía. S.A según lo indica en el sitio web de dicho Laboratorio, Trichosoil® esta formulado en base a una cepa de Trichoderma harzianum aislada de nuestro país.
Según la Lista de Productos Fitosanitarios Autorizados del MGAP al 15/1/2012 este producto es de origen uruguayo, y está registrado con el número 3087 como fungicida en polvo seco, cuya toxicidad es IV.
El agente de control biológico representa una herramienta para ser utilizada en el manejo integrado. Posee una amplia actividad antifúngica contra patógenos de suelo, semillas y foliares, de modo que Trichosoil® detiene el crecimiento del micelio del patógeno y también las estructuras de resistencia de los agentes patogénicos, como los esclerotos, donde los productos químicos no son efectivos. La formulación de este producto según Lage y Cia S.A es, 58.8% es Trichoderma harzianum (cepa L1) y el resto es material inerte (Bóffano y Mosqueira, 2012).
Costo de las aplicaciones en vivero.
Se determinaran los costos considerando al vivero forestal de la empresa Weyerhaeuser S.A, (Departamento de Tacuarembó), dado que en éste se utilizan productos de control biológico en dos de las cuatro fases que tienen: Jardín Clonal y Enraizamiento.
Figura 7. Ubicación del Vivero Weyerhaeuser.

Fuente Google Earth,2013.
Para esta publicación se consideraron como insumo: plantines de híbridos de Eucalyptus grandis, los productos comerciales Trichosoil® y Biorend® en las dosis y frecuencias usadas en cada caso.
Cuadro 3. Aplicaciones de Trichosoil® y Biorend®.
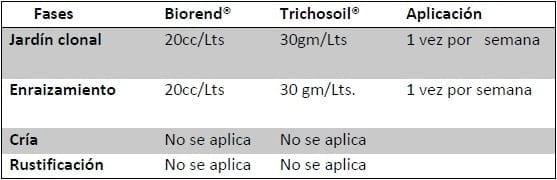
Fuente Olivera Costa y Rodríguez, 2014.
En Jardín clonal actualmente cuentan con 76 176 pie madres; cada aplicación lleva aproximadamente 1 Kg de Trichosoil® y 1 Lt de Biorend®, por lo que aquí el costo total es de U$U1 56 por aplicación (1 Kg*U$U 36 +1 Lt*U$U 20).
En enraizamiento depende de las cantidades de naves que tengan plantas, pero actualmente se aproxima a 486 000 estacas; el gasto en esta fase es de 600 grs de Trichosoil® y 600 c/c de Biorend®, por lo que el gasto total es de U$U 33, (600 gr*U$U 36/1000+600 cc*U$U 20/1000), por cada aplicación.
4. Costo de las aplicaciones en plantación.
Se instaló un ensayo en el Establecimiento Buena Vista I; Paraje Cerro Alegre, (empresa Weyerhaeuser S.A) en el departamento de Rivera. Dentro de las coordenadas 31°21'37.65"S, 55°45'38.38"O.
Figura 8. Ensayo a campo.
Fuente Tesis de grado Olivera Costa y Rodriguez,2014.
Se manejó la misma mezcla aplicada que en vivero , 30 gramos de Trichosoil® por litro de agua y 20 cc de Biorend® por litro de agua. Se aplicó una única dosis con mochila 120 cc de la mezcla a cada planta. Siendo la densidad utilizada de 540 plantas/ha (5 x 3.7 m).
Figura 9. Aplicación a campo de Trichosoil® y Biorend®

Fuente Tesis de grado Olivera Costa y Rodríguez, 2014.
Trichosoil® viene presentado en Bolsas de 2 Kg, a un costo al público de U$U 72. Mientras que Biorend® viene en envase de 1 litro a un costo al público de U$U 20. Se consideró un costo de mano de obra de U$U 70.
El costo calculado de aplicar Trichosoil® a una hectárea es de U$U 70 (30 gr*0.12 cc*540pl/1000*U$U 36 /Kg). Mientras que el costo calculado de aplicar Biorend® a una hectárea es de U$U 26 (20 cc*0.12 cc*540pl/1000*U$U 20). De esto se desprende que el costo total de aplicación por hectárea considerando la mano de obra es de U$U 166.
Existe evidencia científica que reporta las propiedades de Trichoderma harzianum como agente biocontrolador y al quitosano como agente estimulador del crecimiento.
A continuación se presenta un cuadro resumen de los resultados obtenidos en la investigación realizada recientemente por Olivera Costa y Rodríguez (2014), donde se evaluaron dos tamaños (grandes e intermedio) de plantines de híbridos de E. grandis tratados con Trichoderma harzianum más quitosano.
Cuadro 4. Resumen de resultados.
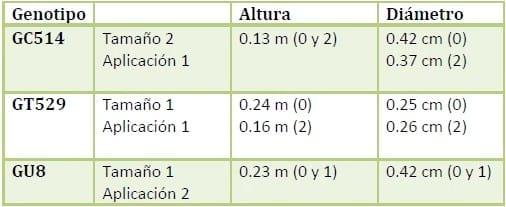
Tamaño 2 (intermedio). Tamaño 1 (grandes).Fuente Olivera Costa y Rodriguez,2014.
Para el caso del efecto de Trichoderma harzianum más quitosano, sobre los genotipos y el tamaño para la variable altura, y diámetro se observó, que el genotipo GC514 tamaño 2 y una aplicación presento un crecimiento en altura promedio de 0.13 m superior con respecto al testigo y dos aplicaciones, en lo que se refiere al diámetro el crecimiento promedio fue de 0.42 cm y 0.37 cm, superior al testigo y dos aplicaciones respectivamente.
Para el genotipo GT529 tamaño 1 y una aplicación, el crecimiento en altura promedio fue de 0.24 m superior al testigo y 0.16 m superior a los individuos que recibieron la segunda aplicación extra. El crecimiento en diámetro fue de 0.25 cm y 0.26 cm superior al testigo y dos aplicaciones respectivamente.
Genotipo GU8 tamaño 1 y dos aplicaciones, el crecimiento en altura que presentaron los individuos en promedio fue de 0.23 m con respecto al testigo y una aplicación. El crecimiento en diámetro fue de 0.42 cm con respecto al testigo y una aplicación.
La aplicación de Trichoderma harzianum más quitosano en los diferentes genotipos tuvo un efecto diferencial en la sanidad de los individuos, donde en la totalidad de las plantas no se visualizaron síntomas de enfermedades, tanto en vivero como en plantación.
Los resultados obtenidos muestran que la aplicación conjunta de Trichoderma harzianum más quitosano, tienen un efecto en el crecimiento, donde se aprecia que dependiendo de la combinación con el genotipo y el tamaño, los individuos presenten una respuesta diferencial, tanto en la variable altura, como en la variable diámetro.
Resumen de trabajos.
5.1 Evaluación de diferentes dosis de fertilización en la producción de plantines de Eucalyptus grandis w. Hill ex Maiden creciendo en sustrato colonizado por Trichoderma harzianum.
2002
Romero.G, Cabrera.R, Tejera.R. Facultad de Agronomía. Universidad de la República
Resumen.
La inclusión de un agente de biocontrol en el sistema de producción comercial de plantines forestales, no ha sido estudiada en profundidad por lo que no se encuentran antecedentes nacionales o internacionales que informen sobre la dinámica del antagonista dentro del sistema sustrato-plantin. El ensayo se instaló en el vivero Buena Unión con Eucalyptus grandis sembrado en sustrato comercial mezcla de diferentes componentes orgánicos, esterilizado e inoculado con una cepa de Trichoderma harzianum de comprobado poder antagonista contra patógenos del suelo en general y de Botrytis cinérea en particular. Este hongo provoca importantes pérdidas de plantines y los productos químicos no son totalmente efectivos. Los plantines recibieron diferentes dosis de N P K administradas en tres momentos del ciclo, arranque, cría, y terminación. Estos permanecieron cinco meses en el vivero. El testigo (T1) recibió un nivel básico de fertilización y a diferencia de T2, el sustrato no fue inoculado con el antagonista. En T3, T4 y T5 el sustrato correspondiente estuvo inoculado con Trichoderma y las variantes fueron las dosis de fertilización en cada etapa del ciclo productivo. Se evaluaron parámetros morfológicos, fisiológicos, sanidad de los plantines y la dinámica de Trichoderma en el sustrato. La inclusión de Trichoderma harzianum en el sustrato tuvo un efecto promotor en el crecimiento expresado tanto en altura, diámetro como en el peso seco de los plantines y se alcanzaron antes los estándares de calidad establecidos para la especie en estudio. No se observaron respuestas significativas a la adición de dosis más altas de nutrientes que justifiquen un beneficio concreto. Trichoderma sobrevivió en el sustrato estudiado durante todo el ciclo del cultivo en niveles aproximados de 1,7 x 106 UFC/gr. de sustrato. No se pudo comprobar efecto inmovilizador de nutrientes en ningún tratamiento de fertilización. La incidencia de Botrytis fue del 20% en el tratamiento 5, la más alta de todos los tratamiento, siendo un 11% aproximadamente el valor más bajo. Las dosis más bajas de fertilización contribuyeron al mejor balance y a la menor incidencia del patógeno. Con una sola aplicación del funguicida químico se consiguió frenar el ataque de Botrytis. Se discuten resultados con la finalidad de establecer las pautas de manejo a la luz de la información nutricional y sanitaria de los plantines, conjuntamente con la dinámica del agente de biocontrol en el sustrato. En vista de estos resultados se sugiere la continuación de estos estudios para ajustar dichas pautas para el control integrado de la sanidad de plantines en vivero.
5.2 Evaluación de diferentes sustratos colonizados con el antagonista (Trichoderma harzianum Fr.) sobre la calidad de plantines de Eucalyptus grandis w. Hill ex Maiden., Eucalyptus globulus spp. globulus Labill. y Pinus taeda L
2003
Romero.G, Cárdenas.Diego. Facultad de Agronomía. Universidad de la República.
Resumen.
El sustrato es la vía más económica para incorporar un microorganismo al sistema suelo-planta. Hay muy poca información a nivel comercial de los beneficios que acarrea al sistema, la inclusión de agentes biológicos promotores del crecimiento vegetal lo que en la literatura se cita como PGPR (plant growth promoting organism). Varios trabajos citan a Trichoderma como un agente microbiano promotor del crecimiento en algunas especies, principalmente en floricultura por mecanismos que no están bien definidos aun. El uso de productos biológicos en la producción agrícola es bastante reciente si se lo compara con el uso de los agroquímicos. Los estudios e investigaciones sobre estos agentes de biocontrol comenzaron en el sector hortifruticola, debido a la creciente presión a nivel mundial en la disminución y la mayor concientización del efecto del uso de productos químicos, principalmente por tratarse de productos de consumo directo. Se planteó realizar un estudio de incorporación de Trichoderma harzianum a dos sustratos en la producción comercial de plantines de Eucalyptus grandis W.Hill ex Maiden.;Eucalyptus globulus spp. Globulus Lanil. y Pinus taeda L. El ensayo se llevó a cabo en un vivero forestal en los meses de febrero a julio del 2001.Se determinó la colonización y la sobrevivencia de T.harzianum en ambos sustratos. Además en los plantines creciendo en los diferentes sustratos inoculados con Trichoderma se evaluaron: parámetros morfológicos y fisiológicos, la incidencia y severidad de Botrytis cinérea y aspectos nutricionales durante el ciclo de producción. Se evidenciaron claramente las diferencias entre los dos sustratos en estudio a través de los parámetros morfologicos y fisiologicos de las tres especies. El sutrato de Colonvade (S1) con mayor disponibilidad de nutrientes en solución promovio mayor desarrollo de arranque que el Agroplus (S2). Este último requiere fertirrigacion permanente debido a la gran estabilidad de sus componentes orgánicos. Si bien las tendencias generales fueron similares, las tres especies forestales se comportaron de forma bien diferente en cuanto a la dinámica de crecimiento en los dos sustratos y a través de todo el ciclo de evaluación. Se observó en todos los plantines respuesta significativa a la fertilización y esa respuesta fue claramente condicionada por el tipo de sustrato y la especie forestal. La respuesta a la incorporación de Trichoderma en el sistema sustrato x plantin, fue muy diferente en función del tipo de sustrato. Ocurrió inmovilización en el S1 y promoción en el S2, siendo esta respuesta muy dependiente de la especie forestal. La colonización y sobrevivencia de Trichoderma en los sustratos no tuvo restricciones importante y se alcanzaron niveles adecuados a pesar de las limitaciones nutricionales. Ninguno de los sustratos evidenció problemas de damping-off siendo la emergencia e implantación adecuadas. Botrytis cinerea promovida por condiciones ambientales de humedad relativa tuvo mayor incidencia en plantines con mayor porcentaje de nitrógeno en planta promovido por fertilizaciones tardías en la fase de terminación en Eucalyptus. Algún efecto antagonista pudo observarse en el S2 inoculado artificialmente en E.globulus. Debido a la ausencia de información nacional e internacional entorno a estos aspectos , para lograr una implementación de esta herramienta con el fin de sustituir o disminuir el uso de productos químicos en la producción agropecuaria, es necesario continuar los estudios antes de establecer conclusiones.
Evaluación de diferentes dosis de fertilización en la producción de plantines de Pinus taeda L. creciendo en sustrato colonizado por Trichoderma harzianum.
2004
Romero.G, Añon.D, Levitan.A, Tarino.E. Facultad de Agronomía. Universidad de la República
Resumen.
El control biológico de enfermedades es una herramienta que ha comenzado a tener difusión a nivel comercial en nuestro país, fundamentalmente en el sector horti-frutícola. Si bien la inclusión de agentes de biocontrol en la producción de plantines forestales no ha sido estudiada profundamente; los resultados obtenidos en el presente trabajo y experiencias similares a nivel nacional, son contundentes en lo que respecta a los beneficios que aporta. E uso de productos biológicos como el Trichosoil ®, a base de Trichoderma harzianum, es reciente si se compara con el uso de agroquímicos en la producción agropecuaria. En varios informes se cita a Trichoderma sp. como un agente microbiano promotor del crecimiento para varias especies vegetales, además del control que ejerce sobre gran número de hongos patógenos del suelo. El ensayo consistió en la incorporación de Trichosoil ®, al sustrato (no esterilizado) con diferentes dosis de fertilización por tratamiento, en la producción comercial de plantines de Pinus taeda L. Fue instalado en el vivero “Buena Unión” perteneciente a la empresa COLONVADE S.A. y se llevó a cabo en los meses de enero a mayo de 2004. Se realizaron 5 tratamientos con diferentes dosis de fertilizante (NPK), aplicadas en tres etapas del ciclo de fertilización: arranque, cría y terminación. El tratamiento 0 (testigo) no fue inoculado y recibió la dosis estándar utilizada por el vivero. El sustrato de los restantes tratamientos (T1,T2,T3 y T4) fue inoculado con Trichosoil ® y recibieron las siguientes dosis de fertilizante: T1 misma dosis, T2 mitad de la dosis, T3 el doble de la dosis y T4 cuatro veces la dosis usada por el vivero COLONVADE. Se evaluaron parámetros morfológicos: altura y diámetro; fisiológicos: peso fresco y seco de planta entera, parte aérea y parte radical, nutrición de los plantines; sanidad de los plantines y sobrevivencia de Trichoderma en el sustrato en todo el ciclo del almácigo. Los resultados obtenidos muestran que la inclusión de Trichosoil ® tuvo efecto promotor en el crecimiento de los plantines. Dicho efecto se expresó en todos los parámetros analizados, por ejemplo, 24% de incremento en altura, 15% mayor en diámetro de cuello, 49% mayor en peso fresco y 38% mayor en peso de la materia seca respecto al tratamiento sin inocular; y se evidenció fundamentalmente en la comparación de los tratamientos testigo (no inoculado) y tratamiento 1 (inoculado) que recibieron la misma dosis de nutrientes. En varios parámetros se observó una respuesta significativa a la fertilización, en algunos casos cuadrática y en otros lineal. La sobrevivencia de Trichoderma en el sustrato se mantuvo, durante el ciclo del almácigo, en niveles aceptables (x 105 UFC/gr de sustrato). Por lo que no fue necesario realizar aplicaciones foliares del agente de biocontrol. No se detectaron enfermedades en el ensayo, por lo que no se aplicaron fitosanitarios químicos a los plantines. A la luz de los resultados obtenidos en este trabajo y en otros similares, se hace evidente la obtención de beneficios que se manifiestan en incrementos en el crecimiento y calidad de plantas, sumado a la mejora ambiental por un menor uso de pesticidas químicos. Comercialmente esto significa un avance en calidad de producción, lo que fundamenta la necesidad de implantación de estos manejos por empresas productoras forestales de avanzada.
Palabras clave: Pinus taeda, biocontrol , plantines forestales, parámetros morfológicos, fisiológicos, altura, diámetro, peso fresco , peso seco, nutrición de plantines; sanidad de plantines, sobrevivencia, Trichoderma harzianum, fertilización.
Evaluación del comportamiento de plantines de Pinus taeda L. con y sin aplicación de fertilización starter creciendo en sustrato con Trichoderma harzianum.
2008
Romero.G, Negrone. C, León. M, Villalba. N. Facultad de Agronomía. Universidad de la República.
Resumen.
Este ensayo fue llevado a cabo con el fin de seguir avanzando en la investigación del uso de Trichoderma harzianum como control biológico y biopromotor, siendo una herramienta en la implementación de un plan de manejo integrado. Se inoculó el sustrato en el mes de noviembre, con el hongo de interés colonizando al mismo y se llegó a un número de unidades formadoras de colonias acorde al número adecuado para un buen control de enfermedades. Se separaron diferentes pilas de sustrato según cantidad de Trichosoil aplicado. Luego de un mes de inoculado el sustrato se prosiguió a la siembra de las semillas de Pinus taeda proporcionada por el vivero “La Buena Unión” de la empresa Colonvade, en donde se realizó el ensayo. Cada tratamiento se diferenció según aplicación o no de Trichosoil y fue en esta etapa en donde se aplicó o no la fertilización starter. Los tratamientos que se plantearon fueron los siguientes: T0 como testigo; T1 con aplicación de starter y no de Trichosoil; T2 sin aplicación de starter y con dosis simple de Trichosoil; T3 con aplicación starter y el doble de dosis de Trichosoil; T4 sin aplicación starter y con dosis simple de Trichosoil; T5 como el testigo T0 pero otra semilla. Se llevaron las bandejas sembradas al invernáculo y se mantuvieron allí durante todo el ciclo de vivero. Se realizaron mediciones de parámetros morfológicos a partir del 13 de marzo, fecha en la cual las semillas de todos los tratamientos ya habían germinado y permitían la toma de altura y diámetro de cuello. A partir de la misma fecha se tomaron muestras para pesos frescos y secos de parte aérea y radicular de todos los tratamientos. Se obtuvo como resultados que la aplicación de fertilización starter fue determinante en el desarrollo de los plantines tanto en altura como en diámetro, lo que no se vio fue la respuesta a la aplicación de Trichosoil en ninguno de los parámetros medidos, pero esto si se observó en otros ensayos realizados anteriormente. A modo de profundizar en la investigación, se estudió la actividad peroxidasa frente a la presencia de Trichoderma harzianum, no obteniéndose ningún resultado concluyente debido a que no se realizaron las repeticiones correspondientes. Finalizando este resumen se puede decir que por más que no se llegaron a los resultados esperados, este ensayo ayuda a tener una fuente más de antecedentes, adaptada a las condiciones locales de producción de plantines de pino. También sirven como base para plantear ensayos en un futuro.
Palabras clave: Plantines; Sustrato; Vivero; Pinus taeda; Trichoderma harzianum; Fertilización; Biocontrol; Biopromotor.
Evaluación de Trichoderma harzianum como agente biopromotor y de biocontrol en plantines de Eucalyptus dunii Maiden.
2010
Romero.G, Rossi. C. Facultad de Agronomía. Universidad de la República.
Resumen.
Uno de los puntos salientes en el desarrollo forestal que tiene el país e importante también en la cadena forestal es la innovación tecnológica actual de los viveros forestales, los cuales, en el transcurso de estos últimos años han incorporado tecnologías apropiadas para acrecentar los estándares de producción y de calidad. Estas innovaciones se originan a partir de la creciente demanda y exigencia de la industria del sector por la producción de plantines dentro de los parámetros de calidad, uniformidad y sanidad requeridos. En este marco se encuadra la utilización de Trichoderma harzianum en viveros forestales como uno de los microorganismos más usados como agente de control biológico y como biopromotor del crecimiento vegetal. Por consiguiente en este trabajo se determinó el potencial y la eficacia de Trichoderma harzianum inoculado en sustrato, asociado a plantines de Eucaliptus dunnii para promover la calidad de los mismos según los parámetros más importantes utilizados en viveros forestales, a través de la toma de medidas físicas y estudios fisiológicos. En este sentido se realizaron estudios isoenzimáticos de peroxidasas para corroborar la inducción de resistencia a nivel endógeno en la planta por el bioagente. Por otra parte se determinó la capacidad de Trichoderma harzianum en la colonización y supervivencia en el sustrato. Los resultados finales de esta tesis indicaron que la aplicación de Trichoderma harzianum en sustrato tuvo efecto promotor en el crecimiento de plantines de Eucalyptus dunnii evidenciado en todos los parámetros evaluados. En otro orden se pudo constatar en los análisis isoenzimáticos de peroxidasas que Trichoderma, a nivel endógeno, indujo resistencia a enfermedades en el vegetal ya que al alterar la expresión de las isoenzimas mencionadas promovió la formación de un tipo diferente de enzima dentro de la familia de las peroxidasas. Por último la colonización y supervivencia de Trichoderma en sustrato se mantuvo en niveles adecuados a lo largo del ensayo.
Palabras clave: Trichoderma harzianum; Biopromoción; Biocontrol; Eucalyptus dunnii.
Efecto de Trichoderma harzianum cepa L1 sobre la calidad de plantines en Pinus taeda.
2011
Romero.G, Donati.S. Facultad de Agronomía. Universidad de la República.
Resumen.
Diversos estudios sobre control biológico de enfermedades, han posicionado al género de hogos Trichoderma como uno de los más promisorios agentes de control biológico de enfermedades. Una de las características más significativas que presenta dicho género, se basa en los diversos mecanismos de acción, que conllevan a disminuir el riesgo de aparición de razas resistentes de patógenos. En este sentido, existen antecedentes a nivel local (sobre todo en el rubro hortícola) que incorporan la técnica de control biológico de enfermedades como una herramienta más, dentro del sistema de producción. Es así que a mediados de la década del 90, aparecen los primeros trabajos específicamente dentro del rubro forestal, enmarcados en la fase de vivero. Debido al gran desarrollo que ha venido teniendo el sector forestal en los últimos años, cada vez es mayor la demanda de plantines de calidad, por parte de las diferentes empresas del rubro para la plantación. Teniendo en cuenta los antecedentes mencionados anteriormente, en este trabajo se estudia la conveniencia de incorporar el producto comercial Trichosoil®, al sustrato de producción de un vivero forestal. De los diferentes mecanismos de acción que presenta el género Trichoderma, en este trabajo se evalúan el efecto promotor en el crecimiento en plantas, la inducción de resistencia a enfermedades y la solubilización de nutrientes minerales. El efecto promotor del crecimiento en los plantines se evalúa a través de su calidad, definida por diferentes parámetros: altura parte aérea, diámetro del cuello, peso fresco y peso seco, concentración de nutrientes minerales y supervivencia de plantines. Asimismo se utilizan diversos índices que determinan la calidad óptima de plantines de Pinus taeda para plantación, entre los que se encuentran: índice de esbeltez, índice tallo-raíz, índice de calidad de Dickson, índice de lignificación y porcentaje de raíces. El efecto de inducción de resistencia en los plantines se estudia a través del análisis isoenzimático, mediante la técnica electroforética de proteínas con actividad peroxidasa. Finalmente, la solubilización de nutrientes minerales se estudia en base a diferentes análisis foliares realizados a los largo del ciclo de producción de los plantines. Por último, se estudia la supervivencia de Trichoderma harzianum cepa L1 (sustancia activa de Trichosoil®), mediante el recuento de colonias de la cepa desde que se inoculó al sustrato de producción, hasta que los plantines son despachados a campo. Los resultados obtenidos indican que la inclusión de Trichoderma harzianum en el sustrato tuvo un efecto positivo en las variables diámetro del cuello y altura, aumentando dichos parámetros. A su vez, se pudo comprobar el efecto positivo de Trichoderma en promover el crecimiento de los plantines, evidenciándose por el aumento de los pesos frescos y secos de los mismos. En referencia a los diferentes índices de calidad de plantín utilizados, la inoculación del antagonista presentó diferentes efectos. Para los índices de calidad de Esbeltez, Dickson y Sobrevivencia de plantines se observaron resultados positivos, para los índices Tallo-Raíz y Porcentaje de Raíces un efecto negativo. El índice de Lignificación fue el único que no presentó variación con la incorporación de Trichoderma. En el efecto de solubilización de nutrientes minerales Trichoderma presentó una buena tendencia, ya que la concentración de estos en las acículas aumenta. Sin embargo, se observaron efectos parcialmente negativos para los microminerales hierro y boro. El análisis isoenzimático fue el que presentó un comportamiento más desparejo. La respuesta de los plantines frente al agregado de Trichoderma exhibió dos padrones de actividad peroxidasa bien definidos, que se definen según los materiales genéticos y condiciones de migración electroforética utilizados. Sin perjuicio de lo anterior, se puede concluir que Trichoderma tuvo un efecto positivo en la inducción de resistencia a enfermedades, evidenciándose por la producción de proteínas con actividad peroxidasa. En último lugar, el estudio de la supervivencia del antagonista en el sustrato presentó resultados aceptables. La instalación y posterior sobrevivencia del hongo se mantuvieron en niveles razonables una vez transcurridos dos meses desde su incorporación, pero una vez cumplidos cinco meses, los niveles en el sustrato descienden considerablemente.
Palabras clave: Control biológico; Trichoderma harzianum; Plantín forestal; Índice de calidad; Pinus taeda; Peroxidasas.
Evaluación de la respuesta de cinco diferentes híbridos de Eucaliyptus grandis, con Trichoderma harzianum y quitosano en vivero y plantación.
2012
Romero.G, Bóffano. A, Mosqueira. M. Facultad de Agronomía. Universidad de la República.
Resumen
El manejo integrado de plagas aparece como una nueva visión respecto a los patógenos, insectos y malezas, considerándolas como componentes del agro-ecosistema. Una de las herramientas de este manejo, es el control biológico, el cual excluye la utilización de plaguicida. En este marco se llevó a cabo esta investigación, con el objetivo principal de evaluar la respuesta de cinco diferentes híbridos de Eucalyptus grandis con Trichoderma harzianum y quitosano en vivero y plantación. Existen evidencias científicas, que comprueban las propiedades de Trichoderma harzianum como agente biológico de biocontrol y estimulador del crecimiento de diferentes especies vegetales. Además otros estudios demuestran que el quitosano, es un biopolímero natural, utilizado en algunas actividades agrícolas, como bioestimulante e inductor de resistencia. De esta manera esta investigación comprende dos etapas, la primera llevada a cabo en el vivero forestal propiedad de Weyerhaeuser S.A, y la segunda en una plantación de GMO-Cloverly, los cuales están ubicados en el departamento de Tacuarembó. En el mes de junio de 2011, se instaló el ensayo en vivero, donde se realizó un submuestreo de cinco híbridos de E. grandis (GU8, GC172, GC513, GC515, GT529). Esta etapa comprendió el período entre las fases de cría y rustificación, se evaluaron parámetros morfológicos tales como, altura del plantín, diámetro de cuello, peso fresco y seco, de raíz y parte aérea. Así como también la calidad vegetal de los mismos, ante condiciones desfavorables para el crecimiento y desarrollo de los plantines. En el mes de octubre de 2011, se llevó a cabo la segunda etapa de esta investigación, instalándose la plantación con los plantines evaluados en la etapa anterior. En este caso, se realizó un diseño de bloques completos al azar, a los efectos de estudiar la respuesta de los cincos híbridos de Eucalyptus grandis, a la aplicación de una dosis extra de trichosoil y biorend, previo a plantación. De esta manera, se evaluaron simultáneamente dos factores, con y sin dicha dosis extra. Asociado con la etapa de vivero, se evidenciaron diferencias significativas entre los híbridos evaluados, para los parámetros altura y diámetro de cuello de plantín, en la etapa de vivero. Asimismo, se observó en plantación una respuesta diferente de los híbridos al agregado de una dosis extra de trichosoil y biorend. Debido a la poca información a nivel nacional e internacional entorno a los efectos de la aplicación conjunta Trichoderma harzianum y quitosano en especies forestales, es necesario establecer nuevas investigaciones. Por lo cual esta investigación es una base, para desarrollar herramientas que permitan reducir o eliminar el uso de productos químicos en la producción agropecuaria.
Palabras claves: Eucalyptus grandis; Trichoderma harzianum; Quitosano; Control biológico; Vivero.
Evaluación de metabolitos inducidos en plantines de Eucalyptus grandis y E. globulus creciendo en vivero sobre sustrato inoculado con Trichoderma Harzianum.
2013
Romero. G, Kurioka. M, Martirena.V, Mulvany. J. Facultad de Agronomía. Universidad de la República.
Resumen.
El aumento en el uso de productos químicos en el área agrícola, ha incrementado los efectos negativos sobre el ambiente y la salud humana. Como consecuencia de ello los estudios de organismos biocontroladores y biopromotores de crecimiento han comenzado a tener mayor difusión en nuestro país. Existen varios antecedentes que citan a Trichoderma un agente promotor de crecimiento para numerosas especies vegetales. El ensayo consistió en la aplicación de Trichoderma harzianum (Trichosoil) en plantines de Eucaliptus globulus y grandis, llevándose a cabo en dos etapas: en primera instancia en un vivero “Forestal Solís”, ubicado en Solís de Mataojo, donde se midieron parámetros morfológicos. La segunda etapa fue realizada en el laboratorio de genética en la facultad de agronomía. El ensayo fue realizado sobre dos especies Eucalyptus globulus y grandis, con y sin aplicación de Trichoderma harzianum (dos tratamientos), las mediciones de parámetros morfológicas se realizaron en cuatro diferentes fechas en la etapa de vivero. En la segunda instancia se procedió al análisis de peroxidasa a través de técnicas de tinción histoquímica y electroforesis. En ambas técnicas se utilizó extracto proteico proveniente de dos orígenes: de plantines congelados obtenidos del vivero, en cuatro fechas y, de plantines frescos sembrados en el laboratorio de genética. La incorporación de Trichoderma harzianum tuvo un efecto de promoción de crecimiento solamente para Eucalyptus grandis en las últimas etapas de crecimiento, dicho efecto no se evidencio para Eucalyptus globulus. En el análisis de electroforesis los extractos de plantines no tratados con Trichosoil mostraron una migración menor, mientras que algunos de los extractos que fueron tratados presentaron una mayor migración, pudiéndose asociar a la existencia de peroxidasa relacionada directamente a la presencia de Trichoderma harzianum.
Palabras clave: Plantines; Biopromotor; Biocontrolador; Trichoderma harzianum; Eucalyptus grandis; Eucalyptus globulus; Peroxidasa.
Evaluación de crecimiento, sanidad y resistencia a heladas de tres híbridos de Eucalyptus grandis con aplicación de bio estimulantes, trichoderma harzianum (trichosoil®) y quitosano (biorend®), en plantación.
2014
Romero. G, Olivera Costa. M, Rodríguez .D. Facultad de Agronomía. Universidad de la República.
Resumen.
El gran interés despertado por el control biológico de patógenos de plantas es una respuesta en gran parte a la creciente preocupación de la sociedad acerca del uso de pesticidas químicos. Se parte del supuesto de que no es posible destruir ni eliminar a las poblaciones de patógenos de plantas, sino que es necesario convivir con ellas manejándolas de tal modo que su interferencia con los cultivos sea menor permitiendo producir en forma comercial. Existe evidencia científica que reportan las propiedades de Trichoderma harzianum como agente biocontrolador y estimulador del crecimiento y a quitosano como agente estimulador del crecimiento es por esto que el objetivo de este trabajo es evaluar crecimiento, sanidad y resistencia a heladas (probabilidad de sobrevivencia) de tres híbridos de E. grandis con aplicación conjunta de Trichoderma harzianum (Trichosoil®) y Quitosano (Biorend®), en plantación, considerando la aplicación en dos tamaños de plantas. Esta investigación comprende dos etapas la primera llevada a cabo en el vivero de Weyerhaeuser S.A en el Departamento de Tacuarembó y la segunda se instaló un ensayo de plantación en el Establecimiento Buena Vista I propiedad de Weyerhaeuser S.A, en el Departamento de Rivera. En abril de 2013 se realizó un DCA donde la variable aleatoria en estudio fue altura (cm), 3 tratamientos que consistieron en diferentes genotipos de E.grandis (GU8, GT529, GC514), donde se seleccionaron al azar 75 plantines (siendo estos la unidad experimental), realizándose 75 repeticiones. Se procedió a realizar mediciones de alturas con regla a los plantines con el objetivo de poder determinar si efectivamente hay dos tamaños (grandes e intermedios) que será la base de estudio de este trabajo. En el mes de mayo se realizó la segunda etapa que consistió en un DBCA con arreglo factorial, donde los factores evaluados fueron: genotipos (GU8, GT529, GC514), dos tamaños (intermedios y grandes), y aplicación de Trichosoil® más Biorend® (testigo, una y dos dosis extra). Resultando en 18 tratamientos por bloque, con 3 repeticiones. Cada parcela conto con 30 plantines(UE), a una densidad de 540 plantas/ha. Los resultados obtenidos muestran que hay una respuesta diferencial frente a la aplicación conjunta de Trichoderma harzianum más quitosano, sobre el crecimiento (altura y diámetro), probabilidad de sobrevivencia, daños por heladas y sanidad, la cual depende de la combinación con el genotipo y el tamaño.
Palabras clave: Control biológico; Crecimiento; Departamento Tacuarembó; Eucalyptus grandis; Plantación forestal; Sobrevivencia; Trichoderma harzianum; Quitosano.
Bibliografía.
1. Añon, D.; Levitan, A.; Tarino, E. 2004. Evaluación de diferentes dosis de fertilización en la producción de plantines de Pinus taeda creciendo en sustrato colonizado por Trichoderma harzianum. Tesis Ing. Agr. Montevideo, Uruguay. Facultad de Agronomía. 125 p.
2. Boffano, A.; Mosqueira, M. 2012. Evaluación de la respuesta de cinco diferentes híbridos de Eucalyptus grandis con Trichoderma harzianum y quitosano en vivero y plantación. Tesis Ing. Agr. Montevideo, Uruguay. Facultad de Agronomía. 86 p.
3. Cabrera, R.; Tejera, R. 2002. Evaluación de diferentes dosis de fertilización en la producción de plantines de Eucalyptus grandis w. Hill ex Maiden creciendo en sustrato colonizado por Trichoderma harzianum. Tesis Ing. Agr. Montevideo, Uruguay. Facultad de Agronomía. 156 p.
4. Cárdenas, Diego.2003. Evaluación de diferentes sustratos colonizados con el antagonista (Trichoderma harzianum Fr.) sobre la calidad de plantines de Eucalyptus grandis w. Hill ex Maiden., Eucalyptus globulus spp. globulus Labill. y Pinus taeda L. Tesis Ing. Agr. Montevideo, Uruguay. Facultad de Agronomía.195 p.
5. Chávez, P. 2006. Producción de Trichoderma spp, y evaluación de su efecto en cultivo de Crisantemo (Dendranthema grandiflora). (en línea). Trabajo de grado. Bogotá, Colombia. Facultad de Ciencias.178 p. Consultado 20 junio 2014. Disponible en http://www.javeriana.edu.co/biblos/tesis/ciencias/tesis286.pdf
6. Cruzat, R. y Ionannidis D. 2008. Biocontrol de Enfermedades Fungosas con Trichoderma spp. Proyecto de Innovación en las Regiones de O´Higgins y del Mauledisponible. (en línea). s.l., Ograma. pp. 1-28. Consultado 25 junio 2014.
7. Donati, S. 2011. Efecto de Trichoderma Harzianum cepa L1 sobre la calidad de plantines en Pinus taeda. Tesis Ing. Agr. Montevideo, Uruguay. Facultad de Agronomía. 144 p.
8. Ezziyyani M.; Pérez C.; Sid A.; Requena, M. E.; Candela, M.E.; 2004. Trichoderma harzianum como biofungicida para el biocontrol de Phytophthora capsici en plantas de pimiento (Capsicum annuum L.).(en línea). Murcia, Universidad de Murcia. Departamento de Biología Vegetal, Facultad de Biología.10 p. Consultado 28 setiembre 2013.Disponible en https://www.um.es/analesdebiologia/numeros/26/PDF/05-TRICHODERMA.pdf
9. Kurioka, M.; Martirena, V.; Mulvany, J. 2013. Evaluación de metabolitos inducidos en plantines de Eucalyptus grandis y E. globulus creciendo en vivero sobre sustrato inoculado con Trichoderma harzianum. Tesis Ing. Agr. Montevideo, Uruguay. Facultad de Agronomía. 146 p.
10. Negrone,C.; León, M.;Villalba, N.2008 Evaluación del comportamiento de plantines de Pinus taeda L. con y sin aplicación de fertilización starter creciendo en sustrato con Trichoderma harzianum, Tesis Ing. Agr. Montevideo, Uruguay. Facultad de Agronomía. 60p.
11. Pérez Consuegra, N. 2004. Manejo ecológico de plagas. (en línea). La Habana, Cuba, Centro de Estudios de Desarrollo Agrario y Rural (CEDAR). 296 p. Consultado en 20 junio 2014. Disponible en http://www2.fcnym.unlp.edu.ar/catedras/ecoplagas/Bibliografia.pdf
12. Olivera costa, V., Rodríguez, D. 2014. Evaluación del crecimiento, sanidad y resistencia a heladas de tres híbridos de Eucalyptus grandis con aplicación de bio estimulantes, Trichoderma harzianum (Trichosoil®) y quitosano (Biorend®), en plantación. Tesis Ing. Agr. Montevideo, Uruguay. Facultad de Agronomía. 205p.
13. Romero, O.; Huerta, M.; Damián, M.; Domínguez, F.; Arellano, D. 2009. Características de Trichoderma harzianum, como agente limitante en el cultivo de hongos comestibles. (en linea).Revista Colombiana Biotecnología. 11(2): 143-151. Consultado 20 junio 2014. Disponible en http://es.scribd.com/doc/42390176/Caracteristicas-de-Trichoderma-harzianum-como-agente-limitante-en-el-cultivo-de-hongos-comestibles
14. Rossi,C. 2010. Evaluación de Trichoderma harzianum como agente biopromotor y de biocontrol en plantines de Eucalyptus dunii Maiden. Tesis Ing. Agr. Montevideo, Uruguay. Facultad de Agronomía. 120p.
Temas relacionados:
Autores:
Universidad de la República de Uruguay (UdelaR)
Referentes que Recomendaron :
Jacobo MendezRecomendar
Comentar
Compartir
Universidad de Sonora (México)
19 de agosto de 2021
Graciela: Excelente articulo y muy completo. Felicidades!!! Aqui en el Nw de Mexico, se esta utilizando una cepa de T. harzianum , que le asignamos el Numero B-11- Nos ha dado excelentes resultados en todos los cultivos, y hemos reducido la dependencia de Agroquimicos en esta region. Cultivos de produccion nacional y de exportacion, ya que estamos a 3 horas de la frontera con USA:Para los agricultores, se ha vuelto muy comun, aplicar este genero fungoso, tan util en el control Biologico. Ojala y nos encontremos en algun Congreso Internacional acerca de este impó'rtante Genero en el Control Biologico.
Recomendar
Responder
28 de diciembre de 2020
Muy buen articulo. Felicitaciones de antemano, Me perimito hacer la siguiente consulta. Para una plantación de Maracuya cual recomienda usted debe ser la frecuencia de aplicación para prevenir el ataque de Fusarium, Se puede aplicar con melaza para incentivar la multiplicación de la Trichorderma?. Es compatible con El caldo Bordeless?
Recomendar
Responder
10 de diciembre de 2020
Comercializamos Trichodermas solas o combinadas con otros microorganismos en el sector agrícola extensivo, y felicito este trabajo que aportará mucho a entender los procesos en que se involucra. Ojala en las Universidades se traten asi estos temas y se vuelquen a la práctica.
Recomendar
Responder
Recomendar
Responder
19 de mayo de 2020
Graciela buenas tardes Mi nombre es Avaro Castillo he trabajado por mas de 10 años con microorganismos eficientes , soy Ingeniero Forestal. y creo con el pasar del tiempo soy mutación con el trichoderma ,excelente tu articulo, muy profundo, pero lleno de elementos nuevos , que nos pone en una nueva forma de ver el agro y el suelo como ser vivo. gracias
Recomendar
Responder
16 de enero de 2020
Excelente investigación y muy completa sobre este agente de control biológico. Felicito a las autoras por tan interesante e importante trabajo. Aquí en Venezuela lo utilizamos en diferentes rubros: musáceas, caña de azúcar, pastos, cacao, etc.
Recomendar
Responder
1 de diciembre de 2019
ING Graciela. Muy buena publicación de la investigacion realizadae en área forestal; sin embargo es aplicable en otros cultivos.
Tambíen da luces de gran trascendencia a otros prácticas en el uso de otras alternativas q sirven para el manejo de las enfermedades. Ej. el Sílice.
Sin embargo la expresión literal de solubilidad de algunos metales pesados debe preocuparnos por la presencia de alguno de ellos en ciertos productos Ej Cacao q nos margina de venta de este producto como materia prima.
Recomendar
Responder
4 de noviembre de 2019
COLEGA:
GRACIELA
ME ENCANTO Y ME PARECE ESTA MUY COMPLETO CON TODOS LOS DETALLES PRACTICOS Y TEORICOS QUE NECESITAMOS EN NUESTRA PROFESION.
HACE DIAS TE ESCRIBI PERO NO HE RECIBIDO RESPUESTA.
MARCO TULIO OSORIO S
Recomendar
Responder
16 de septiembre de 2019
Excelente investigaciòn sobre control biològico estamos utilizandolo y ademàs bacillus s.buenos controles . Graciàs. Ing.Benjamìn
Recomendar
Responder
6 de mayo de 2019
Primero agradezco su atención y, pues felicidades una enorme investigación parea entrar en esta etapa de sistema de control de plagas y enfermedades.
Abrazos.
Ing. Luis García Santiago
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.






