INTRODUCCIÓN
En Uruguay, la producción comercial de hortalizas de la Zona Sur aplica altos volúmenes de fertilizantes y enmiendas orgánicas, principalmente la cama de pollo proveniente de la actividad avícola. El agregado de éstos materiales mejora las propiedades químicas y físicas del suelo, a pesar que el contenido de nutrientes de los abonos es muy variable (Baccaro, et al., 2006; Barbazan et al., 2011). Similar a lo que ocurre en nuestro país se ha manifestado en España en invernáculos, donde las aplicaciones de N como fertilizante y estiércol fueron superiores a los requerimientos del cultivo (Thompson et al., 2007). A su vez en California, se detectaron altos niveles de P en suelos hortícolas, por la utilización de altas tasas de fertilización (Hartz & Johnstone, 2006). Un problema adicional se genera si se desea estimar la dosis de abono a aplicar debido a que la estimación se basa en el contenido de N y la tasa de mineralización, lo cual puede ocasionar acumulación de P en los suelos, dada la baja relación N/P de éstos materiales (Edmeades, 2003; Barbazan et al., 2011). Elevadas concentraciones de P en el suelo pueden afectar la calidad del AS a través de la desorción de formas solubles de P en el agua de escorrentía, así como por la erosión que remueve preferencialmente las partículas más finas (arcillas) que son las mas enriquecidas con P en comparación a las que le dieron origen (Alberts et al., 1981; Sharpley, 1985). Al igual que P, las pérdidas de N por escurrimiento son favorecidas por un aumento del transporte de la materia orgánica suspendida (Delgado, 2002).
En el caso del N, la alta movilidad del NO3 determina que se produzca también exportación de éste nutriente por lixiviación y se contaminen AP (Randall & Mulla, 2001, Perdomo, 2001). En AS el principal riesgo de contaminación surge del incremento de la concentración de P y N de las mismas; el exceso de uno de ellos favorece la eutrofización. Cuando la relación N/P es menor a 9 limita el N y cuando es mayor limita el P siendo la relación optima 9/1 (Redfield, 1934; Vollenweider, 1983). Por lo tanto, la sobrefertilización y el uso de altos aporte de abonos pueden incrementar la concentración de P y N de las aguas, dañando los recursos hídricos.
En cuencas hortícolas de Australia, la concentración mediana de AS de NT y PT fue de 32,2 y 1,5 mg L-1 respectivamente, mientras que en EEUU la concentración mediana de PT varió de de 2,5 a 3,1 mg L-1. Los autores concluyeron que la carga de P en las aguas estuvo relacionada con los niveles de P lábil en el suelo y los volúmenes de fertilizantes utilizados (Bartley et al., 2011; He et al., 2006). A nivel internacional se han establecido niveles de referencia de acuerdo al recurso hídrico (curso superficial o lago) y la región considerada. En EEUU el nivel máximo para PT y NT es de 0,13 y de 2,2 mg L-1, en Australia y Nueva Zelanda es de 0,07 y de 1,2 mg L-1 y en Europa es de 0,25 y de 0,025 mg L-1 respectivamente (USEPA, 2002; ANZECC, 2000; EEA, 2000). En Uruguay la referencia es el decreto 253/79 que establece para todas las aguas (AS y AP) un nivel máximo de PT de 0,025 mg L-1, similar al de Europa (Uruguay, PE, 1979). El decreto nacional no establece un nivel máximo de NT. De acuerdo a estos niveles las AS de las cuencas hortícolas de diversas regiones del mundo superaron ampliamente los estándares internacionales, tanto para PT como para NT. Por otro lado las AP de zonas hortícolas de Australia presentaron una concentración de N-NO3 que varió de 9 a 56 mg L-1 y las de EEUU variaron de 0,2 a 50,5 mg L-1, según los autores éstas concentraciones podrían tener un impacto ambiental (Pionke et al., 1996; Kraft & Suites, 2003). A nivel regional en zonas hortícolas de Argentina el rango de N-NO3 fue de 3,4 a 30,6 mg L-1 y en el 60 % de los sitios se detectó coliformes fecales (CF) (Baccaro et al., 2006). A nivel internacional, en AP el nivel crítico para consumo humano de N-NO3 es de 10 mg L-1, el cual coincide con el valor crítico del decreto 253/79 (USEPA, 1986; MEGJ, 1997; Uruguay, PE, 1979). Al igual que en AS, las AP superaron ampliamente el estándar internacional de N-NO3, por lo que no se consideran aptas para el consumo.
A nivel nacional, existe poca información sobre niveles de nutrientes en AS y AP en sitios hortícolas. Uno de los pocos estudios relacionados con los efectos de la horticultura en la calidad de aguas fue realizado en la cuenca del Río Santa Lucia. Éste trabajo determinó que la concentración de PT y NT en AS fue mayor a 0,025 y de 0,9 mg L-1 respectivamente y la concentración de N-NO3 en AP fue superior a 10 mg L-1 en el 20 % de los sitios muestreados, sin embargo el trabajo no fue diseñando específicamente para evaluar el efecto de la horticultura sobre la calidad del agua (JET-DINAMA. 2010). En zonas agrícolas de litoral del país (Rio Uruguay) se determinó que la máxima concentración de PT y NT fue mayor a 0,025 y 0,62 mg L-1 respectivamente y en AP del litoral oeste (Colonia y Soriano) la concentración de N-NO3, osciló entre 1 y 93 mg L-1 y el 60 % de las muestras estuvo contaminada con CF (DINAMA, 2009; Perdomo et al., 2001).
Estos antecedentes muestran que las zonas hortícolas de varias regiones del mundo tienen problemas de calidad de agua, pero en Uruguay hay poca información al respecto. Por tanto, el objetivo de este trabajo fue determinar los niveles de PT, NT y N-NO3 y otras variables en AS y AP para caracterizar la calidad de las aguas en zonas hortícolas del sur del Uruguay.
MATERIALES Y MÉTODOS
Este relevamiento se realizó en 12 predios hortícolas (S1 a S12) del sur del país (Montevideo y Canelones), durante 2008 y 2009 inclusive. Se colectaron 33 muestras de AS, 88 muestras de AP y 21 muestras de aguas mixtas (AM) (ambos orígenes). Los sitios muestreados se encuentran dentro de la cuenca del Río Santa Lucia.
Las muestras fueron colectadas manualmente en botellas de plástico (1 L). Inmediatamente antes de su colecta, se agregó 1 mL de H2SO4 10M a los recipientes para prevenir la ocurrencia de cambios químicos o biológicos en las muestras. Para el análisis bacteriológico, las muestras fueron colectadas en frascos estériles de 250 mL. Posteriormente se mantuvieron refrigeradas a 4-6 ºC hasta su posterior análisis. Las muestras fueron analizadas por nitrógeno total (NT) (Bremmer & Mulvaney, 1982; Rhine et al., 1998), fósforo total (PT), fósforo disuelto reactivo (Dissolved Reactive Phosphorus-DRP) (Pote & Daniel, 2000), nitratos (N-NO3) (Keeney y Nelson, 1982), amonio (N-NH4) (Rhine et al., 1998), coliformes fecales (CF) y turbidez (APHA, 1995). Las mediciones colorimétricas se realizaron con un espectrómetro UNICAM 5675.
Debido a que la concentración de los nutrientes en agua se distribuyó en forma asimétrica, se presentan los resultados de las medianas. Para el análisis estadístico de las diferencias entre las medianas de cada sitio por parámetro se realizó con el test no paramétrico Kruskal-Wallis (Kruskal & Wallis 1952). Se utilizó el programa INFOSTAT Estudiantil, versión 2011 (Di Rienzo et al., 2011).
RESULTADOS Y DISCUSIÓN
Aguas superficiales
La concentración mediana de NT superó ampliamente los estándares internacionales más exigentes (ANZEC, 2007; EEA, 2000), pero se encontró dentro del rango considerado por EPA como aceptable para su ecorregión más agrícola (USEPA, 2002) (Tabla 1).

La concentración mediana de PT fue superior a los estándares internacionales y al decreto nacional (Tabla 1). Este valor superó incluso ampliamente el nivel de referencia de la ecoregión mas agrícola de EEUU. La concentración de DRP (Dissolved Reactive Phosphorus) fue similar a la de PT (0,34 mg L-1), lo que indica que el mayor aporte de P provino de formas solubles y no asociado a las partículas, por lo cual la erosión no fue la principal fuente de aporte. La relación N/P estuvo por debajo del óptimo de 9/1, indicando que la eutrofización estuvo limitada por N o que el P fue el nutriente más excesivo. La concentración promedio de P lábil (P Bray1) en estos predios fue muy elevada (81 ppm), por lo cual parte de los altos niveles de PT en el aguas puedan ser explicados por contaminación difusa desde el suelo. El valor de turbidez (Tb) fue inferior a los estándares internacionales, pero superior al valor de la ecoregión más prístina de EEUU (Tabla 1) (ANZEC, 2007; USEPA, 2002). No obstante, casi ninguna de las muestras de agua pudo ser catalogada como no-potable, ya que solo en un sitio se detectó presencia de CF y el contenido de N-NO3 fue bajo (0,34 mg L-1). Las concentraciones de nitrógeno como amonio (N-NH4), N-NO3, NT y sólidos totales (ST) no difirieron significativamente entre sitios, pero si lo hicieron las
concentraciones de PT (P>0,010) y DRP (P>0,030). Si bien la Tb no fue significativamente diferente, la probabilidad fue baja (P>0,074), y el sitio con mayor NT (S6) presentó también mayor Tb (P>0,0155). En cambio, las aguas con más N-NO3 tuvieron menor Tb (S9 y S1), lo que sugiere un ambiente más aeróbico. Además, la Tb no se debería a ST, ya que las muestras con más ST (S1 y S12) fueron menos turbias. Por lo tanto la Tb se pudo deber a materia orgánica en suspensión pues no existió relación significativa entre NT y ST. Resultados similares fueron reportados en cuencas ganaderas del Río Tacuarembo presumiblemente por la presencia de estiércol proveniente de animales en pastoreo (Barreto et al., 2010).
Aguas de origen mixto
En cuanto al riesgo de eutrofización las AM presentaron un patrón muy similar al de las AS, con valores de concentración de NT (2,02 mg L-1) inferiores a los estándares internacionales (Tabla 1) (ANZEC, 2007; USEPA, 2002). La concentración de PT fue superior a los estándares nacionales e internacionales (0,32 mg L-1), y la relación N/P estuvo por debajo de la óptima. La concentración de DRP fue similar a PT (0,23 mg L-1), lo cual nos indicaría que la mayor parte del P estuvo en forma soluble. El valor de Tb fue de 20,6 NTU, el cual supera el valor considerado por EPA aceptable para la ecoregión más agrícola de EEUU. La concentración de N-NH4 fue inferior a 0,11 mg L-1, aunque el 75 % de las muestras tuvo concentraciones menores a 0,30 mg L-1. Estas aguas no podrían clasificarse como no-potables pues los contenidos de N-NO3 fueron inferiores (0,02 mg N L-1) a los niveles críticos citados y solo en dos sitios de 22 (9 %) se detectó presencia de CF.
Los sitios analizados no difirieron significativamente entre si en NT, N-NO3, PT, DRP, ST y Tb pero esto si ocurrió en N-NH4 (P>0,05). Las aguas donde se acumuló N-NH4 tuvieron menor contenido de ST y las aguas con altos contenidos de N-NO3 tuvieron menores contenidos de DRP y Tb. Además, las aguas que tuvieron altas concentraciones de N-NO3, tuvieron bajas concentraciones de NT y menor Tb (S10).
Aguas profundas
Las AP presentaron valores de concentración mediana de N-NO3 de 1,48 mg L-1, sin embargo en 4 sitios se reportaron concentraciones mayores a 10 mg L-1, las cuales superan el nivel crítico para consumo humano (USEPA, 1986; MEGJ, 1997). Se detectó presencia de CF en el 17 % de las muestras lo cual inhabilitaría estas aguas para consumo humano. Las concentraciones de NT (0,20 mg L-1) y PT (0,05 mg L-1) fueron inferiores a las concentraciones de las AS y AM, aunque los valores de ambos parámetros estuvieron por encima del valor considerado por EPA aceptable para la ecoregión más agrícola de EEUU y aun al estándar nacional (USEPA, 2002; Uruguay, PE, 1979). Esto indica que si las AP fueran puestas en superficie tendrían un menor riesgo de eutrofización que las AS, pero éste riesgo aun existiría. Obviamente éste proceso no podría darse en profundidad ya que en éste estado el factor limitante es la luz. La Tb fue de 0,7 NTU, valor menor al nivel crítico establecido por EPA para su ecoregión mas prístina. Las concentraciones de N-NH4, NT, PT, ST, Tb y CF no difirieron significativamente entre sitios, pero si difirieron significativamente la concentración de N-NO3 (P>0,004), DRP (P>0,002) y PT (P>0,004). Al igual que en AS existió una alta correlación entre PT y DRP (datos no mostrados) lo cual indicaría que la mayor parte del PT se correspondió con formas solubles. Los sitios con mayor concentración de NT (S2 y S9) fueron también los sitios con mayores concentraciones de PT y DRP.
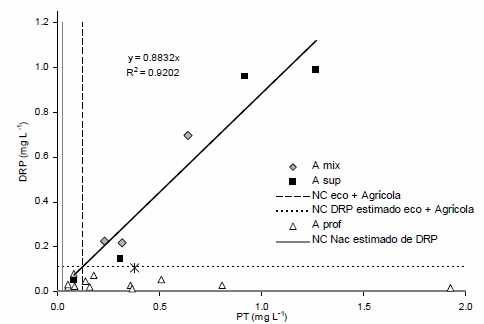
Relaciones entre PT y DRP en los tres tipos de aguas
Tanto AS como AM presentaron un 88,3 % del PT en forma de DRP, y existió una estrecha relación entre ambas (Figura 1). En cambio, las AP mostraron un patrón diferente, pues aunque
los rangos de PT fueron similares a las AS y AM, los valores de DRP fueron bajos (solo 9.6% del PT fue DRP).
Figura 1: Relación de la concentración mediana de PT y DRP en aguas superficiales, mixtas y profundas por sitio.
Se estimó a partir de la relación entre PT y DRP en AS y AM la concentracion crítica de DRP para el valor de PT del decreto 253/79 y el de USEPA (2002) para la ecoregión más agrícola. Las AS y AM de todos los sitios superaron los valores críticos estimados de DRP a partir de ambas referencias (Figura 1). Estos resultados muestran que la actividad hortícola intensiva ha elevado los niveles de P de la mayoría de las AS y AM por encima de los estándares nacionales e internacionales, por lo cual se podrían catalogar como aguas degradadas o contaminadas.
CONCLUSIÓN
Las AS y las AM superaron ampliamente los límites nacionales e internacionales de PT, presentando por tanto un elevado riesgo de eutrofización. Las AP en su mayoría serían aptas para consumo humano salvo excepciones debido a la presencia de CF y/o nitrato en alta concentración. En general, las distintas clases de aguas presentaron un deterioro de la calidad, por lo que se deberían incorporar prácticas de manejo que compatibilicen una elevada productividad con un mínimo impacto ambiental.
BIBLIOGRAFÍA
- Alberts, EE; WH Neibling; & WC Moldenhauer. 1981. Transport of sediment nitrogen and phosphorus in runoff through cornstalk residue strips. Soil Sci. Soc. Am. J. 45:1177–1184.
- American Public Health Association. 1995. Standard methods for the examination of water and wastewater. 19th ed. APHA, Washington, DC. USA.
- ANZECC. 2000. Australian and New Zealand guidelines for fresh and marine water quality. . Consultado 28 de Octubre de 2011.
- Baccaro, K; D Ddegorgue; M Lucca; L Picone; E Zamuner & Y Andreoli. 2006. Calidad del agua para consumo humano y riego en muestras del cinturón hortícola de Mar del Plata. RIA, 35: 95-110.
- Barbazán, M; A del Pino; C Moltini; J Hernández & J Rodríguez. 2011. Caracterización de materiales orgánicos aplicados en sistemas agrícolas intensivos de Uruguay. Agrociencia-Uruguay 15:82-92.
- Barreto, P; V Piñeiro; G Chescheir; & C Perdomo. 2010. Efectos de la aforestación sobre la calidad del agua de escurrimiento en una cuenca del río Tacuarembó. En: Suelos y Aguas – Fac. Agronomía. Jornadas de actualización técnica 10 años de investigación en producción forestal. 11-15 pp.
- Bartley, R; WJ Speirs; TW Ellis & DK Waters. 2011. A review of sediment and nutrient concentration data from Australia for use in catchment water quality models. Mar. Pollut. Bull. in press
- Bremmer, JM & CS Mulvaney. 1982. Nitrogen-total. Pp. 595-624 In: Methods of soil analysis. A.L. Page, R.H. Miller, Keeney D.R. (Eds). Chemical and microbiological properties, 2nd ed. Agronomy series Nº9 ASA, SSSA, Madison, Wisconsin, USA.
- Delgado, JA. 2002. Quantifying the loss mechanisms of nitrogen. J. Soil Water Conserv. 57:389–398.
- Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez; M Tablada & CW Robledo. InfoStat versión 2011. Grupo. InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. Consultado 28 de Octubre
- de 2011
- DINAMA. 2009. Plan de Seguimiento Planta de Celulosa en Fray Bentos. Reporte de datos de calidad de agua superficial y sedimentos. Consultado el 14 de Noviembre 2011
- Edmeades, DC. 2003. The long-term effects of manures and fertilisers on soil productivity and quality: a review. Nutr. Cycl. Agroecosys. 66:165–180
- EEA. 2000. Nutrients in European ecosystems. Environmental Assessment Report Nº 4. . Consultado 28 de Octubre de 2011.
- Hartz, TK & PR Johnstone. 2006. Nitrogen Availability from High-nitrogen-containing Organic Fertilizers. Horttechnology 16:39-42.
- He, ZL; MK Zhang; PJ Stoffella; XE Yang & DJ Banks. 2006. Phosphorus Concentrations and Loads in Runoff Water under Crop Production. Soil. Sci. 70: 1807–1816
- JET-DINAMA. 2010. Informe de situación sobre fuentes de contaminación disfusa en la cuenca del Río Santa Lucia. . Consultado el 14 de Noviembre de 2011
- Keeney, DR & DW Nelson. 1982. Nitrogen - inorganic forms. In Page, A L. Methods of soil analysis. Part 2: chemical and microbiological properties: 643-698. American Society of Agronomy, Soil Science Society of America. Madison, WI, USA.
- Kraft, GJ; & W Stites. 2003. Nitrate impacts on groundwater from irrigated-vegetable systems in a humid north-central US sand plain. Agric. Ecosyst. Environ. 100:63–74.
- Kruskal, WH & WA Wallis. 1952. Use of ranks in one-criterion analysis of variance. J. Am. Stat. Assoc. 47: 583– 621
- MEGJ, 1997. Environmental Quality Standards for Groundwater Pollution. . Consultado 28 de Octubre de 2011.
- Perdomo, CH; ON Casanova & VS Ciganda. 2001. Contaminación de aguas subterráneas con nitratos y coliformes en el litoral del sudoeste del Uruguay. Agrociencia-Uruguay 5:10-22.
- Pionke, HB; ML Sharma & KJ Hirschberg. 1990. Impact of irrigated horticulture on nitrate concentrations in groundwater. Agr. Ecosyst. Environ. 32:119-132
- Pote, DH & TC Daniel. 2000. Analyzing for total phosphorus and total dissolved phosphorus in water samples. p. 94–97. In Pierzynski (ed.) Methods of phosphorus analysis for soils, sediments, residuals and waters. G.M.
- Randall, GW & DJ Mulla. 2001. Nitrate nitrogen in surface waters as influenced by climatic conditions and agricultural practices. J. Environ. Qual. 30:337–344.
- Redfield, AC 1934. On the proportions of organic derivations in sea water and their relation to the composition of plankton. In James Johnstone Memorial Volume. (ed. R.J. Daniel). University Press of Liverpool, pp. 177-192 .
- Rhine, ED; GK Sims; RL Mulvaney & EJ Pratt. 1998. Improving the Berthelot reaction for determining ammonium in soil extracts and water. Soil Sci. Soc. Am. J. 62:473–480.
- Sharpley, AN. 1985. The selective erosion of plant nutrients in runoff. Soil Sci. Soc. Am. J. 49:1527–1534.
- Thompson, RB; M Gallardo; LC Valdez & MD Fernández. 2007. Using plant water status to define threshold values for irrigation management of vegetable crops using soil moisture sensors. Agric. Water Manage. 88:147-15.
- USEPA. 1986. Maximum contaminant levels subpart B of part 141, National interim primary drinking water regulations. In: U.S. Code of Federal Regulations, Title 40, Parts 100 to 149, Revised as 1 July 1986, pp. 524-528 and 567-568. USEPA, Washington, DC, USA.
- USEPA. 2002. Ecoregional Criteria. Consultado 12 de Noviembre de 2011.
- Uruguay. PE. 1979. Decreto 253/79. Normas para prevenir la contaminación ambiental mediante el control de las aguas. Consultado 28 de Octubre de 2011.
- Vollenweider, RA.1983. Eutrophication. Notes distributed during the II Meeting of the Regional Project on the Eutrophication of Tropical Lakes.