Contribución del nitrógeno incubado en anaerobiosis al diagnóstico de nitrógeno en maíz
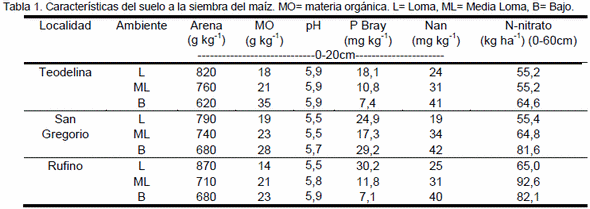
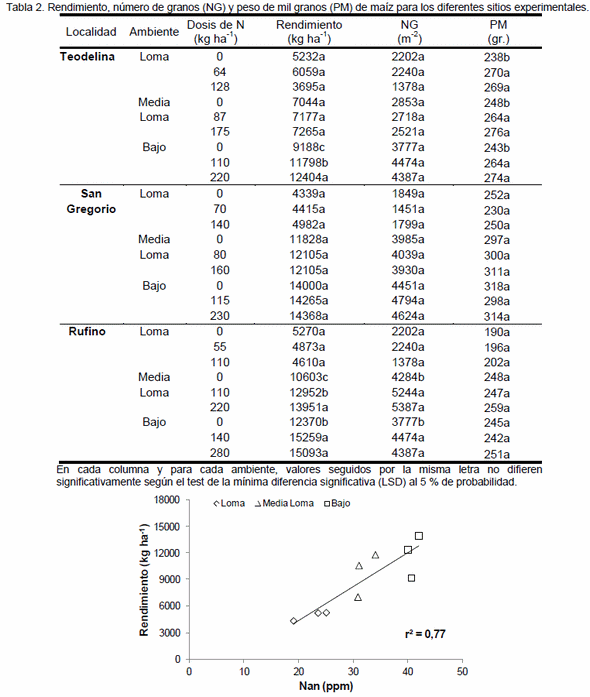
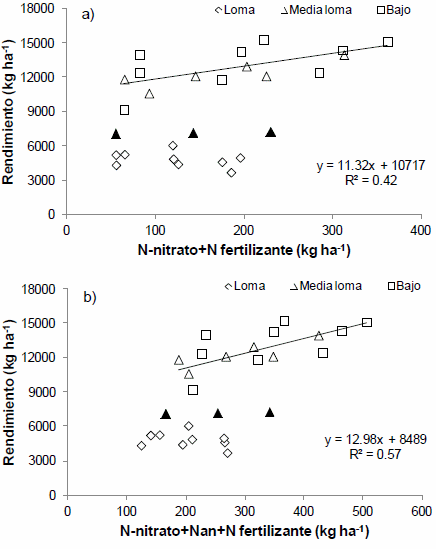
La determinación del contenido de nitrógeno (N)-nitrato en pre-siembra y en el estadio de 5-6 hojas de maíz, son los métodos más difundidos para el diagnóstico de N. No obstante, los índices de mineralización, tales como el N-incubado en anaerobiosis (Nan), podrían contribuir a mejorar la evaluación de la disponibilidad de N para el cultivo. El objetivo fue evaluar el empleo del Nan como herramienta complementaría a la determinación del contenido de N-nitrato a la siembra del maíz. Se realizaron 3 ensayos de fertilización nitrogenada en lotes con diferente historia agrícola del Sur de Santa Fé. En cada sitio, los experimentos fueron realizados en ambientes de Loma (L), Media Loma (ML) y Bajo (B). El rendimiento promedio del testigo fue de 4950, 9825 y 11853 kg ha-1 para la L, ML y B, respectivamente. La respuesta al agregado de N fue baja (600 kg ha-1) o nula en L, de 221 a 3348 kg ha-1 en ML y de 368 a 3216 kg ha-1 en el B. La determinación del Nan permitió identificar ambientes con diferente potencialidad dentro de un mismo lote. Por otra parte, la disponibilidad inicial de N (suelo+fertilizante) explicó el 42% de la variación en el rendimiento, sin embargo, cuando se incorporó el Nan dicha variación fue explicada en un 57%. Por lo tanto, la determinación del contenido de Nan junto con la de N-nitrato a la siembra del maíz permite cuantificar con mayor precisión la disponibilidad de N para el cultivo, lo cual contribuiría a mejorar la producción minimizando el impacto ambiental.
PALABRAS CLAVE: Mineralización de nitrógeno; métodos biológicos; maíz.
Para la zona centro y norte de la región pampeana se recomienda la determinación del contenido de N-nitrato en pre-siembra como método de diagnóstico de N, debido a las escasas lluvias invernales y las mayores temperaturas en relación a la zona sur (Alvarez et al., 2004). Sin embargo, en regiones húmedas y/o con menores temperaturas (sur de la región pampeana) este método de diagnóstico es poco sensible debido a las pérdidas y/o a la baja mineralización de N antes del período de mayor consumo de N por el cultivo (Sainz Rozas et al., 2008). Además, en general, estas zonas se caracterizan por altos contenidos de MO, y por ende, un mayor aporte de N por mineralización, el cual no siempre puede ser evaluado con el muestreo en pre-siembra. Frente a esta situación, Sainz Rozas et al. (2000) proponen la determinación del contenido de N-nitrato en el estadio de 5-6 hojas en el estrato 0-30cm como método de diagnóstico de N. No obstante, esta metodología presenta la desventaja del escaso tiempo disponible entre la toma de la muestra de suelo y la fertilización, particularmente cuando se siembran grandes superficies donde es necesario adelantar el muestreo de suelo. Por lo tanto, surge la necesidad de contar con algún indicador del aporte de N por mineralización con el objetivo de mejorar la evaluación temprana de la disponibilidad de N para el cultivo. Para tal fin, la determinación del contenido de N-amonio producido en incubación anaeróbica (Nan) de muestras de suelo del estrato superficial (0-20cm) parecería ser un indicador confiable (Echeverría et al., 2000). En el sudeste bonaerense, Sainz Rozas et al. (2008), reportaron que el empleo del Nan permitió ajustar el umbral de respuesta a N en el estadio de seis hojas (V6), sin embargo, la información es escasa en áreas de mayor potencial de rendimiento donde suele emplearse la determinación de N-nitrato a la siembra. El objetivo de este trabajo fue evaluar el empleo del Nan, como herramienta complementaría a la determinación del contenido de N-nitrato a la siembra del cultivo, para el diagnóstico de N en maíz.
- Andrade, FH & VO Sadras. 2000. Efectos de la sequía sobre el crecimiento y rendimiento de los cultivos. En: Andrade F.H. y V.O. Sadras (eds). Bases para el manejo del maíz, el girasol y la soja. Editorial Médica Panamericana S.A., Buenos Aires, Argentina. pp. 173-206.
- Alvarez, R; HS Steinbach; C Alvarez & S. Griguera. 2003. Recomendaciones para la fertilización nitrogenada de trigo y maíz en la pampa ondulada. Informaciones agronómicas del cono sur 18: 14-18.
- Calviño, PA & HE Echeverría. 2003. Incubación anaeróbica de suelo como ayuda al diagnóstico de la respuesta a nitrógeno en maíz bajo siembra directa. Ci. Suelo 21:24-29.
- Diovisalvi, N; NI Reussi Calvo; GA Studdert & GF Domínguez. 2010. Relación entre el nitrógeno incubado anaeróbico y fracciones de carbono orgánico en suelos con diferente textura. XXII Congreso Argentino de la Ciencia del Suelo. Actas y CD 2 pág. Rosario, Sante Fé, Argentina.
- Echeverría, HE; N San Martin & R Bergonzi. 2000. Métodos rápidos de estimación del nitrógeno potencialmente mineralizable en suelos. Ci. Suelo 18: 9-16.
- Echeverría, HE & H Sainz Rozas. 2005. Maiz. En: Echeverría H.E. y F.O. Garcia (eds). Fertilidad de Suelos y Fertilización de Cultivos. Editorial INTA, Buenos Aires, Argentina. pp. 255-282.
- García, F; M Boxler; J Minteguiaga; R Pozzi; L Firpo; I Ciampitti; A Correndo; F Bauschen; A Berardo & N Reussi Calvo. 2010. La Red de Nutrición de la Región CREA Sur de Santa Fe: Resultados y conclusiones de los primeros diez años 2000-2009. 62 p.
- Gee, GW & JW Bauder. 1986. Particle size analysis, in: Blake, G.R., Hartge, K.H. (Eds.) Methods of Soil Analysis, Part 1. physical and Mineralogical Methods – Agronomy monograph nº 9 (2nd Edition) E-Publishing Inc., American Society Agronomy, Madison, USA, 15, 383-411.
- Keeney, DR & DW. Nelson. 1982. Nitrogen inorganic forms. In: Page, A.L. et al. eds. Methods of soil analysis. Part 2. Agron. Monog 9 ASA and SSSA, Madison, WI. pp. 643-698.
- Magdoff, FR; D Ross & J. Amadon. 1984. A soil test for nitrogen availability to maize. Soil Sci. Soc. Am. J. 48:1301-1304.
- Nelson, DW & LE Sommers. 1973. Determination of total nitrogen in plant material. Agron. J. 65:109-112.
- Nelson, DW & LE Sommers. 1996. Total carbon, organic carbon, and organic matter. In Methods of Soil Analysis, Part 3, Chemical Methods, ed. D. L. Sparks, 961–1010. Madison, WI: ASA-SSSA.
- Sainz Rozas, H; HE Echeverria & H Angelini. 2011. Niveles de carbono orgánico y ph en suelos agrícolas de la región pampeana y extrapampeana argentina. Ci. Suelo 29:29-37.
- Sainz Rozas, H; H Echeverría; G Studdert & G Dominguez. 2000. Evaluation of the presidedress soil nitrogen test for no-tillage maize fertilized at planting. Agron. J. 92:1176-1183.
- Sainz Rozas, H; P Calviño; H Echeverría; M Redolatti & P Barbieri. 2008. Contribution of anaerobically mineralized nitrogen to reliability of planting or presidedress soil nitrogen test in maize. Agronomy journal 100:1020-1025.
- SAS INSTITUTE INC.1988. SAS/STAT Users Guide. Version 6.03 Edition. Cary, NC.
- Sharifi, M; BJ Zebarth; DL Burton; CA Grant; S Bittman; CF Drury; BG McConkey & N Ziadi. 2008. Response of potentially mineralizable soil nitrogen and indices of nitrogen availability to tillage system. Soil Sci. Soc. Am. J. 72:1124–1131.
- Studdert, GA & HE Echeverría. 2000. Crop rotations and nitrogen fertilization to manage soil organic carbon dynamics. Soil Sci. Soc. Am. J. 64: 1496-1503.




