Control de patógenos de fin de ciclo asociados en Soja
Compuestos Antifúngicos de origen vegetal para el control de patógenos de fin de ciclo asociados en Soja
Publicado: 15 de octubre de 2006
Por: Laura A. Svetaz, Rosanna N. Pioli, Susana A. Zacchino, Elisa Petenatti. Fac. Cs. Bioquímicas y Farmacéuticas U.N.R,
La soja (Glycine max L. Merr.) es una fuente primaria de aceite y de proteínas, y losproductos derivados son muy importantes en la formulación de nuevos alimentos de bajocosto, nutricionalmente balanceados y de alto contenido proteínico1. Desafortunadamente,la soja es frecuentemente afectada por infecciones fúngicas durante el cultivo y postcosecha,afectando severamente su productividad y comercialización2. Dada la grandiversidad de ambientes en los que la soja se cultiva, la importancia económica de estasenfermedades varía con cada región, con las distintas prácticas de manejo de granos, decultivos y con el agente causante de la enfermedad2. Condiciones climáticas de altahumedad y temperaturas superiores a 25ºC, durante el período de maduración yprecosecha del cultivo afectan a la madurez fisiológica y la sanidad de las semillas3. Ladisponibilidad y distribución de semillas con sanidad aceptable constituyen uno de losfactores más importantes para obtener una mayor productividad en el cultivo de soja; dadoque las semillas y los rastrojos infectados son la principal fuente de infección4. Laobtención de nuevos antifúngicos efectivos y de amplia actividad, menos tóxicos y segurospara el ambiente son aun necesarios para combatir las infecciones producidas por hongosfitopatógenos5. Las fuentes potenciales de metabolitos antifúngicos naturales son lasplantas de la flora autóctona. Zuccagnia punctata Cav. (Fabaceae, Caesalpinoideae,Caesalpinieae) es una especie monotípica de la región del centro y oeste de Argentina9,10seleccionada por la capacidad de inhibir el crecimiento de hongos fitopatógenos11. Elobjetivo del trabajo fue aislar e identificar compuestos antifúngicos de Zuccagnia punctataque inhiban a los hongos causales de Enfermedades de Fin de Ciclo (EFC) y otraspatologías relevantes en el cultivo de soja de Argentina6,7,8.
MATERIALES Y MÉTODOS
Material Vegetal:
Hojas y tallos pequeños de Z. punctata Cav. fueron recolectados en el DepartamentoBelgrano, Pcia. de San Luis, Argentina, en abril de 2001. El material vegetal fueidentificado por L. A Del Vitto y E. Petenatti y un voucher specimen fue depositado en elHerbario de la Universidad Nacional de San Luis (Del Vitto y Petenatti #9230, UNSL).
Extracción y Aislamiento:
Las partes aéreas secadas al aire (655 g) fueron molidas y sometidas a extraccionesrepetidas con EtOH a temperatura ambiente (3 x 800 ml, 24 hs cada una). Se juntaron losextractos y el solvente fue evaporado bajo presión reducida a 40ºC, dando 168 g de unextracto EtOH semisólido (25% p/p con respecto al material de partida seco).Una muestra de 40 g del extracto EtOH fue disuelto en 260 ml de EtOH / H2O 78:22 ysucesivamente particionado con n-Hexano (3 x 130 ml), CHCl3 (3 x 130 ml), y n- BuOH (4x 50 ml), para dar, luego de concentrar bajo presión reducida, 3,7 g de extracto hexánico,14.57 g de extracto clorofórmico, y 1.94 g de extracto butanólico.Una muestra de 1 g del extracto CHCl3 fue cromatografiado en Silica Gel 60H y eluídosucesivamente con CHCl3, CHCl3 / EtOAc, EtOAc, MeOH, MeOH / H2O, y H2O. Lasfracciones fueron analizadas por Cromatografía en Capa Delgada, con distintas fasesmóviles y usando luz UV o p-anisaldehido sulfúrico como agentes reveladores. Cadafracción fue concentrada hasta sequedad en vacío y ensayada para su actividadantifúngica. Repetidas columnas cromatográficas de las fracciones activas condujeron alaislamiento de tres compuestos conocidos (1, 2 y 3) y dos compuestos nuevos (4 y 5). Seestimó el rendimiento de extracción de cada uno de los compuestos. Las Chalconas 1(41.9 mg, 0.38% p/p en términos del material de partida seco) y 2 (16.4 mg, 0.15% p/p entérminos del material de partida seco) y la flavanona 3 ( 6.6 mg, 0.06% p/p en términos del material de partida seco) fueron identificados por comparación de sus datosespectroscópicos con aquellos reportados en la literatura12. El compuesto 4, 1-metil-3-(4′-hidroxifenil)-propil cafeato tuvo un rendimiento de 19.3 mg (0.17 % p/p en términos delmaterial de partida seco), y el compuesto 5, 1-metil-3-(3′,4′-dihidroxifenil)-propil cafeato unrendimiento de 17.9 mg (0.16 % p/p en términos del material de partida seco).
Microorganismos y Medio:
Los hongos utilizados para las pruebas antifúngicas fueron aislados de plantassintomáticas de diferentes cultivares y recolectadas en distintas localidades de las Pcias.de Santa Fe (Bigand, Casilda, Classon, Barrancas) y Buenos Aires (Pergamino, SanPedro), Argentina. Se evaluó la incidencia de las enfermedades y su localización en tallos,frutos y semillas. Los tejidos fueron desinfectados superficialmente con hipoclorito desodio al 2% durante un minuto. Los patógenos fueron aislados usando el test deincubación13 en las siguientes condiciones: Placas conteniendo medio de cultivo AgarPapa Glucosa Acidulado (APGA). La incubación se realizó durante 7 días a 25 ± 2 ºC, conalternancia de 12 h de luz cercana a UV y 12 h de oscuridad. Los aislamientos purosfueron repicados en medio Agar Papa Glucosa Acidulado (APGA), con 1.6% de glucosa y2% de ácido láctico (medio empobrecido con bajo porcentaje de glucosa) y en medio AgarAgua (AA), con 2% de agar (medio mínimo) a 25 ± 2 ºC para promover la fructificación14.Las colonias y cuerpos fructíferos fueron examinados en una lupa estereoscópica (×40,CETI, Belgium) y las esporas fueron examinadas usando un microscopio óptico (×400,×600 y ×1000), para poder ser caracterizados e identificados. La identidad de los hongosfue verificada de acuerdo a Barnet y Hunter15, Domsch16, y Nelson et al.17, y nombradosde acuerdo a Rossman et al.18 y Hawksworth et al.19. Los patógenos aislados fuerondepositados en el Centro de Referencia en Micología, FCByF.UNR.
Los siguientes aislamientos fúngicos fueron obtenidos de frutos y semillas de soja:
Phomopsis longicolla Hobbs (CE117-2001); Alternaria alternata (Fr.) Keissler (CE172-2001); Fusarium equisetti (Corda) Sacc (CE181-2001), Colletotrichum truncatum (Schw.)Andrus y W.D. Moore (CE175-2001), Aspergillus flavus, Nigrospora orizae. Un aislamientode Sclerotium bataticola Taub. (CE173-2001) obtenido de tallos de soja, y cuatroaislamientos de Fusarium graminearum (Schw.) (CE170-2001, CE171-2001, CE169-2001,y CE135-2001) también fueron evaluados.
Ensayos Antifúngicos:
La actividad antifúngica se determinó en base al Método de dilución en agar. Serealizaron diluciones de la muestra original y cada una fue inoculada con el hongo aprobar. Se determinó la concentración inhibitoria mínima (CIM), que es la menorconcentración de extracto o compuesto a la cual se inhibe el crecimiento delmicroorganismo. Tiene la ventaja de ser cuantitativo y poder ser usado tanto con muestrassolubles en agua como lipofílicas20 Durante el proceso, se hicieron diluciones sucesivasde los extractos y compuestos puros a partir de 1000 y 50 μg/ml respectivamente,y fueronincorporados dentro de medios de cultivo de acuerdo a los procedimientos reportados20, 21.Los extractos y compuestos puros con valores de CIM >1000 ó >50 μg/mlrespectivamente fueron considerados inactivos. Las suspensiones de esporas fueronobtenidas de acuerdo a los procedimientos reportados22 y ajustadas a 106 con habilidadde formar colonias /ml.
Las soluciones stock de extractos en dimetil sulfóxido (DMSO) fueron diluidas para dardiluciones seriadas que fueron agregadas a cada medio resultando en concentracionesque iban desde 0.24 a 1000 μg/ml (o 0.20-50 μg/ml para compuestos puros). Laconcentración final de DMSO en el ensayo no deberá exceder el 2%. Usando unamicropipeta, un inóculo de 5 μl de esporas o suspensión micelial fueron agregados a cadatubo conteniendo 500 μl de medio.
Los antifúngicos estrobirulinas Pyraclostrobin (MC Comet, BASF, Buenos Aires,Argentina) y Azoxystrobin (Amistar, Syngenta, Buenos Aires, Argentina) así como tambiénlos azoles metil benzimidazol-2-ylcarbamato (Carbendazim,Agar Cross, Rosario,Argentina) y ketoconazol (Sigma, MO) fueron incluidos en el ensayo como controlespositivos. Medio libre de droga fue usado como un control negativo. Las placas fueronincubadas por 48 ó 72 h, a 28 ºC (de acuerdo al control de crecimiento del hongo).
RESULTADOS Y DISCUSIÓN
El extracto EtOH de partes aéreas secas de Z. punctata mostró actividad frente a todoslos hongos evaluados, con CIMs entre 62.5 y 500 μg/ml, siendo N. orizae, P. longicolla yC. truncatum las especies más susceptibles.
Este extracto fue sucesivamente particionado entre n-Hexano, CHCl3 y n-BuOH, siendo elextracto clorofórmico el que mostró los menores valores de CIM frente a los hongospatógenos de soja; con valores entre 62.5 y 250 μg/ml. El fraccionamiento cromatográficodel extracto clorofórmico guiado por actividad, dio lugar al aislamiento de cincocompuestos puros, dos de ellos son nuevos ésteres del ácido caféico28.
La tabla 1 muestra las actividades antifúngicas (valores de CIM en μg/ml) de loscompuestos 1 al 5 aislados a partir de Z. punctata, frente a todos los hongos aislados.
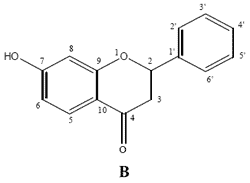
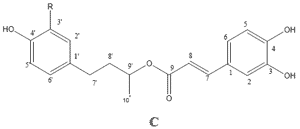
Tabla 1: Estructura y actividad antifúngica de los compuestos aislados de Z. punctata usando elmétodo de dilución en agar.
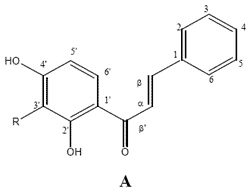
A.f.: Aspergillus flavus; N.o.: Nigrospora oryzae; P.l.1: Phomopsis longicolla (CE117); P.l.2: Phomopsis longicolla
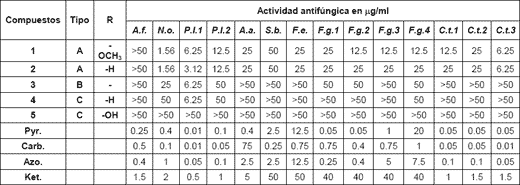
(M3); A.a.: Alternaria alternata (CE172); S.b.: Sclerotium bataticola (CE173); F.e.: Fusarium equiseti (CE181);F.g.1: Fusarium graminiarum (CE170); F.g.2: Fusarium graminiarum (CE171); F.g.3: Fusarium graminiarum(CE169); F.g.4: Fusarium graminiarum (CE135); C.t.1: Colletotrichum truncatum ( San Pedro); C.t.2:Colletotrichum truncatum (Casilda); C.t.3: Colletotrichum truncatum (Classon). (CE175)
1: 2',4'-dihidroxi-3'-metoxichalcona 2: 2',4'-dihidroxichalcona 3: 7-hidroxiflavanona 4: 1-Metil-3-(4'-hidroxifenil)-propilcafeato 5: 1-Metil-3-(3', 4'-dihidroxifenil)-propil cafeato; Pyr.: Pyraclostrobin; Carb.: Carbendazim; Azo.:Azoxystrobin. Ket.: Ketoconasol
Los datos indican que particularmente las dos chalconas (compuestos 1 y 2) tienenconsiderable actividad in vitro contra la mayoría de los hongos evaluados, con CIMs entre1,56 y 50 μg / ml. Los compuestos 3 y 4 mostraron actividades muy interesantes solofrente a P. longicolla (CIM= 6.25 μg / ml), mientras que el compuesto 5 no mostró ningunaactividad, con CIM > 50 μg / ml.
…Es interesante notar que cuatro de los cinco compuestos aislados a partir del extractoclorofórmico de Z. punctata desarrollaron muy buenas actividades (CIM ≤ 6.25 μg / ml)frente a P. longicolla. Este hongo es el agente causal del decaimiento y deterioro desemillas, una patología altamente severa que afecta la calidad y el rendimiento de lassemillas de soja23. En Argentina, este patógeno fue aislado y cuantificado en frutos ysemillas de soja industrial y verde (consumo fresco), a partir de diferentes localidades delárea de producción24, 25. Las semillas infectadas son arrugadas, resquebrajadas y deaspecto blancuzco. Cuando la soja madura en climas templado-húmedos y la cosecha es demorada, el decaimiento de semillas asociado con el tizón del tallo y de la vaina puededisminuir la viabilidad de las semillas24, 26.Ninguno de los extractos y compuestos fueron efectvos frente a A. flavus.Las chalconas 1 y 2 mostraron marcada actividad frente a Colletotrichum truncatum(CIM= 6.25 μg / ml). C. truncatum es el agente causal de la Antracnosis de soja yconstituye el complejo de EFC, infecta tallos y vainas disminuyendo el número y peso desus semillas.
C. truncatum y P. longicolla, EFC relevantes por su frecuencia y niveles de intensidad entejidos de soja14, 27, y Nigrospora orizae, patógeno de maíz y soja, fueron los hongos mássensibles a estos compuestos. Estos resultados proveen un punto de partida para laobtención de nuevos compuestos antifúngicas a partir de nuestra flora nativa28.
REFERENCIAS
1. Backman, P.A. Compendium of Soybean diseases, 3er ed. Sinclair & Backman (Eds.), American Phytopathological Society Press: Urbana, USA: 1989.
2. Ploper, L.D. Situación actual de las enfermedades de la soja en la Argentina. En: Resúmenes del Workshop en Mercosoja 99, Rosario, 21-25/6/99, p. 35.
3. Balducchi AJ, McGee DC, 1987. Environmental factors influencing infection of soybean seeds by Phomopsis and Diaporthe species during seed maturation. Plant-Disease, 71(3):209-212.
4. Garzonio DM, McGeeDC, 1983. Comparison of seeds and crop residues as sources of inoculum for pod and stem blight of soybeans. Plant-Disease, 67(12):1374-1376.
5. Ploper L.D. Management of economically important diseases of soybean in Argentina, Proceedings of the World Soybean Research Conference VI, Chicago, Ill, USA, 4-7/8/99, p.269
6. Castelli, M. V.; García Cortés, J. C.; Escalante, A. M.; Bah, M.; Pereda, R.; Ribas, J. C.; Zacchino, S. In vitro inhibition of 1,3-β-glucan synthasa by glycolipids from convolvulaceous. Planta Med. 2002, 68, 729-732.
7. Vila, R.; Mundina,M.; Tomi, F.; Furlán, R. L.; Zacchino, S. A.; Cassanova, J.; Cañigueral, S. Composition and antifungal activity of the essential oils of Solidago chilensis. Planta Med. 2002, 68, 164-167.
8. Escalante, A. M.; Santecchia, C.; López, S.; Gattuso, M.; Gutiérrez, A.; Delle Monache, F.; Gonzalez Sierra, M.; Zacchino, S. A. Isolation of antifungal saponins from Phytolacca tetramera, an Argentinean species in Critic Risk. J. Ethnopharm. 2002, 82, 29-34.
9. Zuloaga, F., Morrone, O. (eds.). Catálogo de las Plantas Vasculares de la República Argentina II. Missouri Botanical Garden Press, (St. Louis, USA), 1999, p.743.
10. Del Vitto, L., Petenatti, E., Petenatti, M. Herbal resourses of San Luis (Argentina), first part: Native plants. Multequina 1997, 6, 49-66. 11. Quiroga EN, Sampietro AR, Vattuone MA; Screening antifungal activities of selected medicinal plants, Journal of ethnopharmacology 74 (2001) 89-96.
12. Wollenweber, E.; Seigler, D. S. Flavonoids from Acacia neovernicosa. Phytochemistry 1982, 21, 1063-1066.
13. Hepperly, P. R.; Sinclair, J. B. Quality losses in Phomopsis- soybean seeds. Phytopathology 1978, 68, 1684- 1687.
14. Pioli, R.N., Benavidez, R., Morandi, E. N, Bodrero, M. Estudio epidemiológico de enfermedades asociadas a carpelos y semillas de soja en Santa Fe, Argentina, Fitopatología 2000,35, 111-118.
15. Barnett, H. L.; Hunter, B. B. Illustrated Genera of Imperfect Fungi, 4th Ed.; The American Phytopathological society, Ed.; APS Press: St. Paul, MN, 1999; p 218.
16. Domsch, K. H. Compendium of Soil Fungi. Academic Press: London, UK, 1980; Vol. 1., p 880.
17. Nelson, P. E.; et. al Fusarium. Manual for identification. Pennsyl St Univ Press: Washing, DC, 1983; p 193.
18. Rossman, A. Y.; Palm, M. E.; Spielman, L. J. Literature Guide for the Identification of Plant Pathogenic Fungi. The American Phytopathological Society, Ed. APS Press: St. Paul, MN, 1994; p 252.
19. Hawksworth, D. L.; Kirk, P. M.; Sutton, B. C.; Pegler, D. N. Dictionary of the Fungi. 8th ed.; International Mycological Institute of CAB International: Wallingford, UK, 1995; p 616.
20. Mitscher, L., Leu, R.., Bathala,M., Wu, W., Beal, J. Antimicrobial agents from higher plants. I. Introduction, rationale and methodology, Lloydia 1972, 35,157-166.
21. Zacchino, S., López, S., Pezzenati, G., Furlán, R., Santecchia, C., Muñoz, L., Giannini, F., Rodríguez, A., Enriz, R. In vitro evaluation of antifungal properties of phenylpropanoids, J. Nat. Prod. 1999, 62, 1353-1357.
22. Wright, L., Scott, E., Gorman, S. The sensitivity of mycelium, arthrospores and microconidia of Tricophyton mentagrophytes to imidazoles determined by in vitro tests. J. Antimicrobial Chemoterapy 1983,12, 317-327.
23. Athow, K. L. Soybeans: improvement, Production, and Uses, 2nd ed. Monogr. 16; Wilcox J. R. Ed.; American Society of Agronomy: Madison,WI, 1987; pp. 687-727.
24. Pioli, R. N.; Benavides, R; Morandi, E. N.; Estudio sobre la incidencia de patógenos en semillas de soja fresca para consumo humano. Fitopatología 1997, 32,116-120.
25. Pioli, R. N.; Morandi, E. N.; Martinez, M. C.; Lucca, M.F.; Tozini, A.; Bizarro, V.; Hopp, H. E: Morphological, molecular, and pathogenic characterization of D. phaseolorum variability in soybean producing area of Argentina. Phitopathología 2003, 93,136-146.
26. Kulik, M. M.; Sinclair, J. B. Compendium of soybean diseases; Hartman, G. L.; Sinclair, J. B.; Rupe, J. C., Eds.; APS Press: St.Paul, MN, 1999; pp 32-33
27. Henning, A.A., In: Patologia de sementes; Soave, J.; Da Silva Wetzel, M. M.; Eds.; Fundação Cargill: Campinas, Brazil, 1987; pp 441-454.
28. Svetaz, L; et al. Antifungal chalcones and new caffeic acid esters from Z. punctata. Journal of Agricultural and Food Chemistry. 2004, 52(11):3297-3300.
Temas relacionados:
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
