Carbón de la panoja (sporisorium reilianum f. Sp. Zeae) del maíz (zea mays l.)
Publicado: 1 de abril de 2021
Por: Roberto Luis De Rossi (Universidad Católica de Córdoba); Lucrecia Couretot (INTA Pergamino); Marta Monica Astiz Gasso (Universidad Nacional de la Plata); García, J. (Oro Verde); Samoiloff, A. (INTA Pergamino); Guerra, F.A.; Vuletic, E.; Plazas, M.C. & Guerra, G.D. (Universidad Católica de Córdoba). Argentina
Introducción
El maíz (Zea mays L.) es un cultivo susceptible a diferentes patologías que pueden desarrollarse a lo largo de su ciclo de crecimiento. En el mismo pueden generarse dos enfermedades que son denominadas con el nombre de carbón: el “carbón común del maíz”, causado por Ustilago maydis (DC.) Corda y el “carbón de la panoja del maíz”, causado por Sporisorium reilianum f. sp. zeae (Kühn) Langdon & Fullerton.
En Argentina, el carbón común (U. maydis) es el de mayor distribución y el que normalmente se encuentra, campaña tras campaña, en todas las regiones productoras de maíz (Hirschhorn, 1941; Astiz Gassó & Molina, 2010). En la actual campaña agrícola 2020/21, se ha detectado una reemergencia del carbón de la panoja en la zona sur de las provincias de Córdoba y Santa Fe.
Atentos a esta situación, y para empezar a generar trabajos de identificación, cuantificación y prevención de esta problemática, es que se publica este informe técnico, donde han participado en conjunto la Universidad Católica de Córdoba, Universidad Nacional de La Plata, Oro Verde, INTA Pergamino, SENASA Córdoba y SENASA Central, desde la Dirección de Información Estratégica Fitosanitaria.
La enfermedad
Esta enfermedad recibe el nombre de “carbón de la panoja”, por generar en el cultivo de maíz una sintomatología que llama la atención fácilmente al desarrollar cambios notorios en la estructura floral masculina (panoja). Sin embargo, se debe tener en cuenta que sus síntomas pueden desarrollarse tanto en la panoja como en la estructura floral femenina (espiga). De la misma manera es denominada en inglés como “head smut”, y en portugués como “carvão do pendão” o “carvão do topo”, haciendo referencia a lo anteriormente explicado. La misma ha sido un problema serio desde la década de 1970 en EE.UU., México, Australia, China, Sudáfrica y Francia (Stromberg, 1981; Bernardo et al., 1992; Jin et al., 2000; CABI, 2021), y en Brasil suele encontrarse en las regiones productoras de maíz del sur del país (Reis et al., 1996).
El carbón de la panoja en Argentina, es una enfermedad declarada en Sistema Nacional de Vigilancia y Monitoreo de plagas (SINAVIMO) como Sporisorium reilianum. Los primeros registros y antecedentes de la presencia de este patógeno en nuestro país, fueron realizados y publicados entre 1935 y 1941, por la Dra. Elisa Hirschhorn, en la que menciona y describe como “Sorosporiumreilianum” (syn= Sporisorium reilianum) afectando al cultivo de maíz (Zea mays) en diferentesprovincias del país (Hirschhorn & Hirschhorn, 1935; Hirschhorn, 1941).
Desde ese trabajo en adelante, las subsiguientes citas que mencionan a este patógeno en Argentina, lo hacen en términos generales y/o con su asociación a los cultivos de maíz y sorgo, con diversa fuente registral, sin volver a detallarse o registrarse estudios específicos de hallazgos a campo de esta enfermedad (Sarasola et al.,1981; Giorda, 2002; Carmona et al., 2007).
Es así que, desde hace aproximadamente 75 años, no se habían reportado en nuestro país nuevas informaciones sobre S. reilianum afectando al cultivo de maíz. El actual surgimiento de la enfermedad pone en alerta al sector productivo, principalmente porque una planta de maíz afectada por este patógeno es una planta con pocas a nulas probabilidades de generar granos viables (Hirschhorn, 1941; Ali & Baggett, 1990) y, además, esta enfermedad puede, indirectamente, afectar el valor de los granos por estar sujeta a restricciones de importación por algunos países (Jackzon-Ziems, 2014).
Síntomas y daño
Los síntomas del carbón de la panoja son visibles durante la etapa de floración en el desarrollo de las panojas y las espigas, a pesar de que el patógeno infecta la raíz durante la germinación y primeras etapas de desarrollo de la plántula (Martínez et al., 2000; Martínez et al., 2002; Zhao et al., 2015). El micelio infectivo invade sistémicamente los tejidos, hasta llegar al meristema apical (Frederiksen & Reyes, 1980; Martínez et al., 1999; Zhao et al., 2015). Las panojas (Imagen 1), así como las espigas (Imagen 2) infectadas son sustituidas por soros de carbón, en algunos casos se puede observar filodia (transformación de órganos de la planta en hojas modificadas) (Imagen 3). Los soros son cubiertos por una membrana, que más tarde se rompe exponiendo una masa de teliosporas. Las espigas se tornan esféricas con los granos transformados en soros. Los elementos vasculares con aspecto fibroso, permanecen relativamente intactos a medida que las teliosporas son liberadas. Ocasionalmente pueden encontrarse espigas donde se desarrollaron algunos granos. Generalmente las plantas infectadas pueden presentar multifloración y disminución de tamaño (Imagen 4).
El daño principal es ocasionado durante la etapa de floración, cuando el micelio establecido en el meristema produce soros que reemplazan a los granos en la panoja y espiga. Al madurar, los soros liberan las teliosporas, que caen al suelo, y el aire las transporta a cortas distancias (Montes & Díaz, 2006; Ghareeb et al., 2011). El daño producido está directamente relacionado a la cantidad de plantas que se infectaron, ya que aquellas plantas afectadas normalmente no son productivas (Ali & Baggett, 1990).
Imagen 1. Panojas de maíz con síntomas de masa carbonosa producida porS. reilianum.
Fotos: De Rossi & Couretot, 2021. Corral de Bustos, Córdoba y Chañar Ladeado, Santa Fe.

Imagen 2. Espigas de maíz con síntomas de masa carbonosa producida porS. reilianum.
Fotos: De Rossi, Couretot,& García 2021. Corral de Bustos y Sampacho, Córdoba.

Imagen 3. Síntomas de filodia en espigas y panojas de maíz causados porS. reilianum.
Fotos: De Rossi & Couretot, 2021. Corral de Bustos, Córdoba y Chañar Ladeado, Santa Fe.

Imagen 4. Multifloración, masas carbonosas y cambios en el desarrollo de plantas afectadaspor S. reilianum.
Fotos: De Rossi & Couretot, 2021. Corral de Bustos, Córdoba y Chañar Ladeado, Santa Fe.

Etiología y taxonomía
El carbón de la panoja es causado por el hongo biotrófico Basidiomiceto Sporisoriumreilianum f. sp. zeae (Kühn) Langdon & Fullerton, sinónimos Sorosporium reilianum (Kühn)McAlpine; Sphacelotheca reiliana (Kühn) Clinton; Ustilago reiliana Kühn.
Sobre el aspecto de variabilidad fisiológica, recientemente han sido descriptas dos formas especiales (f. sp.) de este patógeno. Una que infecta al sorgo (S. reilianum f. sp. reilianum) y que presenta cuatro razas fisiológicas, y otra forma especial que infecta solamente al maíz y no presenta razas fisiológicas (S. reilianum f. sp. zeae) (Poloni & Schirawski, 2016).
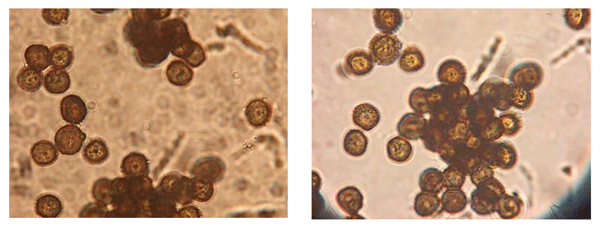
Los teliosporos de S. reilianum son de coloración parda-rojiza a negra, con pared celular densa y equinulada, globosos, midiendo de 9 a 12 m de diámetro (Imagen 5). Germinan formando un basidio de cuatro células (promicelio septado) que sostiene basidiosporos pequeños, hialinos, con paredes finas, unicelulares, haploides y midiendo de 7 a 15 m. La infección de las plántulas ocurre a través de penetración directa del promicelio, o de la hifa de infección binucleada originada de la fusión de basidiosporas de tipo compatibles (Martinez et al., 2002).
Imagen 5. Teliosporas deS. reilianum.Observación en microscopio 40x.
Fotos: De Rossi & Couretot, 2021. Corral de Bustos, Córdoba.
Ciclo y epidemiología
El hongo S. reilianum f. sp. zeae es considerado un hongo de suelo, porque las teliosporas sobreviven en él, y se constituyen así en la principal fuente de inóculo (Lübberstedt et al., 1999). El agente causal, es un hongo fitopatógeno dimórfico, que presenta una fase saprofítica haploide y una fase parasítica diploide. El ciclo de la enfermedad inicia cuando las teliosporas presentes en espigas y panojas son diseminadas por el viento y lluvia, para finalmente depositarse en el suelo (Martinez et al., 2001), en donde sobreviven hasta cinco años (Matyac & Kommedahl, 1985b). El hongo infecta al maíz únicamente durante la emergencia de las plántulas, por medio de las teliosporas presentes en el suelo (Xu et al., 1999). El micelio infectivo penetra las raíces de las plántulas de maíz, por esta razón, en etapas tempranas de la infección hay una proliferación de hifas alrededor de la raíz (Martinez et al., 2001). El micelio crece sistémicamente con el meristema, terminando por invadir los tejidos florales cuando todavía no se han diferenciado, y luego de la esporogénesis, las inflorescencias son reemplazadas total o parcialmente por soros negros colmados de teliosporas (Xu et al., 1999). Las teliosporas también pueden estar presentes infestando las semillas, y, a pesar de que éstas no son consideradas una fuente de inóculo de gran relevancia cuando la enfermedad ya está presente en una región, es de fundamental importancia para su diseminación e introducción en nuevas áreas. Los factores ambientales que favorecen la infección incluyen suelo seco (humedad de 15 a 25 % peso/peso) con temperaturas de 23 a 30 °C (Martinez et al., 2000). La incidencia de la enfermedad disminuye con la aplicación de urea, sulfato de amonio, superfostato triple y nitrato de calcio (Popov, 1968). La morfología y el ciclo de vida de S. reiliana es semejante a U. maydis, sin embargo, S. reiliana puede ser distinguido por iniciar suciclo de vida infectando al maíz en los estadios de plántula vía el suelo.
Manejo
Debido a que el inóculo se encuentra en el suelo, las estrategias de manejo se enfocan en evitar la infección durante el desarrollo de la plántula. Para esto, se utilizan estrategias preventivas como: i) tratamiento de semilla con fungicidas, en otros países son utilizados: carbendazim, tiabendazol, tebuconazol, tebuconazol + thiram, propiconazol, propiconazol + triadimenol, triadimenol, flutriafol + imazalil, sedaxane, azoxistrobina + fludioxonil + mefenoxan + tiabendazol (Stienstra et al., 1985; Pradhanang & Ghimire, 1996; Wright et al., 2006; Intagri, 2017; Purvis & Price, 2017); ii) prácticas de manejo culturales, como rotación de cultivos por 2 - 5 años, aplicación de fertilizantes como urea, sulfato de amonio y superfostato triple (Mack et al., 1984; Matyac & Kommedahl, 1985a) y, iii) obtención de resistencia del hospedante (Baggett & Koepsell, 1983; Stromberg et al., 1984; Song et al., 2000; Aquino et al., 2011), siendo esta última, la estrategia más conveniente al evitar daños y reducir costos de producción. Entre los estudios efectuados para identificar genotipos resistentes al carbón de la espiga se destacan los realizados en Sudáfrica (Krüger, 1962), EE.UU. (Baggett & Koepsell, 1983), Kenya (Njuguna & Odhiambo, 1989), Francia (Lübberstedt et al., 1999) y China (Duan et al., 1992; Wang et al., 2008). Aun cuando existen líneas de maíz que presentan variaciones en la susceptibilidad a S. reilianum, y que se han utilizado para mapear numerosos QTLs (loci de rasgos cuantitativos) de resistencia a S. reilianum (Chen et al., 2008), hasta el momento sólo un gen de resistencia de maíz es efectivo frente S. reilianum (Zuo etal., 2015).
Estado de situación
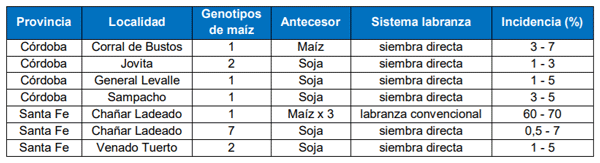
Hasta el momento, febrero del 2021, esta enfermedad se ha determinado en las provincias de Córdoba y Santa Fe, específicamente en las localidades de Corral de Bustos, Jovita, General Levalle, Chañar Ladeado, Venado Tuerto y Sampacho. Se observó sobre diferentes genotipos y en lotes con diferentes manejos (antecesor soja, antecesor maíz, fechas de siembra de octubre y noviembre) (Tabla 1). En la mayoría de los casos, la incidencia (número de plantas afectadas) se encuentra entre el 0,5 y el 7 %. Pero llamó la atención un caso donde se registró a la enfermedad en aproximadamente el 60-70 % de las plantas. Esta situación se dio en un lote de monocultivo de maíz por tres años consecutivos y de labranza convencional. Al momento, la hipótesis de la reemergencia de esta enfermedad estaría basada en la introducción de inóculo vía semillas en los últimos años.
En Argentina, aún no se han llevado adelante trabajos específicos para su precisa identificación, pero por sintomatología característica y morfología de estructuras fúngicas, se determinó que estamos en presencia de esta enfermedad. A pesar de ello, estudios de identificación molecular deberán ser llevados a cabo para el conocimiento y aseveración de especie y posibles razas presentes, así como también, de diferenciación de comportamientos de distintos híbridos frente a esta enfermedad.
Tabla 1. Información relevada sobreS. reilianumdurante la campaña 2020/21.
Recomendaciones de manejo para la actual campaña:
El inóculo de la enfermedad queda en el suelo y se puede incrementar año a año. Por ello, revise/monitoree los lotes, busque síntomas característicos y diferencie entre los dos carbones del cultivo (ver Anexo). Para evitar la dispersión de la enfermedad, se recomienda:
- Localizar plantas afectadas, extraerlas evitando dispersar teliosporas y eliminarlas(quemarlas).
- Limpiar y desinfectar la cosechadora, tanto al ingreso como a la salida de lotes conpresencia de la enfermedad.
- En caso de dudas, solicitar asesoramiento a la Universidad, INTA o SENASA más cercano.
- Se invita a realizar la siguiente encuesta para censar la situación de ausencia o presencia de la enfermedad en su zona: https://forms.gle/HKydaBrPuTj1QGHJ8
Recomendaciones de manejo para la próxima campaña:
- Realizar rotación de cultivos, no sembrar maíz en lotes afectados por lo menos por dos-cinco años, para evitar nuevas infecciones.
- Realizar tratamiento de semilla con productos eficientes para el control deS. reilianum.
- Utilizar materiales de mejor comportamiento frente a esta enfermedad. Esta es unaimportante medida a tomar, aunque seguramente no estará disponible en el corto plazo.
Agradecimiento: destacamos y agradecemos el trabajo en conjunto realizado junto a SENASACórdoba y SENASA Central, desde la Dirección de Información Estratégica Fitosanitaria.
Anexo
Para poder diferenciar a los dos carbones que afectan al cultivo de maíz, ponemos a disposición imágenes del carbón común causado por U. maydis (Imagen 6) y tabla comparativa de las características del carbón común con el carbón de la panoja causado por S. reilianum (Tabla 2).
Tabla 2. Diferencias entre el carbón común y el carbón de la panoja de maíz.
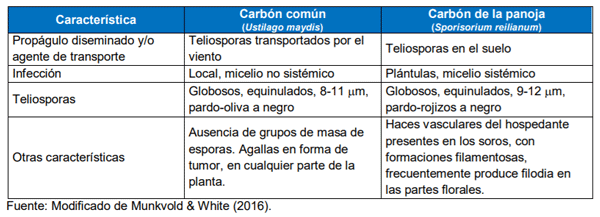
Imagen 6. Síntomas de soros con masas carbonosas en espiga y en hojas afectadas porUstilago maydis.
Fotos: De Rossi, 2021. Córdoba.

- Ali, A. & Baggett, J.R. (1990). Inheritance of resistance to head smut disease in corn. J. Amer. Soc. Hort. Sci. 115(4):668-672. Aquino-Martínez, J.G.; Sánchez-Flores, A.; González-Huerta, A. & Sánchez-Pale, J.R. (2011). Resistencia de variedades e híbridos de maíz (Zea mays L.) a Sporisorium reilianum y su rendimiento de grano. Revista Mexicana de Fitopatología. 29:39-49.
- Astiz Gassó, M.M. & Molina, M. del C. (2010). MANAGENENT OF FUNGAL PLANT PATHOGENS 2010 Capítulo 11: Physiological specialization of Ustilaginales (smut) of género Bromus, Zea and Triticum in Argentina. Págs. 138-146. CAB International 2010 (Eds. A. Arya & A.E. Perelló). SBN: 81-7233-468-0 Pág.388.
- Baggett, J.R. & Koepsell, P.A. (1983). Field inoculation of sweet corn with the head smut pathogen (Sphacelotheca reiliana). HortScience 18:67-68.
- Bernardo, R.; Bourrier, M. & Oliver, J.L. (1992). Generation means analysis of resistance to head smut in maize. Agronomie 12: 303-306. https://doi.org/10.1051/agro:19920403
- CABI, 2021. Sphacelotheca reiliana (head smut of maize) (cabi.org). https://www.cabi.org/isc/datasheet/50937
- Carmona, M. A.; Reis, E. M. & Trezzi Casa, R. (2007). Identificación y manejo de las principales enfermedades del maíz. Ed. Horizonte A. Págs: 44.
- Chen, Y.; Chao, Q.; Tan, G.; Zhao, J.; Zhang, M.; Ji, Q. & Xu, M. (2008). Identification and fine-mapping of a major QTL conferring resistance against head smut in maize. Theor. Appl. Genet. 117, 1241–1252.
- Duan, Y.Z.; Li, X.X.; Ai, F.Z.; Yang, J.H. & Li, F.M. (1992). Selection and identification on resistance resource of corn head smut of Shanxi Province. Acta Agriculturae Boreali-occidentalis Sinica. 1:83-86.
- Frederiksen, R.A. & Reyes, L. (1980). The head smut program at Texas A&M. p. 367-372. In: Williams, R. J., R. A. Frederiksen, L. K. Mughogho & G. D. Bengston (eds). Sorghum Diseases: A World Review. ICRISAT. Patancheru, A. P. India
- Ghareeb, H.; Becker, A.; Iven, T.; Feussner, I. & Schirawski, J. (2011). Sporisorium reilianum infection changes inflorescence and branching architectures of maize. Plant Physiology. 156: 2037-2052. DOI: 10.1104/pp.111.179499
- Giorda, L. (2002). Sorghum Diseases in Argentina. - Página/s: 389-391.
- Hirschhorn, E. & Hirschhorn, J. (1935) Los carbones del maíz en la Argentina. Caracteres sistemáticos genéticos y parasitarios. Revista de la Facultad de Agronomía, ISSN 0041-8676, ISSN-e 1669-9513, Vol. 20, Nº. 2, págs. 108-139.
- Hirschhorn, E. (1941). Las especies de Sorosporium de la flora argentina. Revista del Museo de La Plata 1941 Vol.3 pp.335-354 pp. Jackson-Ziems, T.A. (2014). Smut diseases of corn. Neb Guide. University of Nebrasca-Lincoln Extension. Institute of Agriculture and Natural Resources. http://extension.unl.edu/publications.
- Jin, Q.M.; Li, J.P.; Zhang, X.W., Wang, G.X.; Song, S.Y.; Liu, Y.C. & Wang, L.X. (2000). Establishment IPM of system of corn dis eases and pest insects in the spring corn belt. J. Maize Sci. 8:84-88.
- Krüger, W. (1962). Sphacelotheca reiliana on maize. I. Infection and control studies. South African Journal of Agricultural Science. 5:43-56.
- Lübberstedt, T.; Xia, X.C.; Tan, G.; Liu, X. & Melchinger, A.E. (1999). QTL mapping of resistance to Sporisorium reiliana in maize. Theoretical and Applied Genetics. 99:593-598.
- Mack, H.J., Baggett, J.R. & Koepsell, P.A. (1984). Effects of cultural practices on the incidence of head smut in sweet corn. HortScience 19:77-78.
- Martinez, C.; Buée, M.; Jauneau, A.; Bécard, G.; Dargent, R. & Roux, C. (2001). Effects of a fraction from maize root exudates on haploid strains of Sporisorium reilianum f.sp. zeae. Plant and Soil 236: 145–153. https://doi. org/10.1023/A:1012776919384
- Martínez, C.A.; Jauneau, C.; Roux, C., Savy, C. & Dargent, R. (2000). Early infection of maize roots by Sporisorium reilianum f. sp. zeae. Protoplasma 213:83-92.
- Martínez, C.A.; Roux, A.; Jauneau, A. & Dargent, R. (2002). The biological cycle of Sporisorium reilianum f. sp. zeae: an overview using microscopy. Mycologia 94:505-514. http://dx.doi.org/10.1080/15572536.2003.11833215
- Martínez, C.A.; Roux, C. & Dargent, R. (1999). Biotrophic development of Sporisorium reilianum f. sp. zeae in vegetative shoot apex of maize. Phytopathology 89:247-253. http:// dx.doi.org/10.1094/PHYTO.1999.89.3.247
- Martínez-Ramírez, J.L. & Ledesma-Medrano, J. (1990). Control químico del carbón de la espiga Sphacelotheca reiliana (Kühn) Clint. del maíz, en el Valle de Zapopan, Jalisco. México. Revista Mexicana de Fitopatología. 8:68-70.
- Matyac, C.A. & Kommedahl, T. (1985a). Factors affecting the development of head smut caused by Sphacelotheca reiliana on corn. Phytopathology 75:577-581.
- Matyac, C.A. & Kommedahl, T. (1985b). Occurrence of chlorotic spots on corn seedlings infected with Sphacelotheca reiliana and their use in evaluation of head smut resistance. Plant Disease. 69:251-254. DOI: 10.1094/PD-69-251.
- Montes, G.N. & Díaz, A.F. (2006). Fitopatología. p. 192-213. In: Campo Experimental Río Bravo: 50 años de Investigación Agropecuaria en el Norte de Tamaulipas, Historia, Logros y Retos. Rodríguez del Bosque, L. A. (ed). Libro Técnico No. 1, INIFAP. Río Bravo, Tamaulipas, México.
- Munkvold, G.P. & White, D.G. (2016). Compendium of Corn Diseases (4th ed.), American Phytopathological Society, St. Paul, MN. Njuguna, JGM. & Odhiambo, R.O. (1989). Head smut distribution, expression and genetic resistance of maize to Sphacelotheca reiliana in Kenya. East African Agricultural and Forestry Journal. 55:81-83.
- Poloni, A. & Schirawsi, J. (2016). Host specificity in Sporisorium reilianum is determined by distinct mechanisms in maize and sorghum. Molecular plant pathology 17(5):741-754.
- Popov, A. (1968). Sphacelotheca reiliana infection on maize grown in monoculture. Rev. Appl. Mycol. 47:623.
- Pradhanang, P.M. & Ghimire, S.R. (1996). Fungicide management of maize head smut (Sphacelotheca reiliana) by seed treatment. Trop. Agric. 73:325-328.
- Purvis, M. & Price, T. (2017). Seed treatments, in-furrows sprays and granular fungicide options. Field crops. Lousiana State University. 43_seed treatments field crops 2019 kppdf.pdf (lsuagcenter.com)
- Quezada-Salinas, A.; Moreno-Velázquez, M.: De León-García de Alba, C.; Nava-Díaz, C.; Solano-Báez, A.R. (2017). Genetic resistance to Sporisorium reilianum f. sp. zeae in selected maize (Zea mays L.) lines with white and yellow endosperm. Revista Mexicana de Fitopatología 35(3): 534-548. DOI: 10.18781/R.MEX.FIT.1705-2.
- Reis, E.M. & Casa, R.T. (1996). Manual de identificação e de controle de doenças do milho. Passo Fundo. Aldeia Norte Editora, 80p. Sarasola, A. A.; Rocca de Sarasola, M. A. (1981). Enfermedades y daños sobre maíz, sorgo y girasol en la Argentina. Hemisferio Sur. Song, S.Y.; Sun, X.H.; Guo, W.G. & Liu, J.R. (2000). Identification of germplasm for resistance to head smut in maize. Agric.Sci. Jilin 25:32-33.
- Stienstra, W.C.; Kommedahl, T.; Stromberg, E.L.; Matyac, C.A.; Windels, C.E. & Morgan, F. (1985). Suppression of Corn head smut with seed and soil treatments. Plant Disease. 69:301-302.
- Stromberg, E.L. (1981). Head smut of maize, a new disease in Minnesota. Phytopathology 71:906
- Stromberg, E.L.; Stienstra, W.C.; Kommedahl, T.; Matyac, C.A.; Windels, C.E. & Geadelman, J.L. (1984). Smut expression and resistance of corn to Sphacelotheca reiliana in Minnesota. Plant Disease. 68:880-884.
- Wang, Z.H.; Li, X.H.; Xie, C.X.; Li, M.S.; Hao, Z.F.; George, M.L.C.; Xiao, M.J.; Gao, S.R. & Zhang, S.H. (2008). Genetic diversity in a collection of chinese maize inbred lines for resistance to head smut caused by Sporisorium reiliana. Maydica 53:47-54.
- Wright, P.J.; Fullerton, R.A. & Koolaard, J.P. (2006). Fungicide control of head smut ( Sporisorium reilianum) of sweetcorn (Zea mays). New Zealand Journal of Crop and Horticultural Science. 34:23-26.
- Xu, M.L.; Melchinger, A.E. & Lübberstedt, T. (1999). Species specific detection of the maize pathogens Sporisorium reiliana and Ustilago maydis by dot blot hybridization and PCR-based assays. Plant Disease 83: 390–395. https://doi.org/10.1094/pdis.1999.83.4.390
- Zuo, W.L.; Chao, Q.; Zhang, N.; Ye, J.R.; Tan, G.Q.; Li, B.L.; Xing, Y.X.; Zhang, B.Q.; Liu, H.J.; Fengler, K.A.; Zhao, J.; Zhao, X.R.; Chen, Y.S.; Lai, J.S.; Yan, J.B. & Xu, M.L. (2015) A maize wall-associated kinase confers quantitative resistance to head smut. Nat. Genet. 47, 151–157.
Temas relacionados:
Autores:



Recomendar
Comentar
Compartir
7 de abril de 2021
Con las sugerencias en el manejo cultural, para la próxima campaña agricola, se podrían evitar trtamientos costosos e inoportunas.
1-Realizar rotación de cultivos, no sembrar maíz en lotes afectados por lo menos por dos-cinco años, para evitar nuevas infecciones.
2- Realizar tratamiento de semilla con productos eficientes para el control de S. reilianum.
3- Utilizar materiales de mejor comportamiento frente a esta enfermedad. Esta es una importante medida a tomar, aunque seguramente no estará disponible en el corto plazo.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Usuarios destacados en Agricultura

Miguel Ángel Taboada  Instituto Nacional de Tecnología Agropecuaria - INTA
Instituto Nacional de Tecnología Agropecuaria - INTA

Investigación, director del Instituto de Suelos del INTA
Estados Unidos de América
Estados Unidos de América

Dr. Ramon León González  North Carolina State University - NCSU
North Carolina State University - NCSU

Investigación / Profesor asociado, biología y ecología de malezas
Estados Unidos de América
Estados Unidos de América

Prof. Luis Ávila  Mississippi State University
Mississippi State University

Profesor Asociado / Investigador
Estados Unidos de América
Estados Unidos de América







