Efecto de los cultivos de cobertura sobre la diversidad funcional bacteriana del suelo
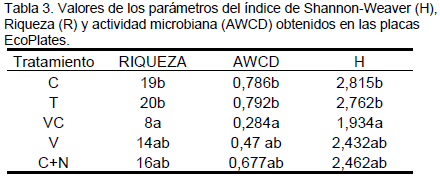
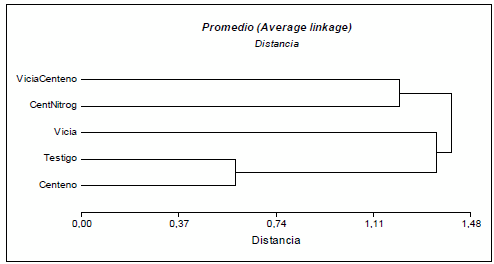
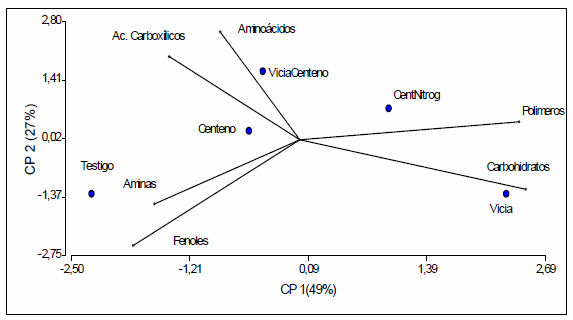
Los sistemas de laboreo que incluyen la utilización de cultivos de cobertura se convirtieron en una alternativa viable en la región semiárida Argentina por el aporte de materia orgánica que generan, mejoran la fertilidad física y química e incrementan la actividad biológica del suelo, los cuales están involucrados en los ciclos de los nutrientes. El objetivo del presente trabajo fue evaluar el efecto de la utilización de cultivos de cobertura sobre la diversidad funcional y estructural microbiana del suelo y en particular las bacterias solubilizadoras de fósforo (BSP). Los tratamientos evaluados correspondieron a los siguientes sistemas 1) Testigo 2) Centeno 3) Vicia 4) Vicia/Centeno y 5) Centeno fertilizado con nitrógeno. Para evaluar la diversidad funcional y estructural microbiana del suelo se empleó el sistema Biolog Ecoplate mediante el índice de Shannon-Waever (H), el desarrollo promedio de color (AWCD) y la Riqueza (R). Estos atributos fueron significativamente mayores para el tratamiento con centeno y para el testigo respecto al tratamiento que combinaba vicia con centeno. El análisis del dendograma mostró una gran similitud de perfiles para los tratamientos centeno y testigo y entre los tratamientos con vicia/centeno y centeno con fertilización nitrogenada. Las poblaciones bacterianas del suelo que combina vicia y centeno se diferencian del cultivo de centeno, sin embargo, el tratamiento que presenta solo vicia se asemeja a ambos tratamientos. El análisis de la estructura de la comunidad microbiana nos permitió detectar cambios de la comunidad inducidos por la presencia de centeno. El análisis de la comunidad microbiana a partir del nivel fisiológico (CLPP) permitió discriminar entre tratamientos basándose en el consumo diferencial de fuentes carbonadas. El parámetro BSP no mostró ser un indicador que pueda diferenciar entre tratamientos
PALABRAS CLAVE: Cultivo cobertura; biolog ecoplate; diversidad microbiana
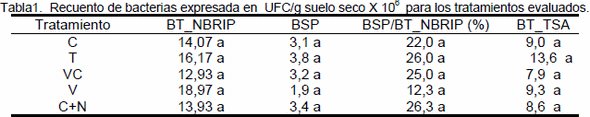
La densidad bacteriana no mostró variaciones importantes para los sistemas de manejo evaluados, como podemos observar en la tabla 1 el análisis de la varianza no detectó diferencias significativas entre tratamientos para el recuento de bacterias totales en medio NBRIP y TSA, BSP y para la relación BSP/BT_NBRIP (en porcentaje). Similares resultados fueron reportados por otros autores, por ejemplo Poonguzhali y colaboradores (2006) al estudiar el efecto de las prácticas de manejo sobre la comunidad microbiana asociada a la rizósfera de Chinese cabbage, encontraron que el número de bacterias cultivables no fue afectado por los diferentes tipos de usos. El número de PSB es diez veces más bajo que el número total de bacterias en medio NBRIP, estos resultados concuerdan con los obtenidos por los autores, Kucey (1983) y Santa Regina y colaboradores (2003).
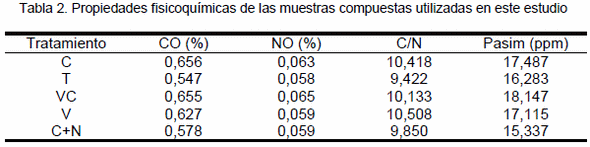
según el test de la mínima diferencia significativa (LSD) al 5% de probabilidad.
La pérdida de diversidad de cultivos debería ocasionar una reducción en la cantidad y calidad de los exudados radiculares pudiendo modificar la abundancia, actividad y diversidad de la comunidad microbiana (Hooper et al., 2000, Loranger-Merciris, et al. 2006). Sin embargo en nuestro ensayo el tratamiento con mayor diversidad de cultivos (Vicia/Centeno) fue la combinación que presentó los valores más bajos de diversidad, riqueza y actividad microbiana (AWCD). Posiblemente ello se debe a que este sistema presenta una mejor cobertura del suelo, impidiendo el establecimiento de malezas, que son probablemente las causantes en el resto de los tratamientos de la mayor actividad microbiana del suelo.
- Acosta-Martínez, V; L Cruz; D Sotomayor-Ramírez & L Pérez-Alegría. 2007. Enzyme activities as affected by soil properties and land use in a tropical watershed. Applied Soil Ecology 35(1): 35-45.
- Beniítez, E; R Nogales; M Campos & F Ruano. 2006. Biochemical variability of oliveorchard soils under different management systems. Appl. Soil Ecol. 32: 221-231.
- Doran, JW & MR Zeiss. 2000. Soil health and sustainability: managing the biotic component of soil quality. App. Soil Ecol. 15: 3-11.
- Du Pont, ST; H Ferris & M Van Horn. 2009. Effects of cover crop quality and quantity on nematode-based soil food webs and nutrient cycling. Appl. Soil Ecol. 41: 157-167.
- Chabot, R; Beauchamp, C J; Kloepper, J W & Antoun, H. 1998. Effect of phosphorus on root colonization and growth promotion of maize by bioluminescent mutants of phosphate-solubilizing Rhizobium leguminosarum biovar phaseoli. Soil. Biol. Biochem. 30, 1615–1618.
- Fang,M; RJ Kremer; PP Motavalli & G Davis. 2005. Bacterial Diversity in Rhizospheres of Nontransgenic and Transgenic Corn. App. Environ. Microbio. 71(7): 4132–4136.
- Fernández, L; Zalba, P; Gómez, M; Sagardoy, M. 2007. Phosphate-solubilization activity of bacterial strains in soil and their effect on soybean growth under greenhouse conditions. Biol Fertil Soils. 43: 805–809.
- Garland, JL & AL Mills. 1991. Classification and characterization of heterotrophic bacterial communities on the basis of patterns of community-level sole-carbon-source utilization. Appl. Environ. Microbiol. 57: 2351-2359.
- Gomez, E; J Garland & M Monti. 2004. Reproducibility in the response of soil bacterial community-level physiological profiles from land use intensification gradient. Appl. Soil Ecol. 26: 21-30.
- Gupta, R D; Bherdwaj, K R; Morwan, B C &Tripathi, B R. 1986. Occurrence of phosphate dissolving bacteria in soils of North-West Himalayas under biosequence and climosequence. J. Indian Soc. Sci. 34, 498–504.
- Hooper, DE; VK Bignell; L Brown; JM Brussaard; DH Dangerfield; DA Wall et al., 2000. Interactions between aboveground and belowground biodiversity in terrestrial ecosystems: patterns, mechanisms, and feedbacks. BioScience, 50: 1049-1061.
- Santa-Regina, I; Peix, A; Díaz, T; Rodríguez-Barrueco, C & E. Velásquez. 2003. Effects of plant community composition on total soil microbiota and on phosphate-solubilizing bacteria of ex-arable lands. First International Meeting on Microbial Phosphate Solubilization. Developments in Plant and Soil Sciences. Ed. Velázquez, E. Rodríguez-Barrueco, C. Springer Netherlands. 2007. 102: 277-280.
- Subba-Rao, N S. 1982. Phosphate solubilization by soil microorganisms. In Advances in Agricultural Microbiology. Ed. Subba-Rao N S. Butterworth Sci, pp. 295–305. London.
- Kucey R M N. 1983. Phosphate solubilizing bacteria and fungi in various cultivated and virgin Alberta soils. Can. J. Soil
- Sci. 63, 671–678.
- Loranger-Mercirisa, G; L Barthes; A Gastine & P Leadley. 2006. Rapid effects of plant species diversity and identity on soil microbial communities in experimental grassland ecosystems. Soil Biology and Biochemistry. Volume 38, Issue 8, August 2006, Pages 2336-2343
- Lupwayi, NZ; KG Hanson; KN Harker; GW Clayton; RE Blackshaw; JT O’Donovan et al., 2007. Soil microbial biomass, functional diversity and enzyme activity in glyphosate-resistant wheat–canola rotations under low-disturbance direct seeding and conventional tillage. Soil Biol. & Bioch. 39: 1418 -1427.
- Nahas, E. 1996. Factors determining rock phosphate solubilization by microorganisms isolated from soil. World J. Microbiol.
- Biotech. 12, 567–572.
- Nautiyal Cs , 1999. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS Microbiology Letters 170: 265-270.
- Ramos, ME; E Benítez; PA García & AB Robles. 2010. Cover crops under different managements vs. frequent tillage in almond orchards in semiarid conditions: Effects on soil quality. App. Soil Ecol. 44: 6-14
- Schmalenberger, A & CC Tebbe. 2002. Bacterial community composition in the rhizosphere of a transgenic, herbicide-resistant maize (Zea mays) and comparison to its non-transgenic cultivar Bosphore. FEMS Microbiol. Ecol. 40:29-37.
- Wainwright, Md & Sowden, F J. 1977. Influence of fungicide treatment on CaCl2)extractable phosphorus and phosphatesolubilizing microoganisms in soil. Plant Soil 48, 335–345.
- Wardle, DA. 1992. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil. Biol. Rev. 67: 321-358.
- Yan, F; AB McBratney & L Copeland. 2000. Functional substrate biodiversity of cultivated and uncultivated A horizons of vertisols in NW New South Wales. Geoderma 96: 321-343.
- Zak, JC; MR Willing; DL Moorhead & HG Widman.1994. Functional diversity of microbial communities: a quantitative approach. Soil Biol. Biochem. 26: 1101-1108.


