En suelos con altas temperaturas, los microorganismos del suelo comenzarán rápidamente a convertir el amonio a nitrato en el proceso de nitrificación [NH4 + + 2O2 → NO3- + H2O + 2H+]. Durante esta reacción microbiana, se libera acidez [H+], que en última instancia reducirá el pH del suelo con un uso repetido. El sulfato de amonio posee un efecto acidificante en el suelo debido al proceso de nitrificación -no por la presencia de sulfato, que tiene un efecto insignificante sobre el Ph-. Para una cantidad equivalente de N, el potencial de acidificación del sulfato de amonio es mayor que el del nitrato de amonio, por ejemplo, debido a que todo el N en el sulfato de amonio se convierte en nitrato, mientras que solo la mitad del N del nitrato de amonio se convierte en nitrato.
Desde la nutrición bacteriana, el nitrógeno y el azufre son elementos que pueden ser cubiertos de modo muy distinto, dependiendo del tipo de bacteria que consideremos. Concretamente, los elementos N y S (que requieren todos los seres vivos) pueden ser captados por las bacterias de modos muy distintos, dependiendo de sus capacidades biosintéticas. Tanto el N como el S se encuentran en la célula en estado reducido: el radical -NH2 forma parte de los aminoácidos (que a su vez son los sillares de las proteínas) y de las bases nitrogenadas (que participan en los ácidos nucleicos y en algunas coenzimas y el radical -SH interviene en determinados aminoácidos y en coenzimas como la CoA.
La forma química de entrada del N y S a las bacterias: la mayoría de las bacterias fotosintéticas y muchas heterótrofas asimilan estos elementos en forma combinada inorgánica oxidada como NO3--, merced a la actuación secuencial de nitrato-reductasas y nitrito-reductasas asimilatorias; también como SO42-. Este sulfato se activa con ATP, y luego se reduce hasta sulfito y finalmente sulfhídrico, que ya tiene el estado de reducción adecuado para la incorporación del S o muchas bacterias heterótrofas pueden usar alguna forma reducida de N inorgánico: amonio (NH4+), de S inorgánico: sulfuros (S2-, SH-) o S orgánico: cisteína.Muchas de las bacterias que pueden usar amonio como única fuente de nitrógeno también pueden usar nitratos. Patiño (2014)
El Tamo del arroz, es uno de los coproductos agrícolas lignocelulósicos más abundantes en el planeta, luego de los residuos producidos por los cultivos de maíz y trigo, con una producción mundial estimada de 1000 millones de toneladas según estadísticas de la FAO. En el contexto de la agricultura moderna es determinante lograr un manejo ambientalmente sostenible de este recurso mediante su incorporación al suelo, de tal forma que se logre el reciclaje de nutrientes, evitando la incorporación de patógenos al sistema y la inmovilización de elementos como el nitrógeno por la comunidad microbiana. (Cruz, 2017)
OBJETIVOS
1.- Evaluar el efecto de diferentes dosis de SAM en la velocidad de transformación de los residuos de cosecha tamo del arroz*
2.- Establecer la dosis agronómica y económicamente viable en el proceso de uso de los residuos de cosech
3.- Diferenciar el proceso de transformación del tamo con o sin adición de sales, a los microorganismos.
MATERIALES Y MÉTODOS
El presente estudio se realizó en la finca Quitilandia del señor Gustavo Castilla ubicada en la vereda Pueblitos del municipio de El Zulia, departamento de Norte de Santander. En la evaluación se desarrollaron actividades de aplicación y monitoreo, utilizando materiales como tamo de arroz, mallas finas, fuente de microorganismos Residuol en duopack, equipos de aplicación, y balanzas.
El SAM se utilizó teniendo como base la dosis de 30 kg/ton utilizado en la descomposición de los residuos del maíz. Se evaluaron dosis de 25% y 50% por debajo y por arriba en la mezcla con los microorganismos, comparándolo con un testigo con solo microorganismos y otro sin aplicación. La fuente de microorganismos evaluados fue el RESIDUOL® Inoculante Biológico en formulación liquida y en presentación de dúo-pack, elaborado con base en dos hongos: LIGNIBIOL SC en base de Pleorotus ostreatus descomponedor de lignina en concentración de 1x106 UFC/L y CELUBIOL SC, Penicillium pinophilum descomponedor de celulosa, en concentración de 1x108 UFC/L (estructuras reproductivas). Su modo de acción acelerar el proceso de descomposición liberando ácidos orgánicos y los nutrientes aprovechables, reduciendo el tiempo en la transformación del tamo que contribuye a mejorar las condiciones físicas, químicas y microbiológicas de los suelos. Se utilizó el Duopack (Residuol) en dosis de 1 litro de Lignibiol y 1 litro de Celubiol por hectárea.
Efecto de las dosis de SAM en la velocidad de transformación del tamo del arroz.
Se evaluaron 7 tratamientos con dosis de SAM de 15, 23. 30, 38 y 45 kg/ha en mezcla con microorganismos, comparados con un testigo de sólo microorganismos y otro el testigo solo con el tamo sin aplicaciones. Se utilizó un kilogramo de tamo por muestra en bolsa de malla, se determinó la humedad tomando una submuestra adicional la cual se secó en el laboratorio empleando la estufa universal, a temperatura de 110°c por 24 horas.
La muestra de 1 kilogramo de tamo se introdujo en la bolsa fabricada con malla plástica de ojo fino de polietileno de alta densidad 56035ASTM D-1238 / ASTM D-1505, POLIETILENO HEXENO PPQ-077 ASTM D-1238 / ASTM D-792. El ojo de la malla de 17 x 15 mm tiene ancho de 1,2m x 30 m de largo. Se construyen 21 bolsas (7 tratamientos x 3 repeticiones) de 1,2m de ancho por 1m de largo.
Figura 1. Bolsas en malla para empacar el tamo
Después de conformada las bolsas con el tamo se procedió a la aplicación con equipo de precisión la mezcla según los tratamientos; para la mezcla se agregó el 50% de agua a emplear, luego se disolvió muy bien el sulfato y se adicionó el microorganismo, se agregó 25% del agua, se mezcló y adiciono el otro 25% del agua restante, aplicando primero por una cara y después por la otra. Las bolsas de dejaron en el campo sobre los caballones exponiéndolas a las condiciones del clima.
Para cada tratamiento se determinó la tasa de descomposición relacionada con la pérdida de humedad y el grado de dureza del tamo.
Para la perdida de humedad. Se partió de un tiempo cero que es el peso inicial del tamo (1 kilogramo) posteriormente a los 8, 15, 22 y 30 días se pesó cada muestra para establecer las diferencias de peso
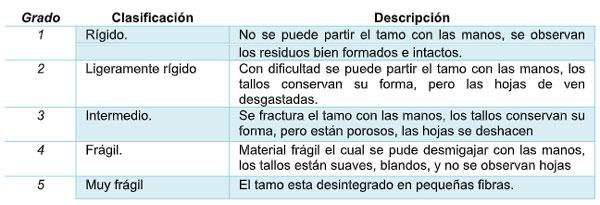
Grado de dureza. Cada vez que se tomó los pesos por tratamiento se realizó la prueba de consistencia del tamo en una muestra conservable por bolsa teniendo y se clasifica teniendo en cuenta la siguiente tabla de dureza. Tabla 1.
Tabla 1. Escala de evaluación de la consistencia del tamo
5.2. Determinación del índice de cosecha IC
El índice de cosecha (IC) Indica la eficiencia de la planta para desarrollar sus estructuras durante el ciclo reproductivo y el aprovechamiento de los nutrientes para formar sus estructuras relacionadas con la producción de granos y se calculó determinando el rendimiento en grano seco, el peso del tamo seco y la biomasa total seca. El índice de cosecha se calculó seleccionando un metro cuadrado del área del cultivo al momento de la cosecha, se cortaron todas las plantas, se separó el grano de la paja, se secó al 14% de humedad y, se calculó de acuerdo con la formula.
La cantidad de tamo producido por hectárea. Se calculó pesando el tamo verde después de separar el grano (tamo verde) y después de seco (tamo seco) en tres puntos representativos.
Se estableció la dosis agronómica y económicamente viable a utilizar junto con los microorganismos en el proceso de transformación del tamo. Se tomaron análisis de microscopia electrónica de barrido MEB para determinar la secuencia de la degradación sobre las estructuras celulares en los tiempos 8, 15, 22 y 30días después de aplicados los 7 tratamientos. Con base en las imágenes se determinó la colonización de los microorganismos, así como también análisis microbiológico para determinar grupos funcionales.
RESULTADOS Y DISCUSION
Colombia mediante la ley 1196 de 2008 ratificó el convenio de Estocolmo sobre los contaminantes orgánicos persistentes (COP) con el objeto de proteger la salud humana y del medio ambiente de estos contaminantes, mediante la adopción de medidas para prevenir y mitigar la liberación de los COP denominados no intencionales. El tamo como biomasa es quizá una fuente de materia orgánica más eliminadas con fuego en gran extensión y distribución en el país. Dentro del convenio marco se adelantó el proyecto COL98842/94749 entre Fedearroz, Ministerio de Ambiente, PNUD y GEF cuyo objetivo fue su reducción proveniente de la quema del tamo, en las diferentes regiones del país. En este proyecto se logró avances significativos en la disminución de las quemas, y demostrativos de la transformación del tamo fuente de materia orgánica; se capacitaron a los productores para que valoren el tamo y la implementación de buenas prácticas agrícolas (BPA) en el cultivo del arroz mediante el programa AMTEC .(Cuevas A, et all, 2022).
El uso de aceleradores como fuentes energéticas a base de sales o fuentes de azucares en la transformación del tamo son de gran utilidad, para permitir la rápida y mayor colonización de los microorganismos sobre los polímeros (Celulosa, lignina, Hemicelulosa). La evaluación de sales como sulfato de amonio a diferentes dosis permite analizar este efecto buscando reducir el tiempo de transformación y uso del tamo como materia orgánica.
Índice de cosecha (IC) y tamo producido por el cultivo.
El índice de cosecha es la relación entre el rendimiento del grano y la biomasa. La variedad sembrada fue Fedearroz 2000 a densidad de 200 kg.ha-1 siembra al voleo con semilla pregerminada en el mes de febrero del 2022 y la cosecha en el mes de mayo del 2022. Los promedios de tres sitios evaluados arrojaron 13,28 ton.ha-1 de tamo verde y 5.467,23 kg.ha-1 de grano, posteriormente se procedió a secar la biomasa obteniendo el peso del grano al 14% de humedad; los registros muestran 6,8 ton.ha-1 de tamo seco y un rendimiento de grano de 4.610 kg.ha-1. El IC calculado 0,39 que corresponde a un rendimiento medio, pues hay mayor producción de paja que de grano, lo cual está relacionado con la época de siembra o el manejo agronómico. La cantidad de tamo producido en verde fue de 13,2 ton y en seco de 6,8 ton por hectárea, estos valores representan importante fuente de materia orgánica aprovechable para transformarla en materia orgánica que haga parte del suelo, mejorando sus propiedades y las del desarrollo del cultivo.
Efecto de las dosis de SAM en la transformación del tamo por los microorganismos
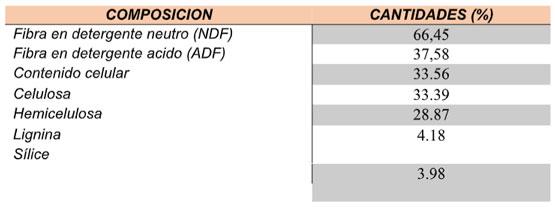
El análisis de composición estructural de tamo en la variedad Fedearroz 2000 presento el 33,3% compuesto por Celulosa, el 28,8% compuesto por Hemicelulosa y la lignina del 4,18% con presencia del 3,98% de sílice. Tabla 2.
Tabla 2. Composición estructural del tamo de arroz en la variedad Fedearroz 2000, análisis por Van Soest.
Los microorganismos empleados en un duopack fueron Pleorotus ostreatus descomponedor de lignina en concentración de 1x106 UFC/L en mezcla con Penicillium pinophilum descomponedor de celulosa, en concentración de 1x108 UFC/L (estructuras reproductivas).El género Pleurotus, secretan diversas enzimas, como las lacasas, que se ha propuesto están involucradas en mecanismos de degradación de compuestos ligninocelulósicos (Royse y Sánchez, 2017; Royse et al., 2017) con diferentes aplicaciones biotecnológicas (Arora y Sharma, 2010; Viswanath et al., 2014) y relacionadas con la capacidad de defensa del hongo ante interacciones antagónicas con otros organismos que pueden ser nematodos como Meloidogyne javanica (Heydari et al., 2006).
Reducción en el peso del tamo
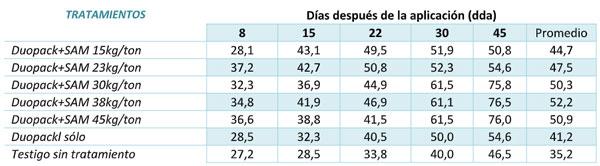
Los microorganismos requieren de aportes de sales nitrogenadas, fosfóricas o potásicas; así como también azucares que permiten condiciones ideales para que crezcan y se multipliquen en su fase saprofita; el contenido de humedad es fundamental para completarse los procesos. Las mayores reducciones de peso se obtuvieron a los 45 dda en los tratamientos duopack +SAM 34,5kg/ton con 76,5%, duopack +SAM 40kg/ton con 76% y duopack +SAM 30 kg/ton con el 75,8%. Respecto al testigo sin tratamiento que alcanzó solo el 46,5%. Tabla 3.
Tabla 3. Porcentaje de reducción en el peso del tamo de acuerdo con los tratamientos.
Durante la observación, los tratamientos estuvieron influenciadas por las precipitaciones frecuentes que favorecieron los procesos de colonización biológica de los. La humedad es un factor importante para que los microorganismos puedan ejercer su acción de penetración y colonización en los tejidos y ruptura de las estructuras de los polímeros. Se observó en el tratamiento de Duopack + SAM 30 kg/ha la presencia de estructuras sombrilla del hongo P. ostreatus. Figura 2.
Figura 2. Estructuras de Pleorotus ostreatus sobre el tamo en transformación
Consistencia del tamo y su grado de rigidez.
La consistencia está dada por la fibra contenida en la pared celular de la cual los polímeros Lignina, celulosa y hemicelulosa hacen parte, aporta rigidez a los tejidos, confiere la capacidad de crecimiento en altura de la planta, protege de la radiación ultravioleta y del ataque de microorganismos, e impermeabiliza los vasos permitiendo el transporte de agua, nutrientes y sales minerales, El proceso se transformación de las estructuras del tamo se realiza por la degradación biológica de la lignina que se describe como una combustión enzimática (Guzmán G, 2018).
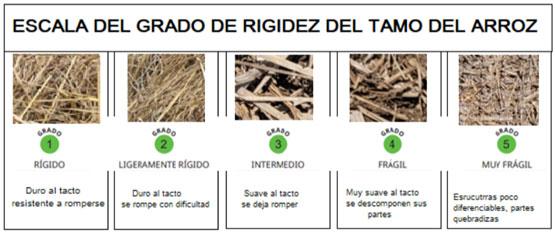
La consistencia se midió a través de escala, se determinó mediante fuerza aplicada al tamo el grado de resistencia después de la aplicación de los microorganismos. Figura3.
Figura 3. Escala de medida el grado de en la degradación del tamo
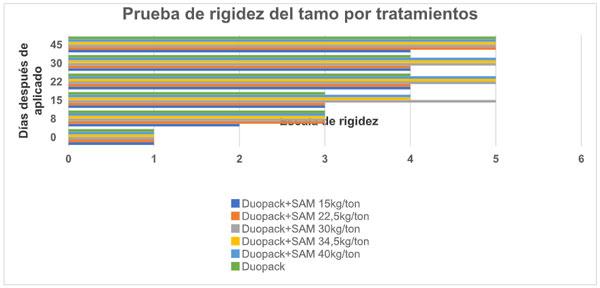
En la composición del tamo diferenciemos dos cualidades: la consistencia del tamo que está relacionada con la conservación de la integridad de sus estructuras en términos de duración, estabilidad y solidez, y la rigidez como la capacidad de resistir una fuerza sin deformarse. Se evaluó la rigidez a criterio del evaluador. En grado 3 las estructuras son suaves al tacto y al hacer presión se dejan romper, esto sucedió a los 8 días para los tratamientos Duopack en mezclas desde 20 hasta 40 kg de SAM/ha y el tratamiento Duopack. A los 22 dda los tratamientos Duopack +SAM 15kg/ha, Duopack +SAM 22,5kg/ha, Duopack y el testigo se calificaron en grado 4 y, los tratamientos SAM 30kg/ha, Duopack +SAM 34,5kg/ha, Duopack +SAM 40 kg/ha en grado 5. Figura 4.
Figura 4. Calificación del grado de rigidez por tratamiento.
Efecto de los microorganismos y las mezclas de SAM sobre las estructuras del tamo
A través de imágenes de microscopía electrónica (MEB) se observó el efecto colonizador de los microorganismos y su accionar sobre las paredes de los polímeros. Las muestras para ser observadas en el microscopio electrónico se recubrieron con oro; el recubrimiento es necesario en muestras no conductores ya que evita daño del haz de electrones a muestras lábiles, y evita la generación de artefactos causados por la acumulación de electrones mejorando la resolución de las imágenes.
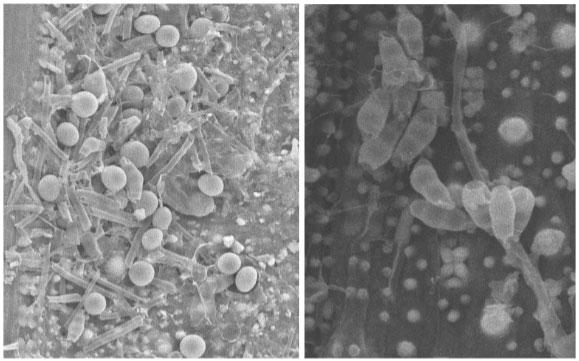
La acción de los hongos del género Pleurotus spp es a través de la secreción de diversas enzimas, como las lacasas, que están involucradas en mecanismos de degradación de compuestos ligninocelulósicos (Royse y Sánchez, 2017). El tamo sin ningún tratamiento tiene un proceso de degradación a largo plazo, muy lento y dependerá de condiciones del clima o existencia de cepas de microorganismos naturales que ejerzan esa acción. Las estructuras de Pleurotus ostreatus son llamadas toxocistos (toxon: arco, cisto: bolsa) son estructuras esféricas y pediceladas. Penicillium pinophilum se caracteriza por formar conidios en una estructura ramificada semejante a un pincel que termina en células conidiógenas llamadas fiálides. Las hifas alcanzan un diámetro entre tres micrómetros y tienen septos. (Figura 5)
Figura 5. Micrografias de estructuras de Pleorotus ostreatus (izquierda) y Penicillium pinophilum (derecha)
El sulfato de amonio tiene influencia positiva en la producción de enzimas. La biodegradación de la celulosa del tamo del arroz esta mediada por enzimas de tipo celulasas, producidas por los microorganismos como Penicillium pinophilum.
El proceso inicia con la colonización del hongo, mediante la penetración dentro de los polímeros del tamo, una vez allí el hongo se reproduce y aumenta su concentración, rompe las cadenas laterales y los enlaces de la pentosas y hexosas restándole rigidez. El tamo sin tratamiento conserva sus estructuras a través del tiempo; la aplicación de microorganismos acelera el proceso y degradan el tamo, cuando adicionamos SAM los procesos, estos son más acelerados y se logra menor rigidez en poco tiempo. Figura 6.
Figura 6. Proceso de colonización y degradación de los microorganismos sobre las estructuras del tamo del arroz, imágenes MEB
Las imágenes MEB permiten hacer seguimiento del proceso de transformación del tamo por los microorganismos. Describiendo uno de los tratamientos (figura 6): observemos en el caso duopack más 30kg/ha de SAM la rápida alteración de las paredes del tamo, aparecen primeras estructuras de los hongos y reducción de la rigidez; a los 15 días se identifican con facilidad los toxocistos en el caso de Pleurotus ostreatus y las conidias de Penicillium pinophilum el tamo se friable y se deja partir con facilidad, de igual manera podemos observar el comportamiento de los demás tratamientos.
El hongo Neurospora crassa se encontró asociado a la descomposición del tamo y está presente en su transformación mediante la producción de celulasas; por lo general se observa con mayor frecuencia en los tallos calcinados del tamo de arroz y maíz. Figura 7
Figura 7. Estructuras del hongo Neurospora crassa en residuos de cosecha.
6.4 Dosis de SAM ideales para mezcla con microorganismos.
Los tratamientos que presentaron mejor comportamiento fueron los conformados por duopack compuesto por los hongos Pleorotus ostreatus descomponedor de lignina en concentración de 1x106 UFC/L en mezcla con Penicillium pinophilum descomponedor de celulosa, en concentración de 1x108 UFC/L en mezclas con sulfato de amonio en las cantidades de 30kg/ha, 34,5kg/ha y 40 kg/ha respectivamente.
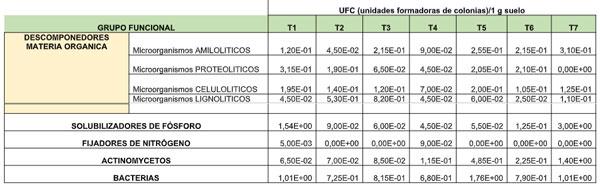
Por tratamiento se realizó análisis microbiológico para observar al final de proceso los contenidos de microorganismos. Los amilolíticos descomponedores de materia orgánica fueron mayores en el T2 (Duopack + 23 kg SAM) con 4,50E-02UFC/1 g suelo), para los proteolíticos en el T3 (Duopack + 30 kg SAM) con valor de 6,5E-02 UFC, para los celulíticos el tratamiento T4 con 7,00E-02 UFC y para los Lignolíticos tratamiento T5 (Duopack +45 kg SAM) con 6,00E-02 UFC/1 g suelo.
Mayor presencia de solubilizadores de fósforo se obtuvieron en el tratamiento T2 y tratamiento T3; de fijadores de nitrógeno en tratamiento T1 y los actinomicetos y bacterias en el tratamiento T3. Tabla 4.
Tabla 4. Composición microbiana de los tratamientos en mezcla de microorganismos y sulfato de amonio,
CONCLUSIONES Y RECOMENDACIONES
- El tamo del arroz en la medida que pierde humedad se hace más rígido y difícil de transformar en materia orgánica. Por lo cual se hace necesario, el uso de microorganismos que actúan a nivel de los polímeros (celulosa, hemicelulosa y lignina) según su especialidad.
- Los microorganismos necesitan de fuentes energéticas como sales y azúcares para ejercer su acción en el rompimiento de las cadenas de los polímeros y multiplicarse dentro de los residuos hasta destruirlos y formar partículas de materia orgánica.
- Se observó que el sulfato de amonio es un facilitador del proceso al acelerarlo y permitir en menor tiempo la transformación del tamo la cual equivale entre 8 a 10 días comparado con los tratamientos en donde no se adicionó. Esto permite reducir las quemas indiscriminadas del tamo que emiten compuestos orgánicos persistentes contaminantes.
- La dosis de 30 kg/ha de sulfato de amonio (SAM) adicionada a los microorganismos presentó excelente repuesta en la velocidad de transformación reduciendo el tiempo en 9% respecto a microorganismos solo y 15% respecto al no uso de microorganismos y sales.
- Recordemos que la humedad es fundamental para mejorar los procesos de los microorganismos y se observó que la rápida colonización de los microorganismos está dada por los contenidos de humedad y la adición de fuentes como las sales como el SAM