Introducción
En Venezuela el arroz (Oriza sativa L.) se ubica entre los principales rubros del Estado, por ser una fuente calórica importante en la dieta diaria del venezolano y uno de los cultivos de mayor importancia en la agricultura, estimándose una superficie cosechada de 198.834 ha con un rendimiento promedio de 5.354 kg.ha-1 para el 2014, mientras que el rendimiento promedio mundial fue de 4.600 kg.ha-1 (FAO, 2015).
Al igual que en otros cultivos, las plagas representan una de las principales limitantes para el aumento de la productividad del arroz en los trópicos, por aumentar los costos de los insumos en el sembrado y restringir la expansión del cultivo a nuevas áreas. Entre las enfermedades que afectan a la planta de arroz se encuentra el tizón de la vaina (TDV), causada por el patógeno necrótofo habitante del suelo Rhizoctonia solani Kühn, (teleomorfo: Thanatephorus cucumeris [Frank] Donk) (Moreano y Vivas, 2011; Wang et al., 2015).
El TDV fue considerado por muchos años una enfermedad de poca importancia económica; sin embargo, a partir de la década de los 80 comenzaron a observarse incrementos en su incidencia y severidad, debido al uso de un sistema de producción caracterizado por altas densidades de siembra, abundante aplicación de fertilizantes nitrogenados y un monocultivo intensivo. Estas prácticas junto con la utilización de cultivares susceptibles, la naturaleza saprofita y el amplio rango de hospedantes del patógeno, han ayudado a la diseminación, establecimiento y persistencia del hongo en la mayoría de las áreas productoras de arroz (Nass et al., 1995; González-Vera et al., 2011).
En Venezuela, el TDV fue reportado por primera vez por Malaguti (1952), mientras que el agente causal de la enfermedad fue identificado como R. solani, ubicado en el grupo de anastomosis AG1-IA (Cedeño et al., 1996).
Para controlar la enfermedad, se han usado principalmente prácticas culturales y entre ellas el uso de productos químicos (Rodríguez et al., 1999), pero debido a su impacto ambiental se ha generado en los últimos años gran preocupación por el abuso de su aplicación en campos comerciales de arroz.
En Venezuela la información acerca de R. solani, así como el grado de resistencia en las variedades de arroz mejoradas en el país es escasa (Graterol et al., 1996; González-Vera et al., 2011). El uso de cultivares resistentes es prerrequisito para la agricultura sustentable, por lo económico, biológicamente seguro, usualmente compatible con el control biológico, el no ser dañino para el ambiente y no representar un costo adicional para el agricultor. Es por ello, que el objetivo de este estudio fue determinar la herencia de la resistencia al hongo R. solani en dos poblaciones de arroz (O. sativa L.) en Venezuela.
Materiales y métodos
Las poblaciones experimentales de arroz obtenidas a partir de los parentales susceptibles y resistentes para la evaluación de la resistencia a R. solani mediante inoculaciones artificiales se realizó en el umbráculo ubicado en el Instituto Nacional de Investigaciones Agrícolas (INIA), Araure, estado Portuguesa, 9º36' N, 69º13' O, 200 msnm.
Como progenitores resistentes se seleccionaron los cultivares: Palmar y Jefferson y como susceptibles: Fonaiap 1 y Fonaiap 2000, realizándose los cruces Fonaiap 1 x Palmar y Fonaiap 2000 x Jefferson. Estos parentales fueron elegidos de acuerdo con las evaluaciones realizadas por Delgado y Rodríguez (2005). Las semillas de los cultivares utilizados fueron suministrados por el programa de mejoramiento de plantas de arroz del INIA.
La siembra de progenitores se realizó en materos de plástico contentivos de suelo previamente esterilizado dos veces en un autoclave por 30 min a 121ºC y 15 psi de presión, colocándose cinco plántulas/ matero/cultivar. Las plántulas se obtuvieron al sembrar las semillas de cada cultivar en cajas de Petri estéril contentivas de papel absorbente esterilizado y humedecidas con agua destilada estéril. Luego de la emergencia de la radícula, se procedió al trasplante al matero respectivo. Para asegurar la coincidencia de floración entre los progenitores se realizaron tres siembras continuas cada cinco días.
Las plantas se mantuvieron en observación y se realizaron las prácticas culturales para el mantenimiento del buen desarrollo y sanidad. Al llegar a la etapa de emergencia de la panícula, a las plantas seleccionadas como madres le fueron tomadas las macollas que presentaron una emergencia de 5 a 10 cm de la hoja bandera, se les eliminaron todas las hojas y las espiguillas ubicadas en el tercio superior e inferior, realizando la emasculación al día siguiente. Las macollas se identificaron con etiquetas indicando, el nombre del cultivar y la fecha de recolección y se conservaron en cilindros de plástico sumergidas en 15 cm de agua, cambiándose periódicamente.
A las panículas seleccionadas como madres se les removieron las anteras de las flores antes de la antesis evitando la autofecundación. Una vez emasculadas, las panículas se protegieron con una bolsa de papel glasé para evitar la fecundación con polen no deseado. La polinización se realizó al ocurrir la antesis en el progenitor masculino, anotando el nombre del cultivar padre y la fecha de polinización. Después de la polinización, las panículas se cubrieron de nuevo con la bolsa de papel glasé por cinco días, tiempo en el cual el estigma dejó de ser receptivo y los tallos se mantuvieron en umbráculo hasta el desarrollo completo de la semilla. Al madurar la semilla, se recolectó y guardó en sobres, identificándose con el cruce y fecha de cosecha y se almacenaron en refrigeración hasta su utilización.
La siembra de las semillas F1 se realizó de igual forma que fueron sembrados los progenitores. Una vez madurada la semilla se recolectaron en bolsas individuales identificadas con el cruce y fecha de cosecha y almacenadas en refrigeración hasta su uso, esta semilla constituyó la generación F2 .
La evaluación de los cultivares de arroz por su reacción a R. solani, se hizo en umbráculo, determinándose el valor promedio del área afectada por la enfermedad en tres tallos seleccionados al azar por planta. Se utilizaron tres potes/progenitor con cuatro plantas cada uno, mientras que en la progenie, cada individuo se evaluó de manera independiente, colocando una planta por pote.
En este estudio se usó el aislamiento 101-18 del TDV, registrado, identificado y preservado en el labora torio de Fitopatología del INIA-Portuguesa. La multiplicación del inóculo se hizo en cajas de Petri estériles contentivas de 20 mL de agar papa dextrosa esterilizado y acidificado (APDA), colocándose un esclerocio en el centro de la caja, al germinar el esclerocio se dejo crecer en ambiente (25-28°C) del laboratorio por cinco días, luego se tomaron 10 trozos de agar contentivo de micelio del hongo y se colocaron en igual número de caja de Petri con APDA y se dejaron por ocho días en un mesón en ambiente de laboratorio (25-28°C) hasta su utilización.
Para el caso de la progenie, en cada cruce se evaluaran 100 plantas. La inoculación se realizó en la fase de inicio de la exerción de la panícula (R4), por haberse demostrado que la severidad de la infección de R. solani, fue mayor en esta etapa que en alguna otra. Las hojas se enumeraron del 1 al 5 comenzando de arriba hacia abajo, siendo la número 1 la hoja bandera. Se evaluaron las lesiones en la segunda, tercera, cuarta y quinta hoja por ser éstas las más indicadas para determinar la severidad de la infección en plantas individuales (Eizenga et al., 2002).
Con la ayuda de un sacabocados previamente flameado, los tallos seleccionados se inocularon en el nudo dentro de la vaina, con discos de agar con micelio del hongo. Inmediatamente después de la inoculación las plantas se cubrieron con una bolsa plástica y se dejaron incubadas en cámara húmeda por una semana (Eizenga et al., 2002). Luego de este tiempo, se retiro la bolsa, se midió el área total y afectada en cada una de las plantas, se determinó el porcentaje de área afectada por el TDV, para luego ser agrupadas según la escala 0 a 9 donde 0 = sin lesión, 1 = lesiones cubriendo el 10% de la superficie del área foliar y así sucesivamente hasta 9 = lesiones cubriendo toda el área foliar (90 a 100% de las hojas). Plantas con valores de 0 a 4 se consideraron resistentes y de 5 a 9 se consideraron susceptibles.
Los datos obtenidos de las poblaciones segregantes se analizaron utilizando estadística descriptiva, la probabilidad para normalidad de ShapiroWilk y la prueba de Bondad de Ajuste [Chi-cuadrado (X2 )] para dos clases fenotípicas (resistentes [R] : susceptibles [S]), con un grado de confianza de 5% y la siguiente hipótesis: Hipótesis nula: la población segrega en una proporción R1:S1. Hipótesis alternativa: la población no segrega en una proporción R1:S1.
Resultados y discusión
En el presente trabajo las dos progenies segregantes mostraron variabilidad fenotípica por las diferencias en las épocas de floración y altura de plantas, entre otras características. Además, el método de inoculación e incubación (Eizenga et al., 2002; Delgado et al., 2004; González-Vera et al., 2011) mostró ser seguro, al no ocurrir escape, evidenciado al manifestarse los síntomas del TDV entre 24 y 48 días después de la inoculación, ocurriendo diferentes grados de severidad, permitiendo la agrupación de la descendencia (F2 ) de acuerdo al porcentaje del área afectada, indispensable para la determinación del modo de herencia de la resistencia a R. solani en cultivares de arroz.
Las condiciones para realizar el presente trabajo se seleccionó debido a que ha sido señalado que las pruebas realizadas con R. solani en parcelas experimentales (Che et al., 2003) utilizando diferentes métodos de inoculación artificial (Marchetti et al., 1996; Pan et al., 1999), para determinar cultivares con susceptibilidad reducida al TDV, mostraron resultados inconsistentes, incluso entre plantas del mismo cultivar, repeticiones, año a año y de una localidad a otra (Pinson et al., 2005). Además, los estudios realizados en umbráculo demostraron mayor precisión que los ensayos en campo (Araujo et al., 2007; Liu et al., 2009); así como condiciones más uniformes (Pinson et al., 2005).
Los progenitores mostraron un porcentaje de área afectada entre un 11 y 67%, resultando resistentes, de acuerdo a la escala de evaluación, Palmar (11%) y Jefferson (32%), mientras que los cultivares Fonaiap 1 (60%) y Fonaiap 2000 (67%) resultaron susceptibles, coincidiendo con lo señalado por Delgado y Rodríguez (2005). La variación fenotípica a la reacción al TDV entre los progenitores, medida por la diferencia del área afectada, fue de 49% entre los cultivares Palmar y Fonaiap 1 y de 35% entre los progenitores Jefferson y Fonaiap 2000. Además, la variación fenotípica entre los progenitores resistentes, medida por la diferencia del área afectada fue de 21%, mientras que entre los progenitores susceptibles fue de 7%.
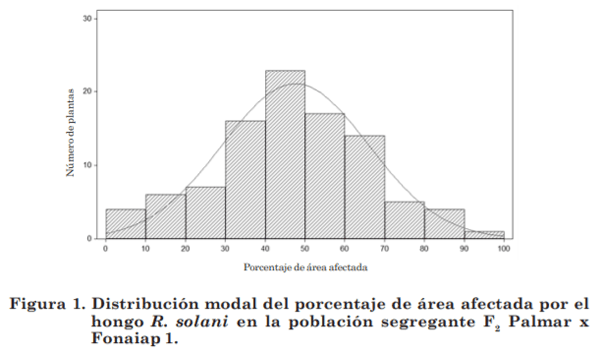
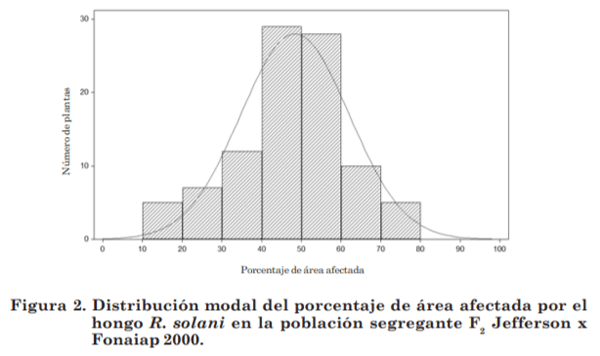
En la población F2 producto del cruce entre Palmar x Fonaiap 1, el porcentaje de área afectada mostró una media de 47,5; una desviación muestral ± 17,54; una varianza muestral de 307,80; un valor mínimo de 8% un valor máximo de 91% y mediana 50, siendo la variación a la reacción en esta población de 83%. Mientras que para el cruce Jefferson x Fonaiap 2000, mostró una media de 48,62%; desviación muestral ± 13,55; varianza muestral de 183,48; valor mínimo 12%, un valor máximo de 80% y mediana 50, con una variación a la reacción de 68%.
Para la población segregante Palmar x Fonaiap 1 se observaron 42 plantas resistentes y 58 plantas susceptibles, resultando con un grado de confianza del 5%, por lo que se aceptó la hipótesis nula debido a que el valor calculado (2,56) fue menor que el valor tabulado (3,84). Por lo tanto, la población segregante se ajustó a una proporción 1 resistente:1 susceptible (1:1).
Para la población segregante Jefferson x Fonaiap 2000 se observaron 57 plantas resistentes y 43 plantas susceptibles, determinándose con una probabilidad del 5%, que el valor calculado (1,96) fue menor que el valor tabulado (3,841), aceptándose la hipótesis nula; por lo tanto la población segregante se ajustó a una proporción 1:1 resistente: susceptible.
La población F2 obtenida del cruce Palmar x Fonaiap 1 mostró, de acuerdo a la formula de probabilidad para normalidad de Shapiro-Wilk, que la reacción fenotípica de la población segregante al hongo R. solani presentó una variación continua con un valor de W= 0,9862 y PW= 0,4084, siendo el valor W mayor que el valor PW, por lo tanto se ajustó a una distribución normal (figura 1).
De acuerdo a la formula de probabilidad de Shapiro-Wilk, la población F2 del cruce Jefferson x Fonaiap 2000 mostró, que la reacción fenotípica de la población segregante al hongo R. solani presentó una variación continua con un valor de W= 0,9757 y un valor de PW= 0,1052, mostrando que el valor W fue mayor que el valor PW; por lo tanto se ajustó a una distribución normal (figura 2).
En las progenies F2 en ambas poblaciones evaluadas se observó una variación continua en la reacción fenotípica producto de la inoculación artificial del hongo R. solani. Además, ambas poblaciones mostraron segregación transgresiva, determinada en la descendencia por la reacción fenotípica que mostró individuos más resistentes o más susceptibles que los respectivos parentales (Russell, 2013). En consecuencia la herencia transgresiva es considerada el efecto principal producto de la acción complementaria de genes presentes en ambos progenitores, siendo esta una característica cuantitativa condicionada por varios genes.
En este mismo sentido, ha sido determinada la ausencia de resistencia completa en arroz a R. solani (Mew et al., 2004), considerándose que la resistencia en arroz al hongo fue multigénica, siendo difícil evaluar el efecto individual de los genes que confirieron esta resistencia (Che et al., 2003).
De acuerdo a la reacción fenotípica producto de la inoculación con R. solani, se determinó la existencia de herencia transgresiva en ambas progenies segregantes evaluadas, explicando el porqué en ambas poblaciones se observó una segregación no ajustadas a las leyes de herencia de Mendel, siendo la proporción determinada 1 resistente: 1 susceptible (1:1); por esto la resistencia al TDV en ambas poblaciones segregantes evaluadas fue condicionada por varios genes, donde cada gen tuvo un efecto pequeño sobre la expresión fenotípica final de resistencia, siendo ésta la suma de los efectos individuales, por lo que el modo de herencia de la resistencia en cultivares de arroz a R. solani es considerada cuantitativa; sin embargo, se debe considerar el estudio con líneas avanzadas con las poblaciones segregantes evaluadas, para determinar el aporte de cada progenitor a la resistencia a R. solani.
Conclusiones
En ambas poblaciones la tendencia fue semejante y se manifestó la herencia transgresiva a la respuesta a la inoculación y las dos poblaciones evaluadas mostraron una distribución continúa. Debido a que la respuesta a la inoculación en las dos poblaciones evaluadas mostraron una distribución continúa.
El modo de herencia de la resistencia en las plantas de arroz se considera cuantitativa, es decir poligénica.