Silicio, níquel y nanopartículas de plata y cobre en el manejo in vivo e in vitro de Botrytis cinerea en fresa (Fragaria x ananassa Duch.)
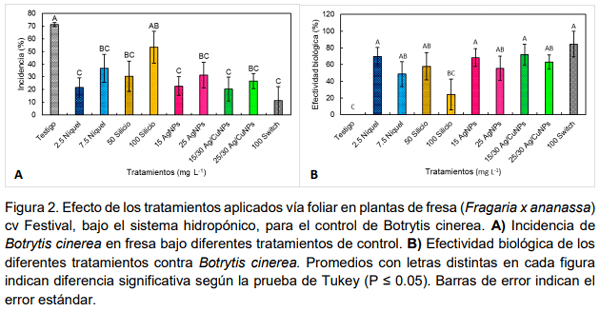
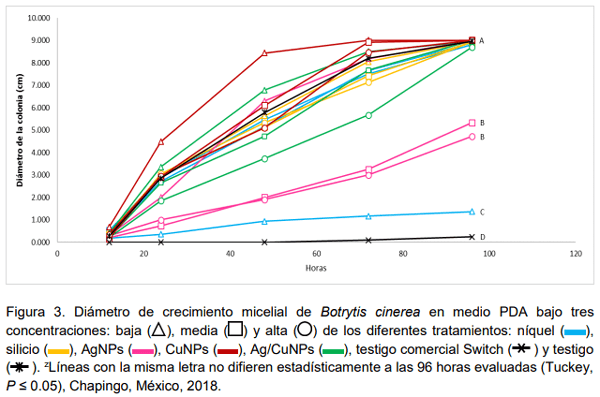
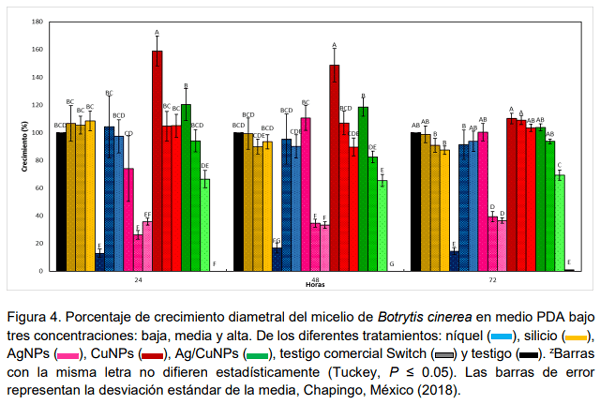
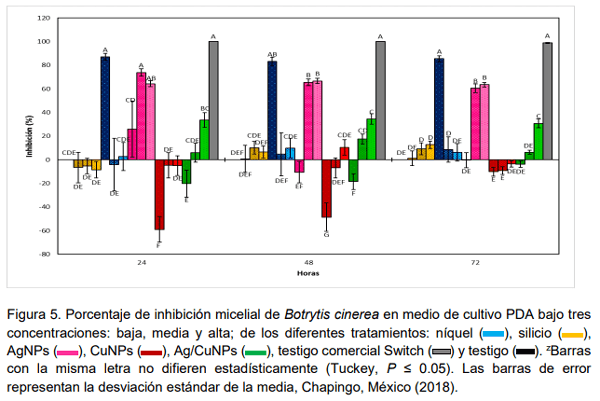
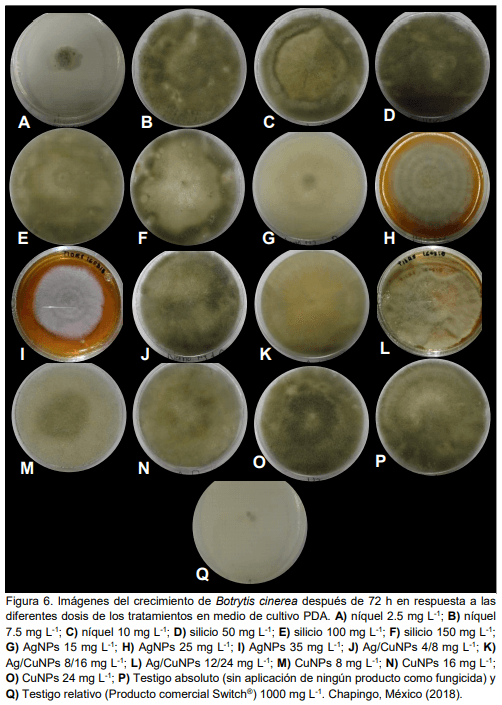
El uso metales en transición como plata, cobre y níquel, así como del silicio puede ser una alternativa para reducir la incidencia de Botrytis cinerea en el cultivo de fresa. El objetivo de la presente investigación fue evaluar la actividad biológica de silicio, níquel, nanopartículas de plata (AgNPs), nanopartículas de cobre (CuNPs) y la combinación de nanopartículas de plata y cobre (Ag/CuNPs) para control de Botrytis cinerea aplicados vía foliar en plantas de fresa (Fragaria x ananassa Duch.) cv. ‘Festival’ bajo sistema hidropónico abierto en condiciones de invernadero y en medios de cultivos PDA. Las dosis evaluadas fueron para níquel 2.5 y 7.5 mg L-1 ; para silicio 50 y 100 mg L-1 ; para AgNPs 15 y 25 mg L-1 ; y Ag/CuNPs 15 y 25 mg L-1 . Se midió la incidencia del hongo en frutos de fresa y la efectividad biológica de los tratamientos. Pruebas en laboratorio de los mismos tratamientos en tres concentraciones diferentes (baja, media y alta) fueron realizadas. En general, los tratamientos Ag/CuNPs, AgNPs en dosis alta y níquel en dosis baja disminuyeron significativamente la incidencia de la enfermedad en los frutos. Pruebas de laboratorio en medios de cultivo PDA en cajas de Petri en la dosis baja de níquel, 2.5 mg L-1 , seguido por AgNPs en dosis alta 35 mg L-1 , fueron los que presentaron mayor porcentaje de inhibición del micelio Botrytis cinerea. En plantas y en medios de cultivo AgNPs y níquel promovieron respuestas positivas en los parámetros evaluados en comparación con el testigo; por lo que se considera que tiene potencial en el manejo de Botrytis cinerea en este estudio.
Palabras clave: AgNPs, incidencia, efectividad biológica

- Abbott, W. (1925). A method of computing the effectiveness of an insecticide. Journal of Economic Entomology, 18: 256-267.
- Asay, D., & Kim, S. (2005). Evolution of the Adsorbed Water Layer Structure on Silicon Oxide at Room Temperature. The Journal of Physical Chemistry B, 109(35), 16760- 16763. doi: 10.1021/jp053042o
- Baraona M., y Sancho E. (1992). Fruticultura especial: manzana, melocotón fresa y mora. Fascículo 6. EUNED. San José, Costa Rica. 140 p.
- Barcelos, J., Reis, H., Godoy, C., Gratão, P., Furlani Junior, E., y Putti, F. et al. (2018) Impacto de la aplicación de níquel foliar en la actividad de la ureasa, metabolismo antioxidante y control del oídio (Microsphaera diffusa) en plantas de soja. Plant Pathology, 67 (7), 1502-1513. doi: 10.1111 / ppa.12871
- Bardas, G., Myresiotis, C., & Karaoglanidis, G. (2008). Stability and Fitness of Anilinopyrimidine-Resistant Strains of Botrytis cinerea. Phytopathology, 98(4), 443-450. doi: 10.1094/phyto-98-4-0443
- Barnett, H.,& Hunter, B. (2006). Illustrated genera of imperfect fungi. Fourth edition. Burgess publishing company. New York, USA. 241 p.
- Blanco, C., de Santos, B., y Romero, F. (2006). Relationship between Concentrations of Botrytis Cinerea Conidia in Air, Environmental Conditions, and the Incidence of Grey Mould in Strawberry Flowers and Fruits. European Journal Of Plant Pathology, 114(4), 415-425. doi: 10.1007/s10658-006-0007-3
- Brown, P., Welch, R., & Cary, E. (1987). Nickel: A Micronutrient Essential for Higher Plants. Plant physiology, 85(3), 801-803. doi: 10.1104/pp.85.3.801
- Card, S., Walter, M., Jaspers, M., Sztejnberg, A., & Stewart, A. (2009). Targeted selection of antagonistic microorganisms for control of Botrytis cinerea of strawberry in New Zealand. Australasian Plant Pathology, 38(2), 183. doi: 10.1071/ap08097
- Carlini, C., & Grossi-de-Sá, M. (2002). Plant toxic proteins with insecticidal properties. A review on their potentialities as bioinsecticides. Toxicon, 40(11), 1515-1539. doi: 10.1016/s0041-0101(02)00240-4
- Cioffi, N., Torsi, L., Ditaranto, N., Tantillo, G., Ghibelli, L., & Sabbatini, L. et al. (2005). Copper Nanoparticle/Polymer Composites with Antifungal and Bacteriostatic Properties. Chemistry Of Materials, 17(21), 5255-5262. doi: 10.1021/cm0505244
- Ciurli, S. (2001). Electronic structure of the nickel ions in the active site of urease. Chemistry (Easton), 99-100. Conway, B., & Bockris, J. (1958). The Mechanism of Electrolytic Metal Deposition. Proceedings of The Royal Society A: Mathematical, Physical and Engineering Sciences, 248(1254), 394-403. doi: 10.1098/rspa.1958.0251
- Dixon, N., Gazzola, C., Watters, J., Blakeley, R., & Zerner, B. (1975). Inhibition of jack bean urease (EC 3.5.1.5) by acetohydroxamic acid and by phosphoramidate. Equivalent weight for urease. Journal of The American Chemical Society, 97(14), 4130-4131. doi: 10.1021/ja00847a044
- Feng, Q., Wu, J., Chen, G., Cui, F., Kim, T., & Kim, J. (2000). A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus. Journal of Biomedical Materials Research, 52(4), 662-668. doi: 10.1002/1097- 4636(20001215)52:4<662:aid-jbm10>3.0.co;2-3
- Fokkema, N. (1973). El papel de los hongos saprófitos en el antagonismo contra Dreschlera sorokiniana (Helminthosporium sativum) en placas de agar y hojas de centeno con polen. Fisiol. Planta Pathol. 3: 15-105.
- Foster, H., Ditta, I., Varghese, S., & Steele, A. (2011). Photocatalytic disinfection using titanium dioxide: spectrum and mechanism of antimicrobial activity. Applied Microbiology And Biotechnology, 90(6), 1847-1868. doi: 10.1007/s00253-011-3213-7
- Glover, R., Miller, J., & Hutchison, J. (2011). Generation of Metal Nanoparticles from Silver and Copper Objects: Nanoparticle Dynamics on Surfaces and Potential Sources of Nanoparticles in the Environment. ACS Nano, 5(11), 8950-8957. doi: 10.1021/nn2031319
- Hodgson, E., & Fridovich, I. (1975). Interaction of bovine erythrocyte superoxide dismutase with hydrogen peroxide. Inactivation of the enzyme. Biochemistry, 14(24), 5294-5299. doi: 10.1021/bi00695a010
- Kim, J. S., Kuk, E., Yu, K. N., Kim, J. H., Park, S. J., Lee, H. J., ... & Kim, Y. K. (2007). Antimicrobial effects of silver nanoparticles. Nanomedicine: Nanotechnology, Biology and Medicine, 3(1), 95-101.
- Kim, K., Sung, W, Moon, S., Choi, J., Kim J., & Lee, D. (2008). Antifungal effect of silver nanoparticles on dermatophytes. Microbiology and Biotechnology, 18(8), 1482-1484
- Kim, S., Jung, J., Lamsal, K., Kim, Y., Min, J., & Lee, Y. (2012). Antifungal Effects of Silver Nanoparticles (AgNPs) against Various Plant Pathogenic Fungi. Mycobiology, 40(1), 53- 58. doi: 10.5941/myco.2012.40.1.053
- Kovach, J., Petzoldt, R., & Harman, G. (2000). Use of Honey Bees and Bumble Bees to Disseminate Trichoderma harzianum 1295-22 to Strawberries for Botrytis Control. Biological Control, 18(3), 235-242. doi: 10.1006/bcon.2000.0839
- Krishnaraj, C., Ramachandran, R., Mohan, K., & Kalaichelvan, P. (2012). Optimization for rapid synthesis of silver nanoparticles and its effect on phytopathogenic fungi. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 93, 95-99. doi: 10.1016/j.saa.2012.03.002
- Kubacka, A., Diez, M., Rojo, D., Bargiela, R., Ciordia, S., & Zapico, I. et al. (2014). Understanding the antimicrobial mechanism of TiO2-based nanocomposite films in a pathogenic bacterium. Scientific Reports, 4(1). doi: 10.1038/srep04134
- Kumar, A., Vemula, P., Ajayan, P., & John, G. (2008). Silver-nanoparticle-embedded antimicrobial paints based on vegetable oil. Nature Materials, 7(3), 236-241. doi: 10.1038/nmat2099
- Kwak, S., Kim, S., & Kim, S. (2001). Hybrid Organic/Inorganic Reverse Osmosis (RO) Membrane for Bactericidal Anti-Fouling. 1. Preparation and Characterization of TiO2Nanoparticle Self-Assembled Aromatic Polyamide Thin-Film-Composite (TFC) Membrane. Environmental Science & Technology, 35(11), 2388-2394. doi: 10.1021/es0017099
- Lamsal, K., Kim, S., Jung, J., Kim, Y., Kim, K., y Lee, Y. (2011a). Inhibition Effects of Silver Nanoparticles against Powdery Mildews on Cucumber and Pumpkin. Mycobiology, 39(1), 26. doi: 10.4489/myco.2011.39.1.026
- Lamsal, K., Kim, S., Jung, J., Kim, Y., Kim, K., y Lee, Y. (2011b). Application of Silver Nanoparticles for the Control of Colletotrichum Species In Vitro and Pepper Anthracnose Disease in Field. Mycobiology, 39(3), 194-199. doi: 10.5941/myco.2011.39.3.194
- Lee, H., Park, H, Lee, Y., Kim, K., & Park, S. (2007). A practical procedure for producing silver nanocoated fabric and its antibacterial evaluation for biomedical applications. Chemical Communications, (28), 2959-2961.
- Liu, Y., He, L., Mustapha, A., Li, H., Hu, Z., & Lin, M. (2009). Antibacterial activities of zinc oxide nanoparticles against Escherichia coli O157:H7. Journal Of Applied Microbiology, 107(4), 1193-1201. doi: 10.1111/j.1365-2672.2009.04303.x
- Marambio, C., & Hoek, E. (2010). A review of the antibacterial effects of silver nanomaterials and potential implications for human health and the environment. Journal of Nanoparticle Research, 12(5), 1531-1551.
- McCord, J., & Fridovich, I. (1969). Superoxide dismutase. An enzymic function for erythrocuprein (hemocuprein). The Journal of Biological Chemistry. 244(22), 6049- 6055.http://www.jbc.org/content/244/22/6049
- McCord, J., Keele, B., & Fridovich, I. (1971). An Enzyme-Based Theory of Obligate Anaerobiosis: The Physiological Function of Superoxide Dismutase. Proceedings of The National Academy Of Sciences, 68(5), 1024-1027. doi: 10.1073/pnas.68.5.1024
- McDonnell, G., & Russell, A. D. (1999). Antiseptics and Disinfectants: Activity, Action, and Resistance. Clinical Microbiology Reviews, 12(1), 147–179. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC88911/
- Mertely, J., MacKenzie, S., & Legard, D. (2002). Timing of Fungicide Applications for Botrytis cinerea Based on Development Stage of Strawberry Flowers and Fruit. Plant Disease, 86(9), 1019-1024. doi: 10.1094/pdis.2002.86.9.1019
- Min, J., Kim, K., Kim, S., Jung, J., Lamsal, K., & Kim, S. et al. (2009). Effects of Colloidal Silver Nanoparticles on Sclerotium-Forming Phytopathogenic Fungi. The Plant Pathology Journal, 25(4), 376-380. doi: 10.5423/ppj.2009.25.4.376
- Morones, J., Elechiguerra, J., Camacho, A., Holt, K., Kouri, J., Ramírez, J., & Yacaman, M. (2005). The bactericidal effect of silver nanoparticles. Nanotechnology, 16(10), 2346- 2353. doi: 10.1088/0957-4484/16/10/059
- Oliveira, A., Gomes, V., Sales, M., Fernandes, K., Carlini, C., & Xavier-Filho, J. (1999). The toxicity of jack bean [Canavalia ensiformis (L.) DC.] canatoxin to plant pathogenic fungi. Revista Brasileira De Biologic, 59(1), 59-62. doi: 10.1590/s0034- 71081999000100008
- Ouda, S. (2014). Antifungal Activity of Silver and Copper Nanoparticles on Two Plant Pathogens, Alternaria alternata and Botrytis cinerea. Research Journal of Microbiology, 9(1), 34-42. doi: 10.3923/jm.2014.34.42
- Pal, S., Tak, Y., & Song, J. (2007). Does the Antibacterial Activity of Silver Nanoparticles Depend on the Shape of the Nanoparticle? A Study of the Gram-Negative Bacterium Escherichia coli. Applied And Environmental Microbiology, 73(6), 1712-1720. doi: 10.1128/aem.02218-06
- Polacco, J., Mazzafera, P., & Tezotto, T. (2013). Opinion – Nickel and urease in plants: Still many knowledge gaps. Plant Science, 199–200, 79–90. doi: 10.1016/j.plantsci.2012.10.010
- Rolke, Y., Liu, S., Quidde, T., Williamson, B., Schouten, A., & Weltring, K. et al. (2004). Functional analysis of H2O2-generating systems in Botrytis cinerea: the major Cu-Znsuperoxide dismutase (BCSOD1) contributes to virulence on French bean, whereas a glucose oxidase (BCGOD1) is dispensable. Molecular Plant Pathology, 5(1), 17-27. doi: 10.1111/j.1364-3703.2004.00201.x
- Santiago, E., Moreno, D.E., Vilchis, R., Martinez, J., Trejo, L.I., & Leyva, S.G. (2017). Fertilización foliar de silicio en el control de Botrytis cinerea en fresa (Fragaria x ananassa Duch) en hidroponía. Revista Mexicana de Fitopatología. 34 (132), 13-19.
- Servicio de Información Agroalimentaria y Pesquera (SIAP). (2017). Consultada 09-02- 2018 en http://www.siacon.sagarpa.gob.mx.
- Sesan, T., (2003). Manejo sostenible de moho gris (Botrytis cinerea) en vid, fresa y plantas ornamentales, en: Huang, HG, Acharya, SN (Eds.), Avances en el Manejo de Enfermedades de Plantas, Research Signpost, Kerala, India, pp. 121- 152.
- Vance, C., & Miller, A. (1998). Spectroscopic Comparisons of the pH Dependencies of Fe-Substituted (Mn)-Superoxide Dismutase and Fe-Superoxide Dismutase†. Biochemistry, 37(16), 5518-5527. doi: 10.1021/bi972580r
- Vigneshwaran, N., Kathe, A., Varadarajan, P., Nachane, R., & Balasubramanya, R. (2007). Functional finishing of cotton fabrics using silver nanoparticles. Journal of nanoscience and nanotechnology, 7(6), 1893-1897.
- Yang, S., Wu, J., & Christou, A. (2006). Initial stage of silver electrochemical migration degradation. Microelectronics Reliability, 46(9–11), 1915–1921. Doi: 10.1016/j.microrel.2006.07.080

