Impacto de la fertilización con K y Mn sobre la severidad de la podredumbre carbonosa (Macrophomina phaseolina) en plantas de soja
Publicado: 5 de enero de 2016
Por: Natalia Tobar Gómez (UBA - CONICET), Constanza Seijas, Agustina Elesgaray, Marcelo Carmona (Cátedra de Fitopatología, Facultad de Agronomía-UBA); Federico Spagnoletti, Raúl Lavado (Instituto de Investigaciones en Biociencias Agrícolas y Ambientales (INBA)-CONICET/UBA. Argentina
INTRODUCCIÓN
La producción y la calidad del grano de soja son afectadas por numerosos factores, como el manejo del suelo y el cultivo, condiciones ambientales desfavorables, agentes bióticos como malezas, plagas y enfermedades, destacándose en importancia estos últimos (Hartman et al., 1999). La soja es un hospedante importante del hongo M. phaseolina (Tassi) Goid, entre más de 500 especies afectadas. Este patógeno causa la pudrición carbonosa de la base del tallo (Carmona et al., 2009).
M. phaseolina, sobrevive en el suelo, en el rastrojo o en otros hospedantes y se trasmite por semilla (Formento, 2011). La temperatura óptima para cumplir su ciclo, que dura entre 14 a 21 días, oscila entre 28 y 35°C. Los síntomas más severos los presenta cuando se presentan condiciones ambientales estresantes para el cultivo, suelos compactados, escasa cobertura y plantas con sistema radical deficiente (Pérez Brandan et al., 2009; Formento, 2011).
Además, altas temperaturas y déficit hídrico estimula el desarrollo del hongo, haciéndolo dominante en regiones tropicales y subtropicales (Pérez Brandan et al., 2009; Carmona et al., 2009). La pudrición carbonosa de la base del tallo puede aparecer en cualquier estado fenológico del cultivo y su aparición produce elevados porcentajes de plantas muertas en los lotes (Pérez Brandan et al., 2009; Carmona et al., 2009). Los síntomas de dicha enfermedad varían según el momento del año en el cual la planta se infecta.
Frente a infecciones luego de la emergencia, los síntomas son lesiones de color pardo con manchas oscuras en cotiledones. Cuando la infección se produce desde la etapa de hoja unifoliada en adelante, los hipocótiles aparecen con manchas marrón oscuro a negro, pudiéndose extender hasta el tallo, provocando la muerte de la plántula infectada si las condiciones ambientales predisponentes persisten (Pérez Brandan et al., 2009; Carmona et al., 2009). En plantas adultas, a comienzo de floración el hongo causa lesiones en las raíces, tallos, vainas y semillas. Produce obstrucción del sistema vascular por la producción de microesclerocios de color negro, debajo de la corteza y en la medula, provocando el marchitamiento y muerte de las plantas. En esta etapa es cuando se observan lesiones negras-grises en la base del tallo, generalmente con líneas oscuras en la médula (Pérez Brandan et al., 2009; Carmona et al., 2009). El cultivo infectado en el campo muestra amarillamiento prematuro en manchas.
En condiciones graves de la enfermedad, el cultivo puede ser afectado en áreas grandes del campo (Gupta y Chauhan, 2005).
El hongo M. phaseolina merece atención, ya que la importancia de la enfermedad que causa está incrementándose sostenidamente, independientemente del manejo agrícola que se utilice (Carmona y Reis, 2012). En ciclos agrícolas recientes (2000/01, 2002/03, 2004/05 y 2011/12) se desencadenaron, epidemias severas de podredumbre carbonosa en el cultivo de soja, que causaron serias pérdidas en varias provincias de la Argentina y pérdidas totales en algunos lotes (Resnikov et al., 2013).La dificultad del control de esta enfermedad, constituye una amenaza a la sustentabilidad agrícola. No existen cultivos resistentes ni fungicidas que vayan a raíz.
En condiciones graves de la enfermedad, el cultivo puede ser afectado en áreas grandes del campo (Gupta y Chauhan, 2005).
El hongo M. phaseolina merece atención, ya que la importancia de la enfermedad que causa está incrementándose sostenidamente, independientemente del manejo agrícola que se utilice (Carmona y Reis, 2012). En ciclos agrícolas recientes (2000/01, 2002/03, 2004/05 y 2011/12) se desencadenaron, epidemias severas de podredumbre carbonosa en el cultivo de soja, que causaron serias pérdidas en varias provincias de la Argentina y pérdidas totales en algunos lotes (Resnikov et al., 2013).La dificultad del control de esta enfermedad, constituye una amenaza a la sustentabilidad agrícola. No existen cultivos resistentes ni fungicidas que vayan a raíz.
Un aspecto poco estudiado, para controlar enfermedades de muy difícil control como ésta, es el manejo de la nutrición del cultivo, y como ésta puede afectar la epidemiologia e intensidad de la enfermedad. La forma en que los nutrientes afectan el desarrollo de la enfermedad es a través de cambios en la fisiología de la planta, afectando directamente al patógeno, o a ambos. Cuando un patógeno de suelo infecta la raíz, compromete su habilidad para tomar agua y nutrientes, por lo tanto afecta la translocación y la utilización eficiente de los nutrientes, causando deficiencias (Huber y Graham, 1999). Precisamente, cuando las plantas se encuentran bajo deficiencias, la fertilización reduce la severidad de la enfermedad y optimiza el crecimiento del cultivo (Dordas, 2008).
Los nutrientes generan cambios fisiológicos y bioquímicos sobre la pared celular, la permeabilidad de la membrana y composición química del hospedante, pudiendo aumentar la concentración de compuestos fenólicos (Graham y Webb, 1991).
Uno de los nutrientes que más efectivamente afecta a las enfermedades de las plantas es el potasio (K). Este nutriente se encuentra en el suelo en forma inorgánica, y es altamente móvil dentro de la planta. Los fertilizantes más comunes son cloruro y sulfato de potasio (Daroub y Snyder, 2007; Prabhu et al, 2007). Entre sus funciones se destaca que aumenta el crecimiento de las raíces; mejora la absorción de agua y nutrientes; optimiza la función de las enzimas involucradas en el crecimiento; reduce la respiración; ayuda a la translocación de azucares y de almidón; mantiene la turgencia celular; previene la degradación de clorofila e interviene en la reducción de la severidad de las enfermedades (Marschner, 1995; Prabhu et al., 2007). Perrenoud (1990) encontró que el K disminuye hasta en un 70% de los casos la incidencia de enfermedades fúngicas y que el rendimiento se ve favorecido en las plantas infectadas que se encontraban fertilizadas.
El efecto de la aplicación de este nutriente contra las enfermedades, es el aumento del grosor de las cutículas, primera barrera física para la infección. También reduce la acumulación de N y azúcares en los tejidos, que los hacen más predisponentes al ataque de patógenos y permite una rápida cicatrización de las heridas, acumulando alrededor de la misma compuestos tóxicos para los hongos (Spectrum Analytic, 2008). Por otro lado, plantas resistentes a enfermedades contienen más K que aquellas susceptibles (Prabhu et al., 2007). En plantas de soja, además, se asocia a la producción de fenoles y fitoalexinas, compuestos con propiedades antifúngicas (Couretot y Ferraris, 2007; Carmona y Sautua, 2011)
La relación de la fertilización potásica con la enfermedad producida por el hongo M. phaseolina fue estudiada en diferentes cultivos. Shaw en el año 1924 encontró que suelos con deficiencias de K favorecen el ataque de Macrophomina corchori. Por otro lado, un cultivo de girasol fertilizado con nitrógeno (N), incrementó la susceptibilidad al hongo, mientras que altos niveles de fósforo (P) y K la disminuyeron (Zazzerini et al., 1985; Sivaprakasam et al., 1995). Por otra parte De y Chattopadhyay (1992), evidenciaron en dos variedades de jute (Corchorus olitorius y Corchorus capsularis) que incrementar los niveles de K en el suelo, redujo los daños causados por M. phaseolina. Algo similar ocurrió en plantas de lentejas (Sinha y Sinha, 2004). Por su parte, Indra y Grove (1998) encontraron, que el N y el P incrementaron la severidad de la pudrición carbonosa en Phaseolus vulgaris, mientras que la aplicación de K la redujo. Finalmente, en ensayos a campo sembrados con soja, se demostró que fertilizar con K y P incrementaron la resistencia a M. phaseolina (Csöndes et al., 2008).
Los micronutrientes también juegan un rol importante en la reducción de la severidad de enfermedades de las plantas. Este efecto es atribuido, tal como ocurre en los macronutrientes, a cambios fisiológicos y bioquímicos (Marschner, 1995). El manganeso (Mn) es probablemente el micronutriente más estudiado sobre el desarrollo de la resistencia a enfermedades foliares y de raíz (Graham y Webb, 1991). El Mn se encuentra en el suelo como Mn2+ disuelto en la solución, como Mn2+ intercambiable, Mn orgánicamente ligado y en sus formas oxidadas. La solubilidad es afectada por factores como pH, el potencial redox y los distintos tipos de complejos que forma. La planta lo adsorbe como Mn2+ (Marschner, 1995; Dechen y Nachtigall, 2006, Daroub y Snyder, 2007). El Mn cumple un rol preponderante en la síntesis de clorofila y se encuentra involucrado en la activación de enzimas (Dechen y Nachtigall, 2006). El rol de este elemento en la resistencia a las enfermedades, está relacionada con la ruta metabólica del ácido shikímico. El Mn interviene como cofactor para varias enzimas en la biosíntesis de metabolitos secundarios asociados a ella, como flavonoides, fitoalexinas y los precursores de la lignina (Römheld y Marschner, 1991; Graham, 1983; Krauss, 1999; Malavolta, 2006; Spectrum Analytic, 2006). También inhibe compuestos fitotóxicos solubles, y la actividad de enzimas como aminopeptidasas y pectinesterasas (Krauss, 1999). Si bien se ha reportado el efecto del Mn sobre la disminución de numerosas enfermedades provocadas por hongos y bacterias, no hay información suficiente, en ensayos in vivo, sobre cómo este micronutriente afecta específicamente a la pudrición carbonosa de la base del tallo, en cultivos de soja.
Por su parte, la utilización de la fertilización como una medida de manejo sustentable para el control de enfermedades no se encuentra intensamente estudiada en nuestro país. Este trabajo es la primera aproximación al estudio del efecto de la fertilización con K y Mn, sobre la intensidad y severidad de una de las enfermedades más importantes de la soja, M. phaseolina.
MATERIALES Y MÉTODOS
El ensayo se realizó en el invernáculo de la Cátedra de Fitopatología de la Facultad de Agronomía de la UBA. Se utilizó como hospedante plantas de soja de la variedad N 4990. Se trabajó con macetas de 1.5kg de capacidad, conteniendo un sustrato comercial a base de turba que se mezcló en proporciones 4:1 con arena previamente lavada y secada. De acuerdo con evaluaciones previas, se agregó un 10% de arroz inoculado con M. phaseolina según la técnica de Pastor- Corrales y Abawi (1988). Simultáneamente, se aplicó al suelo sulfato de potasio (K2SO4) y sulfato de manganeso (MnSO4), en forma de riego. Las dosis utilizadas fueron equivalentes a 100 y 200 kg ha-1 de K2SO4 y una única dosis de 600 g ha-1 MnSO4. Las macetas se incubaron durante 5 días y luego se sembraron las semillas esterilizadas superficialmente. Para ello se colocaran en etanol 70% durante un minuto, luego hipoclorito de sodio al 3% y finalmente tres lavados consecutivos con agua destilada estéril. El ensayo contó con 6 repeticiones y tuvo una duración de 70 días, alcanzando el estado fenológico de R4.
Como medida de la severidad de la enfermedad se determinó la intensidad del ataque del hongo medido como microesclerocios. Para ello se utilizó la técnica empleada por Mengistu et al. (2007) y Resnikov et al. (2013). Se tomaron las raíces, se lavaron y se secaron en estufa durante 7 días a 40°C, luego se molieron y tamizaron por malla de 1mm. Posteriormente se tomaron 0,005g de tejido molido, se esterilizó con hipoclorito de sodio al 3% y enjuagó con agua destilada estéril. Por otro lado se preparó Agar papa glucosado (PDA), autoclavado y enfriado, al que previamente se le agregó antibiótico Rifampicina (100mg l-1) para evitar el crecimiento bacteriano y el fungicida metalaxil (224mg l-1) para reducir las contaminaciones fungicas, luego se volcó 5ml del medio en una placa de Petri junto con las raíces molidas y desinfectadas.
Cada placa se incubo en oscuridad por 3 días, contabilizando unidades formadoras de colonias (UFC gr de raíz -1) como medida de severidad de la enfermedad y se calculo el porcentaje de control. El ensayo se realizó por sextuplicado. Se realizó un análisis de la varianza (ANOVA) para contrastar los tratamientos.
RESULTADOS Y DISCUSIÓN
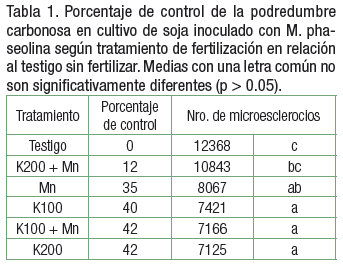
Los menores valores de UFC por gramo de raíz se obtuvo cuando se aplicó la dosis de 200kg de sulfato de potasio ha-1 (7124 UFC g-1), la dosis de 100 kg de sulfato de potasio ha-1 combinada con 600g de sulfato de manganeso (7166 UFC g-1) y la dosis de 100kg de sulfato de potasio ha-1 (7421UFC g-1), esto indica una reducción de la enfermedad en comparación con el testigo sin tratar con fertilizante (12 368 UFC g-1). Por otro lado aplicar al suelo 600gr de sulfato de manganeso ha-1 también presentó una reducción significativa del número de UFC g-1.
Al mismo tiempo el tratamiento de 200kg de sulfato de potasio ha-1 con 600g de sulfato de manganeso ha-1 (10 843 UFC g-1) no se diferenció del testigo (Figuras 1 y 2).
En concordancia con los datos obtenidos, los tratamientos con 200kg de sulfato de potasio ha-1 y 100 kg de sulfato de potasio ha-1 combinada con 600g de sulfato de manganeso obtuvieron los porcentajes de control más altos, controlando a la enfermedad en un 42%. Un valor similar obtuvo la dosis de 100kg de sulfato de potasio ha-1. Finalmente, el tratamiento que presenta el menor control de la intensidad de la enfermedad producida por M. phaseolina es la aplicación de 200 kg de K ha-1 con 600gr de Mn ha-1 con un 12% (Tabla 1).
La metodología utilizada de medición de UFC por gramo de raíz es muy utilizada para evaluar intensidad de enfermedad y como ésta es afectada por diferentes tratamientos propuestos. Sin embargo, esta es la primera vez que se utiliza esta metodología para evaluar el efecto del K y Mn sobre la severidad de M. phaseolina. Si bien existen estudios donde evalúan el efecto de la fertilización con distintos nutrientes y distintas enfermedades, los trabajos relativos al efecto de la aplicación de K con respecto a la podredumbre carbonosa de la base del tallo en soja y otros cultivos son escasos mientras que la evaluación de la fertilización con Mn es inexistente. Ensayos en otras leguminosas demostraron reducción de los daños ocurridos por M. phaseolina cuando se aplicó K (Indra y Grove, 1998; Sinha y Sinha, 2004) mientras que en soja la fertilización con K y fósforo incrementó la resistencia al patógeno (Csöndes et al., 2008).
CONCLUSIONES
La aplicación de dosis variables de K, combinadas o no con Mn, demostraron controlar en un 40% o más, a la enfermedad producida por el hongo M. phaseolina, medido como UFC g-1 de raíz. Sin embargo, el menor nivel de control ocurrió con la combinación de la dosis más alta de K con Mn. Esto determina la necesidad de ajustar las dosis ideales de estos nutrientes que reduzcan el efecto de la enfermedad.
BIBLIOGRAFÍA
- Carmona, M., y E.M. Reis. 2012. Enfermedades en cultivos bajo siembra directa en Argentina y Brasil: pasado, presente y prospectivas de manejo. Revista Soja 2012, AAPRESID Pp.63-75.
- Carmona, M., Gally, M., y F. Sautua. 2009. Identificación y Manejo de las Enfermedades. Manual del cultivo de soja en Fernando Oscar García; Ignacio Antonio Ciampitti; Héctor Baigorri. Pp. 99-127. Editores- 1a ed. - Buenos Aires: International Plant Nutrition Institute, 2009. 180 pag.
- Carmona, M., y F. Sautua. 2011. Impacto de la nutrición y de fosfitos en el manejo de enfermedades en cultivos extensivos de la región pampeana. Actas Simposio Fertilizar 2011. Ed IPNI (International Plant Nutrition Institute) y Fertilizar, 18 y 19 de Mayo, Rosario, Argentina. Pp. 73- 82
- Couretot, L., y G. Ferraris. 2007. Nuevas estrategias de producción para alcanzar los rendimientos potenciales en soja. Uso de cloruro de potasio en combinación con fungicidas. Soja Campaña 2006-07. Available at. http://www.inta.gov.ar/pergamino/info/documentos/ KCL_SojaO/.pdf
- Csöndes. I., Balikó, K., y A. Dégenhardt. 2008. Effect of different nutrient levels on the resistance of soybean to Macrophomina phaseolina infection in field experiments. Acta Agronomica Hungarica. 53:357-362
- Daroub, S.H., y G.H. Snyder. 2007. The chemistry of plant nutrients in soil. In Datnoff L, Elmer W. and Huber D. eds. Mineral nutrition and plant disease. The American Phytopathological society. Pp. 1-7
- De, B.K., y S.B. Chattopadhyay. 1992. Effect of potash on stem rot disease of jute caused by Macrophomina phaseolina. J. Mycopath. Res., 30, 51–55.
- Dechen, A.R., y G.R. Nachtigall. 2006. Micronutrientes. In: FERNADES, M.S. (Ed.) Nutrição mineral de plantas. Viçosa. Soc. Bras. Ci. Sol. Pp 328-352.
- Dordas, C. 2008. Role of nutrients in controlling plant
- diseases in sustainable agriculture. A review. Agron. Sustain. Dev. 28:33-46
- Formento, A.N. 2011. Podredumbre carbonosa (Macrophomina phaseolina). En Las enfermedades de la soja y su importancia en los países del Mercosur. Muñoz, R. y Sillon, M. (Eds). Pp.69-73
- Graham, D.R. 1983. Effects of nutrients stress on susceptibility of plants to disease with particular reference to the trace elements. Adv. Bot. Res. 10:221-276
- Graham, R.D. y M.J. Webb. 1991. Micronutrients and disease resistance and tolerance in plants. Pp..329- 370. In J.J. Mortvedt, F.R. Cox, L.M. Shuman, and R.M. Welch eds. Micronutrients in Agriculture. 2nd edition. Soil Science Society of America. Gupta, G.K., y G.S. Chauhan. 2005. Symptoms, identification and management of soybean diseases, technical bulletin, National Research Centre for Soybean (ICAR), Indore, India. 92
- Hartman, G.L., Sinclair, J.B., y J.C. Rupe. 1999. Compendium of soybean diseases. 4th Ed. APS Press, The American Phytopathological Society, St. Paul MN, USA. Pp. 100.
- Huber, D.M., y R.D. Graham. 1999. The role of nutrition in crop resistance and tolerance to disease, in: Rengel Z. (Ed.), Mineral nutrition of crops fundamental mechanisms and implications, Food Product Press, New York. Pp. 205–226.
- Indra, H., y R.K. Grover. 1989. Influence of host nutrition on the efficiency of fungicides in controlling Macrophomina phaseolina on mung bean. Plant Dis. Res. 4: 170–173.
- Krauss, A. 1999. Balanced Nutrition and Biotic Stress, IFA Agricultural Conference on Managing Plant Nutrition, 29 June-2 July 1999, Barcelona, Spain. Malavolta, E. 2006. Manual de nutrição mineral de plantas. Ceres. 638 pag
- Marschner, H. 1995. Mineral nutrition of Higher Plants. 2nd ed., Academic Press. Pp. 436-460.
- Mengistu, A., Ray J.D., Smith, J.R., y R.L. Paris. 2007. Charcoal Rot Disease Assessment of Soybean Genotypes Using a Colony-Forming Unit Index. Crop Science, 47: 2453-2461
- Pastor-Corrales, M.A., y G.S. Abawi. 1988. Reactions of selected bean accessions to infection by Macrophomina phaseolina. Plant Disease. 72:39-41.
- Pérez Brandan, C., Díaz, C., Carmona, M., y G. March. 2009. Comportamiento de variedades de soja frente a infecciones naturales de la podredumbre carbonosa de la soja (Macrophomina phaseolina) en Salta (Argentina). EEAA Marcos Juárez Ed: INTA. Pp. 41-45.
- Perrenoud, S. 1990. Potassium and plant health. 2.ed. Bern: Inter62. Summa Phytopathol., 33: 56-62.
- Prabhu, A., Fageria, N., Huber, D., y F. Rodríguez. 2007. Potassium and plant disease. In Datnoff L, Elmer W. and Huber D. (Eds). Mineral nutrition and plant disease. The American Phytopathological society Resnikov, S., De Lisi, V., Gonzalez, V., Vellice, G., Castagnaro, A.P., y D.L.
- Ploper. 2013a. Estudios para el control de la podredumbre carbonosa y enfermedades de fin de ciclo de la soja en el Norte argentino. Jornadas Concurso BASF Top Ciencia. Römheld, V., y H. Marschner. 1991. Function of micronutrients in plants, in: Mortvedt J.J., Cox F.R., Shuman L.M., Welch R.M. (Eds.), Micronutrients in Agriculture. Soil Science Society of America, Inc. Madison, Wisconsin, USA. Pp. 297–328
- Sinha, R.K.P., y B.B.P. Sinha. 2004. Effect of potash botanicals and fungicides against wilt disease complex in lentil. Ann. Plant Protect. Sci. 12: 454–455.
- Sivaprakasam, K., K. Pillayarswamy, y S. Rajaram. 1975. Effect of NPK on root rot disease incidence in sunflower. Madras Agric. J. 62: 308–309
- Spectrum Analytic, Inc. 2006. The relationship between nutrients and other elements to plant diseases. Washington. Pp. 17
- Zazzerini, A., M. Monotti, R. Buonaurio, y V. Piran. 1985. Effects of some environmental and agronomic factors on charcoal rot of sunflower. Helia, 8:45–49
Este trabajo forma parte de la tesis de maestría denominada “Efecto de la Fertilización con Potasio y Manganeso sobre la pudrición carbonosa de la base del tallo causada por el hongo Macrophomina phaseolina”
Contenido del evento:
Temas relacionados:
Autores:
Universidad de Buenos Aires
Universidad de Buenos Aires
Universidad de Buenos Aires
Universidad de Buenos Aires
Mostrar más
Recomendar
Comentar
Compartir
16 de abril de 2020
Me parece interesante para prevenir la podredumbre carbonosa y evitar pérdidas en el cultivo de la soja
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.



