RESUMEN
Con el objetivo de evaluar el potencial del hongo Trichoderma spp, se llevaron a cabo dos bioensayos en el año 2006 en el Laboratorio de Microbiología de la Escuela Superior Politécnica Agropecuaria de Manabí Manuel Félix López (ESPAM MFL). En el primer bioensayo se evaluó la velocidad del crecimiento de Trichoderma spp., en dos medios de cultivo: Papa dextrosa agar (PDA), Agar extracto de malta (AEM). Se utilizaron ocho cepas de Trichoderma spp., aisladas de tres áreas de producción del campus de la ESPAM MFL, localizada en el sitio EL Limón, Calceta-Manabí. El diseño experimental utilizado fue un Completamente Aleatorizado (DCA) con tres réplicas. Los mejores resultados se obtuvieron en las cepas provenientes del área de cultivo de cacao TAC1 y TAC2, así como la perteneciente a la unidad de producción ecológica TAE1; y el medio de cultivo PDA. Estos materiales sirvieron de base para el bioensayo 2, en donde se midió la capacidad antagónica de las cepas seleccionadas en el bioensayo 1 frente a los fitopatógenos Fusarium spp., Sclerotinia spp., y Rhizopus spp., el diseño experimental utilizado fue un DCA con cuatro réplicas. Donde se corroboró que las cepas de Trichoderma spp. TAC1, TAC2 y TAE1, ejercen un control del 100% sobre los tres patógenos al quinto día evaluado. La que tiene mejores características para ser multiplicada y liberada en campo es la cepa TAC2, ya que su esporulación es mayor; esta característica es fundamental para que el hongo sea establecido con mayor rapidez en un campo determinado.
ABSTRACT
In order to evaluate the potential of the fungus Trichoderma spp. as a biological control agent of various phytopathogens affecting different cultivations during every cycle of evolution, two assays were carried out in the year 2006. The first assay evaluated the speed of rise of the Trichoderma spp., in two cultivations: 1) Papa Agar Dextrosa (PDA); and , 2) Agar Extract of Malta (AEM). The work procedure in this first phase of study was established using 8 “strains” of Trichoderma spp., insulate in three area of production in the Superior Polytechnic School of Manabí “Manuel Félix López” (ESPAM “MFL”) located in Calceta-Manabí, In this experiment a completely random design (CRD) was used with three replications. Two factors were studied. “Strains” of (Factor A) and “Culture Medias” (Factor B). The best results were obtained from the cacao crops TAC1 and TAC2, also from the ecological production TAE1 strains: and the PDA cultivation. Which were used subsequently in the bioassay 2. Where was evaluated the antagonist capacity of the selected strains in bioassay # 1 opposite to the phytopathogens Fusarium spp., Sclerotinia spp. and Rhizopus spp. It was established a completely random design (CRD) with four replications. Here it was confirmed “in vitro” where the Thichoderma spp., holds the control of 100% up the three phytopathogens in the fifth day of evaluation. In conclusion, the strains TAC1, TAE1 and TAC2 produces a good biological control “in vitro” of the phytopathogens used in this study; however, the strains codified as:TAC2 showed the best characteristic to be multiplied and liberated in the field, because of the higher sporulations observed during its development; this characteristic is fundamental so the fungus can be establish faster in the field.
INTRODUCCIÓN
El uso de microorganismos antagonistas de fitopatógenos habitantes del suelo, cobra cada vez más importancia ya que su aplicación no genera desequilibrios biológicos, y más bien regula o minimiza las poblaciones de fitopatógenos habitantes del suelo; esta acción de los antagonistas, indudablemente, conduce a la disminución o eliminación del uso de productos químicos que son nocivos para el entorno.
En nuestro país estos estudios son muy incipientes o se los ha realizado muy superfluamente, desaprovechando, de esta manera, la posibilidad de manejar problemas fitopatológicos a muy bajos costos y sin riesgos para el medio ambiente.
Para Baker, K. y Cook, J. (1983), se entiende por control biológico la reducción de la densidad o de las actividades productoras de enfermedades de un patógeno o parásito en su estado activo o durmiente, lograda de manera natural por medio de antagonistas a través de la manipulación del ambiente del patógeno que se quiere controlar, hablemos de control biológico haciendo referencia a la utilización de microorganismos antagonistas para el control de enfermedades, entendiéndose por antagonistas aquellos organismos que interfieren en la supervivencia o desarrollo de los patógenos.
Los autores antes mencionados manifiestan, que el control biológico involucraría todas aquellas prácticas tendientes a disminuir la incidencia de enfermedades, excluyendo el control químico. En la naturaleza existe una interacción continua entre los potenciales patógenos y sus antagonistas de forma tal que estos últimos contribuyen a que no haya enfermedad en la mayoría de los casos; es decir, el control biológico funciona naturalmente.
Rollán, et al., (1998), mencionan que en condiciones naturales los microorganismos están en un equilibrio dinámico en la superficie de las plantas. La disminución de la flora de competencia por prácticas agrícolas como lavado de frutos, aplicación de fungicidas, y desinfección de suelos entre otras, favorecen el desarrollo de los patógenos. La posibilidad de desarrollar y aplicar esta tecnología en el país debe ser estudiada, como una alternativa de manejo inocuo de problemas fitosanitarios causado por hongos habitantes del suelo, que parasitan las raíces de las plantas.
MATERIALES Y MÉTODOS
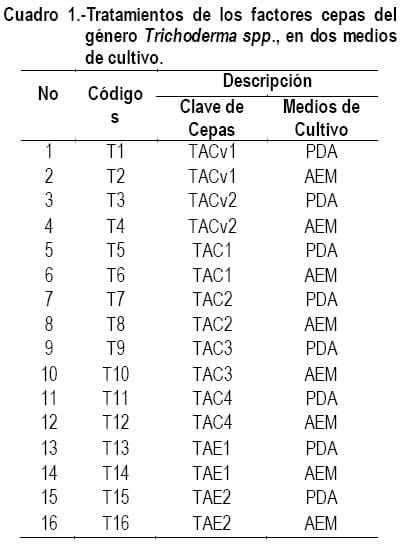
Este trabajo constó de dos bioensayos: En el bioensayo 1, se tomaron muestras de suelo a 20 cm de profundidad de tres diferentes áreas de producción de la ESPAM MFL, se las llevo al laboratorio donde se procedió a realizar una flora total de tres diluciones 10-1, 10-2 y 10-3 y se monitoreó durante 10 días, de donde se obtuvieron ocho cepas de Trichoderma spp., las que fueron codificadas de la siguiente manera: Área de producción convencional Cepa 1 TACv1, Cepa 2 TACv2. Área de cultivo de cacao Cepa 1 TAC1, Cepa 2 TAC2, Cepa 3 TAC3 y Cepa 4 TAC4. Área de producción Ecológica Cepa 1 TAE1 y Cepa 2 TAC2; las que fueron evaluadas estadísticamente para medir su velocidad de crecimiento y el medio de cultivo en el que los microorganismos se desarrollan de mejor manera, evaluando dos medios de cultivo PDA (Papa dextrosa agar) y AEM (Agar extracto de malta).
Experimento 1Detalle de los tratamientos
En el Cuadro 1 se observan los tratamientos expresados con cada una de las claves de las cepas y los medios de cultivo correspondientes a cada uno. En la Foto 1 se observan cada una de las cepas en estudio en los respectivos medios de cultivo en su unidad experimental.
Diseño experimental
Se empleó el Diseño Completamente Aleatorizado (DCA), con tres réplicas. Con arreglo factorial A x B.
Manejo del experimento
Se tomaron discos de 7 mm de diámetro con un sacabocado de las 8 cepas del género Trichoderma spp. Se incubaron los tratamientos en la estufa a 270C durante 2 días, a partir de allí se evaluó: crecimiento en milímetro/día.- Con una regla estandarizada en milímetros se medió el diámetro de crecimiento de las colonias de Trichoderma spp., en sus respectivos tratamientos, cada 24 horas durante 2 días a partir de la siembra.
Morfología.- Al quinto día se observaron las cajas petri al microscopio con el objetivo de 40 X, para determinar algunas de las características de las cepas de Trichoderma spp., y los medios de cultivo en estudio en el bioensayo 1 como: forma del micelio, color del micelio, tipo de micelio, esporulación, color que adquiere el medio de cultivo y el olor que emite cada una de las cepas en estudio.
Análisis estadístico
Para determinar la diferencia estadística entre los tratamientos se utilizó el programa estadístico, paquete de diseños experimentales FAUANL de la Universidad de Nuevo León de México.
Para determinar si existía diferencia significativa entre los tratamientos se realizó una prueba de rangos múltiples de Tukey al p< 0.05.
Experimento 2
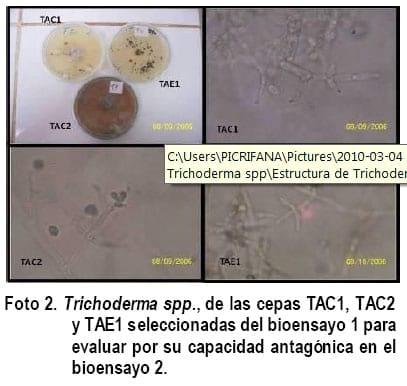
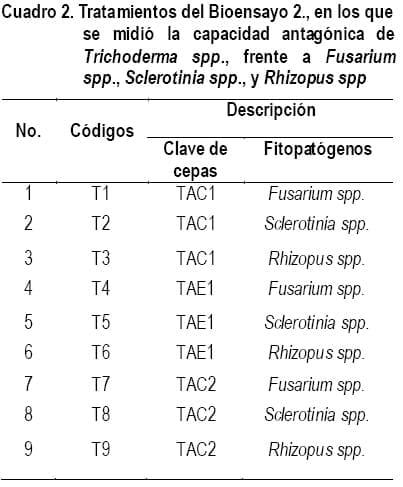
En el bioensayo 2, se evaluó la capacidad antagónica de las mejores cepas de Trichoderma spp., seleccionadas estadísticamente del bioensayo 1, las que fueron: TAC1= Trichoderma spp., Área de Cacao 1, TAE1= Trichoderma spp., Área Ecológica 1 y TAC2= Trichoderma spp., Área de Cacao 2 (Fig. 2), frente a Fusarium spp., Sclerotinia spp., y Rhizopus spp., aislados en el Laboratorio de microbiología de la ESPAM-MFL para este trabajo.
Detalle de los tratamientos
En el Cuadro 2, se expresa cada uno de los tratamientos del segundo bioensayo.
Manejo del experimento
Se tomaron discos de 7 mm de diámetro con un sacabocado de las 3 cepas de Trichoderma seleccionadas de los tres fitopatógenos en estudio, las cuales fueron sembradas de forma simultánea como lo indican los tratamientos. Luego se procedió a incubar los tratamientos en la estufa a 270C durante 5 días. En este lapso se procedió a evaluar el antagonismo. Con una regla estandarizada en (mm) se medió el diámetro de crecimiento de las cepas de Trichoderma spp., y cada uno de los fitopatógenos en su respectivo tratamiento cada 24 horas durante 5 días a partir de la siembra.
RESULTADOS Y DISCUSIÓNBioensayo 1.
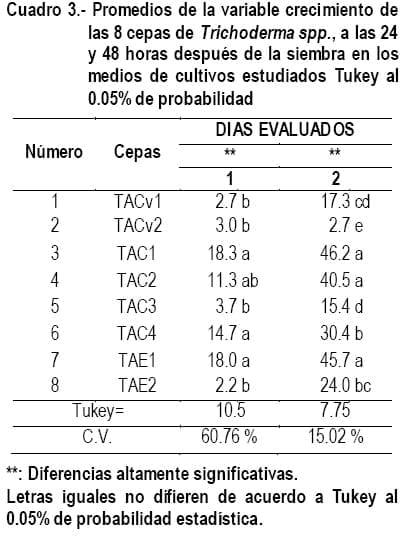
En el cuadro 3, se observan las ocho cepas evaluadas en el bioensayo 1 de las cuales se seleccionaron tres que estadísticamente se encuentran en la primera categoría; dos fueron aisladas del área de producción del cacao (TAC1 y TAC2) y una del área de producción ecológica (TAE1). En estas áreas de producción no se usa agroquímicos de síntesis, los controles fitosanitarios y fertilizaciones son a base de productos artesanales y comerciales de origen biológico, lo que puede haber favorecido a que estas cepas hayan tenido mejor eficiencia en su crecimiento con relación a las del área de producción convencional que, por el alto uso de productos de síntesis química, se han intoxicado los suelos y debilitado la flora benéfica de los mismos.
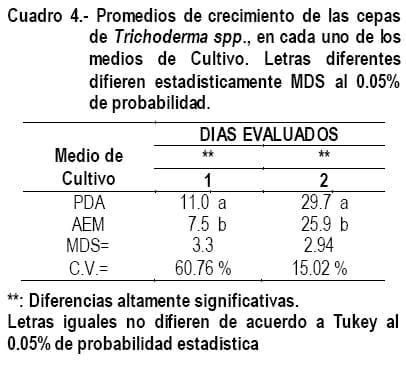
En el cuadro 4, se presenta los promedios de crecimiento de las ocho cepas en cada uno de los medios de cultivo. Se puede apreciar la ventaja estadística del medio de cultivo PDA en los dos días de evaluación. Este tiene influencia, marcada sobre el crecimiento del hongo Trichoderma spp., corroborando lo que manifiesta Monzón y Rodríguez, (s.f.) en que el alto contenido de carbohidratos que contiene el medio de cultivo, condiciona a que los hongos tengan un mayor crecimiento, en detrimento de la esporulación que suele retrasarse hasta un mes. El coeficiente de variación en el bioensayo 1, en el día 1 es alto debido a la alta variabilidad de los materiales biológicos evaluados.
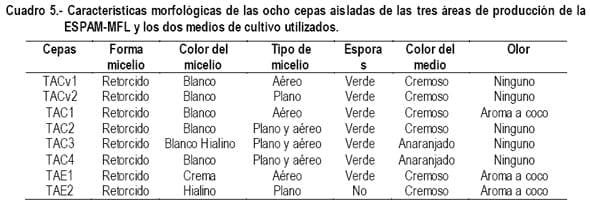
En el cuadro 5, se observan algunas de las características morfológicas más relevantes de las cepas en estudio, se aprecia que siete de las ocho cepas en estudio adquirieron, en la fase de multiplicación, una esporulación de coloración verde, lo cual corresponde a una característica específica para hongos del orden Trichoderma, como lo manifiesta Esposito y Da-Silva, (1998); Harman, (2001); Papavizas, (1985).
De las ocho cepas, las codificadas TAC1 y TAE1, emiten un aroma a coco corroborando lo expresado por Dennis y Webster, (s.f) citado por Biocontrol, (2005), en que una de la características de Trichoderma es el pronunciado aroma a coco que emite el medio de cultivo, lo que certifica que el hongo con que se trabajó pertenecía al género Trichoderma.
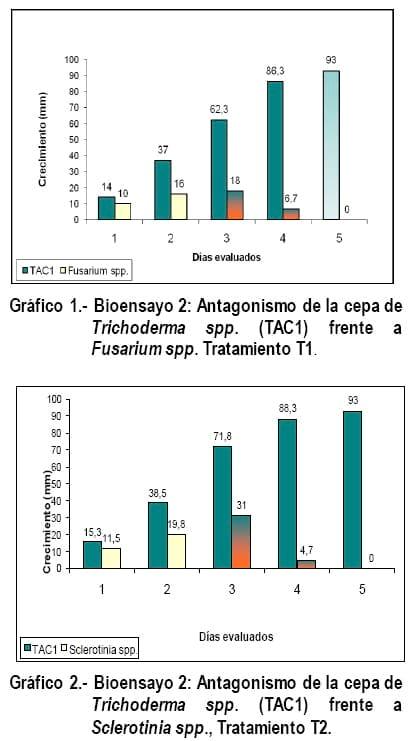
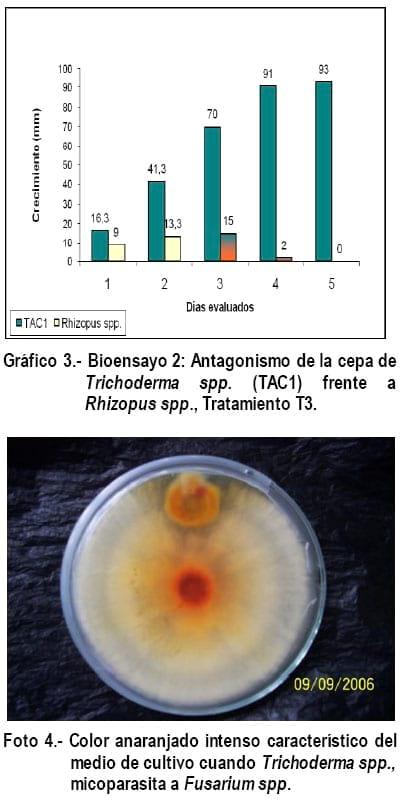
Bioensayo 2. Antagonismo de Trichoderma spp. (Cepa TAC1) frente a Fusarium spp., Sclerotinia spp. y Rhizopus spp., tratamientos 1, 2 y 3 que emite el medio de cultivo, lo que certifica que el hongo con que se trabajó pertenece a Trichoderma.
Como se puede apreciar en los gráficos 1, 2 y 3 en el primer día evaluado, el crecimiento de los dos hongos fue homogéneo, pero para los días 2 y 3 el crecimiento de Trichoderma spp., se incrementa mucho con relación al fitopatógeno, cubriendo la mayor parte del sustrato, en este caso PDA (Papa dextrosa agar), la velocidad del crecimiento que tiene Trichoderma spp., es aprovechada por este como un mecanismo de control biológico conocido como competencia de recurso vital, corroborando lo expresado por Tronsmo y Hhjeljord (1998); citado por Biocontrol, (2005). El tercer día evaluado es el momento en que se confronta el crecimiento del hongo benéfico con el fitopatógeno en la caja petri, es cuando comienza el mico-parasitismo, al cuarto y quinto día Fusarium spp; Sclerotinia spp. y Rhizopus spp., es invadido por las hifas de Trichoderma spp., en el medio de cultivo y este cambia de color, pasando de crema a un color anaranjado intenso (Foto 4), este fenómeno puede ser provocado por la liberación de enzimas que realiza Trichoderma spp., al momento que micoparasita al fitopatógeno, degradándolo y alimentándose de este, corroborando lo expresado por Harman, (2001).
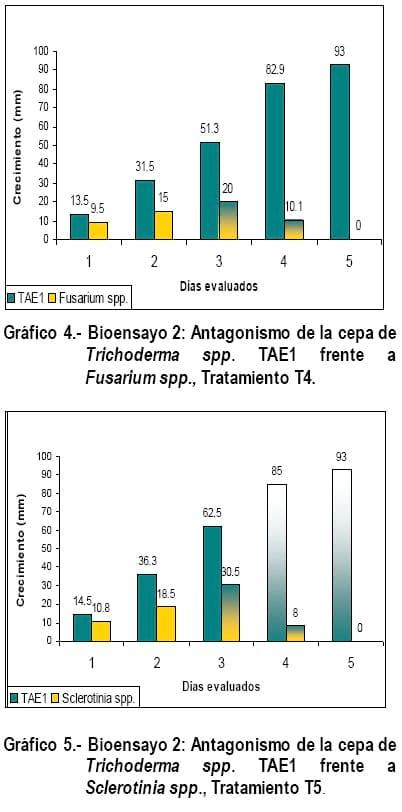
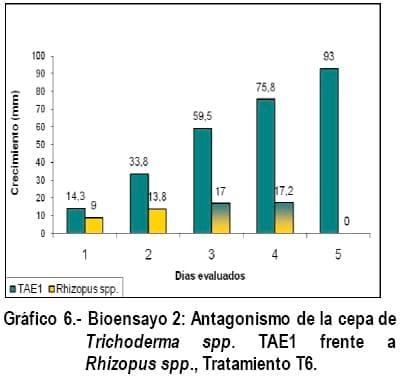
El antagonismo de Trichoderma spp. (Cepa TAE1) frete a Fusarium spp., Sclerotinia spp., y Rhizopus spp., (Gráficos 4, 5 y 6) en los días evaluados tuvieron un comportamiento similar en cuanto a crecimiento y mecanismo de acción, con la diferencia que en estos tratamientos, no hubo cambio de coloración en los fitopatógenos como ocurrió en los tratamientos T1, T2 y T3, solo en el tratamiento T5 la cepa TAE1 al cuarto día evaluado, en el momento que Trichoderma spp., invadía la mitad del crecimiento de Sclerotinia spp., comenzó a esporular y al quinto día, cubrió por completo al fitopatógeno realizando una esporulación abundante sobre el (Foto 5), corroborando lo expresado por Biocontrol (2005), quien manifiesta que en estas pruebas se puede observar hiper parasitismo y en muchos casos incremento de la esporulación cuando Trichoderma spp., crece sobre la colonia del patógeno, siendo este uno de esos casos, degradándolo y alimentándose del fitopatógeno, corroborando lo expresado por Harman, G (2001).
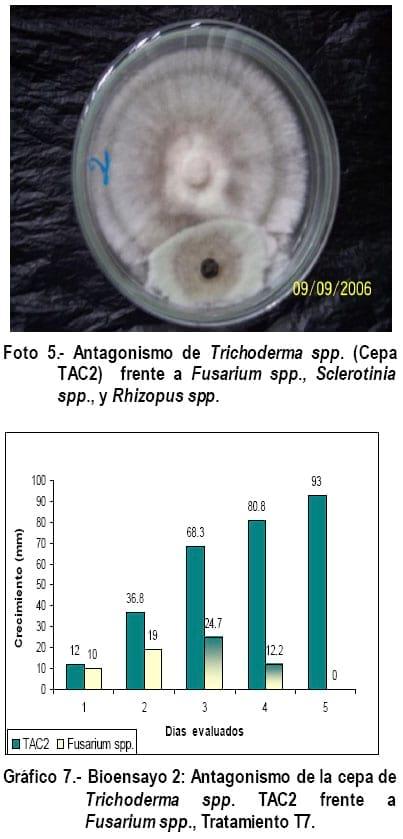
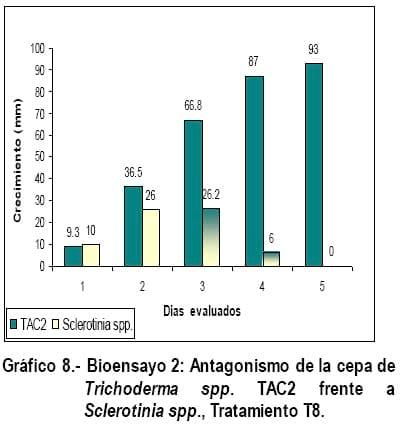
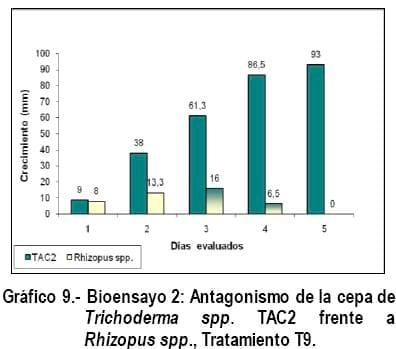
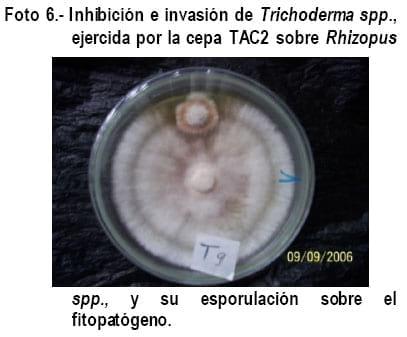
En los Gráficos 8, 9 y 10 se observa que las cepas de Trichoderma (TAC2) y los patógenos tuvieron un comportamiento similar en cuanto a crecimiento y mecanismo de acción de Trichoderma spp., ejercido sobre Fusarium spp; Sclerotinia spp. y Rhizopus spp., con la diferencia que en estos tratamientos no hubo cambio de coloración en los fitopatógenos como ocurrió en los tratamientos T1, T2 y T3, pero en el tratamiento T9 la cepa TAC2 al quinto día evaluado, invadió por completo a Rhizopus spp., parasitándolo y realizando una esporulación abundante sobre este (Figura 6), corroborando lo expresado por Biocontrol (2005), quien manifiesta que en estas pruebas se puede observar hiperparasitismo y en muchos casos incremento de la esporulación cuando Trichoderma spp., crece sobre la colonia del patógeno, siendo este uno de esos casos, degradándolo y alimentándose del fitopatógeno, corroborando lo expresado por Harman., (2001).
En los histogramas de los tratamientos se puede observar la inhibición antagónica, competencia por el sustrato y el micoparasitismo que ejercen las cepas TAC1, TAE1 y TAC2 sobre los fitopatógenos, a partir del tercer día evaluado, corroborando lo expresado por De la Cruz, (1987), que la actividad antagónica de Trichoderma spp., contra hongos fitopatógenos en pruebas “in vitro” es eficiente, determinado que Trichoderma spp., paraliza el crecimiento de los hongos patógenos.
CONCLUSIONES
En nuestros suelos contamos con una excelente microfauna benéfica que puede ser aprovechada y multiplicada a nivel de laboratorio e inoculada en nuestros campos, hasta su establecimiento y así mantener el equilibrio natural de organismos fitopatógenos, sin el uso de agroquímicos.
El medio de cultivo PDA (Papa dextrosa agar) es el más apropiado para ser utilizado en trabajos de laboratorios relacionados con hongos. Las cepas TAC1, TAC2 y TAE1 fueron las mejores en cuanto a su velocidad de crecimiento en relación a las demás cepas en estudio.
Los hongos Fusarium spp., Sclerotinia spp., y Rhizopus spp., fueron inhibidas por las cepas TAC1, TAE1, TAC2, respectivamente.
El mecanismo de acción de las cepas de Trichoderma spp., en estudio fueron, primero por competencia del sustrato por su velocidad de crecimiento y liberación de gases que inhiben el crecimiento del fitopatógeno y luego por micoparasitismo con la eliminación total del organismo.