INTRODUCCIÓN:
Las gramíneas de trópico bajo son de inferior calidad nutricional, comparadas con las producidas en trópico alto. Las limitaciones proteicas de este tipo de forrajes en el oriente Colombiano (departamento de Santander) se reflejan en la baja productividad de las explotaciones bovinas ocasionando así pérdidas económicas a los ganaderos (Navajas, 2011).
Uno de los principales indicadores de éxito zootécnico en la ganadería de cría bovina es la obtención de un becerro por vaca por año, sin embargo, alcanzar este objetivo (reproductivo) resulta difícil bajo condiciones de subnutrición, situación que exige la búsqueda de alimentos alternativos para los bovinos. La pollinaza ha sido utilizada como alternativa nutricional para los bovinos gracias a su contenido proteico, bajo costo, palatabilidad y amplia disponibilidad en la región; el contenido proteico de la pollinaza oscila entre el 11 al 30% dependiendo del tipo de material utilizado como base, alimentación de las aves y periodo de permanencia de estas en el galpón (Vargas 1993). Varios trabajos apoyan las ventajas económicas y zootécnicas de la pollinaza en la alimentación de rumiantes (Ruiz et al 2009, Arroyo 2003, Mercedes 2006); en dietas para pequeños rumiantes se determinó que niveles de inclusión de 50 o 60% no afectan el consumo de materia seca (Rios et al., 2005), sin embargo, las fuentes proteicas pueden desencadenar problemas de tipo reproductivo en vacas próximas al servicio, puesto que su administración en exceso altera el ambiente ruminal generando un aumento del amoníaco (NH3) a éste nivel, con el posterior incremento en la concentración del Nitrógeno Uréico Sanguíneo (NUS) una vez es realizado el ciclo de la urea en el hígado (Arroyo et al., 2003 e Pardo et al., 2008). Según Dhiman et al. (2005) a su vez, el incremento del NUS está asociado con altas concentraciones de amoníaco en el ambiente uterino.
Estudios realizados por Sinklair et al. (2004) demostraron que la concentración de NH3 en el fluido uterino es relativamente mayor a la concentración en el plasma y que tales niveles ejercen efectos directos sobre el ambiente uterino disminuyendo su pH (Rhoads et al., 2004), que normalmente se encuentra con un valor de 6,8 en el estro y de 7,1 al día 7 del ciclo estral (Butler y Elrod, 1993); según Larson et al. (1997) las fallas por muerte embrionaria precoz suceden antes de los 13 días pos fecundación, donde es realizado el reconocimiento materno de la gestación.
Santori y Méndez (2010) concluyeron que el uso de alto contenido de proteínas así como de nitrógeno no proteico en dietas para bovinos, representa aspectos negativos para la reproducción, puesto que a medida que incrementan las concentraciones plasmáticas de Urea y amoníaco, se reduce el pH del lumen uterino alterando la secreción de las glándulas endometriales durante la fase luteal precoz.
Varios autores (Butler et al., 1993, Charmandarian, 1997, Garcia et al., 2010) relatan que, niveles de NUS arriba de 19 mg/dl están asociados con bajas de 19 a 20% en la fertilidad de las vacas.
Las mediciones del Nitrógeno Uréico Sanguíneo pueden ser utilizadas como herramienta para establecer posibles interrelaciones entre éste, el pH y la función reproductiva de vacas alimentadas con fuentes de proteína altamente degradable en el rumen; por tanto las evaluaciones de dichos parámetros en vacas suplementadas con pollinaza a razón de 30% en base a la materia seca en días relacionados con el reconocimiento materno de la gestación, se constituyeron en el objetivo abordado en la presente investigación.
MATERIALES Y METODOS:
El presente estudio fue desarrollado en el Núcleo Bovino del Centro Experimental Santa Lucia, Instituto Universitario de la Paz, departamento de Santander, Colombia; bajo condiciones de temperatura ambiental media de 28°C, precipitación anual de 2820mm, humedad relativa del 80% y altitud al nivel del mar de 75m.
Fueron seleccionadas 10 vacas de la raza Brahman, vacías, multíparas, con condición corporal homogénea y mantenidas bajo el mismo sistema de manejo, en potreros de Brachiaria humidícola, como gramínea base de la alimentación. Los animales fueron separados en dos grupos (T0 o grupo control y T1 o grupo experimental), para el ajuste de la dieta fueron pesados, calculando así el nivel de inclusión de pollinaza (30% con base al consumo de materia seca), la uniformidad reproductiva fue realizada con el método de sincronización de la ovulación CRESTAR®, utilizando implante hormonal subcutáneo en la región auricular. El grupo T1 se sometió a un período de adaptación de 8 días para conseguir que el consumo de la pollinaza por parte de los animales fuera el propuesto en el estudio (durante el período de sincronización). La primera colecta de muestras fue realizada el día 7 del ciclo estral (contando como día cero, el día de la ovulación de los animales) y la segunda el día 13.
El análisis bromatológico de la Pollinaza utilizada en el estudio se realizó en el laboratorio de Nutrición de la Universidad Nacional de Colombia, sede Medellín, mediante el método Kjeldahl (basado en NTC 4657), dando como resultado 2,6% de Nitrógeno Total , obteniendo entonces un valor de 16,25% para proteína bruta (factor de conversión empírico de 6,25 relatado por Morgan, 1969).
En los días 7 y 13 del ciclo estral, y pasadas cuatro horas del consumo de la pollinaza por los animales, comenzó la colecta de muestras en los grupos experimentales, la sangre para la prueba de NUS fue tomada por punción coccígea usando tubos serológicos sin anticoagulante y equipo de vacutainer, se rotularon para su posterior procesamiento por método enzimático (UREA-S), que usa absorbancias de 560 a 620nm. Para obtener el valor de NUS expreso en las unidades mg/dl fue multiplicado, el valor inicial obtenido, por el factor 0,455. Las absorbancias fueron leídas a 578nm
La evaluación del pH uterino fue realizada por lavado uterino, según técnica utilizada por Oliveira et al. (2004) y consistió en conectar un sistema de lavado “Long flush®” (DI.0048-P) con una sonda Foley (18x22”x30cc , de Partnar Animal Health®) e infiltrar vía intracervical uterina 60 ml de agua destilada des ionizada (CORPAUL®) en los cuernos uterinos, una vez realizado el masaje de cada cuerno por mínimo 30 segundos, se colectó el líquido por medio de aspiración en recipientes estériles de tapa roscada que fueron rotulados y refrigerados hasta su posterior análisis en el laboratorio de Ingeniería Agroindustrial del Instituto Universitario de la Paz. Antes de realizar el procedimiento de lavado uterino fue aplicada anestesia epidural a cada animal inyectando 3ml de lidocaína al 2% sin epinefrina. Para el análisis del pH se usó un pHmetro digital marca Oakton 510 acoplado a un electrodo de pH y con escala de medición de 0 a 14. El equipo fue previamente calibrado con soluciones tampón de 4, 7 y 10 así como de ajuste de temperatura ambiente, ajuste también realizado a las muestras con baño serológico (baño maría), previo a la lectura en el pH-metro.
El trabajo fue delineado usando bloques casualizados donde cada animal representó una unidad experimental; los análisis descriptivos de varianza y coeficiente de correlación de Pearson para las variable pH uterino y NUS fueron realizadas usando paquete estadístico SAS 2002 a un nivel de probabilidad de 5%.
RESULTADOS Y DISCUSIÓN:
Los valores presentados en la Tabla 1 muestran las diferencias entre el grupo control T0 respecto al grupo experimental T1 para los días 7 y 13 del ciclo estral.
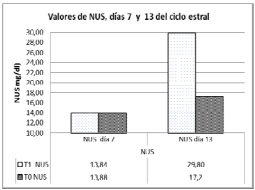
Tabla 1. Valores para pH uterino y Nitrogenio uréico sanguineo los días 7 y 13 del ciclo estral en los grupos control y experimental
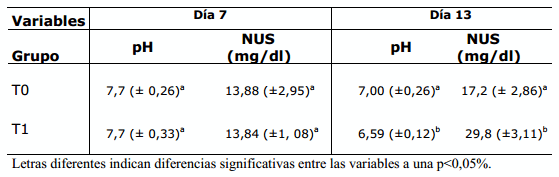
Para el día 7, la variable pH uterino no presentó diferencias significativas entre los grupos mostrando valores medios de 7,7 (± o,26) para el grupo control y de 7,7 (± 0,33) en el grupo experimental, éste resultado difiere del encontrado por Elrod e Butler (1993) que tras la implementación de dos tratamientos experimentales en vacas, uno con alto contenido de proteína bruta (21,8%) y otro con moderada (15,45%). Los autores concluyen que el pH uterino en día 7 del ciclo estral fue de 7,1 en el grupo de proteína moderada y 6,8 en el grupo de alta proteína, mostrando que dicho nivel proteico influenció el pH uterino en el día 7. En nuestro estudio, el valor del pH se consideró alto en los dos grupos, situación que puede explicarse por la menor temperatura de las muestras al momento de la medición del pH (factor de corrección 15 °C). El moderado valor para el NUS encontrado en el estudio y la no variación de un grupo a otro en el día 7 posiblemente sea explicada por el fenómeno de catabolismo muscular debido al bajo escore corporal de los animales, que supone un incremento en el metabolismo proteico a nivel del musculo esquelético y la producción de metabolitos como creatinina y 3-metil-histidina que consecuentemente incrementan los niveles de NUS (Rhoads et al., 2008), de modo que la ración suministrada al grupo T1 no fue relevante en la reducción del pH, hallazgo interesante puesto que los cambios de pH en el día 7 han sido relacionados con muerte embrionaria debida a la disminución en las concentraciones de P, Mg y K en el fluido uterino durante la fase luteal (Jordan et al., 1993). Otro trabajo realizado por Oliveira et al. (2004) mostró que el aumento en los niveles de Urea en la raciones no presentó efecto significativo en la reducción del pH uterino durante el periodo de estro y la fase lútea (día 7).
En el día 13 del ciclo estral, tanto los valores de pH como el tenor de NUS mostraron variaciones significativas en el grupo T1 respecto al control; éste resultado muestra que la pollinaza es fuente de proteína de alta solubilidad a nivel ruminal y que genera tenores de amonio que exceden la capacidad de reciclaje de dicho ion por el animal incrementándose tanto a nivel plasmático como uterino. Estudios adelantados por Rabaglino et al. (2007) mostraron que a partir de la segunda semana (día 14) todos los animales que fueron suplementados con dietas altas en proteína degradable presentaban niveles de NUS por encima de 19 mg/dl. El posible mecanismo que condujo a la reducción del pH se relaciona con la alteración significativa del flujo de iones vía endometrio (P- , Na+ y K+) por parte del amonio hecho que modifica el gradiente de concentración de estos iones y acaba atrayendo iones H+ a la mucosa endometrial (Oliveira, 2004). La reacción H2O + CO2 ↔ H2CO3 ↔ H+ + - HCO3 es catalizada por la enzima anhidrasa carbónica (AC) presente en muchos epitelios secretores incluido el tracto reproductivo donde participa en el transporte selectivo de iones bicarbonato e hidrógeno, y dependiendo de la permeabilidad, las células de dicho epitelio pueden exportar H+ o HCO3 apical o basalmente e intercambiar por sodio, potasio y cloro, y de éste modo, afectar el contenido iónico de la mucosa alterando el fluido luminal uterino (Rodríguez et al., 1991, citado por Rhoads et al., 2004).
La figuras 1 y 2 muestran la relación inversamente proporcional de las variables NUS y pH uterino tras la suplementación con pollinaza en vacas en los días 7 y 13 del ciclo estral. Se encontró una correlación moderada (r= -0,54) entre las variables, atribuida principalmente al número de animales utilizados en el estudio.
Figura 1. pH uterino días 7 y 13 del ciclo estral T1 grupo experimental, T0 grupo control
Figura 2. NUS días 7 y 13 del ciclo estral T1 grupo experimental, T0 grupo
Numerosos estudios relatan baja en la fertilidad (18 al 20%) en vacas alimentadas con altos niveles de proteína degradable ocasionada por diferentes efectos en las etapas del proceso reproductivo, con alteración de la maduración ovocitaria, proceso de capacitación espermática y sobrevivencia embrionaria por alteración de los procesos de secreción endometrial de nutrientes (Costa et al., 2009, Santori, 2010, Rabaglino, 2007, Larson, 1997, Rhoads, 2004).
La utilización de la pollinaza como fuente proteica en vacas próximas a ser reproducidas debe ser evaluada cuidadosamente a fin de evitar los efectos negativos que sobre el NUS y pH uterino fueron mostrados en le presente estudio, en particular en el día 13 del ciclo estral. Se confirma también la utilización del tenor de NUS como mecanismo evaluador del estado energético- proteico en los animales a ser suplementados procurando siempre que dicho valor no supere los valores de 19 mg /dl citados de forma general por los diferentes autores como límite máximo entre la fisiología y la alteración de los procesos reproductivos de la hembra bovina.
AGRADECIMIENTOS:
Los autores agradecen de manera particular a Jhonny Arias Villamizar y al Instituto Universitario de la Paz, por facilitar las herramientas necesarias para la realización del presente estudio.
BIBLIOGRAFIA:
ARROYO, C. Rojas, B.ROSALES R. Urea o pollinaza como suplemento proteico para toretes consumiendo ensilaje de pulpa de pejibaye, Agronomía Costarricense, julio – diciembre, Vol. 27, número 002, Universidad de Costa Rica, San José de Costa Rica, p. 72, 2003.
BUTLER, W.ELROD C. Reducción de la fertilidad y alteración del pH uterino en terneras alimentadas con exceso de proteína degradable en el rumen, journal animal Science. 71: P.694-701, 1993.
BUTLER W. R, CALAMAN J. J. BEAM, S. W. Plasma and milk urea nitrogen in relation to pregnancy rate in lactating dairy cattle, the premier journals and leading source or new knowledge and perspective in animal science, Department of Animal Science, Cornell University, Ithaca, NY 14853, 1993.
BUTLER W. Relationships of Dietary Protein and Fertility. Advances in Dairy Technology Volume 17, page 159, 2005.
CHARMANDARIAN A, et al. Facultad de Ciencias Veterinarias. Universidad Nacional de Rosario. Relación de la concentración de urea láctea y reproducción en vacas lecheras en condiciones de pastoreo Casilda, Arch. Latinoam. Prod. Anim. 5(Supl. 1): 332-334, 1997.
COSTA M, Efeito da uréia na ativação do apoptose em células da granulosa de bovinos, avaliada por citometria de fluxo, revista Portuguesa ciências Veterinárias, p. 41-45, 2008.
DHIMAN, TR.HAMMON DS, HOLYOAK GR, Association between blood plasma urea nitrogen levels and reproductive fluid urea nitrogen and ammonia concentrations in early lactation dairy cows. Department of Animal, Dairy and Veterinary Sciences, Utah State University, 4815 Old Main Hill, Logan, UT 84322-4815, USA. Apr; 86(3-4) p.195-204, 2005.
ELROD y BUTLER, Alterations of pH in response to increased dietary protein in cattle are unique to the uterus, Journal Animal Science, 71:702-706, 1993.
GARCÍA LÓPEZ, R.; BACALLAO, Y. Influencia de la concentración de urea en plasma en la gestación y componentes lácteos para las condiciones del trópico, Revista Cubana de Ciencia Agrícola, vol. 44, núm. 1, p. 19-21, 2010.
LARSON S.F, Butler W. Currie W. Reduced Fertility Associated with Low Progesterone Post breeding and Increased Milk Urea Nitrogen in Lactating Cows, Department of Animal Science, Cornell University, Ithaca, NY 14853 Journal of Dairy Science Vol. 80, No. 7, 1997.
MERCEDEZ G. et al, Suplementación con cama de pollo a vacas lactantes durante la época lluviosa, Zootecnia Tropical 24(1): p 31-42, 2006.
NAVAJAS V.M, Efecto de la fertilización sobre la producción de biomasa y la absorción de nutrientes em Brachiaria decumbens y Brachiaria híbrido Mulato.Tesis de formatura Mestre Ciências agrarias Universidad Nacional de Colombia, 2011.
OLIVIERA M., et., al, Uréia para Vacas Leiteiras no Pós-Parto: Teor Plasmático de Uréia e pH Uterino, R. Bras. Zootec., v.33, n.1, p.123-127, 2004.
PARDO O, et al. Effect of protein and energy relationship on the levels of ammonium rumen and blood urea nitrogen and milk, in dual purpose cows at the llanero foothills,. Revista colombiana de ciencias pecuarias; 21: p.387-397, 2008.
RABAGLINO, M. B. et al., efectos de los altos niveles de urea en el fluido uterino sobre el tejido endometrial en vacas vacías .Sitio Argentino de Producción Animal. 9(35):8-15, 2007.
RHOADS M, et al. Effects of Urea Infusion on the Uterine Luminal Environment of Dairy Cows, J. Dairy Sci. 87:2896–2901 American Dairy Science Association. Journal of DairyScience Vol. 87, No. 9, 2004.
RHOADS M, et al. Metabolic Adaptations to Heat Stress and Related Effects on Fertility. Department of Animal Sciences The University of Arizona, 2008.
RIOS Leyla et al., Uso de excretas de aves en la alimentación de ovinos, Zootecnia Tropical 23(2). Instituto de Producción Animal, Facultad de Agronomía. Universidad Central de Venezuela. P. 183-210, 2005.
RUIZ R. et al., Análisis técnico de un modelo de confinamiento utilizando diferentes proporciones de pollinaza, fruto de palma y pasto maralfalfa en la dieta de bovinos machos en fase de levante. Revista Colombiana De Ciencias Pecuárias , v.20 fasc.4 p.423 – 684, 2007.
SARTORI R, MENDEZ G, Fatores nutricionais associados à reprodução da fêmea bovina, Revista Brasileira de Zootecnia., v.39, p.422-432, 2010.
SINCLAIR K. et al. Nitrogen metabolism and fertility in cattle: II Development of oocytes recovered from heifers offered diets differing in their rate of nitrogen release in the rumen. Journal Animal Science 78, p. 2670-2680, 2000.