
problemas digestivos en lechones al destete
Expresión molecular de la vilina en yeyuno de lechones posdestete que consumieron LPS de E. coli
Con el objetivo de evaluar el efecto la adición de lipopolisacárido LPS de E. coli sobre la expresión molecular de vilina en yeyuno de lechones posdestete, se sacrificaron 52 lechones escalonadamente los días 1 (21 días de edad, día del destete), 5, 7 y 10 posdestete, y se les extrajo completamente el yeyuno para la evaluación de la expresión molecular de vilina. Para inducir la inflamación intestinal los animales fueron alimentados con una dieta basal, adicionada con cuatro niveles de LPS (0, 0.3, 0.5 y 1.0 µg/mg de alimento). El diseño estadístico utilizado fue de bloques al azar en arreglo factorial de 4X4. Se observó una disminución (P<0.01) en la expresión molecular de vilina en los animales que consumieron la dieta con mayor nivel de inclusión de LPS. El LPS de E. coli disminuye la expresión de vilina, lo que está directamente implicado en los cambios morfológicos intestinales, específicamente en la disminución de la altura y el aumento del el ancho de las vellosidades. Este efecto probablemente contribuye a la disminución de la absorción intestinal de nutrientes y a la presentación del síndrome de diarrea posdestete.
Keywords: destete; diarreas; fiebre; lechón.
Materiales y métodos
Todos los procedimientos experimentales fueron llevados a cabo de acuerdo a las guías propuestas por “The International Guiding Principles for Biomedical Research Involving Animals” (5). Esta investigación fue avalada por El Comité de Ética en la Experimentación Animal de la Universidad Nacional de Colombia, Sede Medellín (CEMED 001del 26 de Enero de 2009).
El trabajo de campo se realizó en el Centro San Pablo, perteneciente a la Universidad Nacional de Colombia, Sede Medellín, ubicado en el municipio de Rionegro, paraje “El Tablacito”, localizado a 2100 msnm, con una temperatura entre 12 y 18ºC, correspondiendo a una zona de vida bosque muy húmedo Montano Bajo (bmh-MB).
Se utilizaron 52 lechones resultado de un cruce alterno Duroc x Landrace, destetados exactamente a los 21 días de edad, con un peso de 6.5 ± 0.5 kg. Estos lechones fueron alojados en grupos de ocho, en jaulas provistas de comedero de canoa y agua a voluntad, las cuales fueron ubicadas en un cuarto con temperatura controlada a 26 ± 3°C.
En este experimento se evaluaron cuatro dietas experimentales, una dieta control (basal) y otras tres conteniendo LPS de E. coli, serotipo 0111:B4 (SigmaAldrich, Sigma-Aldrich, St Louis, MO, USA) así:
- - Dieta Basal (DB): Sin adición de LPS.
- - Dieta 1 (D1): DB más la adición de 0.3 µg de LPS /mg de alimento.
- - Dieta 2 (D2): DB más la adición de 0.5 µg de LPS /mg de alimento.
- - Dieta 3 (D3): DB más la adición de 1.0 µg de LPS /mg de alimento.

| ADairylac 80 (Pro-Ag Products Ltd, Winnipeg, Canadá) BProliant 1000 (Alitecno S.A.C., Lima, Perú) CToxibond (Biomix, Medellín, Colombia) DComposición por kg de alimento: vitamina A 1020 UI, vitamina D 198 UI, vitamina E 6 UI, vitamina K 1.20 mg, riboflavina 7.20 mg, vitamina B12 0.04 mg, colina 968.58 mg, niacina 36 mg, ácido pantoténico 16.55 mg, tiamina 30 mg, piridoxina 31 mg, biotina 0.08 mg, ácido fólico 0.75 mg. EComposición por kg de alimento: cobre 14.40 mg, hierro 120 mg, manganeso 36 mg, selenio 0.30 mg, yodo 0.96 mg, zinc 144 mg. FVainilla dulce, esencia de frutas (Prodia, Medellín, Colombia). |
Tabla 2. Análisis Proximal de la dieta basal.

Durante la fase experimental se sacrificaron 52 lechones de la siguiente forma: el día inicial o día 1 (día del destete), se sacrificaron 4 lechones, que representaron el grupo de referencia para verificar el estado general de salud y la evaluación macroscópica del estado de los órganos de los animales antes de suministrar el LPS. Los días cinco, siete y 10 posdestete fueron sacrificados cuatro lechones de cada tratamiento.
Se extrajo el RNA total de las muestras de intestinos previamente almacenadas en nitrógeno líquido empleando el ULTRACLEANTM Tissue & Cells RNA Isolation Kit (MO BIO Laboratories, Inc.). En todos los casos se pesaron 25 mg de tejido (lo máximo recomendado por el fabricante) en una balanza analítica y se continuo con el protocolo descrito en el Kit. Para llevar a cabo la ruptura del tejido se emplearon morteros de losa y nitrógeno líquido. Las superficies y el material de trabajo se trataron antes con DEPC (dietilpirocarbonato) para remover posibles RNAasas. Las muestras de RNA total obtenidas con el procedimiento permanecieron almacenadas a -70°C durante todo el experimento y sólo se tomaron alícuotas en hielo para realizar los análisis. Para evaluar la integridad del material extraído se corrieron todas las muestras en gel de agarosa con bromuro de etidio al 1% (100V por 50 min), para observar las bandas de rRNA (RNA ribosomal). En caso de no visualizar una buena cantidad de material o no ver claramente las bandas de rRNA, se repitió la extracción empleando condiciones idénticas (8).
Para sintetizar cDNA (DNA copia) a partir del RNA total extraído se empleó el QuantiTect® Reverse Transcription Kit (QUIAGEN). El Kit utiliza cebadores hexámericos aleatorios y cebadores de poli-Timidinas para maximizar la reacción de retro-transcripción, obteniendo tanto copias del rRNA como mRNA. Para todas las reacciones de retrotranscripción se utilizó la misma cantidad de muestra (1µg de RNA en cada reacción), con base en los resultados de la cuantificación. Brevemente el protocolo tiene dos pasos: una primera etapa en la que se remueven restos de DNA genómico, para luego adicionar la enzima (Taq polymerase, BIOLASE®) y los nucleótidos trifosfatados para hacer la síntesis del cDNA. Todo el ensayo se realizó teniendo en cuenta las recomendaciones del fabricante. El cDNA obtenido se almacenó a -20°C durante los demás ensayos (18).
Los cebadores para el gen de interés y de expresión constitutiva (Ciclofilina) se muestran en la tabla 3. Estos cebadores fueron tomados de la literatura, verificando que su diseño hubiera sido realizado en los bordes intrón/ exón para evitar la amplificación de DNA genómico. Adicionalmente, se sometieron a diversos análisis bioinformáticos para verificar su especificidad con el fragmento de mRNA o rRNA estudiado y la ausencia de estructuras secundarias, como la formación de lupas o dímeros entre sí o con el otro cebador (4, 18).
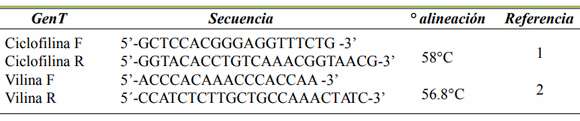
| 1 (Paulin et al., 2007), 2 (Xu et al., 2011) |
Para establecer los niveles de expresión del gen de vilina, se empleó un método de cuantificación relativa usando un gen de expresión constitutiva (Ciclofilina), siguiendo las recomendaciones de diversas publicaciones en cuanto a la escogencia del gen y la estrategia global de normalización 24, 38, 15. La cantidad de material del que se extrajo el RNA, la cantidad de RNA en la reacción de retrotranscripción y la cantidad de cDNA para la amplificación en la PCR fue idéntica para todas las muestras. El gen de expresión constitutiva escogido fue validado en ensayos anteriores bajo condiciones experimentales similares (26). Los resultados obtenidos se analizaron utilizando el software The ImageJ (User Guide) Version 1.43.
La amplificación por RT-PCR del mRNA de Vilina se realizó en muestras individuales de yeyuno (28). El protocolo general de la PCR fue el siguiente:
- - Ciclofilina: 95 ºCx1 min; 37 ciclos 95 ºCx30 seg; 58 ºCx30 seg; 72 ºCx40 seg; 72 ºCx3 min; 10 ºCx∞.
- - Vilina: 95 ºCx1 min; 37 ciclos 95 ºCx30 seg; 57 ºCx30 seg; 72 ºCx40 seg; 72 ºCx3 min; 10 0Cx∞.
El experimento se realizó según un diseño de bloques al azar (para un total de dos bloques) en un arreglo factorial de 4X4 (4 dietas experimentales por 4 edades posdestete) (36). Para la conformación de los bloques se tomó en consideración el peso inicial de los animales. A cada animal le fue asignado uno de los 16 tratamientos y cada tratamiento tuvo cuatro repeticiones. El análisis estadístico se realizó con el procedimiento de Modelos Lineales Generales (GLM) del programa SAS® (34). Las diferencias entre las medias de los tratamientos fueron determinadas por mínimos cuadrados y analizadas por ANOVA. Para realizar la comparación de los promedios entre tratamientos se utilizó una prueba de Duncan (P< 0,05).
Resultados

| a, b, c Dentro de una misma fila, medias con diferente superíndice son estadísticamente significativas (P< 0.01). EEM: Error estándar de la media. |
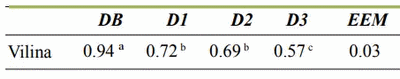
| a, b, c Dentro de una misma fila, medias con diferente superíndice son estadísticamente significativas (P< 0,01). EEM: Error estándar de la media. |

| a, b, c Dentro de una misma fila, medias con diferente superíndice son estadísticamente significativas (P< 0,01). EEM: Error estándar de la media. |
Conclusiones
1. Amador P, Garcia-Herrera J, Marca MC, de la Osada J, Acin S, et al. Intestinal D-galactose transport in an endotoxemia model in the rabbit. J Membr Biol 2007; 215:125-133.
2. Athman R, Fernandez MI, Gounon P, Sansonetti P, Louvard D, et al. Shigella flexneri infection is dependent on villin in the mouse intestine and in primary cultures of intestinal epithelial cells. Cell Microbiol 2005; 7(8):1109-16.
3. Boudry G, Péron V, Le Huërou-Luron I, Lallès JP, Sève B. Weaning induces both transient and longlasting modifications of absorptive, secretory, and barrier properties of piglet intestine. J Nutr 2004 Sep;134(9):2256-62.
4. Bustin, SA. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays. J Mol Endocrinol 2000, 25:169-193.
5. CIOMS (Council for International Organizations of Medical Sciences). International Guiding Principles for Biomedical Research Involving Animals, Geneva, 1985; 28pp.
6. Dheda K, Huggett JF, Chang JS, Kim LU, Bustin SA, et al. The implications of using an inappropriate reference gene for real-time reverse transcription PCR data normalization. Anal Biochem 2005; 344:141-143.
7. Fan MZ. Growth and ontogeny of the gastrointestinal tract. In: Xu. RJ, Cranwell P editors. The neonatal pig. Gastrointestinal physiology. and nutrition. Nottingham University Press 2002; 31-60.
8. Freeman WM, Walker SJ, Vrana KE. Quantitative RTPCR: pitfalls and potential. Biotechniques 1999; 26(1): p. 112-22, 124-5.
9. Garcia-Herrera J, Marca MC, Brot-Laroche E, Guillen N, Acin S, et al. Protein kinases, TNF-α and proteasome contribute in the inhibition of fructose intestinal transport by sepsis in vivo. Am. J Physiol Gastrointest Liver Physiol 2008; 294:G155–G164.
10. Gómez A. El destete y la fisiología del le¬chón. En: I seminario internacional sobre sistemas sostenibles de producción en especies menores. Popayán, 2006. 34p.
11. Gómez IAS, Vergara D, Argote F. Efecto de la dieta y edad del destete sobre la fisiología digestiva del lechón. Revista Biotecnología en el Sector Agropecuario y Agronindustrial 2008; 6:32-41.
12. Hataya Y, Akamizu T, Hosoda H, Kanamoto N, Moriyama K, et al. Alterations of Plasma Ghrelin Levels in Rats with Lipopolysaccharide-Induced Wasting Syndrome and Effects of Ghrelin Treatment on the Syndrome. Endocrinology 2003; 144: 5365-5371
13. Hedemann MS, Hojsgaard S, Jensen BB. Small intestine morphology and activity of intestinal peptidases in piglets around weaning. J Anim Physiol Anim Nutr 2003; 87:32-41.
14. Hedemann MS, Eskildsen M, Lærke HN, Pedersen C, Lindberg JE, et al. Intestinal morphology and enzymatic activity in newly weaned pigs fed contrasting fiber concentrations and fiber properties J Anim Sci 2006; 84:1375-1386.
15. Huggett J, Dheda K, Bustin S, Zumla A. Real-time RT-PCR normalisation; strategies and considerations. Genes Immun 2005; 6:279-84.
16. Johnson GB, Brunn GJ, Samstein B. New insight into the pathogenesis of sepsis and the sepsis syndrome. Surgery 2005; 137:393–395.
17. Kojima CJ, Carroll JA, Matteri RL, Touchette KJ, Allee GL. Effects of weaning and weaning weight on neuroendocrine regulators of feed intake in pigs. J Anim Sci 2007; 85:2133–2139.
18. Kubista M, Andrade JM, Bengtsson M, Forootan A, Jonák J, et al. The real-time polymerase chain reaction. Mol Aspects Med 2006; 27(2-3):95-125.
19. Lallès JP, Boudry G, Favier C, LE Floc’h N, Pié S, Piel C, et al. Gut function and dysfunction in young pigs: physiology. Anim Res 2004; 53:301-316.
20. Lee SC, Han JS, Seo JK, Cha YN. Modulation of cyclooxygenase-2 expression by phosphatidylcholine specific phospholipase C and D in macrophages stimulated with lipopolysaccharide. Mol Cells 2003; 15(3):320-6.
21. Makkink CA, Berntsen PJM, op den Kamp BML, Kemp B, Verstegen WA. Gastric protein breakdown and pancreatic enzyme activities in response to two different dietary protein sources in newly weaned pigs. J Anim Sci 1994; 72:2843-2850.
22. Mariani V, Palermo S, Fiorentini S, Lanubile A, Giuffra E. Gene expression study of two widely used pig intestinal epithelial cell lines: IPEC-J2 and IPI-2I. Vet Immunol Immunopathol 2009; 15,131(3-4):278-84.
23. Marion J, Biernat M, Thomas F, Savary G, Le Breton Y, et al. Small intestine growth and morphometry in piglets weaned at 7 days of age. Effects of level of energy intake. Reprod Nutr Dev 2002; 42: 339–354.
24. Muller PY, Janovjak H, Miserez AR, Dobbie Zl. Processing of gene expression data generated by quantitative real time RT-PCR. Biotechniques 2002; 32: 1372-1374, 1376, 1378-1379.
25. NRC. National Research Council. The Nutrient Requirements of Swine. 8th rev. ed. Washington, DC, USA: National Academy Press, 1998.
26. Paulin SM, Jagannathan A, Campbell J, Wallis TS, Stevens MP, et al. Net replication of Salmonella enterica serovars Typhimurium and Choleraesuis in porcine intestinal mucosa and nodes is associated with their differential virulence. Infect Immun 2007, 75: 3950- 3960.
27. Peiffer I, Guignot J, Barbat A, Carnoy C, Moseley SL, et al. Structural and functional lesions in brush border of human polarized intestinal Caco-2/TC7 cells infected by members of the Afa/Dr diffusely adhering family of Escherichia coli. Infect Immun 2000; 68(10): 5979-90.
28. Petersen YM, Burrin DG, Sangild PT. GLP-2 has differential effects on small intestine growth and function in fetal and neonatal pigs. Am J Physiol Regulatory Integrative Comp Physiol 2001; 281: 1986-1993.
29. Pié S, Lallès JP, Blazy F, Laffitte J, Sève B, et al. Weaning Is Associated with an Upregulation of Expression of Inflammatory Cytokines in the Intestine of Piglets. J Nutr 2004; 134: 641-647.
30. Reis STC, Guerrero CMJ, Aguilera BA, Mariscal LG. Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Téc Pecu Mex 2005; 43 (3): 309-321.
31. Reis STC BAM, Mariscal LG, Guerrero MJC. Morfología del tracto digestivo de lechones alimentados con proteínas de soya aislada o concentrada. Asociación Latinoamericana de Producción Animal 2007; 4:139- 146.
32. Revenu C, Courtois M, Michelot A, Sykes C, Louvard D, et al. Villin severing activity enhances actin-based motility in vivo. Mol Biol Cell 2007; 18(3):827-38.
33. Rodrigues MMA, Silva ODA, Taketomi, AE, Hernandez-Blazquez FJ. IgA production, coliforms analysis and intestinal mucosa morphology of piglets that received probiotics with viable or inactivated cells. Pesq Vet Bras 2007; 27: 241-245.
34. SAS®. SAS/STAT User’s Guide. Institute Inc. Statistical Analysis Systems Institute. Version 9.1th Ed. Cary, NC.: SAS Institute Inc, 2006.
35. Segalés J, Domingo M. La necropsia en el ganado porcino, diagnóstico anatomopatológico y toma de muestras. Madrid (España). Boehringer Ingelheim 2003; pp 10-14.
36. Steel RG, Torrie JH. Principles and Procedures of Statistics: a biometrical approach (2a Ed), New York (USA) McGraw-Hill Book Co, 1985.
37. Touchette KJ, Carroll JA, Allee GL, Matter RL, Dyer CJ, et al. Effect of spray-dried plasma and lipopolysaccharide exposure on weaned pigs: I. Effects on the immune axis of weaned pigs. J Anim Sci 2002; 80: 494-501.
38. Vandesompele J. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol 2002; 3(7): p. Research 0034
39. Vente-Spreeuwenberg MAM, Verdonk AC, Gaskins HR, Verstegen MWA. Small intestine epithelial barrier function is compromised in pigs with low feed intake at weaning. J Nutr 2001; 131: 1520-1527.
40. Vente-Spreeuwenberg MAM, Verdonk JMAJ, Verstegen MWA, Beynen AC. Villus height and gut development in weaned piglets receiving diets containing either glucose, lactose or starch. Brit J Nutr 2003; 90: 907–913.
41. Vente-Spreeuwenberg MAM, Verdonk JMAJ, Bakker GCM, Beynen AC, Verstegen MWA. Effect of dietary protein source on feed intake and small intestine morphology in newly weaned piglets. Livest Prod Sci 2004; 86: 169-177.
42. Wang Y, Shan T, Xu Z, Liu J, Feng J. Effect of lactoferrin on the growth performance, intestinal morphology, and expression of PR-39 and protegrin-1 genes in weaned piglets. J Anim Sci 2006; 84: 2636-2641
43. Willing BP, Van Kessel AG. Enterocyte proliferation and apoptosis in the caudal small intestine is influenced by the composition of colonizing commensal bacteria in the neonatal gnotobiotic pig. J Anim Sci 2007; 85:3256- 3266.
44. Xu RJ, Sangild PT, Zhangc YQ, Zhangd SH. Bioactive compounds in porcine colostrum and milk and their effects on intestinal development in neonatal pigs. Biology of Growing Animals 2002; 1:169-192.
45. Xu ZR, Hu CH, Xia MS, Zhan XA, Wang MQ. Effects of dietary fructooligosaccharide on digestive enzyme activities, intestinal microflora and morphology of male broilers. Poult Sci 2003; 82: 648–654.
46. Yen JT. Anatomy of the Digestive System and Nutritional Physiology. In: Lewis A.J. and L.L. Southern (Ed.). Swine Nutrition 2nd ed. Washington, DC. USA. CRC Press 2002; p 31.
47. Yoo D, Lo W, Goodman S, Ali W, Semrad C, Field M. Interferon-gamma downregulates ion transport in murine small intestine cultured in vitro. Am J Physiol 2000; 279: G1323-G1332.
48. Zhenfeng Z, Deyuan O, Xiangshu P, Sung WK, Yanhong L, et al. Dietary Arginine Supplementation Affects Microvascular Development in the Small Intestine of Early-Weaned. Pigs J Nutr 2008; 138: 1304- 1309.




