
Probióticos en la dieta de lechones destetados
La adición de cepas probióticas modula la secreción de mucinas intestinales en íleon de cerdos en crecimiento
Materiales y métodos
Todos los procedimientos experimentales fueron llevados a cabo de acuerdo a las guías propuestas por “The International Guiding Principles for Biomedical Research Involving Animals” 7 . Esta investigación fue avalada por El Comité de Ética en la Experimentación Animal de la Universidad Nacional de Colombia, Sede Medellín (CEMED-03 del 07 de mayo del 2012).
El trabajo de campo se realizó en el Centro San Pablo, perteneciente a la Universidad Nacional de Colombia, Sede Medellín, ubicado en el municipio de Rionegro, paraje “El Tablacito”, localizado a 2100 msnm, con una temperatura entre 12 y 18 ºC, correspondiendo a una zona de vida bosque muy húmedo Montano Bajo (bmh-MB).
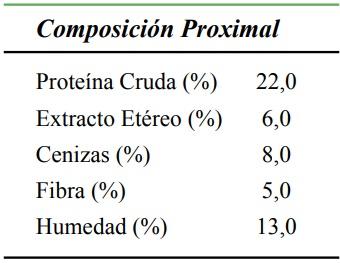
Se utilizaron 35 lechones (hembras y machos) del cruce duroc x pietrain, destetados exactamente a los 21 días de edad, con un peso aproximado de 6 ± 0,5 kg, los cuales fueron alojados en grupos de 8 animales durante el período de levante. Cada una de las instalaciones o corrales estaba provista de comederos de canoa y agua a voluntad, se tenía temperatura controlada (26 ± 3 °C) por termometro digital. La dieta comercial ofrecida a los animales tuvo como componente leche y algunos de sus derivados, además, fue enriquecida con vitaminas, minerales y lisina HCL. Las dietas se balancearon para cumplir con todos los mínimos nutricionales requeridos y propuestos por el NRC 17 (Tabla 1). La cantidad de alimento ofrecido a los lechones por corral fue administrada de acuerdo a la tabla dietaría que corresponde para la etapa productiva (levante). Así mismo, el agua de bebida que contenía las cepas probióticas se ofreció diariamente desde el día 1 del destete hasta el sacrificio, el cual se realizó de manera secuencial o escalonada durante los primeros 30 días de la fase de levante. Durante la lactancia no se suministró alimento sólido a los lechones.
Durante la fase experimental se realizaron eutanasias humanitarias a 35 lechones de la siguiente forma: el día inicial, o día 1 (día del destete), se sacrificaron 5 animales, que representaron el grupo de referencia para verificar el estado general de salud y la evaluación macroscópica del estado de los órganos de los animales antes de suministrar las dietas, y las unidades experimentales para cada uno de los tratamientos. Los días 15 y 30 posdestete fueron sacrificados 3 lechones de cada tratamiento. Estos, se sedaron con un neuroléptico stresnil® (Azaperona) vía intramuscular, posteriormente se sometieron a inhalación con Nitrox® y se sacrificaron 2.5 horas después de su última comida.
Procesamiento histotécnico. Transcurrido 48 horas después de la colecta, las muestras de las diferentes secciones del intestino almacenadas en formalina al 10% 4 , fueron enviadas al laboratorio de Histopatología Animal de la Universidad de Antioquia (Facultad de Ciencias Agrarias) para su analisis respectivo.
- Coloración Azul alcián pH 1.0: para mucinas ácidas intensamente sulfatadas.
- Coloración Azul de alcián pH 2.5: para identificar mucinas ácidas no sulfatadas.
- Coloración de PAS (Periodic Acid Schiff): para identificar mucinas neutras.
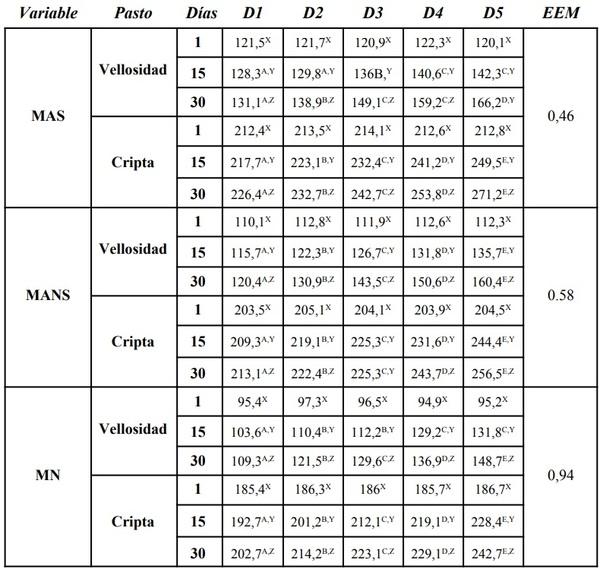
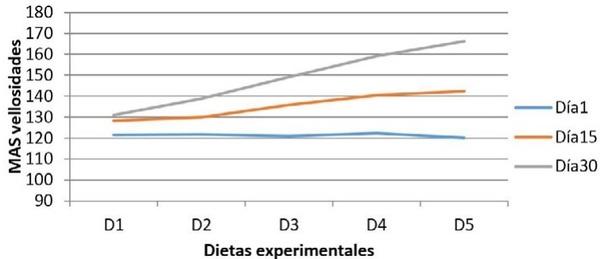
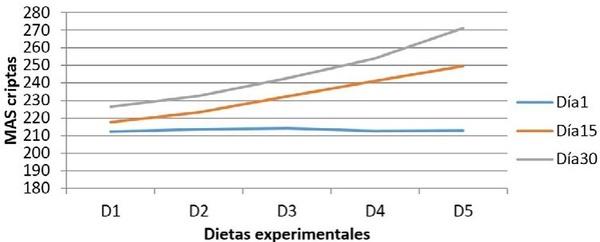
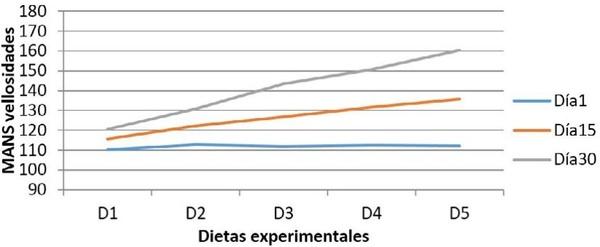
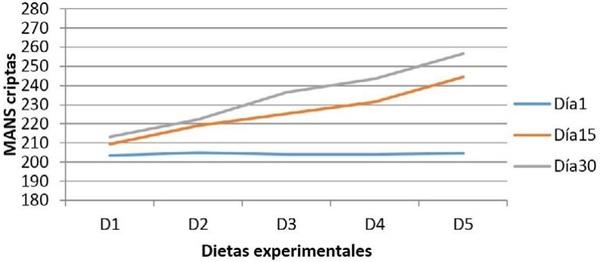
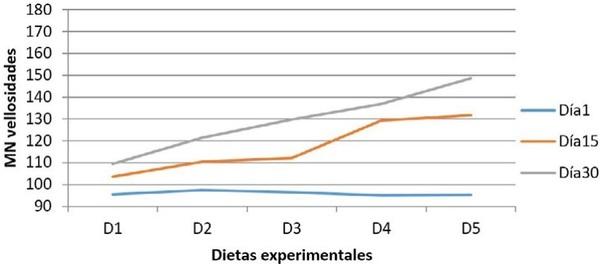
Para evaluación cuantitativa de los cortes histológicos, se empleó un microscopio óptico Leica DMLB (Meyer Instruments, Houston,TX, USA), para la identificación de las zonas tisulares, luego con la cámara de microscopia digital instantánea Leica EC3 (Leica microsystems, Heerbrugg, Switzerland) con resolución de tres megapíxeles, en aumentos de 200x, se capturaron las imágenes de la mucosa; posteriormente, dichas imágenes se analizaron con el programa para tratamiento de imágenes ZEN (blue edition, Carl Zeiss, 2011), identificando un área circular de medida con un diámetro de 200µm y se realizaron seis mediciones por pliegue circular de la mucosa en varias zonas, así: dos en el vértice, dos en cada lado y dos en el fondo; para cada zona, la primera medición en la porción de la vellosidad y la segunda en la glándula de la mucosa intestinal con el fin de valorar su distribución. Finalmente, se realizó un conteo semiautomático de las células caliciformes positivas a cada una de las tinciones28.
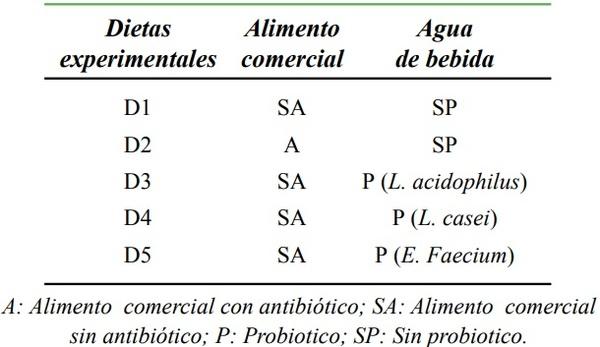
El experimento se realizó según un diseño bloques al azar en un arreglo de parcelas divididas. Para la conformación de los bloques se tomó en consideración el peso inicial de los animales. A cada animal le fue asignado uno de los 15 tratamientos: 5 dietas (alimento sin adición de probióticos ni antibióticos, con adición de antibióticos sin probióticos; y con adición de L. casei, L. acidophilus o Enterococcus faecium) y tres periodos de medición. Cada tratamiento tuvo un total de 3 repeticiones. El análisis estadístico se realizó según el procedimiento GLM (Modelos Lineales Generales) del SAS21. Las diferencias entre las medias de los tratamientos fueron determinadas por mínimos cuadrados y analizadas por ANOVA. Para realizar la comparación de los promedios entre tratamientos se utilizó una prueba de Duncan (P< 0,05).
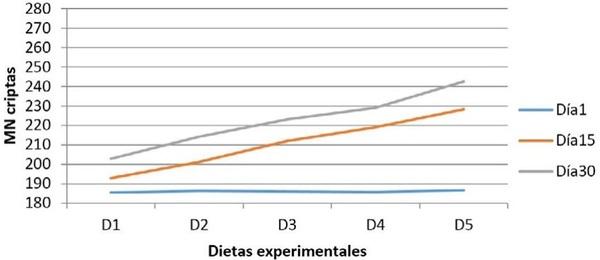
Resultados
Discusión
Universidad CES. Medellín, Colombia. Publicado en engormix.com por gentileza de los autores
1. Alain B, Pajarillo E, Chae JP, Balolong M, Bum Kim, H, Kang DK. Assessment of fecal bacterial diversity among healthy piglets during the weaning transition. J Gen Appl Microbiol. 2014; 60(4):140-6.
2. Betscher S, et al. “Effects of diet’s physical form (grinding intensity; meal/pellets) on morphological and histological parameters (eg ratio of neutral to acid mucins) of the gastrointestinal tract in weaned piglets. Livestock Science 2010; 134.1: 149-151
3. Campbell JM, Crenshaw JD, Polo J. The biological stress of early weaned piglets. J Anim Sci Biotechnol. 2013; 4(1):19.
4. Ciro JA, López HA, Parra JE. Expresión molecular de la vilina en yeyuno de lechones posdestete que consumieron LPS de E. coli. Rev CES Med Zootec. 2013; vol 8, No 2.
5. Chaim FM, Sato DT, Rodrigues MR, Dias AM, Silveira Júnior PP, Pereira JA, Martinez CA. Evaluation of the application of enemas containing sucralfate in tissue content of neutral and acid mucins in experimental model of diversion colitis. Acta Cir Bras. 2014; 29(9):544-52.
6. Chang M, Alsaigh T, Kistler EB, Schmid-Schönbein GW. Breakdown of mucin as barrier to digestive enzymes in the ischemic rat small intestine. PLoS One. 2012; 7(6):e40087.
7. CIOMS International Guiding Principles for Biomedical Research Involving Animals. Altern Lab Anim. 1985; 12(4):ii.
8. Farzan A, Kircanski J, DeLay J, Soltes G, Songer JG, Friendship R, Prescott JF. An investigation into the association between cpb2-encoding Clostridium perfringens type A and diarrhea in neonatal piglets. Can J Vet Res. 2013; 77(1):45-53.
9. Georgiades P, Pudney PD, Rogers S, Thornton DJ, Waigh TA. Tea derived galloylated polyphenols cross-link purified gastrointestinal mucins. PLoS One. 2014; 9(8):e105302.
10. Gopal A, Iyer SC, Gopal U, Devaraj N, Halagowder D. Shigella dysenteriae Modulates BMP Pathway to Induce Mucin Gene Expression In Vivo and In Vitro. PLoS One. 2014; 9(11):e111408.
11. Hensel KO, Boland V, Postberg J, Zilbauer M, Heuschkel R, Vogel S, Gödde D, Wirth S, Jenke AC. Differential expression of mucosal trefoil factors and mucins in pediatric inflammatory bowel diseases. Sci Rep. 2014; 4:7343.
12. Hino S, Sonoyama K, Bito H, Kawagishi H, Aoe S, Morita T. Low-methoxyl pectin stimulates small intestinal mucin secretion irrespective of goblet cell proliferation and is characterized by jejunum Muc2 upregulation in rats. J Nutr. 2013; 143(1):34-40.
13. Liu F, Li G, Wen K, Wu S, Zhang Y, Bui T, Yang X, Kocher J, Sun J, Jortner B, Yuan L. Lactobacillus rhamnosus GG on rotavirus-induced injury of ileal epithelium in gnotobiotic pigs. J Pediatr Gastroenterol Nutr. 2013; 57(6):750-8.
14. Looft TP. The swine intestinal microbiota: localized adaptations and responses to in-feed antibiotics. Graduate Theses and Dissertations. 2012. Tomado de: http://lib.dr.iastate.edu/etd/12390.
15. Lukić J, Strahinić I, Jovčić B, Filipić B, Topisirović, L, Kojić M, Begović J. Different roles for lactococcal aggregation factor and mucin binding protein in adhesion to gastrointestinal mucosa. Appl Environ Microbiol. 2012; 78(22):7993-8000.
16. Makkink CA, Berntsen PJM, op den Kamp BML, Kemp B, Verstegen WA. Gastric protein breakdown and pancreatic enzyme activities in response to two different dietary protein sources in newly weaned pigs. J Anim Sci. 1994; 72: 2843-2850.
17. NRC. National Research Council. The Nutrient Requirements of Swine. 8th rev. ed. Washington, DC, USA: National Academy Press. 1998.
18. Patel S, McCormick BA. Mucosal Inflammatory Response to Salmonella typhimurium Infection. Front Immunol. 2014; 5:311.
19. Prophet EB, Mills B, Arrington JB, Sobin LH. Métodos histotecnológicos. Instituto de Patología de las Fuerzas Armadas de los Estados Unidos (AFIP), 1995.
20. Reis STC, Guerrero CMJ, Aguilera BA, Mariscal LG. Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Téc Pecu Mex. 2005; 43: 309-321.
21. SAS®. SAS/STAT User’s Guide. Institute Inc. Statistical Analysis Systems Institute. Version 9.1th Ed. Cary, NC: SAS Institute Inc. 2006.
22. Segalés J, Domingo M. La necropsia en el ganado porcino, diagnóstico anatomopatológico y toma de muestras, Madrid (España), Boehringer Ingelheim. 2003. 10-14.
23. Strous GJ, Dekker J. Mucin-type glycoproteins. Crit. Rev. Biochem. Mol. Biol 1992; 27:57–92.
24. Voynow JA, Rubin BK. Mucins, mucus, and sputum. Chest. 2009; 135(2):505-12.
25. Wang L, Cao H, Liu L, Wang B, Walker WA, Acra SA, Yan F. Activation of epidermal growth factor receptor mediates mucin production stimulated by p40, a Lactobacillus rhamnosus GG-derived protein. J Biol Chem. 2014; 289(29):20234-44.
26. Wickström C, Chávez de Paz L, Davies JR, Svensäter G. Surface-associated MUC5B mucins promote protease activity in Lactobacillus fermentum biofilms. BMC Oral Health. 2013 Sep 8;13:43.
27. Xiao YP, Wu TX, Hong QH, Sun JM, Chen AG, Yang CM, Li XY. Response to weaning and dietary L-glutamine supplementation: metabolomic analysis in piglets by gas chromatography/mass spectrometry. J Zhejiang Univ Sci B. 2012; 13(7):567-78.
28. Zapata D, Rodríguez B, Ramírez M, López A, Parra J. Escherichia coli lipopolysaccharide affects intestinal mucin secretion in weaned pigs. Revista Colombiana de Ciencias Pecuarias 2015; 28:209-217.




.jpg&w=3840&q=75)