Plasma Rico en Plaquetas (PRP) y su Uso en Cirugía Veterinaria
Publicado: 15 de abril de 2014
Por: Faúndez, Ramón.1MV, Msc (Director de la Revista Hospitales Veterinarios - Hospital Veterinario de Santiago HVS - Chile)
Resumen
El uso de plasma rico en plaquetas (PRP) es una realidad en medicina humana y una herramienta cada vez más usada en medicina veterinaria, principalmente en medicina del deporte y equinos, respectivamente. El PRP corresponde a una fracción de plasma con un concentrado plaquetario, obtenida de la centrifugación de sangre autóloga. Los productos secundarios a la obtención de PRP son el concentrado de glóbulos rojos y el plasma pobre en plaquetas. Las plaquetas son ricas en factores de crecimiento como factor de crecimiento-ß, factor de de crecimiento endotelial y factor de crecimiento derivado de plaquetas. Estos juegan un papel importante en la recuperación de los tejidos. El uso de este recurso en cirugía de tejidos blandos, cirugía traumatológica y ortopedia ha demostrado prometedores resultados, transformándose en un elemento a considerar en aquellos pacientes donde la regeneración tisular es la base de la terapia.
Palabras claves: Plasma rico en plaquetas, PRP, concentrado plaquetario
Palabras claves: Plasma rico en plaquetas, PRP, concentrado plaquetario
Introducción
El uso de plasma rico en plaquetas (PRP) como facilitador del crecimiento tisular ha sido empleado en diversas áreas de la cirugía, encontrándose una considerable cantidad de experiencias en el área de cirugía periodontal y máxilofacial. Aunque los mecanismos que favorecen el crecimiento celular continúan pobremente descritos, los beneficios reportados en la práctica clínica incluyen: regeneración ósea, reducción de sangramientos y regeneración de tejidos1, 2 .Una característica relevante del PRP es la ausencia de reacciones inmunogénicas y la nula posibilidad de transmitir enfermedades, cuando se trata de un producto autólogo2.
Antecedentes
El gel de fibrina alogénica fue descrito originalmente en 1970, formado por la polimerización del fibrinógeno con trombina y calcio1,2 .Veinte años más tarde, Gibble y Ness describen el uso del gel de fibrina autóloga como un biomaterial con propiedades hemostáticas y adhesivas2,3 ; la adición de plaquetas como fuente de factores bioactivos se desarrollaría tiempo más tarde 3,4.
Los factores bioactivos encontrados luego de la activación de las plaquetas contenidas en el PRP incluyen: Factor de crecimiento derivado de las plaquetas y sus isómeros (FCDP-αα, ββ y αβ), factor transformador del crecimiento y sus isómeros (FTC-β, β1, β2 y β3), factor de crecimiento vascular endotelial (FCVE), factor de crecimiento tipo insulina (FCTi) y factor de crecimiento epidérmico (FCE). Todas estas proteínas promotoras del crecimiento tisular favorecen la quimiotaxis, la proliferación y diferenciación celular, la remoción de tejido no vital, la angiogénesis y evitan la pérdida de matriz extracelular. Algunos de estos factores de crecimiento derivado de plaquetas también son producidos por células como macrófagos, células endoteliales, monocitos, fibroblastos y en la matriz ósea 2, 4, 5, 6.
Aunque el detalle biológico molecular del PRP no es bien conocido, recientemente se ha demostrado que los factores obtenidos de plaquetas son muy efectivos en promover la expansión de la médula ósea, en comparación con el suero fetal bovino. Inclusive los factores derivados de plaquetas poseen la capacidad de inducir la formación de cartílago 7. Esto se explica porque las plaquetas son fragmentos citoplasmáticos de los megacariocitos, células formadas en la médula ósea. Las plaquetas son carentes de núcleo, pero poseen estructuras como mitocondrias, microtúbulos y gránulos (α, δ, λ). Por ejemplo, cada plaqueta contiene entre 50 y 80 gránulos α formados durante la maduración de los megacariocitos y que contienen más de 30 proteínas bioactivas, muchas de las cuales poseen un importante papel en la hemostasis y regeneración celular6,7, 8, 9.Un atributo también descrito para el PRP es la capacidad de inducir la secreción de una molécula llamada osteoprotegerina, una proteína capaz de retardar e incluso inhibir la formación de osteoclastos, que son los encargados de la resorción de la matriz ósea10 .
Las aplicaciones clínicas de esta herramienta en medicina humana incluyen el uso de PRP como alternativa a la cirugía en casos de epicondilitis lateral11, en el tratamiento de ruptura de tendón de Aquiles12,13 y en el tratamiento para lesiones del manguito rotador del hombro 14. En cirugía oral y máxilofacial, es común el uso de PRP asociado a injertos autólogos, heterólogos, junto a matriz ósea desmineralizada y otros materiales para defectos de mandíbula, maxila y cráneo 15,16. También se ha reportado el uso de PRP en fusiones vertebrales 17, artrodesis y fracturas con no unión 18. Así mismo, en el manejo del dolor en la aplicación de prótesis de rodilla19 y en el manejo de heridas ulceradas en pacientes diabéticos20.
Los reportes en medicina veterinaria son escasos y el área donde más uso se ha dado es en medicina equina. En ella se ha descrito el uso de PRP en patologías de los tendones 21,22 y articulaciones23; donde los estudios revelan ventajas comparativas en términos de recuperación de la movilidad, disminución del dolor, mejoría clínica de la claudicación, tiempos de retorno al ejercicio acelerados, menores recidivas y evidente recuperación ecográfica de las estructuras dañadas 21,22.
La excepción a este último punto corresponde a equinos que sufren patologías crónicas como la dermitis crónica proximal del ligamento suspensorio22. Del mismo modo, evaluaciones histológicas de las patologías tratadas con PRP demostraron que las fibras de colágeno se estructuran mejor respecto a lesiones tratadas con placebos o no tratadas, con una mayor tasa de actividad metabólica determinada por mayor contenido de colágeno, glicosaminoglicanos y DNA (celularidad). Esto permite que los tendones tratados con PRP posean una alta resistencia a las fuerzas de trabajo, presentando buenos desempeños en módulos elásticos de evaluaciones biomecánicas 24.
En la medicina de animales menores, Kim y colaboradores 25 reportaron buenos resultados en el tratamiento con PRP de una extensa herida de piel en un perro. Del mismo modo, se ha documentado el uso de PRP en la ruptura del ligamento cruzado anterior26, con el argumento que las proteínas contenidas en el concentrado plaquetario favorecerían la viabilidad de las células del ligamento dañado, así como su actividad metabólica y la síntesis de colágeno27. A la luz de los resultados, existen autores que con claridad concluyen que es necesario continuar las investigaciones sobre los efectos del uso del PRP como tratamiento complementario en la ruptura del ligamento cruzado craneal28, pues se ha determinado que el uso de este biomaterial como tratamiento único, no es efectivo29
Tabla 1. Efecto de los factores de crecimiento plaquetarios.
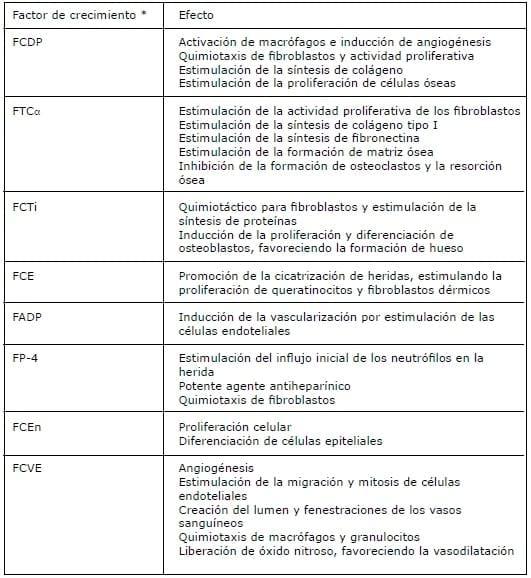 *FCDP, factor de crecimiento derivado de plaquetas; FTC, factor transformador del crecimiento; FCTi, factor de crecimiento tipo insulina; FCE, factor de crecimiento epidérmico; FADP, factor angiogénico derivado de plaquetas; FP, factor plaquetario; FCEn, factor de crecimiento endotelial; FCVE, factor de crecimiento vascular endotelial.
*FCDP, factor de crecimiento derivado de plaquetas; FTC, factor transformador del crecimiento; FCTi, factor de crecimiento tipo insulina; FCE, factor de crecimiento epidérmico; FADP, factor angiogénico derivado de plaquetas; FP, factor plaquetario; FCEn, factor de crecimiento endotelial; FCVE, factor de crecimiento vascular endotelial.
 *FCDP, factor de crecimiento derivado de plaquetas; FTC, factor transformador del crecimiento; FCTi, factor de crecimiento tipo insulina; FCE, factor de crecimiento epidérmico; FADP, factor angiogénico derivado de plaquetas; FP, factor plaquetario; FCEn, factor de crecimiento endotelial; FCVE, factor de crecimiento vascular endotelial.
*FCDP, factor de crecimiento derivado de plaquetas; FTC, factor transformador del crecimiento; FCTi, factor de crecimiento tipo insulina; FCE, factor de crecimiento epidérmico; FADP, factor angiogénico derivado de plaquetas; FP, factor plaquetario; FCEn, factor de crecimiento endotelial; FCVE, factor de crecimiento vascular endotelial.Referencias
1. Man D, Plosket H, Winland-Brown J. The use of autologous platele-rich plasma (plateled gel) and autolous platelet-poor plasma (fibrin glue) in cosmetic surgery. Plast Reconstr Surg 2001; 107: 229-37.
2. Alsousou J, Thompsom M, Hulley P, Noble A, Willet K. The biology of platelet-rich plasma and its application in trauma and orthopaedic surgery. J Bone Joint Surg 2009, 91-B: 987-96.
3. Gibble J, Ness P. Fibrin glue: the perfect operative sealant?. Transfusion 1990; 30: 741-47.
4. Whitman D, Berry R, Green D. Platelet gel: an autologous alternative to fibrin glue with application in oral and maxilofacial surgery. J Oral Maxillofac Surg 1997; 55: 1294-99.
5. Huaschka P, Mavrakos A, Lafrati M, Doleman S, Klagsburn M. Growth factor in bone matrix. J Biol Chem 1986; 261: 12665-74.
6. Oates T, Rouse C, Cochran D. Mitogenic effects of growth factor on human periodontal ligament cell in vitro. J Periodontal 1993; 64: 142-48
7. Zaky S, Ottonello A, Strada P, Cancedda R, Mastrogiacomo M. Platelet lysate favours in vitro expansion of human bone marrow stromal cells for bone and cartilage engineering. Journal of Tissue Engineering and Regenerative Medicine 2008; 2 (8): 472-81.
8. Anitua E, Andia I, Ardanza B, Nurden P, Nurden A. Autologous platelet as a source of proteins for healing and tissue regeneration. Thromb Haemost 2004; 91: 4-15.
9. Bucholz R, Einhorn T, Marsh J. Bone and joint healing. In: Bucholz R, Heckman J, Court-Brown C eds. Rockwood & Green´s fractures in adults. Sixth ed. Lipincrott Williams & Wilkins, 2006: 300-311.
10. Ogino Y, Ayakuwa Y, Kikita T, Atsuta I, Koyano K. Platelet-rich plasma suppresses osteoclastogenesis by promoting the secretion of osteoprotegerin. J Periodontal Research 2010; 44 (2): 217-24.
11. Mishra A, Pavelko T. Treatment of cronic elbow tendinosus with buffered platelet rich plasma. Am J Sports Med 2006; 34: 1774-78.
12. Sánchez M, Anitua E, Azofra J, et al. Comparison of surgically repaired Achilles tendon tears using plateletrich fibrin matrices. Am J Sports Med 2007; 35: 245-51.
13. De Vos R, Weir A, Van Schie H, Bierma-Zeinstra S, Verhaar J, Weinans H, Tol J. Platelet-rich plasma for cronic Achilles tendinopathy: a randomized controlled trial. JAMA 2010, 303 (2): 144-49.
14. Randelli P, Arragoni P, Cabitza P, Volpi P, Maffulli N. Autologous platelet rich plasma for artroscopic rotator cuff repair: a pilot study. Disabil Rehabil 2008: 1-6.
15. Fennis J, Stoelinga P, Jansen J. Mandibular reconstruction: a histological and histomorphometric stady on the use of autogenous scaffolds, particulate corticocancellous bone and platelet rich plasma in goats. Int J Oral Maxillofac Surg 2004; 33: 48-55.
16. Okuda K, Tai H, Tanabe K, et al. Platelet-rich plasma combined with a porous hidroxyapatite graft for the treatment of intrabony periodontal defect in humans: a comparative controlled clinical stady. J Periodontol 2005; 76: 890-98.
17. Lowery G, Kulkarni S, Pennissi A. Use of autologous growth factors in lumbar spinal fusion. Bone 1999; 25 (Suppl): 47-50.
18. Bielecki T, Gazdzik T, Szczepanski T.Benefict of percutaneous injection of autologous platelet-leukociterich gel in patient with delayed union and no union. Surg Res 2008; 40: 289-96.
19. Gardner M, Demetrakopoulos D, Klepchick P, Mooar P. The eficacy of autologous pletelet gel in pain control and blood loss in total knee artroplasty: an analisis of the hemoglobin, narcotic requierement and range of motion. Int Orthop 2007; 31: 309-13.
20. Margolis D, Kantor J, Santanna J, et al. Effective of platelet releasate for the treatment of diabetic neuropathic foot ulcers. Diabetes care 2001; 24: 483-88.
21. Nimura M, Fernández S. Tratamiento con factores de crecimiento plaquetario de una rotura parcial del flexor digital superficial en un caballo de carreras. Revista Complutense de Ciencias Veterinarias 2007; 1 (2): 208-14
22. Carmona J, Paredes M, Argüelles D. Concentrados autólogos de plaquetas como tratamiento de lesiones de tejidos blandos del aparato locomotor en caballos. Arch Med Vet 2009; 41 (1): 77-82.
23. Carmona J, Lopez C, Paredes M. Uso de concentrados autólogos de plaquetas obtenidos mediante el método del tubo como tratamiento de artropatías en caballos. Arch Med Vet 2009; 41 (2): 175-79.
24. Gerco Bosch G, van Schie H, de Groot M, Cadby J, van de Lest C, Barneveld A, van Weeren P. Effects of plateletrich plasma on the quality of repair of mechanically induced core lesions in equine superficial digital flexor tendons: A placebo-controlled experimental study. Journal of Orthopaedic Research 2009: 28 (2): 211-17.
25. Kim J-H, Park Ch, Park H-M. Veterinary Dermatology 2009; 20 (2): 123-26.
26. Murray M, Spindler K, Ballard P, Welch T, Zurakowski D, Nanney L. Enhanced histologic repair in a central wound in the anterior cruciate ligament with a collagenplatelet- rich plasma scaffold. Journal Orthopedic research 2007, 25 (8): 1007-17.
27. Cheng M, Wang H, Yoshida R, Murray M. Platelet and plasma proteins required to stimulated collagen gene expresion by anterior cruciate ligament cells in three- dimensional culture (Abstract). Tissue Eng Part A 2010.Disponibleen:http://www.ncbi.nlm.nih.gov/pubmed/19958169?itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVDocSum&ordinalpos=1 (Consultado Enero 20, 2010).
28. Spindler K, Murray M, Carey J, Zurakowski D, Fleming B. The use of platelets to affect functional healing of an anterior cruciate ligament (ACL) autograft in a caprine ACL reconstruction model. Journal Orthopedic research 2008, 27 (5): 631-38.
29. Murray M, Palmer M, Abreu E, Spindler K, Zurakowski D, Fleming B. Platelet-rich plasma alone is not sufficient to enhance suture repair of the ACL in skeletally immature animals: An in vivo study. Journal Orthopedic research 2008, 27 (5): 639-45.
***El artículo fue originalmente publicado por HOSPITALES VETERINARIOS - Vol. 2 Nº 2 - 2010.
Temas relacionados:
Autores:
Hospital Veterinario de Santiago HVS - Chile
Recomendar
Comentar
Compartir
4 de mayo de 2014
Buenas tardes, necesito mas informacion sobre el tema para tratamiento en tendones de equinos, es para redactar mi tesis de grado
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.