Protocolos de superovulación en bovinos altoandinos
Respuesta ovárica y embrionaria de dos protocolos de superovulación en bovinos altoandinos Pardo Suizo
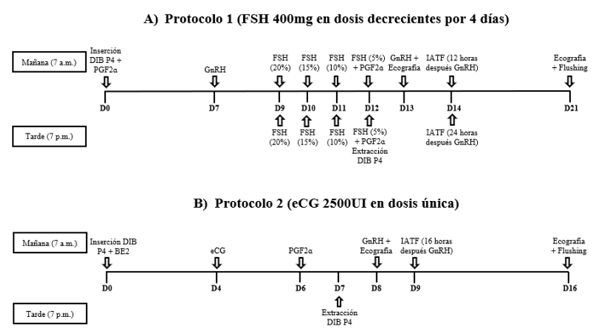
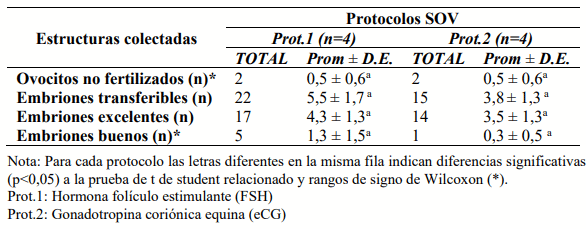
El objetivo del presente artículo fue evaluar la respuesta ovárica y embrionaria de dos protocolos hormonales de superovulación en bovinos altoandinos Pardo Suizo. Se utilizaron cuatro vacas donantes mediante un diseño de series temporales interrumpidas con replicaciones cambiadas y cada vaca fue sometida a dos protocolos hormonales de superestimulación: protocolo 1 (Prot.1, FSH convencional de 400mg en dosis decrecientes por cuatro días) y protocolo 2 (Prot. 2, eCG, 2500UI en dosis única). Durante la realización de los protocolos se hizo la evaluación ovárica de los folículos pre ovulatorios (FPO) y de los cuerpos lúteos (CLs) mediante ecografía. Así mismo se evaluó la calidad y tasa de embriones recuperados. Los resultados mostraron que el número y diámetro de FPO y CLs no mostraron diferencias significativas entre los protocolos; de la misma forma en el número de embriones colectados. Con eso se concluye que ambos protocolos de superovulación (FSH y eCG) son aplicables en bovinos pardo suizo altoandino.
Palabras clave: vacas altoandinas, protocolo hormonal, FSH, eCG, embriones
Introducción
Materiales y métodos
Ubicación y características
Animales y alimentación
Diseño experimental
Evaluación ecográfica de los ovarios
Colecta de embriones
Análisis estadístico
Resultados
Respuesta ovárica

Respuesta embrionaria
Discusión
Conclusiones
Agradecimientos
Normas bioéticas
Armstrong, D. (1993). Recent advances in superovulation of cattle. Theriogenology 39: 7–24.
Baruselli, P.S., Ferreira, R.M., Sa Filho, M.F., Nasser, L.F.T., Rodrigues, C.A., & Bo, G.A., (2010). Bovine embryo transfer recipient synchronization and management in tropical environments. Reprod Fertil Dev 22, 67–74.
Bó, G. A., & Mapletoft, R. J. (2018). Embryo transfer technology in cattle. In Animal Biotechnology 1 (pp. 107-133). Springer, Cham.
Carrière, P. D., Gnemmi, G., DesCôteaux, L., Matsui, M., Miyamoto, A., & Colloton, J. (2010). Bovine ovary. Practical atlas of ruminant and camelid reproductive ultrasonography. DesCoteaux L, Gnemmi G and Colloton J, eds. USA: Blackwell Publishing, 35-59.
Chacón, F. NS., Palacios, F. M., Sedano, R. C., & AhujaAguirre, C. (2020). Embryo production after superovulation of bovine donors with a reduced number of FSH applications and an increased eCG dose. Theriogenology, 141, 168-172.
De Rensis, F., & López‐Gatius, F. (2014). Use of equine chorionic gonadotropin to control reproduction of the dairy cow: a review. Reproduction in domestic animals, 49(2), 177-182.
DesCôteaux, L., Colloton, J., & Gnemmi, G. (Eds.). (2009). Practical atlas of ruminant and camelid reproductive ultrasonography. John Wiley & Sons.
Elsden, R. P., Nelson, L. D. & Seidel, G. E. (1978). Superovulating cows with follicle stimulating hormone and pregnant mare’s serum gonadotrophin. Theriogenology, 9, 17-26
González, F., Calero, P. & Beckers, J.F., (2001). Induction of superovulation in domestic ruminants. In: Renaville, R., Burny, A. (Eds.), Biotechnology in Animal Husbandry. Kluwer Academic Publishers, the Netherlands, pp. 209–223.
Goulding D., Williams D. H., Roche J. F. & Boland M. P. (1996): Factors affecting superovulation in heifers treated with PMSG. Theriogenology, 45, 765-773.
Gutiérrez-Reinoso, M. A., Aguilera, C. J., Navarrete, F., Cabezas, J., Castro, F. O., Cabezas, I., & RodríguezAlvarez, L. (2022). Effects of Extra-Long-Acting Recombinant Bovine FSH (bscrFSH) on Cattle Superovulation. Animals, 12(2), 153.
Hasler, J., McCauley, A., Schermerhorn, E., & Foote, R. (1983). Superovulatory responses of Holstein cows. Theriogenology, 19: 83–99
Jahnke, M. M., & Youngs, C. R. (2021). Superovulation in cattle. Bovine Reproduction, 1032-1040.
Kulus, J., Wieczorkiewicz, M., Kulus, M., & Jaskowski, J. M. (2019). Superovulation in cattle–searching for the optimal dose, alternative routes of administration and a simplified FSH application program. Medycyna Weterynaryjna, 75(09).
Laster, D. B. (1972) Disappearance of and uptake of 125I FSH in the rat, rabbit, ewe and cow. J Reprod Fertil 30:407–415
Lerner, S. P., Thayne, W. V., Baker, R. D., Henschen, T., Meredith, S., Inskeep, E. K., ... & Butcher, R. L. (1986). Age, dose of FSH and other factors affecting superovulation in Holstein cows. Journal of animal science, 63(1), 176-183.
Lindner, G. M., Wright, J. R. W., (1983). Bovine embryo morphology and evaluation. Theriogenology, 20, 407–416.
Mahmood, K., Tahir, M. Z., Butt, M. A., Qureshi, S. M., & Riaz, A. (2021). GnRH or estradiol benzoate combination with CIDR improves in-vivo embryo production in bovines (Bos indicus and Bos taurus) under subtropics. PeerJ, 9, e12077.
Mapletoft, R. J., Steward, K. B., & Adams, G. P. (2002). Recent advances in the superovulation in cattle. Reproduction Nutrition Development, 42(6), 601-611. Mapletoft, R.J., & Bó, G.A. (2013). Innovative strategies for superovulation in cattle. Animal reproduction, 10, 174-179.
Mapletoft, R. J., & Bó, G. A. (2012). The evolution of improved and simplified superovulation protocols in cattle. Reproduction, Fertility and Development, 24(1), 278-283. MINAGRI (2020), “Vacunos de leche,” vacunos-de-leche_ web.pdf (www.gob.pe)
Monniaux, D., Chupin, D. & Saumande, J. (1983) Superovulatory responses of cattle. Theriogenology 19:55–82 Murphy, B. D., & Martinuk, S. D. (1991). Equine chorionic gonadotropin. Endocrine reviews, 12(1), 27-44.
Mutlak, N. K. (2019). The influence of Multiple Ovulation and Nonsurgical Embryo Transfer on pregnancy rate in Holstein Friesian Heifers. Al-Anbar Journal of Veterinary Sciences, 12(1).
Naranjo-Chacón, F., Montiel-Palacios, F., Canseco-Sedano, R., & Ahuja-Aguirre, C. (2019). Embryo production in middle-aged and mature Bos taurus× Bos indicus cows induced to multiple ovulation in a tropical environment. Tropical animal health and production, 51(8), 2641-2644.
Păcală, N., Corin, N., Bencsik, I., Dronca, D., Cean, A., Boleman, A., Caraba, V. & Papp, S. (2010). Stimulation of the reproductive functions at acyclic cows by Ovsynch and PRID/eCG. Scientific papers: Animal Science and Biotechnologies Timişoara, 43.
Quispe, J., Belizario, C., Apaza, E., Maquera, Z., & Quisocala, V. (2016). Desempeño productivo de vacunos Brown Swiss en el altiplano peruano. Revista de Investigaciones Altoandinas, 18(4), 411-422.
Redhead, A.K., Siewb, N., Lambiec, N., Carnarvonc, D., Ramgattieb, R. and Knights, M. (2018). The relationship between circulating concentration of AMH and LH content in the follicle stimulating hormone (FSH) preparations on follicular growth and ovulatory response to superovulation in water buffaloes. Animal Reproduction Science, 188, 66–73.
Schams D., Menzer C., Schallenberger E., Hoffman B., Hahn R. (1978) Some studies of the pregnant mare serum gonadotrophin (PMSG) and on endocrine responses after application for superovulation in cattle. In: Sreenan JM (ed) Control of reproduction in the cow. Martinus Nijhoff, The Hague, pp 122–142.
Segura-Correa, J. C., & Montes-Pérez, R. C. (2001). Razones y estrategias para la conservación de los recursos genéticos animales. Revista Biomédica, 12(3), 196-206.
Solid Perú. (2007). Conociendo la cadena productiva de lácteos de Ayacucho. Recuperado de http://infolactea. com/wp-content/uploads/2015/03/635.pdf.
Sudano, M. J., da Cruz Landim-Alvarenga, F., Sartori, R., & Machado, R. (2011). Reuse of norgestomet implants in an eCG-based superovulation protocol administered to Nelore (Bos taurus indicus) cows. Livestock Science, 141(2-3), 207-212.
Takagi, M., Kim, I. H., Izadyar, F., Hyttel, P., Bevers, M. M., Dieleman, S. J., Hendriksen, P. J. M. & Vos, P. L. (2001). Impaired final follicular maturation in heifers after superovulation with recombinant human FSH. Reproduction, 121(6), 941-951.
Walsh, J. H., Mantovani, R., Duby, R. T., Overstrom, E. W., Dobrinsky, J. R., Enright, W. J. & Boland, M. P. (1993). The effects of once or twice daily injections of pFSH on superovulatory response in heifers. Theriogenology, 40(2), 313-321.
Thank you for having shared your article. When did you remove progesteron device from cows?
Gracias por haber compartido tu artículo. ¿Cuándo quitaron el dispositivo de progesterona a las vacas?





