Estomatitis papular bovina en terneros
Estomatitis papular bovina en terneros de un tambo en la provincia de Córdoba, Argentina
La Estomatitis Papular Bovina (BPSV) es una enfermedad viral caracterizada por la formación de pápulas o nódulos en morro, labios, lengua y mucosa oral. En Argentina, existen escasos registros de su presencia. Se comunica un caso de BPSV observado en terneros de un establecimiento lechero. El comportamiento clínico-epidemiológico, los hallazgos patológicos y la identificación del agente mediante biología molecular son concluyentes para la confirmación del mismo. El sistema de crianza artificial y la falta de algunas medidas sanitarias, favorecieron la transmisión de la enfermedad entre los terneros.
Keywords: estomatitis papular, terneros, tambo, Papular Stomatitis, calves, dairy farm.
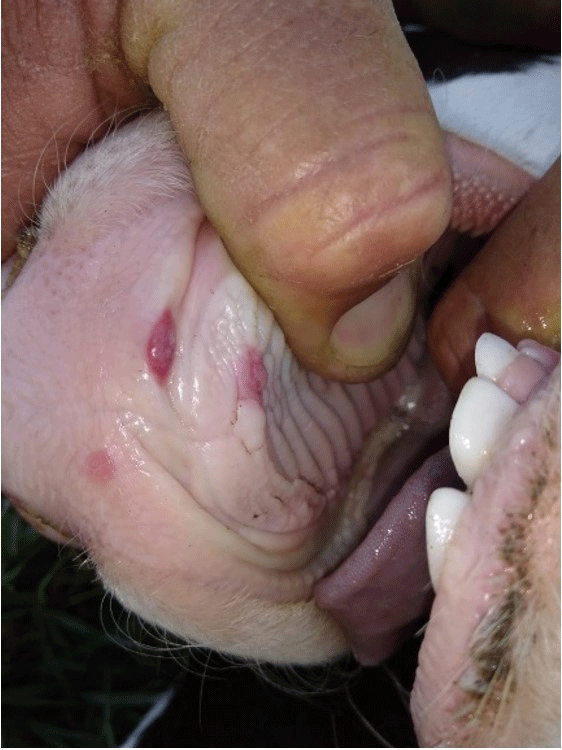
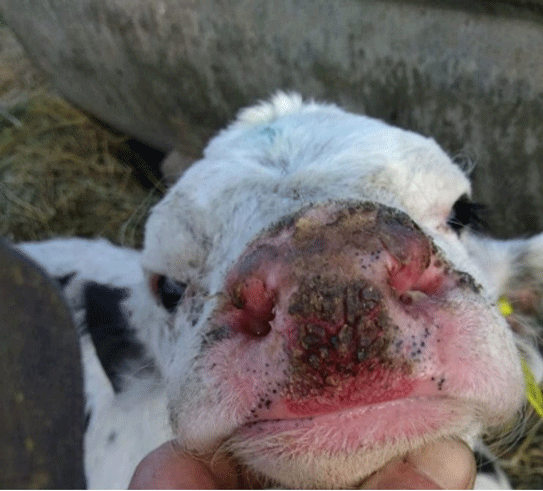
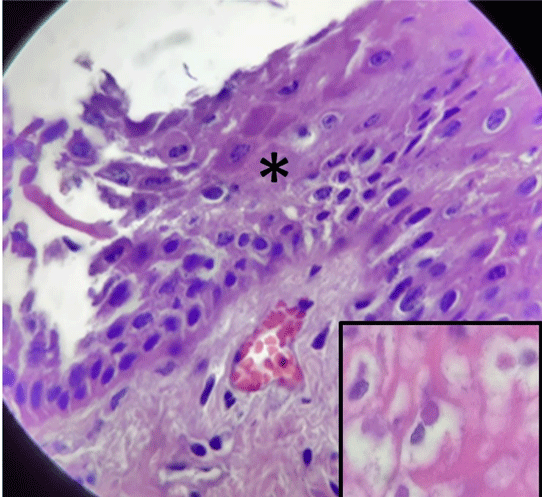
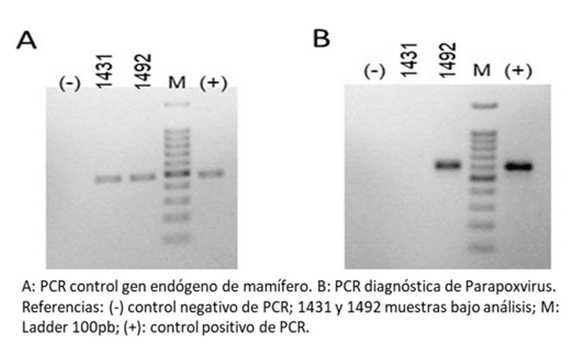
-Bohelay, G., Duong, T.(2017). Infecciones por poxvirus en humanos. EMC – Dermatología. 51(3): 1-9 http://dx.doi.org/10.1016/S1761-2896(17)85923-
-Büttner, M., Rziha, H. (2002). Parapoxvirus: from the lesion to the viral genome". Journal of Veterinary Medicine Series B, 49(1), 7-16.
-Cicculli, V., Ayhan, N., Luciani, L., Pezzi, L., Maitre, A., Decarreaux, D., Lamballerie, X., Paoli, J., Vial, L., Charrel, R., Falchi, A. (2022). Molecular detection of parapoxvirus in Ixodidae ticks collected from cattle in Corsica, France. Veterinary Medicine and Science, 8(2), 907-916.
-De Sant' Ana, F., Rabelo, R., Vulcani, V., Cargnelutti, F., Flores, E. (2012). Bovine papular stomatitis affecting dairy cows and milkers in midwestern Brazil. Journal of Veterinary Diagnosic Investigation, 24(2), 442-445
- Cargnelutti, J., Silva Santos, B., das Neves Lebre, S., Naihane Alves Sodre, D.; Mandu da Silva, R. Weiblen, R. (2014). Pseudocowpox and papular stomatitis in cattle in the Rondonia state, Brazil. Ciencia Rural. 44(3), 479-485.
-Friederichs, S., Krebs, S., Blum, H., Lang, H., Buttner, M. (2015). Parapoxvirus (PPV) of red deer reveals subclinical infection and confirms a unique species. Journal of General Virology, 96(6), 1446-1462.
-García, M. (1986). Estudio de una patología similar a estomatitis papular bovina. XIV Jornadas Uruguayas de Buiatría, Paisandú, Uruguay, -Hart, L., Hayston, J., Keast, J. (1949). Observation on contagious pustular dermatitis of sheep. Australian Veterinary Journal, 25(3), 40-45.
-Inoshima, Y., Morooka, A., Sentsui, H. (2000). Detection and diagnosis of parapoxvirus by the polymerase chain reaction. Journal of Virological Methods. 84(2), 201–208.
-Kato, M., Kawashima, D., Ito, Y., Yamamoto, O., Nakajima, H., Oizumi, T., Shimizu, K, Inoshima, Y. (2021). Successful measures to prevent the spread of bovine papular stomatitis in a dairy farm. Journal of Veterinary Medical Science, 83(2): 304–308 doi: 10.1292/jvms.20-0554.
-Livingston, C., Hardy, W. (1960). Longevity of contagious ecthyma virus. Journal of the American Veterinary Association, 137: 651.
-Micheloud, J., Aguirre, L., Sandoval, G., Avellaneda Cáceres, A., Diodati, J., Peralta, A. (2019). Detection and first molecular characterization of bovine papular stomatitis virus in dairy calves in Argentina. Tropical animal health and production, 52(1), 453-459. https://doi.org/10.1007/s11250-019-02006-w
-Ouedraogo, A., Luciani, L., Zannou, O., Biguezoton, A., Pezzi, L., irion, L., Belem, A., Saegerman, C., Charrel, M., Lempereur, L. (2020). Detection of two species of the genus Parapoxvirus (Bovine Papular Stomatitis Virus and Pseudocowpox Virus) in ticks infesting cattle in Burkina Faso. Microorganisms. 8: 644. doi:10.3390/microorganisms8050644.
-Servicio Nacional de Sanidad y Calidad Agroalimentaria (Senasa). (2020). Disponible en: https://www.argentina.gob.ar/noticias/atencion-de-sospecha-de-enfermeda d-en-bovinos-descarto-aftosa-y-estomatitis
-Yaegashi, G., Fukunari, K., Oyama, T., Murukami, R., Inoshima, Y. (2016). Detection and quantification of parapoxvirus DNA by use of a quantitative real-time polymerase chain reaction assay in calves without clinical signs of parapoxvirus infection. American Journal of Veterinary Research, 77(4), 383-387





